剩余采食量(residual feed intake,RFI)是家畜实际采食量与根据其维持及生产或体型大小及生长速度所计算的预期采食量之间的差值[1],可以有效评价动物饲料转化率、群体代谢水平以及品种选育[2]。许多地区将RFI作为肉牛或奶牛监测、管理和育种的选择工具或标准,并取得了良好的效果[3-4]。近年来随着科学技术的发展,已有科学家和科研团队将压力传感技术、图像识别技术等高新技术体系引入畜牧生产,可以准确收集采食量数据,提高了RFI测定的准确性和稳定性,并且极大地节省了人力物力,也为RFI的更广泛应用提供了基础。
由于饲料成本占反刍动物养殖总成本的60%~70%,所以如何提高饲料利用效率,降低饲料成本,是反刍动物养殖产业的经济可持续性发展的关键。RFI可以根据动物的不同用途进行生产性能评价,是一种有效地评价饲料利用效率的指标。RFI越低意味着饲料利用效率越高,表示在同等的维持需要和产奶量等生产需要的情况下,消耗的饲粮更少。通过一系列饲养措施或育种策略,降低牧场RFI,可以有效降低养殖成本,提高经济效益[5]。有研究结果表明RFI存在巨大的遗传变异,并且这种变异的大小足以使这一特性被认为是未来奶牛育种目标的候选性状。饲料转化效率受应激、消化能力、产热、身体状况和个体活动等情况的影响[6],RFI性状受饲粮、环境条件、健康状况、遗传等因素影响[7],在饲粮、环境以及健康状况相似时,个体遗传因素是控制RFI性状的主要因素。所以可以通过测定牛群个体RFI的变化,比较个体间的差异,对肉牛养殖中个体的健康、疾病和应激等情况进行监测,在现代化、规模化养殖中增加对个体的关注,问题早发现、早解决。本文综述了RFI的应用模型类别和应用效果、测定采食量的方法以及RFI在营养物质代谢、屠宰性能和遗传方面的相关性的研究进展。
1 RFI的计算模型如何定义RFI的模型是应用RFI的关键,根据被测对象的用途不同,制定不同的RFI模型,对结果进行线性回归分析,计算出家畜的预期采食量。根据预期采食量模型,验证其模型方程的截距是否显著,若截距显著,则可根据此模型计算出预期采食量。实际采食量减去预期采食量即为RFI。目前国内外文献中的RFI预测模型主要有以下几种。
Koch等[1]提出的预测模型:Yi=β0+β1ADGi+β2AMWTi+ei或Yi=β0+β1ADGi+β2MMWi+ei,其中前1个预测模型中,Yi为动物i的干物质采食量(DMI);β0为回归截距;β1为采食量对平均日增重(ADG)的偏回归系数;AMWTi为动物i的平均中期体重;β2为AMWT对DMI的影响程度;ei为动物i的实际采食量与拟合采食量之差,即RFI;后1个预测模型是目前澳大利亚用于预测肉牛的RFI的模型,主要的不同在于MMWi为动物i的平均中期代谢重,计算公式为[(初始体重+最终体重)/2]0.75。该模型较上一模型更能准确地估计RFI。在实践中发现不同数量的群体需要不同的方法来计算RFI,小群体使用这一模型将降低用于计算预期饲粮摄入量的回归可靠性。
还有一种包含了动物的体组成特性的预测模型,除了掌握DMI、ADG、AMWT的数据外,还需要超声波测量或屠宰后测定其背膘厚(FT)以及眼肌厚度(ED),其模型为Yi=β0+β1ADGi+β2MWTi+β3FT+β4ED+ei,其中,β0为回归截距;β1为ADG的偏回归系数;β2为MWT对DMI的影响程度;β3为FT对DMI的影响程度;β4为ED对DMI的影响程度,为定值[8];ei为动物i的实际采食量与拟合采食量之差,即RFI。
而对于奶牛的饲料利用效率的估算,DiGiacomo等[9]用以下模型来估算奶牛的RFI:RFI=DMI-(μ+BW+BWΔ+farm+age+age2),其中,μ为总平均影响因子;BW为中期体重;BWΔ为增长率;farm为牧场影响值(DMI与生长率和体重的相关性);age为犊牛的日龄(d)。Fischer等[10]提出了一种基于法国农业科学院定义的牛奶净能和食物摄取净能的预测方法,用多元线性回归对泌乳期能量净摄入和产出牛奶的净能拟合,并引入体况评分(BCS)的得失计算出净能的差值,以此表示能量利用效率。根据法国标准能源需求方程,牛奶净能(MNE)的预测公式为:MNE=7.12×{MY×[0.44+0.005 5×(MFC-40)+0.003 3×(MPC-31)]},其中,MNE为每天牛奶中的净能,以MJ为单位;MY为每天的产奶量,以kg为单位;MFC为牛奶中的脂肪浓度,单位是g/kg;MPC为牛奶中的蛋白质浓度,单位是g/kg。作者认为,奶牛在很长一段时间内的饲料利用效率是稳定的,可以利用平均数据来估计整个测算时期的饲料利用效率,所以可以使用变量的平均值来计算剩余能量摄入量(REI),进而估算几乎整个泌乳时期的饲料利用效率。研究人员还通过试验证明,净能摄入量相比DMI可以避免在泌乳期间由于变化的饮食质量而导致的偏差。通过体重(BW)的平均值与每日BCS损失之和的乘积估算身体储备损失。反之,身体储备增加是通过BW的平均值与每日BCS增加之和的乘积来估算。这种做法更正了BCS因不同牛的体形差异而造成的改变。REI被法国能量系统表示为净能的残差,以MJ表示。NEI=μ+a×MNE+b×(BW0.75)+c×(BW×ΔBCS+)+d×(BW×ΔBCS-)+REI,其中,NEI为每天食物摄入的净能,单位是MJ;μ是截距;ΔBCS+为测算期间BCS的增益;ΔBCS-为测算期间BCS的损失;a、b、c、d是回归系数;REI即是奶牛的剩余能量摄入量,并以此来预测饲料利用效率。
2 RFI的数据采集方法因为牧场中DMI的测定耗时费力,特别是对于牛群来说,测定个体动物的采食量十分困难,同时也限制了RFI在养殖中的应用,所以获得采食量数据的方法就显得尤为关键。在国内一些试验中,对RFI相关数据的采集往往是人工进行,即在投料时称量投料重,保证家畜自由采食且饲粮不受污染,并在第2天投料前清理收集剩料并称量。根据孙雨坤等[11]的报道,一种典型的人工方法是根据前1天的采食量设定当天的投喂量,投喂量应是实际采食量的105%~110%,精粗分饲,根据动物生长阶段设定不同精粗比,先粗后精,当动物开始停止采食粗料时投喂精料,据此在后1天晨饲前收集剩料,并最后确定动物采食量。该方法精度较高,但因其费时耗力,并不适用于实际生产。
还有其他研究人员根据条件,采用基于无线射频识别(RFID)和带有压力传感器的组合系统记录动物的个体采食量,Chiba等[12]报道,验证RFID系统监测饲喂奶牛的采食行为,发现该系统的RFID识别存在一些会产生错误的内在因素。系统RFID的有限读取范围也是导致误差的因素,当RFID的耳标不在范围内时,实际的数据可能未被记录下来[13]。
Shelley[14]运用三维成像技术扫描奶牛饲喂前后的料槽,通过内容物的变化情况以确定饲粮的体积和重量。其优点在于不会阻碍工作流程或奶牛的采食行为。这种饲粮摄取量监测系统利用结构光照明(SLI)架构向料槽投射光带,从投射的变形情况,创建深度和表层的信息来计算饲粮变化,该系统由数码相机和投影仪组成,摄像机位于投影仪上方,以便捕获和投影。在图 1-A中,在SLI系统YZ平面,列坐标是固定的一个值n。通过结构光照明的方式,能够在有效提高传统多摄像机立体视觉系统的分辨率和精度的同时,将立体视觉系统精简只包括1个摄像机和1个投影机的结构。Shelley[14]研究中使用的SLI系统的基本结构如图 1-B所示,图 1-C为此设备的实物图。基于SLI扫描的基本几何原理,该系统能够利用三角测量软件来确定料仓内饲粮的体积和重量。
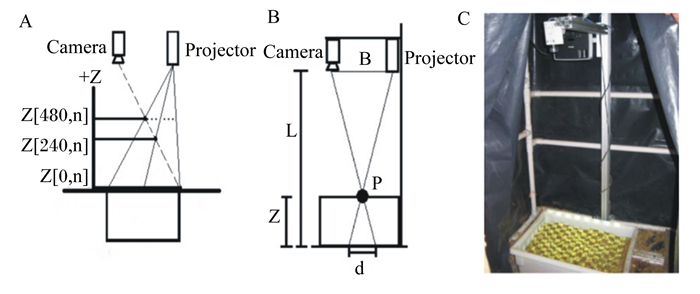
|
Camera为照相机;Projector为投影仪。 Z表示饲料表面上任一点的垂直方向的坐标。n代表相机采集到图像的列坐标,在坐标系中对应的是X轴。P代表结构光系统投射至饲料表面的任意一点。L代表料槽底面至投射采集系统平面的距离。 Z represents vertical coordinate of any point on the surface of feed. n represents column coordinate of images collected by a camera, which is X axis in the coordinate system. P represents any point on the surface of feed projected by the structured light system. L represents the distance between the bottom of the feed tank and the plane of the projection acquisition system. 图 1 采食量图像识别系统 Fig. 1 Image recognition system of feed intake[14] |
RFI是评价饲料效率的有效指标。Connor等[15]在一项研究中发现,RFI最低的奶牛比RFI最高的奶牛节约15%的饲粮。粗饲料的利用方面研究发现,摄入不同淀粉含量的饲粮,RFI的变异有9%到31%源于可消化性的不同,低RFI奶牛对低淀粉饲粮的干物质消化能力比高RFI奶牛更强,但RFI与精料中中性洗涤纤维(NDF)的消化率呈负相关[16]。在激素方面研究发现,由于造成RFI变异的因素有很多,并且由于不同RFI家畜对应激反应和外界压力的敏感性不同,可能导致消化能力出现差异。Digiacomo等[9]研究了RFI与内分泌系统中下丘脑-垂体-肾上腺(HPA)轴的关系,发现犊牛低RFI对胰岛素的刺激可产生更高水平的血浆胰岛素生长因子-1,并且肾上腺素的反应中血浆脂肪酸浓度更高,这表明高RFI奶牛对HPA轴反应更灵敏。因此,高RFI的泌乳牛可能将部分产奶净能用于响应HPA轴,进而降低饲料利用率。
4 RFI与瘤胃功能有研究表明RFI与瘤胃功能关系密切。瘤胃作为反刍动物特有的器官,是饲粮发酵消化的主要场所,在消化代谢中起重要作用,而瘤胃独特的功能要归功于其中大量存在的微生物,主要包括细菌、厌氧真菌、瘤胃原虫以及少数噬菌体,它们可帮助反刍动物消化纤维、淀粉等物质并合成菌体蛋白后被全部消化,成为反刍动物的主要营养物质来源。Guan等[17]运用PCR变性梯度凝胶电泳(PCR-DGGE)技术探究了不同RFI的安格斯肉牛在饲喂高能饲粮(代谢能为12.18 MJ/kg)时瘤胃内的细菌组成,通过对9头不同RFI的肉牛瘤胃细菌组成对比后发现,不同RFI的肉牛瘤胃菌谱明显不同,并且某些特定细菌只出现在低RFI的肉牛或高RFI的肉牛瘤胃中。Ellison等[18]研究认为,在不同RFI的肉羊瘤胃中,某些特定类型的菌群会对饲料利用效率有所影响,比如在不同RFI的肉羊中存在的普雷沃氏菌和史氏甲烷短杆菌等存在差异(表 1)[18],这些菌群能够更好地利用粗饲料,因此,进一步验证了低RFI的家畜对淀粉和纤维等营养物质的消化能力更强[19]。
|
|
表 1 用操作分类单元比较不同RFI的肉羊瘤胃中菌群数量 Table 1 Compare bacteria number in rumen of meat sheep with different RFI using OTUs[18] |
在分子水平上探讨RFI与瘤胃的相关性研究中,Benedeti等[20]研究了瘤胃上皮中ATP的合成和水解过程,提供了可用于提高肉牛饲料利用效率的标记方式。在瘤胃上皮内的大部分细胞能量都是氧化磷酸化过程通过ATP的形成而产生的,相关基因泛素细胞色素C还原酶(UQCR10)、泛素氧化还原酶亚基B4(NDUFB4)的mRNA表达在RFI组中存在差异。与高RFI的牛相比,中、低RFI的牛瘤胃上皮氧化磷酸化过程中涉及的编码关键蛋白质的基因NDUFB4和UQCR10的mRNA表达减少。虽然这是第1次证明挥发性脂肪酸(VFA)运输关键基因与RFI具有相关性,但是其他研究也发现不同RFI的肉牛瘤胃pH和总VFA含量无显著差异[21-23]。
5 RFI与屠宰性能优质、高产是肉用牛羊生产者的生产目标。Nascimento等[24]研究发现,低RFI的肉牛产肉效率不但更高,而且肋骨重量和肌内脂肪含量也高于高RFI组,分析原因认为低RFI可以更有效地沉积蛋白质,降解速率更低,理论上应该具有胴体瘦肉率高、皮下脂肪含量少、肌内脂肪含量高的特点[25-26]。因此,高RFI的饲料利用效率较低,能量利用超出生产所需,超出的能量会使皮下脂肪含量增加,影响肉品质。但一些报道发现,以RFI作为饲料转化效率的指标,低RFI可以更高效地产出相同肉品质的胴体,不同RFI之间的胴体品质没有显著差异。Fidelis等[5]的试验中,低RFI的内洛尔牛每天消耗的饲粮比预期低0.479 kg,高RFI的牛比预期高0.483 kg,而在屠宰性能、内脏器官重、肉质和肉的不同部位之间均没有显著差异。同样,在Zorzi等[27]的试验中,内洛尔牛剪切力和可溶性蛋白含量在低RFI组中较高,每天低RFI组的DMI比高RFI组低0.73 kg,但内脏器官重和屠宰性能方面没有显著变化。因此,RFI的高低可以影响胴体脂肪含量,低RFI可以提高优质肉品的生产效率。
6 RFI与遗传动物饲粮对产品(如牛奶或肉类)的转化效率受遗传、生理和环境因素的综合影响,导致能量消耗的个体差异。有文献记载,RFI的遗传力是中等且多变的[28-29],即使在群体数量庞大的情况下,遗传力也只有0.18。为确定长期饲料利用效率的潜在遗传决定因素,Tempelman等[30]建立了1项关于泌乳奶牛的试验,通过REI测定了泌乳奶牛饲料利用效率的个体差异,其中REI是作为产奶净能、代谢体重和BCS得失的校正后的净能量摄入计算的,结果表明在所有测量的性状中,采食行为、活动、瘤胃温度、体储变化和消化率解释了58.9%的REI表型变异,相当于净能摄入表型变异的3.8%。其中活动和采食行为占比例最多,分别为26.5%和21.3%。在采食行为、活动、瘤胃温度和消化特性等方面观察到存在交互效应。因此,目前的结果还不足以对饲料利用效率的生物学决定因素作出明确的结论。进一步的研究需要更好地描述饲料利用效率与采食行为、消化率、体储变化、活动和瘤胃温度之间的因果关系,以便更好地了解泌乳奶牛的饲料利用效率差异,为动物生产方面选育最佳品种提供理论依据。
7 小结综上所述,在反刍动物生产中选育低RFI的畜群可以节约饲养成本,增加经济效益,因为低RFI的家畜对淀粉的利用效率更高,在不增加饲料成本的前提下,产肉效率更高,肌内脂肪沉积更好,虽然RFI对瘤胃功能的影响并不显著,但是RFI同VFA转运的关键基因具有相关性。同时,在科技进步的背景下,RFI数据采集方式更加快捷准确,选择适当的测量方式,将为规模化牧场中发挥RFI的优势提供可靠的技术支持。
| [1] |
KOCH R M, SWIGER L A, CHAMBERS D, et al. Efficiency of feed use in beef cattle[J]. Journal of Animal Science, 1963, 22(2): 486-494. DOI:10.2527/jas1963.222486x |
| [2] |
BASARAB J A, PRICE M A, AALHUS J L, et al. Residual feed intake and body composition in young growing cattle[J]. Canadian Journal of Animal Science, 2003, 83(2): 189-204. DOI:10.4141/A02-065 |
| [3] |
DAMIRAN D, PENNER G B, LARSON K, et al. Use of residual feed intake as a selection criterion on the performance and relative development costs of replacement beef heifers[J]. The Professional Animal Scientist, 2018, 34(2): 156-166. DOI:10.15232/pas.2017-01635 |
| [4] |
STEYN Y, VAN MARLE-KÖSTER E, THERON H E. Residual feed intake as selection tool in South African Bonsmara cattle[J]. Livestock Science, 2014, 164: 35-38. DOI:10.1016/j.livsci.2014.03.007 |
| [5] |
FIDELIS H A, BONILHA S F M, TEDESCHI L O, et al. Residual feed intake, carcass traits and meat quality in Nellore cattle[J]. Meat Science, 2017, 128: 34-39. DOI:10.1016/j.meatsci.2017.02.004 |
| [6] |
HERD R M, ODDY V H, RICHARDSON E C. Biological basis for variation in residual feed intake in beef cattle.1.Review of potential mechanisms[J]. Australian Journal of Experimental Agriculture, 2004, 44(5): 423-430. DOI:10.1071/EA02220 |
| [7] |
肖成, 曹阳, 金海国, 等. 家畜剩余采食量性状候选基因的研究进展[J]. 黑龙江畜牧兽医, 2018(5): 45-49. |
| [8] |
FRANÇOIS D, BIBÉ B, BOUIX J, et al.Genetic parameters of feeding traits in meat sheep[C]//Proceedings of the 7th world congress on genetics applied to livestock production.Montpellier: Institut National de la Recherche Agronomique, 2002.
|
| [9] |
DIGIACOMO K, NORRIS E, DUNSHEA F R, et al. Responses of dairy cows with divergent residual feed intake as calves to metabolic challenges during midlactation and the nonlactating period[J]. Journal of Dairy Science, 2017, 101(7): 6474-6485. |
| [10] |
FISCHER A, DELAGARDE R, FAVERDIN P. Identification of biological traits associated with differences in residual energy intake among lactating Holstein cows[J]. Journal of Dairy Science, 2018, 101(5): 4193-4211. DOI:10.3168/jds.2017-12636 |
| [11] |
孙雨坤, 岳奎忠, 李文茜, 等. 图像信息技术在奶牛生产中的应用[J]. 动物营养学报, 2018, 30(5): 1626-1632. DOI:10.3969/j.issn.1006-267x.2018.05.003 |
| [12] |
CHIBA L.Dairy cattle nutrition and feeding[M/OL]//CHIBA L.Animal nutrition handbook.2013: 486-517[2018-06-12].http://www.ag.auburn.edu/~chibale/an15dairycattlefeeding.pdf.
|
| [13] |
SCHWARTZKOPF-GENSWEIN K S, HUISMA C, MCALLISTER T A. Validation of a radio frequency identification system for monitoring the feeding patterns of feedlot cattle[J]. Livestock Production Science, 1999, 60(1): 27-31. DOI:10.1016/S0301-6226(99)00047-0 |
| [14] |
SHELLEY A N.Monitoring dairy cow feed intake using machine vision[D].Master Thesis.Kentucky: University of Kentucky, 2013. https://uknowledge.uky.edu/cgi/viewcontent.cgi?referer=https://cn.bing.com/&httpsredir=1&article=1021&context=ece_etds
|
| [15] |
CONNOR E E, HUTCHISON J L, OLSON K M, et al. Triennial lactation symposium:opportunities for improving milk production efficiency in dairy cattle[J]. Journal of Animal Science, 2012, 90(5): 1687-1694. DOI:10.2527/jas.2011-4528 |
| [16] |
POTTS S B, BOERMAN J P, LOCK A L, et al. Relationship between residual feed intake and digestibility for lactating Holstein cows fed high and low starch diets[J]. Journal of Dairy Science, 2017, 100(1): 265-278. DOI:10.3168/jds.2016-11079 |
| [17] |
GUAN L L, NKRUMAH J D, BASARAB J A, et al. Linkage of microbial ecology to phenotype:correlation of rumen microbial ecology to cattle's feed efficiency[J]. FEMS Microbiology Letters, 2010, 288(1): 85-91. |
| [18] |
ELLISON M J, CONANT G C, LAMBERSON W R, et al. Diet and feed efficiency status affect rumen microbial profiles of sheep[J]. Small Ruminant Research, 2017, 156: 12-19. DOI:10.1016/j.smallrumres.2017.08.009 |
| [19] |
CARBERRY C A, KENNY D A, HAN S, et al. Effect of phenotypic residual feed intake and dietary forage content on the rumen microbial community of beef cattle[J]. Applied and Environmental Microbiology, 2012, 78(14): 4949-4958. DOI:10.1128/AEM.07759-11 |
| [20] |
BENEDETI P D B, DETMANN E, MANTOVANI H C, et al. Nellore bulls (Bos taurus indicus) with high residual feed intake have increased the expression of genes involved in oxidative phosphorylation in rumen epithelium[J]. Animal Feed Science and Technology, 2017, 235: 77-86. |
| [21] |
FITZSIMONS C, KENNY D A, MCGEE M. Visceral organ weights, digestion and carcass characteristics of beef bulls differing in residual feed intake offered a high concentrate diet[J]. Animal, 2014, 8(6): 949-959. DOI:10.1017/S1751731114000652 |
| [22] |
LAWRENCE P, KENNY D A, EARLEY B, et al. Intake of conserved and grazed grass and performance traits in beef suckler cows differing in phenotypic residual feed intake[J]. Livestock Science, 2013, 152(2/3): 154-166. |
| [23] |
FITZSIMONS C, KENNY D A, DEIGHTON M H, et al. Methane emissions, body composition, and rumen fermentation traits of beef heifers differing in residual feed intake[J]. Journal of Animal Science, 2013, 91(12): 5789-5800. DOI:10.2527/jas.2013-6956 |
| [24] |
NASCIMENTO M L, SOUZA A R D L, CHAVES A S, et al. Feed efficiency indexes and their relationships with carcass, non-carcass and meat quality traits in Nellore steers[J]. Meat Science, 2016, 116: 78-85. DOI:10.1016/j.meatsci.2016.01.012 |
| [25] |
HERD R M, DICKER R W, LEE G J, et al. Steer growth and feed efficiency on pasture are favourable associated with genetic variation in sire net feed intake[J]. Science Access, 2004, 1(1): 93-96. |
| [26] |
ROBINSON D L, ODDY V H. Genetic parameters for feed efficiency, fatness, muscle area and feeding behaviour of feedlot finished beef cattle[J]. Livestock Production Science, 2004, 90(2/3): 255-270. |
| [27] |
ZORZI K, BONILHA S F M, QUEIROZ A C, et al. Meat quality of young Nellore bulls with low and high residual feed intake[J]. Meat Science, 2013, 93(3): 593-599. DOI:10.1016/j.meatsci.2012.11.030 |
| [28] |
BERRY D P, CROWLEY J J. Cell biology symposium:genetics of feed efficiency in dairy and beef cattle[J]. Journal of Animal Science, 2013, 91(4): 1594-1613. DOI:10.2527/jas.2012-5862 |
| [29] |
YAO C, DE LOS CAMPOS G, VANDEHAAR M J, et al. Use of genotype×environment interaction model to accommodate genetic heterogeneity for residual feed intake, dry matter intake, net energy in milk, and metabolic body weight in dairy cattle[J]. Journal of Dairy Science, 2017, 100(3): 2007-2016. DOI:10.3168/jds.2016-11606 |
| [30] |
TEMPELMAN R J, SPURLOCK D M, COFFEY M, et al. Heterogeneity in genetic and nongenetic variation and energy sink relationships for residual feed intake across research stations and countries[J]. Journal of Dairy Science, 2015, 98(3): 2013-2026. DOI:10.3168/jds.2014.8510 |




