在反刍动物的饲养过程中,青贮饲料已经成为必不可少的重要饲料[1]。玉米、甘蔗尾、象草和苜蓿等是均青贮时最常用的青贮原料,在全球范围内青贮饲料已经成为反刍动物最为广泛使用的饲粮成分[2]。青贮是一种通过附生微生物的作用在厌氧条件下保存新鲜饲料的方法。在青贮饲料制作过程中,发酵质量受青贮技术、压实度、青贮饲料长度、筒仓密封等因素的影响[3]。青贮饲料开窖后,氧气的侵入会激活被抑制的好氧微生物,使得pH升高,这些好氧微生物会影响青贮饲料的有氧稳定性,给养殖业带来威胁[4]。青贮饲料的有氧稳定性是指青贮饲料在储藏和饲喂动物期间,pH、温度不升高,依然保持新鲜、气味酸香的能力[5]。青贮饲料中主要的微生物有乳酸菌、酵母菌、肠细菌、霉菌和其他好氧性细菌[6-8],这些微生物严重影响着青贮有氧暴露期间的稳定性。青贮饲料中的微生物对青贮饲料有氧稳定性的影响一直以来都是国内外青贮饲料研究领域的热点和重点,近年来国内外研究人员在微生物对青贮发酵有氧稳定性方面的研究越来越深入。本文主要综述了青贮饲料发酵过程中微生物的种类及变化、相关微生物对青贮饲料有氧稳定性的影响等,为制作优质青贮饲料和提高青贮饲料有氧稳定性提供理论数据。
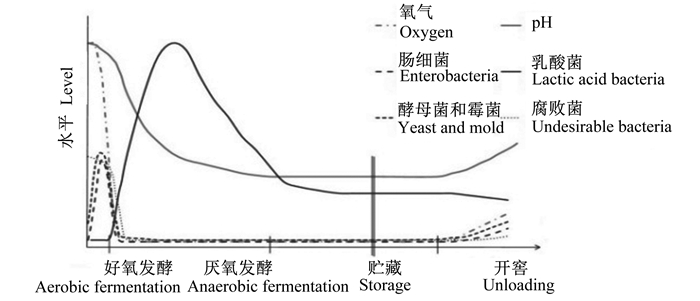
1 青贮发酵过程中微生物的种类及动态变化不同青贮原料中的微生物无论是在种类上还是数量上都有很大的区别,青贮饲料中干物质含量、可溶性碳水化合物含量、缓冲力等影响其附生微生物的种类和数量。有研究者对同一地区的高粱、苜蓿、黑麦草和玉米表面的附生的微生物进行了研究,结果显示,青贮饲料附生微生物主要包括乳酸菌、酵母菌、霉菌和其他好氧细菌等(表 1)[9]。Kasmaei等[10]对同一地点采集的玉米秸秆、三叶草和牧草表面附生微生物进行了研究,发现玉米秸秆中乳酸菌丰度最高,其总数是牧草的7倍,是三叶草的15倍。一般来讲,即使青贮原料中微生物种类和数量不同,但处理良好的青贮饲料的主要理化值和微生物种群的理论演变大致是相同的(图 1)[11]。
|
|
表 1 青贮原料表面附生微生物的种类及数量 Table 1 Epiphytic microorganism species and numbers on ensiling materials[9] |
|
图 1 青贮发酵过程中氧气含量、pH和不同微生物数量理论变化(鲜重基础) Fig. 1 Theorical changes in oxygen content, pH and different microbial populations during silage fermentation processing (fresh weight basis)[11] |
青贮饲料发酵是一个复杂的微生物群落演变过程。青贮饲料开始发酵时好氧细菌处于活跃期,当发酵体系中的氧气被消耗完,乳酸菌开始大量增殖并产生乳酸降低发酵体系pH,腐败微生物被抑制。随着发酵时间的延长,发酵体系pH继续降低,乳杆菌科(Lactobacillaceae)逐渐占据主导地位[12]。陶莲等[13]采用MiSeq高通量测序技术分析了自然青贮前后玉米秸秆中菌群结构的变化,与青贮前相比,青贮发酵增加了厚壁菌门(Firmicutes)、芽孢杆菌纲(Bacilli)、乳杆菌目(Lactobacillales)、乳杆菌科、片球菌属(Pediococcus)和乳杆菌属(Lactobacillus)细菌的数量,而降低了变形菌门(Proteobacteria)和肠杆菌科(Enterobacteriaceae)细菌的数量。韩吉雨[14]采用聚合酶链反应-变性梯度凝胶电泳(PCR-DGGE)技术对玉米和苜蓿青贮发酵过程中菌群结构的动态变化进行了研究,结果显示,青贮前期乳酸球菌数量较多,随着发酵的进行,乳酸杆菌逐渐成为优势菌种。国内关于青贮饲料表面附生微生物种类及其代谢产物的报道较少,而微生物在青贮过程中的代谢产物对青贮有氧稳定性起着至关重要的作用,分析附生微生物在青贮过程中的动态变化及其代谢产物的特性对青贮饲料品质和有氧稳定性都有很重要的影响。
2 青贮微生物对青贮饲料有氧稳定性的影响青贮过程中的微生物大致可以分为两类:1)有利于饲料发酵并保存饲料营养特性的理想微生物,如乳酸菌等;2)不利于青贮饲料的储藏,导致青贮饲料有氧变质的微生物,如酵母菌、霉菌和梭菌等好氧性细菌。
2.1 提高青贮饲料有氧稳定性的微生物乳酸菌是青贮饲料中重要的有益微生物。根据乳酸菌代谢产物的不同将其分为同型发酵乳酸菌和异型发酵乳酸菌。同型发酵乳酸菌可以产生较多的乳酸,能够提高青贮发酵品质;而异型发酵乳酸菌可以产生乳酸和挥发性脂肪酸,能够抑制好氧细菌的生长,提高青贮有氧稳定性。经过长时间的研究和实践发现,异型发酵乳酸菌中的布氏乳杆菌(Lactobacillus buchneri)和希氏乳杆菌(Lactobacillus hilgardii)等在改善青贮饲料有氧稳定性方面效果显著。最近,研究人员还发现Lactobacillus parafarraginis、产细菌素菌株和非乳酸菌细菌也可以显著改善青贮饲料有氧稳定性。
2.1.1 Lactobacillus buchneriLactobacillus buchneri可以将乳酸厌氧转化为乙酸和1, 2-丙二醇,乙酸通过抑制腐败菌的生长改善青贮饲料的有氧稳定性,这一结论已经被许多研究人员证实。Wang等[15]研究了Lactobacillus buchneri单独或与植物乳杆菌组合接种对鞭草青贮饲料有氧稳定性的影响,结果显示,Lactobacillus buchneri单独或与植物乳杆菌组合接种相比于其他处理显著增加了青贮饲料的乙酸含量,酵母菌和霉菌的活性受到抑制,尤其是酵母菌;并通过在有氧暴露期间有较低的pH、CO2含量和酵母菌及霉菌数量反映出Lactobacillus buchneri改善了鞭草青贮饲料的有氧稳定性。Gandra等[16]采用Lactobacillus buchneri对向日葵进行青贮试验,结果显示,与对照组相比,接种Lactobacillus buchneri增加了青贮饲料的乙酸含量,有氧暴露期间霉菌和酵母菌数量显著降低。许多研究表明Lactobacillus buchneri在青贮后期才开始大量增殖,产生较多的乙酸,从而改善青贮饲料的有氧稳定性。Jin等[17]比较了单独添加Lactobacillus buchneri和混合添加Lactobacillus buchneri与外源性纤维蛋白酶对青贮大麦的影响,结果显示,青贮第1~7天,对照组中Lactobacillus buchneri数量从6.5 lg(拷贝数/g)增加到8.0 lg(拷贝数/g),此后保持稳定,而试验组中Lactobacillus buchneri数量则从7.0 lg(拷贝数/g)增加到10.0 lg(拷贝数/g);试验组中Lactobacillus buchneri数量在青贮第28天达到10.5 lg(拷贝数/g),此时具有较低的pH,产生了较多的乙酸和乙醇,但是比对照组产生的乳酸要少;有氧暴露第21天,与对照组相比,试验组pH和酵母菌的数量都显著降低。Daughtry等[18]在腌制黄瓜时发现,不同的Lactobacillus buchneri对乳酸利用率和程度各不相同,目前还不清楚青贮饲料中天然存在的Lactobacillus buchneri是否存在类似情况。
最初认为Lactobacillus buchneri不能将1, 2-丙二醇进一步代谢为丙醇和丙酸。Zielińska等[19]经过研究发现,Lactobacillus buchneri AKKP 2047p能够将1, 2-丙二醇代谢成丙酸,并且葡萄糖和钴胺素对其代谢有促进作用。Lactobacillus buchneri在青贮后期开始大量增殖,逐渐成为主要的优势菌种[17],了解其在发酵过程中成为优势菌种的原因,可以帮助我们更好地了解提高青贮饲料有氧稳定性的微生物特性。
2.1.2 Lactobacillus hilgardiiLactobacillus hilgardii属于异型发酵乳酸菌,在青贮发酵过程中可以产生较高含量的乙酸,有氧暴露阶段高含量的乙酸抑制酵母菌和霉菌的生长,从而延长青贮饲料的有氧稳定性。Reis等[20]评估了从甘蔗青贮饲料中分离的Lactobacillus hilgardii CCMA 0170对玉米青贮饲料的影响,结果显示,与对照组相比,Lactobacillus hilgardii CMA 0170减少了干物质损失,并保存了更多的可溶性碳水化合物,同时,试验组中乳酸菌群、乳酸、乙酸以及1, 2-丙二醇的含量增加,有氧暴露后丝状真菌和酵母菌数量小于可检测的最小值[ < 2.0 lg (CFU/g)]。Ávila等[21]用Lactobacillus hilgardii UFLA SIL 51和UFLA SIL 52处理甘蔗尾后青贮,与对照处理和用短乳杆菌处理相比,可以产生更高含量的乙酸和1, 2-丙二醇,丁酸、干物质损失和乙醇含量显著降低,同时有氧暴露期间可以保持较低的酵母菌及霉菌数量。Polukis等[22]采用Lactobacillus hilgardii CNCM I-4785或Lactobacillus buchneri 40788青贮新鲜高水分玉米,结果显示,与未经处理的玉米青贮饲料相比,这2种菌株都增加了青贮饲料中乙酸和1, 2-丙二醇的含量,并使酵母菌数量减少;发酵10 d后,未处理的青贮饲料有氧稳定性为22 h,而Lactobacillus hilgardii CNCM I-4785和Lactobacillus buchneri 40788处理的青贮饲料有氧稳定性分别增加至42和56 h;发酵30和90 d后经Lactobacillus hilgardii CNCM I-4785或Lactobacillus buchneri 40788处理的青贮饲料有氧稳定性超过250 h,而未经处理的青贮饲料有氧稳定性为31~49 h。
接种同型发酵乳酸菌降低了青贮饲料中乙酸的含量,促进了酵母菌生长的速率,导致青贮饲料有氧稳定性降低[23],因此,借助Lactobacillus hilgardii产生较多乙酸的特点,将其与同型发酵乳酸菌组合,对青贮饲料发酵品质和有氧稳定性或许能够产生更好的效果。
2.1.3 Lactobacillus parafarraginisLactobacillus parafarraginis是近几年研究人员新发现的能够改善青贮饲料有氧稳定性的乳酸菌物种。Xu等[24]研究发现,接种Lactobacillus parafarraginis的玉米青贮饲料,在青贮前期观察到pH迅速降低,并且出现高含量的乳酸和乙酸;青贮第45天时,接种Lactobacillus parafarraginis的玉米青贮饲料中Lactobacillus parafarraginis成为主要的优势菌,比例为61.63%,同时可以观察到乳酸含量降低以及乙酸和1, 2-丙二醇含量增加,并降低了氨态氮(NH3-N)与总氮的比值,有效提高了玉米青贮饲料的有氧稳定性。
乙酸一直以来被认为是提高青贮饲料有氧稳定性最好的解释。然而,Liu等[25]比较了新型细菌菌株Lactobacillus parafarraginis ZH1(ZH1组)与植物乳杆菌Chikuso-1(LP组)和Lactobacillus buchneri NCIMB 40788(LB组)对燕麦青贮饲料有氧稳定性和鉴定抗酵母菌物质的影响,结果显示,ZH1组产生的乙酸、苯甲酸和十六烷酸多于LP、LB组,并具有最佳的有氧稳定性;此外,苯甲酸和十六烷酸在纯培养物中对靶酵母具有最小的抑制浓度,Lactobacillus parafarraginis ZH1具有更强的抗酵母菌潜力,并且比其他菌株更有效地改善了燕麦青贮饲料的有氧稳定性。Broberg等[26]报道,接种乳酸菌的青贮饲料能够产生3-羟基癸酸、水杨酸、苯甲酸、儿茶酚、氢化肉桂酸、3-苯基乳酸和4-羟基苯甲酸等抗菌化合物,青贮饲料有氧暴露稳定性得到延长。因此,多种抗菌化合物或其协同效应可以解释除了乙酸以外改善青贮饲料有氧稳定性产生的较好效果,这也为我们研发改善青贮饲料有氧稳定性新的添加剂组合提供了理论依据。
2.1.4 产细菌素的细菌近年来,具有生物防腐剂潜力的细菌素和产细菌素的菌株成为研究的焦点。细菌素是由不同微生物产生的抗微生物蛋白(肽),对于与其密切相关的细菌具有拮抗活性。最近,Amado等[27]研究了乳球菌产生的细菌素pediocin SA-1作为添加剂对青贮玉米的影响,结果显示,与对照组相比,pediocin SA-1具有很好的抗菌活性,有效地降低了玉米青贮中李斯特菌数量,并且提高了乙酸和1, 2-丙二醇的含量以及降低了残余糖的含量,延长了青贮饲料有氧暴露的时间。PCR-DGGE分析显示,添加细菌素不影响自发发酵的细菌群落。Marciñaková等[28]报道了产细菌素的屎肠球菌对青贮牧草有氧稳定性的影响,结果显示,与对照组相比,试验组pH降低更快,乳酸含量升高,乙酸和丁酸含量降低,在有氧暴露的7 d中pH均低于4.3,李斯特菌和霉菌的数量减少。Ganzorig等[29]发现由希氏乳杆菌Uvu-21和Lactobacillus diolivorans Tuv-33产生的2种上清液具有有效的抗菌和蛋白质水解活性,经蛋白酶处理后活性消失,表明该生物活性源自乳酸菌产生的肽。Parvin等[30]发现,巴氏醋杆菌产生的细菌素可有效地抑制酵母菌的增殖,青贮饲料的有氧稳定性得到显著提高。
细菌素的发现对提高青贮饲料的有氧稳定性具有潜在的作用,但对于使用产细菌素的细菌进行青贮试验研究的甚少。因此,挖掘产细菌素的菌株及其对青贮饲料有氧稳定性的影响值得进一步研究。
2.1.5 非乳酸菌细菌近年来,研究人员发现了几种能够改善青贮饲料有氧稳定性的非乳酸菌物种,主要为枯草芽孢杆菌和丙酸杆菌等微生物。Lara等[31]比较了3种处理(未处理、枯草芽孢杆菌处理和枯草芽孢杆菌+Lactobacillus plantarum处理)的玉米青贮饲料,青贮96 d后,枯草芽孢杆菌处理中酵母菌数量最低,而其他2种处理中酵母菌数量相似。枯草芽孢杆菌和枯草芽孢杆菌+Lactobacillus plantarum处理的青贮饲料的有氧稳定性分别比未处理的青贮饲料高3倍以上和2倍。Gandra等[32]研究了Lactobacillus buchneri和Lactobacillus buchneri+枯草芽孢杆菌对甘蔗青贮饲料的影响,结果显示,与Lactobacillus buchneri处理相比,Lactobacillus buchneri+枯草芽孢杆菌处理的乙酸含量更高,丁酸含量更低。Zachary[33]采用丙酸杆菌处理青贮玉米,青贮30和90 d后,与对照组相比,具有较低的pH,较高的丙酸和乙酸含量,有氧稳定性测试中一氧化碳(CO)含量最少,酵母菌数量低于可检测水平。
枯草芽孢杆菌可能是通过产生抑制酵母菌和霉菌的类似细菌素的代谢物来提高青贮饲料的有氧稳定性[34],这一结论还需要作进一步的研究来证实。即便如此,枯草芽孢杆菌和丙酸杆菌等非乳酸菌物种改善青贮饲料有氧稳定性的试验还是为预测和研发新的添加剂指明了方向。
2.2 降低有氧稳定性的微生物 2.2.1 酵母菌和霉菌酵母菌一直以来被认为是导致青贮饲料有氧变质的主要微生物。引起青贮饲料有氧变质的酵母菌分为两类:一类是利用酸,如假丝酵母属(Candida)、拟内孢霉属(Endomycopsis)、汉逊酵母属(Hansenula)和毕赤酵母属(Pichia);一类是利用糖,如球拟酵母属(Torulopsis) [35]。Wang等[36]研究了全混合日粮(TMR)中酵母菌在有氧变质过程中的作用,结果显示,盔形毕赤酵母(Pichia manshurica)、嗜酒假丝酵母(Candida ethanolica)、拜氏接合酵母(Zygosaccharomyces bailii)能够耐受乙酸,对青贮早期时青贮有氧变质产生更多的影响;青贮后期,Zygosaccharomyces bailii是引起青贮饲料有氧变质的主要酵母菌。Carvalho等[37]在青贮甘蔗尾研究中发现青贮饲料的有氧变质与主要酵母菌的新陈代谢密切相关,Candida、粟酒裂殖酵母菌(Schizosaccharomyces pombe)和Zygosaccharomyces bailii是降低青贮饲料有氧稳定性的主要微生物。Hao等[38]研究发现,青贮饲料有氧暴露期间,Zygosaccharomyces bailii数量的增加引起TMR的有氧变质。
绝大部分研究者认为酵母菌是引起青贮饲料有氧变质的主要群体,而有一部分研究者却持相反态度。Savage等[39]将2株酿酒酵母和1种未知酵母菌接种到玉米青贮中,结果显示,与对照组相比,3种菌株对青贮饲料的有氧稳定性菌没有产生显著影响。研究发现,在青贮甘蔗尾中添加开菲尔乳杆菌(Lactobacillus kefiri)或短乳杆菌(Lactobacillus brevis)均降低了酵母菌的数量,但并未改变其有氧稳定性[40]。有研究者还发现,有些酵母菌可以产生抑制其他真菌及革兰氏阴性菌活性的代谢物[41]。从高水分小麦中分离的异常毕赤酵母(Pichia anomala)J121接种大麦比未处理的大麦具有更高的酵母菌数量(超过100倍),然而,霉菌和肠杆菌数量低于可检测水平[42]。Schnürer等[43]也证实了Pichia anomala J121菌株抑制真菌及某些革兰氏阴性菌活性的结论。酵母菌代谢产物及其在青贮饲料有氧变质中的作用应有更多的数据来阐述,采用抑制真菌及某些革兰氏阴性菌的酵母菌进行青贮接种值得进一步探讨分析。
霉菌是严格的好氧性微生物。Orsi等[44]检测和分析了195份青贮玉米中霉菌的种类和数量,镰刀霉菌属是最多的,其次为曲霉菌属、青霉菌属、毛孢子菌属和分子孢子菌属,这些菌属可以降解玉米中的糖和乳酸,导致青贮饲料发热变暖,降低青贮饲料的有氧稳定性。Macêdo等[3]报道,烟曲霉菌(Aspergillus fumigatus)是引起青贮饲料温度升高和有氧变质的一种真菌。反刍动物摄食变质的青贮饲料,不仅会损害动物本身的健康,最终也会通过肉类和乳制品将毒素传递给人类。因此,抑制霉菌产生是动物饲料和营养领域中不可忽视的环节。
2.2.2 梭菌梭菌属于厌氧微生物,其主要产物为丁酸,对青贮饲料有氧稳定性产生负面影响。张大伟等[45]报道,梭菌在生长过程中,通过脱氢、脱羧和氧化还原等方式使蛋白质腐败,引起青贮饲料变质。Jatkauskas等[46]在青贮玉米有氧稳定性的试验中发现,降低青贮饲料中梭菌的数量以及丁酸、氨态氮的含量后有氧稳定性提高了66~312 h。Vukmirović等[47]在苜蓿青贮中发现,降低梭菌的数量后青贮饲料的有氧稳定性比对照组提高了3倍。由此可见,抑制梭菌及丁酸的产生对青贮饲料有氧稳定性至关重要。
抑制好氧微生物的生长,改善青贮饲料的有氧稳定性一直以来都是青贮饲料研究领域中的热点和重点。目前发现的能够显著提高青贮饲料有氧稳定性的乳酸菌属大多是在青贮后期才开始发挥作用,利用新的技术分析植物附生微生物种类及其在青贮发酵过程中的演替,能够在青贮早期识别提高青贮饲料有氧稳定性的菌株,对改善青贮饲料有氧稳定性将有很大帮助。
3 小结青贮饲料的有氧变质一直是养殖业关注的焦点,不仅影响青贮饲料的营养价值,而且威胁着动物和人类健康。除了采用科学的青贮管理技术外,在青贮发酵过程中微生物的变化及其代谢产物不同程度地影响青贮饲料的有氧稳定性,了解青贮发酵过程中微生物的特性是提高青贮饲料有氧稳定性的重要依据。我国对青贮饲料有氧稳定性的研究起步较晚,特别是对微生物影响青贮饲料有氧稳定性机理的研究还不够透彻。因此,未来应该应用Illumina、Solexa Genome Analyzer测序等高新技术,以便能更全面、更好地分析微生物及其代谢产物在青贮发酵过程中的动态变化,为进一步改善青贮饲料有氧稳定性,调制优质的青贮饲料及研发新型优质微生物添加剂提供理论依据。
| [1] |
LI M H, SHAN G L, ZHOU H Y, et al. CO2 production, dissolution and pressure dynamics during silage production:multi-sensor-based insight into parameter interactions[J]. Scientific Reportsvolume, 2017, 7: 14721. DOI:10.1038/s41598-017-14187-1 |
| [2] |
POWELL J M, BARROS T, DANES M, et al. Nitrogen use efficiencies to grow, feed, and recycle manure from the major diet components fed to dairy cows in the USA[J]. Agriculture, Ecosystems & Environment, 2017, 239: 274-282. |
| [3] |
MACÊDO A J D S, SANTOS E, OLIVEIRA J D E, et al.Microbiology of silages: literature review[J/OL].Revista Electronica de Veterinaria, 2018, 18(9).http://www.veterinaria.org/revistas/redvet/n090917/091764.pdf.
|
| [4] |
TENNANT R K, SAMBLES C M, DIFFEY G E, et al. Metagenomic analysis of silage[J]. Journal of Visualized Experiments, 2017(119): e54936. |
| [5] |
YUAN X, WEN A, DONG Z W, et al. Effects of formic acid and potassium diformate on the fermentation quality, chemical composition and aerobic stability of alfalfa silage[J]. Grass and Forage Science, 2017. DOI:10.1111/gfs.12296 |
| [6] |
倪奎奎.全株水稻青贮饲料中微生物菌群以及发酵品质分析[D].博士学位论文.郑州: 郑州大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10459-1016160918.htm
|
| [7] |
RAO Y, QIAN Y, SHE X, et al. Pellicle formation, microbial succession and lactic acid utilisation during the aerobic deteriorating process of Sichuan pickle[J]. International Journal of Food Science & Technology, 2018, 53(3): 767-775. |
| [8] |
杨文琦, 龙宣杞, 崔卫东. 玉米青贮中细菌多样性分析[J]. 新疆农业科学, 2013, 50(8): 1424-1433. |
| [9] |
许冬梅, 张萍, 柯文灿, 等. 青贮微生物及其对青贮饲料发酵品质影响的研究进展[J]. 草地学报, 2017, 25(3): 460-465. |
| [10] |
KASMAEI K M, DICKSVED J, SPÖRNDLY R, et al. Separating the effects of forage source and field microbiota on silage fermentation quality and aerobic stability[J]. Grass and Forage Science, 2017, 72(2): 281-289. DOI:10.1111/gfs.2017.72.issue-2 |
| [11] |
DUNIÈRE L, SINDOU J, CHAUCHEYRAS-DURAND F, et al. Silage processing and strategies to prevent persistence of undesirable microorganisms[J]. Animal Feed Science and Technology, 2013, 182(1/2/3/4): 1-15. |
| [12] |
GHARECHAHI J, KHARAZIAN Z A, SARIKHAN S, et al. The dynamics of the bacterial communities developed in maize silage[J]. Microbial Biotechnology, 2017, 10(6): 1663-1676. DOI:10.1111/1751-7915.12751 |
| [13] |
陶莲, 刁其玉. 青贮发酵对玉米秸秆品质及菌群构成的影响[J]. 动物营养学报, 2016, 28(1): 198-207. DOI:10.3969/j.issn.1006-267x.2016.01.026 |
| [14] |
韩吉雨.青贮发酵体系中乳酸菌多样性的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1474315
|
| [15] |
WANG M S, YANG C H, JIA L J, et al. Effect of Lactobacillus buchneri and Lactobacillus plantarum on the fermentation characteristics and aerobic stability of whipgrass silage in laboratory silos[J]. Grassland Science, 2015, 60(4): 233-239. |
| [16] |
GANDRA J R, OLIVEIRA E R, DE SENA GANDRA E R, et al. Inoculation of Lactobacillus buchneri alone or with Bacillus subtilis and total losses, aerobic stability, and microbiological quality of sunflower silage[J]. Journal of Applied Animal Research, 2016, 45(1): 609-614. |
| [17] |
JIN L, DUNIERE L, LYNCH J P, et al. Impact of ferulic acid esterase producing lactobacilli and fibrolytic enzymes on conservation characteristics, aerobic stability and fiber degradability of barley silage[J]. Animal Feed Science and Technology, 2015, 207: 62-74. DOI:10.1016/j.anifeedsci.2015.06.011 |
| [18] |
DAUGHTRY K V, JOHANNINGSMEIER S D, SANOZKY-DAWES R, et al. Phenotypic and genotypic diversity of Lactobacillus buchneri strains isolated from spoiled, fermented cucumber[J]. International Journal of Food Microbiology, 2018, 280: 46-56. DOI:10.1016/j.ijfoodmicro.2018.04.044 |
| [19] |
ZIELIŃ SKA K, FABISZEWSKA A, ŚWIATEK M, et al. Evaluation of the ability to metabolize 1, 2-propanediol by heterofermentative bacteria of the genus Lactobacillus[J]. Electronic Journal of Biotechnology, 2017, 26: 60-63. DOI:10.1016/j.ejbt.2017.01.002 |
| [20] |
REIS C B, DE OLIVEIRA DOS SANTOS A, CARVALHO B F, et al. Wild Lactobacillus hilgardii (CCMA 0170) strain modifies the fermentation profile and aerobic stability of corn silage[J]. Journal of Applied Animal Research, 2017, 46(1): 632-638. |
| [21] |
ÁVILA C L S, CARVALHO B F, PINTO J C, et al. The use of Lactobacillus species as starter cultures for enhancing the quality of sugar cane silage[J]. Journal of Dairy Science, 2014, 97(2): 940-951. DOI:10.3168/jds.2013-6987 |
| [22] |
POLUKIS S A, SMITH M L, SAVAGE R, et al. The effect of two microbial inoculants on the aerobic stability of high-moisture corn[J]. Journal of Animal Science, 2016, 94(Suppl.5): 324. |
| [23] |
WEINBERG Z G, MUCK R E. New trends and opportunities in the development and use of inoculants for silage[J]. FEMS Microbiology Reviews, 2010, 19(1): 53-68. |
| [24] |
XU Z S, HE H Y, ZHANG S S, et al. Effects of inoculants Lactobacillus brevis and Lactobacillus parafarraginis on the fermentation characteristics and microbial communities of corn stover silage[J]. Scientific Reports, 2017, 7: 13614. DOI:10.1038/s41598-017-14052-1 |
| [25] |
LIU Q H, LINDOW S E, ZHANG J G. Lactobacillus parafarraginis ZH1 producing anti-yeast substances to improve the aerobic stability of silage[J]. Animal Science Journal, 2018, 117(2): 405-416. |
| [26] |
BROBERG A, JACOBSSON K, STRÖM K, et al. Metabolite profiles of lactic acid bacteria in grass silage[J]. Applied and Environmental Microbiology, 2007, 73(17): 5547-5552. DOI:10.1128/AEM.02939-06 |
| [27] |
AMADO I R, FUCIÑOS C, FAJARDO P, et al. Pediocin SA-1:a selective bacteriocin for controlling Listeria monocytogenes in maize silages[J]. Journal of Dairy Science, 2016, 99(10): 8070-8080. DOI:10.3168/jds.2016-11121 |
| [28] |
MARCIÑAKOVÁ M, LAUKOVA A, SIMONOVÁ M P, et al. A new probiotic and bacteriocin-producing strain of Enterococcus faecium EF9296 and its use in grass ensiling[J]. Czech Journal of Animal Science, 2008, 53(8): 336-345. |
| [29] |
GANZORIG O, SUMISA F, BATDORJ B, et al. Isolation and identification of new lactic acid bacteria with potent biological activity and yeasts in airag, a traditional Mongolian fermented beverage[J]. Food Science and Technology Research, 2016, 22(5): 575-582. DOI:10.3136/fstr.22.575 |
| [30] |
PARVIN S, WANG C, LI Y, et al. Effects of inoculation with lactic acid bacteria on the bacterial communities of Italian ryegrass, whole crop maize, guinea grass and rhodes grass silages[J]. Animal Feed Science and Technology, 2010, 160(3/4): 160-166. |
| [31] |
LARA E C, BASSO F C, DE ASSIS F B, et al. Changes in the nutritive value and aerobic stability of corn silages inoculated with Bacillus subtilis alone or combined with Lactobacillus plantarum[J]. Animal Production Science, 2015, 56(11). DOI:10.1071/AN14686 |
| [32] |
GANDRA J R, OLIVEIRA E R, TAKIYA C S, et al. Chitosan improves the chemical composition, microbiological quality, and aerobic stability of sugarcane silage[J]. Animal Feed Science and Technology, 2016, 214: 44-52. DOI:10.1016/j.anifeedsci.2016.02.020 |
| [33] |
ZACHARY S.Effects of forage preservation methods, dietary starch amount and supplementation with Propionibacterium freudenreichii strain P169 on transition cow health and production, and ketosis prediction tools[D]. Ph.D.Thesis.Minneapolis: The University of Minnesota, 2015. https://search.proquest.com/docview/1698505079
|
| [34] |
PAHLOW G, MUCK R E, DRIEHUIS F, et al.Microbiology of ensiling[M]//BUXTON D R, MUCK R E, HARRISON J H.Silage science and technology.Wisconsin: American Society of Agronomy, 2003, 42: 31-94.
|
| [35] |
WOOLFORD M K. The detrimental effects of air on silage[J]. Journal of Applied Microbiology, 1990, 68(2): 101-116. |
| [36] |
WANG H L, WEI H, NING T T, et al. Characterization of culturable yeast species associating with whole crop corn and total mixed ration silage[J]. Asian-Australasian Journal of Animal Sciences, 2017, 31(2): 198-207. |
| [37] |
CARVALHO B F, ÁVILA C L S, MIGUEL M G C P, et al. Aerobic stability of sugar-cane silage inoculated with tropical strains of lactic acid bacteria[J]. Grass and Forage Science, 2015, 70(2): 308-323. DOI:10.1111/gfs.2015.70.issue-2 |
| [38] |
HAO W, WANG H L, NING T T, et al. Aerobic stability and effects of yeasts during deterioration of non-fermented and fermented total mixed ration with different moisture levels[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(6): 816-826. DOI:10.5713/ajas.14.0837 |
| [39] |
SAVAGE R M, WINDLE M C, JOHANNINGSMEIER S D, et al. The effects of strains of yeasts or Lactobacillus buchneri 40788 on the fermentation, production of volatile organic compounds (VOCs) and aerobic stability of corn silage[J]. Dairy Science, 2014, 97: 537-538. DOI:10.3168/jds.2013-7376 |
| [40] |
DANIEL J L P, CHECOLLI M, ZWIELEHNER J, et al. The effects of Lactobacillus kefiri and L. brevis on the fermentation and aerobic stability of sugarcane silage[J]. Animal Feed Science and Technology, 2015, 205: 69-74. DOI:10.1016/j.anifeedsci.2015.04.015 |
| [41] |
WILKINSON J M, DAVIES D R. The aerobic stability of silage:key findings and recent developments[J]. Grass & Forage Science, 2013, 68(1): 1-19. |
| [42] |
OLSTORPE M, JENNY B, JOHAN S, et al. Pichia anomala yeast improves feed hygiene during storage of moist crimped barley grain under Swedish farm conditions[J]. Animal Feed Science and Technology, 2010, 156(1/2): 47-56. |
| [43] |
SCHNVRER J, JONSSON A. Pichia anomala J121:a 30-year overnight near success biopreservation story[J]. Antonie van Leeuwenhoek, 2011, 99(1): 5-12. DOI:10.1007/s10482-010-9509-2 |
| [44] |
ORSI R B, CORRÊA B, POSSI C R, et al. Mycoflora and occurrence of fumonisins in freshly harvested and stored hybrid maize[J]. Journal of Stored Products Research, 2000, 36(1): 75-87. DOI:10.1016/S0022-474X(99)00029-6 |
| [45] |
张大伟, 陈林海, 朱海霞, 等. 青贮饲料中主要微生物对青贮品质的影响[J]. 饲料研究, 2007(3): 65-68. DOI:10.3969/j.issn.1002-2813.2007.03.023 |
| [46] |
JATKAUSKAS J, VROTNIAKIENE V. Evaluation of fermentation parameters, microbiological composition and aerobic stability of grass and whole crop maize silages treated with microbial inoculants[J]. Zemdirbyste-Agriculture, 2013, 100(2): 143-150. DOI:10.13080/z-a.2013.100.018 |
| [47] |
VUKMIROVĆ D M, PALIŃ D V, ŇOLOVIŃ R R, et al. The influence of bonsilage forte on fermentation and aerobic stability during alfalfa ensiling[J]. Food & Feed Research, 2011, 56(1): 15-23. |




