抗微生物内源性抗菌肽也称宿主防御肽,是由细胞前体肽原经内源蛋白酶水解加工,产生的具有成熟生物活性的多肽,具有广谱的抗菌、抗病毒、抗癌和抗寄生虫等多种生物学活性[1]。抗菌肽的主要种类有防御素、cathelicidins、S100蛋白、C型凝集素和核糖核酸酶等[2]。防御素、cathelicidins在目前研究较多,按其结构防御素又分为α-防御素[骨髓源性防御素嗜中性粒细胞肽(human neutrophil peptide,HNP)-1、2、3、4和肠源性防御素(human defensin,HD)-5、6]、β-防御素[(β-defensin,BD)-1、2、3、4、5、6]和θ-防御素;cathelicidins又分为α-螺旋cathelicidins(LL-37)、延伸-螺旋cathelicidins(来源牛的Bac4、5、7和猪的PR-39)、环状cathelicidins(来源于牛嗜中性白细胞的dodecapeptide)和β-片层cathelicidins(来源于猪白细胞的protegrins)[3]。抗菌肽的抗菌机制主要分为胞膜作用和胞内作用,除抗菌活性外,内源性抗菌肽还具有免疫调节活性,参与调节先天性和适应性免疫应答,是机体防御外来物质入侵的重要介质,同时也是机体适应环境产生的免疫活性分子[4]。内源性抗菌肽主要由动物机体免疫细胞产生,已发现它们的表达水平在一定程度上受饲粮中维生素、微量元素和必需氨基酸等营养素的诱导而变化。最新研究表明,动物饲粮中营养组分和非营养组分具有强烈诱导内源性抗菌肽表达的能力[5]。因此,了解外源途径上调内源性抗菌肽表达水平而不引起炎症反应的作用机制,以及预防和控制动物中重要的食源性病原体十分必要。
1 内源性抗菌肽的生物学功能内源性抗菌肽不仅对革兰氏阴性和革兰氏阳性细菌具有强大杀菌活性,还可以作为免疫细胞的化学引诱物,具有增强机体免疫的功能。
1.1 内源性抗菌肽的免疫调节和炎症反应抗菌肽针对病原菌的入侵具有保护作用,并作为改变宿主基因表达的有效免疫调节剂,诱导趋化因子产生,抑制脂多糖(lipopolysaccharides,LPS)或磷壁酸诱导促炎因子产生,调节树突状细胞(dendritic cells, DCs)或T细胞先天性和适应性免疫应答。
1.1.1 促进免疫细胞的趋化多数内源性抗菌肽可促进免疫细胞的趋化。它们可以通过受体依赖性机制上调趋化因子或细胞因子的表达,迅速募集单核细胞、嗜中性粒细胞和淋巴细胞集合到感染部位,发挥抗感染功能。人β-防御素(human β-defensin,hBD)-1和hBD-2可以通过人趋化因子受体6(human chemokine receptor 6,CCR6)结合趋化DCs和T淋巴细胞[6]。hBD-3与单核细胞和树突状细胞上的Toll样受体(Toll like receptors,TLR)1和TLR2相互作用,借助髓样分化因子88(myeloid differentiation primary response protein,MyD88)信号传导途径,促进白细胞介素-1受体相关激酶(interleukin-1 receptor-associated kinase,IRAK)1磷酸化,激活转录因子激活蛋白1(activator protein,AP-1)和核转录因子-κB(nuclear factor-κB,NF-κB)信号途径,诱导抗原提呈细胞炎性因子和共刺激分子CD80、CD86和CD40的表达,趋化T细胞增强机体抗原特异性免疫反应[7]。同样HNP-1、HNP-2、鼠类β-防御素和猪cathelicidin PR-39等内源性抗菌肽也可以直接或间接诱导不同免疫细胞例如单核细胞、DCs、T淋巴细胞、肥大细胞和嗜中性粒细胞到感染部位,发挥免疫反应[8]。
1.1.2 延长嗜中性粒细胞的寿命内源性抗菌肽具有延长嗜中性粒细胞寿命的能力。已发现内源性抗菌肽cathelicidin LL-37通过诱导细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)1/2的磷酸化并随后表达抗凋亡蛋白B细胞淋巴瘤/白血病-xL(B cell lymphoma/leukemia-xL,Bcl-xL),抑制天冬氨酸特异性半胱氨酸蛋白酶-3(Caspase-3)活性来延长嗜中性粒细胞凋亡过程[9]。LL-37加入到细菌代谢物刺激的巨噬细胞后,结合细菌代谢物降低其刺激巨噬细胞的能力,进而减少肿瘤坏死因子(tumor necrosis factor,TNF)-α产生[10]。存在炎性刺激物的情况下,内源性抗菌肽hBD-3靶向炎性通路TLR介导NF-κB,选择性抑制促炎症反应,启动募集和移动关键的免疫细胞增强抗炎机制,同时维持或增强关键的免疫反应[11]。
1.2 内源性抗菌肽机体生理修复作用内源性抗菌肽还存在促进其他免疫相关功能,包括促进伤口愈合、血管生成(毛细血管生长)和动脉生成(预先存在的血管的生长),诱导肥大细胞脱粒并释放组胺和前列腺素D2。鸡胚绒毛尿囊膜模型(chick embryo chorioallantoie membrane,CAM)和人脐静脉内皮细胞(human umbilical vein endothelial cells,HUVEC)试验证实,内源性抗菌肽唾液富组蛋白histatin-1促进内皮细胞黏附、迁移和血管生成[12]。在皮肤伤口的小鼠模型中,cathelicidin-OA1(来自云南臭蛙皮肤)向伤口部位募集巨噬细胞,诱导人表皮角质形成细胞(HaCaT cell)增殖和人皮肤成纤维细胞(human skin fibroblasts,HSF)迁移,加速肉芽组织形成,快速促进伤口愈合[13]。
2 内源性抗菌肽主要表达调控途径 2.1 TLR-维生素D受体(vitamin D receptor,VDR)通路外源性物质通过激活相应TLR,增强25-(OH)-D3 1α-羟化酶(25-hydroxy vitamin D3 l alppha-hydroxylase,CYP27B1)和VDR表达。细胞中CYP27B1催化25-(OH)-D3转化为1, 25-(OH)2-D3,激活VDR,引发TLR2表达,激活VDR变构随即与维甲酸X受体(RXR)形成异源二聚体识别靶基因启动子区域中维生素D效应元件(vitamin D receptor element,VDRE),刺激角化细胞、单核细胞、中性粒细胞以及上皮细胞调节抗菌肽表达,从而调控宿主免疫反应[14-15]。研究表明,皮肤损伤或病菌感染时,25-(OH)-D3羟基化为1, 25-(OH)2-D3,激活TLR2和局部细胞因子表达,进而引发局部反应,1, 25-(OH)2-D3和VDRE结合引发人cathelicidin抗菌肽基因快速表达[16]。胆汁酸介导人胆道上皮细胞中宿主防御肽基因表达也是通过VDR介导:1)1, 25-(OH)2-D3与VDR结合致使其变构,随即与RXR形成VDR:RXR二聚体,进而识别靶基因启动子区域中VDRE,启动目标基因转录;2)1, 25-(OH)2-D3存在情况下,胆汁酸刺激ERK1/2信号途径,依次诱导VDR蛋白,启动cathelicidin抗菌肽基因表达[17]。
2.2 TLR-NF-κB通路外源性物质通过激活相应TLR,招募接头分子,继而激活核转录因子NF-κB,最后启动宿主防御肽表达[18]。TLR信号传导中最常见的NF-κB激活形式是由RelA和p50组成的异源二聚体,RelA-p50与细胞中未激活的IκB(inhibitor of NF-κB)相互作用以非活性形式潜伏在细胞质中。当胞质中TLR受到胞膜陆续传递的信号后受体二聚体化,然后接头分子MyD88和Toll/白细胞介素(IL)-1受体衔接蛋白(Toll/interleukin-1 receptor domain-containing proteins,TIRAP)被募集到TLR复合物中,MyD88死亡结构域与IRAKs死亡结构域相互作用,IRAK4和IRAK1依次磷酸化并与MyD88分离,进而促进肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor6,TRAF6)的聚合和活化,招募转化生长因子β活化激酶1(transforming growth factor-β-activated kinase 1,TAK1),刺激NF-κB抑制物激酶(inhibitor of nuclear factor-κB kinase,IKK)复合物的多蛋白复合物触发IκB蛋白的32、36位丝氨酸快速磷酸化,IKK复合物由2种催化组分IKKα和IKKβ以及调节组分IKKγ(又称NEMO)组成,磷酸化的IκB蛋白从NF-κB脱落被泛素-26S蛋白酶体途径降解,从而允许RelA和p50组成的异源二聚体进入细胞核,其相应位点与内源性抗菌肽基因启动子或增强子序列特定位点发生特异性结合促进转录,调控内源性抗菌肽基因的表达,参与免疫调节和炎症反应[19-20]。
TLR信号转导通路分为MyD88依赖和β干扰素TIR结构域衔接蛋白(TIR-domain-containing adaptor inducing interferon-β,TRIF)2条不同的信号转导途径(图 1)[21]。MyD88与IRAK家族蛋白分子结合后募集并活化下游TRAF6分子,激活NF-κB等转录因子,促进相关促炎因子和宿主防御基因表达。而TRIF主要通过募集TRAF3和TRAF6分别通过TANK结合激酶(TANK-binding kinase,TBK)1和TAK1来引起NF-κB的晚期活化和干扰素调节因子(interferon regulatory factor,IRF)23的核转位,调控炎性因子和宿主防御基因表达[22]。
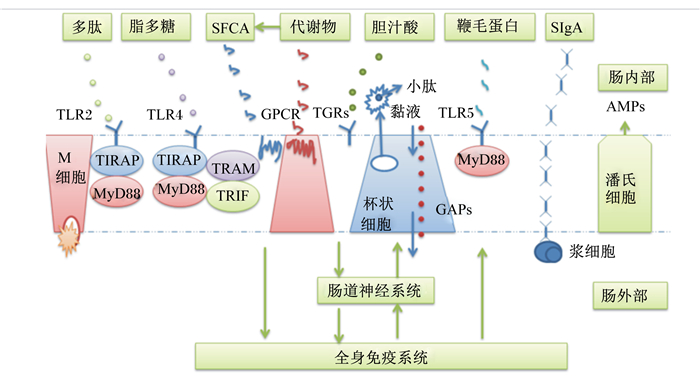
|
SFCA:短链脂肪酸short-chain fatty acids;SIgA:分泌型免疫球蛋白A secretory immunoglobulin A;TLR:Toll样受体Toll-like receptors;GPCR:G蛋白偶联受体G protein-coupled receptors;TGRs:胆汁酸膜受体bile acid receptor;AMPs:抗微生物肽antimicrobial peptides;GAPs:杯状细胞相关抗原通道goblet cell associated antigen pathway;TIRAP:Toll/IL-1受体衔接蛋白Toll/interleukin-1 receptor domain-containing proteins;TRIF:β干扰素TIR结构域衔接蛋白TIR-domain-containing adaptor inducing interferon-β;TRAM:TRIF相关接头分子TRIF-related adaptor molecule;MyD88:髓样分化因子88 myeloid differentiation primary response protein。 图 1 MyD88依赖和MyD88非依赖(TRIF)2条不同的信号转导途径 Fig. 1 Two different signaling pathways: MyD88-dependent and MyD88-independent (TRIF) |
宿主防御肽猪PR-39、人LL-37和鸡gallinacin-6等基因的5’端启动子区域中均含有与NF-κB转录因子相结合位点,NF-κB被激活时,介导宿主防御肽表达的调控,但NF-κF途径激活并不是抗菌肽基因表达上调的充分条件,许多病原模式分子可激活NF-κF途径,但不一定会上调宿主抗菌肽表达[23]。
3 饲料添加剂影响内源性抗菌肽表达已经证实,通过增强营养水平可促进动物自身免疫,并受到更多研究者认可。动物机体分泌抗菌肽依赖于大量非特异免疫调节分子刺激进而表达[24]。短链脂肪酸、肽聚糖、寡糖、维生素A、维生素D、矿物质及一些功能性养分参与调控内源性抗菌肽的表达(表 1),其应用技术日渐清晰。微生物参与先天性和适应性免疫应答的分子反应正在倍受关注。因此,可以通过添加外源营养素来增强内源性抗菌肽表达进而提高机体免疫力和降低炎症反应。
|
|
表 1 饲料添加剂影响内源性抗菌肽表达 Table 1 Feed additives affect the expression of endogenous antimicrobial peptides |
微量营养素调控动物内源性抗菌肽表达的研究主要有:1)矿物质元素。断奶仔猪饲粮中添加不同锌源可激活内源性抗菌肽PR-39基因启动子上游区域中锌指蛋白Sp-1识别位点,提高PR-39 mRNA表达量[25]。小鼠饲粮添加铁或胃肠外途径补给铁,均出现小鼠肝脏细胞抗菌肽Hepcidin mRNA的表达量与铁累积剂量呈正相关[26]。2)维生素。鸡肠上皮细胞中添加维生素D能通过与其启动子区VDRE作用提高免疫应激状态下β-防御素的表达[27]。在仔猪饲粮中添加维生素A、维生素D、维生素E均能提高小肠上皮细胞防御素-1、2、3基因的表达,并能促进其蛋白质的分泌[28]。3)氨基酸。在细胞培养基中添加5~50 μg/mL的异亮氨酸(isoleucine,Ile)可提高人结肠上皮细胞系Caco-2中hBD-2表达[29]。丙氨酸和Ile作用于小肠上皮细胞IPEC-J2,均提高猪防御素EP2c以及信号通路蛋白沉默信息调节因子2同源蛋白(silent mating type information regulation 2 homolog,Sirt)1和叉头转录因子(forkhead transcription factor,FoxO)4表达水平,推测氨基酸对防御素表达的调控与Sirt1和FoxO信号通路有关,但信号通路蛋白对不同氨基酸应答反应程度各不相同[30]。4)短链脂肪酸(short-chain fatty acids,SFCA)。SFCA刺激鸡HD11巨噬细胞和初级单核细胞,发现内源性抗菌肽的诱导表达与大部分游离脂肪烃链长度呈负相关。其中乙酸、丙酸和丁酸在鸡细胞增强内源性抗菌肽基因表达方面发挥强大协同作用,与添加1种SFCA相比,将3种SFCA混合添加更能进一步减少鸡盲肠中肠炎沙门氏菌感染,增强内源性抗菌肽基因表达而不刺激促炎IL-1β产生[5]。反刍动物牛乳腺上皮细胞试验也证明乙酸、丙酸、丁酸和己酸均能减少金黄色葡萄球菌感染牛乳腺上皮细胞,上调抗原处理相关转运体、β-防御素5基因表达[31]。因此可以推测外源性添加微养分通过诱导内源性抗菌肽表达,抵抗外源性病原体入侵以及杀死胞内定植细菌,募集更多免疫细胞进行炎症反应,从而增强机体免疫能力,促进动物健康生长。
3.2 益生菌调控内源性抗菌肽的表达益生菌对肠道微生物平衡调节、干扰肠道黏膜病原菌的定植和感染、调节机体局部或全身免疫反应、增强胃肠道上皮屏障功能、诱导细胞因子等方面发挥重要作用[32]。研究发现,其通路是益生菌直接(黏附)或间接(代谢物)促进上皮细胞表达TLRs以及多种细胞因子诱导宿主体内防御素的表达,参与宿主的先天性免疫防御。乳酸杆菌通过诱导人宫颈癌上皮细胞HeLa表达TLR2,活化NF-κB、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPKs)信号转导,促使细胞合成hBD-2和hBD-3抵抗白色念珠菌对细胞感染[33]。鼠李糖乳杆菌MLGA及其细胞壁组分完整肽聚糖(WPG)对鸡外周血单核细胞AvBD9、Cath-B1内源性抗菌肽基因表达具有促进作用,也能促进鸡外周血单核细胞细胞表面受体TLR2及细胞胞浆内模式识别受体(nucleotide binding oligomerization domain,NOD)1基因表达。鼠李糖乳杆菌MLGA肽聚糖一方面可能被细胞表面受体TLR2识别,通过TLR2介导的信号参与到体内免疫反应而发挥益生作用;另一方面,肽聚糖也可能被单核细胞吞噬后进入胞浆内被胞浆内的识别受体NOD1识别,进而激活下游信号分子如NF-1和激活蛋白-1(activator protein 1,AP-1)而启动天然免疫应答发挥益生作用[34]。酿酒酵母可上调绵羊瘤胃上皮细胞BD-1基因表达增强瘤胃天然免疫功能,同时证实,BD-1蛋白分泌至细胞外发挥其生物学作用;并推测酿酒酵母可能通过诱导或促进瘤胃在黏膜局部形成高浓度内源性抗菌肽表达,从而抑制和杀灭瘤胃内有害菌,并调节有益菌数量和种类以维持瘤胃微生态平衡,增强机体免疫力[35]。其作用宿主细胞过程中,病原体模式识别受体被结合,激活Toll样受体介导信号通路,促进机体细胞β-防御素基因表达,并由防御素作为免疫信号分子介导益生菌和机体免疫系统应答或信息交换并参与调节宿主免疫反应,继而提高动物机体免疫力。研究发现,在不影响机体正常稳态的条件下,有害菌如大肠杆菌、沙门氏菌、金黄色葡萄球菌等的添加同样也能诱导机体宿主防御肽表达,进而提高机体免疫功能。
3.3 植物提取物调控内源性抗菌肽的表达一些植物提取物可诱导机体释放内源性免疫物质,这些成分介导内源性抗菌肽基因的转录与翻译,提高内源性抗菌肽表达水平,调控机体免疫水平。白术微粉以0.5%和1.0%水平添加到仔猪饲粮中通过激活巨噬细胞、内皮细胞和平滑肌细胞等释放内源性免疫调控物质,促进PR-39和Protegrin-1的基因表达[36]。黄芪多糖肌肉注射于猪体后,生成IL-6的T淋巴细胞和单核细胞活性增强,IL-6含量增加,PR-39 mRNA表达量升高;黄芪多糖诱导IL-6的释放并通过IL-6受体激活Janus激酶/信号转导与转录激活子(the Janus kinase/signal transducer and activator of transcriptions,JAK/STAT)和Ras/NF-IL-6信号通路中JAK激酶和MAPK激酶,使STAT3和NF-IL-6转录因子磷酸化,从而诱导PR-39 mRNA的表达[37]。Park等[38]发现膳食成分——金雀异黄酮可以上调人表皮细胞内CAMP/LL-37宿主防御肽表达,其表达调控通过一种新型的信号脂-鞘氨醇磷酸酯(sphingosine-1-phosphate,S1P)依赖机制,激活雌激素-β,进而激活S1P表达,然后通过核因子途径ER-β→S1P→NF-κB→C/EBPα调控宿主防御肽表达,并通过siRNA基因沉默的方法证明人表皮细胞内CAMP/LL-37的表达不依赖于VDR机制。周洋[39]在50种中药中发现,党参、木香、白茅根和川楝子等提取物也可以诱导抗菌肽的基因表达,缓解肠道炎症的损伤,提高机体免疫力。
4 小结通过外源途径诱导内源性抗菌肽表达,是增强机体先天性免疫防御力的一种重要作用方式。调节控制动物内源性抗菌肽表达的信号通路主要有NF-κB、MAPK、Sirt和FoxO等。其中,NF-κB信号通路主要是通过LPS、脂磷壁酸、脂蛋白等诱导,氨基酸相关的信号通路主要有MAPK、Sirt、哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)、FoxO等。但对于外源性刺激的程度和种类以及具体何种受体和转录因子的参与调控还有待于进一步的研究。
| [1] |
ARNETT E, LEHRER R I, PRATIKHYA P, et al. Defensins enable macrophages to inhibit the intracellular proliferation of Listeria monocytogenes[J]. Cellular Microbiology, 2011, 13(4): 635-651. DOI:10.1111/cmi.2011.13.issue-4 |
| [2] |
蔡杰, 唐志如, 邓欢, 等. 动物肠道黏膜抗菌肽维持微生物区系平衡机制研究进展[J]. 动物营养学报, 2014, 26(8): 2071-2076. DOI:10.3969/j.issn.1006-267x.2014.08.007 |
| [3] |
广慧娟, 厉政, 王义鹏, 等. Cathelicidins家族抗菌肽研究进展[J]. 动物学研究, 2012, 33(5): 523-526. |
| [4] |
CHANU K V, THAKURIA D, KUMAR S. Antimicrobial peptides of buffalo and their role in host defenses[J]. Veterinary World, 2018, 11(2): 192-200. DOI:10.14202/vetworld. |
| [5] |
SUNKARA L T, JIANG W, ZHANG G L. Modulation of antimicrobial host defense peptide gene expression by free fatty acids[J]. PLoS One, 2012, 7(11): e49558. DOI:10.1371/journal.pone.0049558 |
| [6] |
YANG D, CHERTOV O, BYKOVSKAIA S N, et al. β-defensins:linking innate and adaptive immunity through dendritic and T cell CCR6[J]. Science, 1999, 286(5439): 525-528. DOI:10.1126/science.286.5439.525 |
| [7] |
FUNDERBURG N, LEDERMAN M M, FENG Z M, et al. Human β-defensin-3 activates professional antigen-presenting cells via Toll-like receptors 1 and 2[J]. Proceeding of the National Academy of Sciences of the United States of America, 2007, 104(47): 18631-18635. DOI:10.1073/pnas.0702130104 |
| [8] |
SCOTT M G, DAVIDSON D J, GOLD M R, et al. The human antimicrobial peptide LL-37 is a multifunctional modulator of innate immune responses[J]. The Journal of Immunology, 2002, 169(7): 3883-3891. DOI:10.4049/jimmunol.169.7.3883 |
| [9] |
NAGAOKA I, TAMURA H, HIRATA M. An antimicrobial cathelicidin peptide, human CAP18/LL-37, suppresses neutrophil apoptosis via the activation of formyl-peptide receptor-like 1 and P2X7[J]. The Journal of Immunology, 2006, 176(5): 3044-3052. DOI:10.4049/jimmunol.176.5.3044 |
| [10] |
NIJNIK A, PISTOLIC J, FILEWOD N C J, et al. Signaling pathways mediating chemokine induction in keratinocytes by cathelicidin LL-37 and flagellin[J]. Journal of Innate Immunity, 2012, 4(4): 377-386. DOI:10.1159/000335901 |
| [11] |
SEMPLE F, MACPHERSON H, WEBB S, et al. Human β-defensin 3 affects the activity of pro-inflammatory pathways associated with MyD88 and TRIF[J]. European Journal of Immunology, 2011, 41(11): 3291-3300. DOI:10.1002/eji.201141648 |
| [12] |
TORRES P, DIAZ J, ARCE M, et al. The salivary peptide histatin-1 promotes endothelial cell adhesion, migration, and angiogenesis[J]. The FASEB Journal, 2017, 31(11): 4946-4958. DOI:10.1096/fj.201700085R |
| [13] |
CAO X Q, WANG Y, WU C Y, et al. Cathelicidin-OA1, a novel antioxidant peptide identified from an amphibian, accelerates skin wound healing[J]. Scientific Reports, 2018, 8(1): 943. DOI:10.1038/s41598-018-19486-9 |
| [14] |
DIMITROV V, WHITE J H. Species-specific regulation of innate immunity by vitamin D signaling[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2016, 164: 246-253. DOI:10.1016/j.jsbmb.2015.09.016 |
| [15] |
BAKKE D, SUN J. Ancient nuclear receptor VDR with new functions:microbiome and inflammation[J]. Inflammatory Bowel Diseases, 2018, 24(6): 1149-1154. DOI:10.1093/ibd/izy092 |
| [16] |
CHUN R F, LIU N Q, LEE T, et al. Vitamin D supplementation and antibacterial immune responses in adolescents and young adults with HIV/AIDS[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2015, 148: 290-297. DOI:10.1016/j.jsbmb.2014.07.013 |
| [17] |
ARECO V, RIVOIRA M A, RODRIGUEZ V, et al. Dietary and pharmacological compounds altering intestinal calcium absorption in humans and animals[J]. Nutrition Research Reviews, 2015, 28(2): 83-99. DOI:10.1017/S0954422415000050 |
| [18] |
PARKER A, LAWSON M A E, VAUX L, et al. Host-microbe interaction in the gastrointestinal tract[J]. Environmental Microbiology, 2017. DOI:10.1111/1462-2920.13926 |
| [19] |
ZHAI Z Z, BOQUETE J P, LEMAITRE B. Cell-specific imd-NF-κB responses enable simultaneous antibacterial immunity and intestinal epithelial cell shedding upon bacterial infection[J]. Immunity, 2018, 48(5): 897-910. DOI:10.1016/j.immuni.2018.04.010 |
| [20] |
CUSHING L, WINKLER A, JELINSKY S A, et al. IRAK4 kinase activity controls Toll-like receptor-induced inflammation through the transcription factor IRF5 in primary human monocytes[J]. Journal of Biological Chemistry, 2017, 292(45): 18689-18698. DOI:10.1074/jbc.M117.796912 |
| [21] |
LACAGNINA M J, WATKINS L R, GRACE P M. Toll-like receptors and their role in persistent pain[J]. Journal of Pharmacology and Experimental Therapeutics, 2017, 184: 145-158. |
| [22] |
KIM S, PARK M K, YU H S. Toll-like receptor gene expression during Trichinella spiralis infection[J]. The Korean Journal of Parasitology, 2015, 53(4): 431-438. DOI:10.3347/kjp.2015.53.4.431 |
| [23] |
张龚炜, 周定刚, 雷荣苹, 等. 1, 25-(OH)2-D3对抗菌肽表达调控的影响[J]. 中国畜牧杂志, 2009, 45(13): 59-63. |
| [24] |
ŻELECHOWSKA P, AGIER J, BRZEZIŃ SKA-BLASZCZYK E. Endogenous antimicrobial factors in the treatment of infectious diseases[J]. Central European Journal of Immunology, 2016, 41(4): 419-425. |
| [25] |
汪以真, 王静华, 林文学, 等. 不同锌源对断奶仔猪抗菌肽PR-39 mRNA表达的影响[J]. 中国兽医学报, 2005, 25(5): 523-526. DOI:10.3969/j.issn.1005-4545.2005.05.024 |
| [26] |
PIGEON C, ILYIN G, COURSELAUD B, et al. A new mouse liver-specific gene, encoding a protein homologous to human antimicrobial peptide hepcidin, is overexpressed during iron overload[J]. Journal of Biological Chemistry, 2001, 276(11): 7811-7819. DOI:10.1074/jbc.M008923200 |
| [27] |
LU L, LI S M, ZHANG L, et al. Expression of β-defensins in intestines of chickens injected with vitamin D3 and lipopolysaccharide[J]. Genetics and Molecular Research, 2015, 14(2): 3330-3337. DOI:10.4238/2015.April.13.12 |
| [28] |
陈金永.猪β-防御素基因表达特点及维生素A的调节作用[D].博士学位论文.雅安: 四川农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10626-2010244549.htm
|
| [29] |
KONNO Y, ASHIDA T, INABA Y, et al. Isoleucine, an essential amino acid, induces the expression of human β defensin 2 through the Activation of the G-protein coupled receptor-ERK pathway in the intestinal epithelia[J]. Food and Nutrition Sciences, 2012, 3(4): 548-555. DOI:10.4236/fns.2012.34077 |
| [30] |
任曼, 宫碧霜, 靳二辉, 等. 营养、大肠杆菌和氨基酸对猪小肠上皮细胞抗菌肽和信号通路蛋白表达的影响[J]. 动物营养学报, 2016, 28(5): 1489-1495. DOI:10.3969/j.issn.1006-267X.2016.05.025 |
| [31] |
WEI Z K, XIAO C, GUO C M, et al. Sodium acetate inhibits Staphylococcus aureus internalization into bovine mammary epithelial cells by inhibiting NF-κB activation[J]. Microbial Pathogenesis, 2017, 107: 116-121. DOI:10.1016/j.micpath.2017.03.030 |
| [32] |
HICKEY D K, FAHEY J V, WIRA C R. Mouse estrous cycle regulation of vaginal versus uterine cytokines, chemokines, α-/β-defensins and TLRs[J]. Innate Immunity, 2013, 19(2): 121-131. DOI:10.1177/1753425912454026 |
| [33] |
RIZZO A, LOSACCO A, CARRATELLI C R. Lactobacillus crispatus modulates epithelial cell defense against Candida albicans through Toll-like receptors 2 and 4, interleukin 8 and human β-defensins 2 and 3[J]. Immunology Letters, 2013, 156(1/2): 102-109. |
| [34] |
艾红英.鼠李糖乳杆菌肽聚糖对鸡外周血单核细胞抗菌肽基因表达的影响及其信号转导途径[D].硕士学位论文.南昌: 江西农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10410-1016280676.htm
|
| [35] |
范燕茹, 金鑫, 田巧珍, 等. 植物乳杆菌诱导绵羊瘤胃上皮细胞SBD-1表达的信号通路途径初探[J]. 畜牧兽医学报, 2016, 47(5): 1026-1032. |
| [36] |
赵燕飞, 汪以真. 白术微粉对仔猪抗菌肽PR-39 mRNA和Protegrin-1 mRNA表达的影响[J]. 中国兽医杂志, 2008, 44(10): 50-51. DOI:10.3969/j.issn.0529-6005.2008.10.029 |
| [37] |
范阔海, 李娟娟, 张蓓, 等. 黄芪杂多糖对仔猪IL-6和PR-39表达的影响[J]. 中国畜牧兽医, 2013, 40(2): 1-5. DOI:10.3969/j.issn.1671-7236.2013.02.001 |
| [38] |
PARK K, KIM Y I, SHIN K O, et al. The dietary ingredient, genistein, stimulates cathelicidin antimicrobial peptide expression through a novel S1P-dependent mechanism[J]. The Journal of Nutritional Biochemistry, 2014, 25(7): 734-740. DOI:10.1016/j.jnutbio.2014.03.005 |
| [39] |
周洋.中药提取物对氧化及炎症诱导的果蝇肠道免疫功能的影响[D].硕士学位论文.哈尔滨: 东北林业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10225-1015665404.htm
|




