近年来,随着我国畜牧养殖业集约化程度的不断提高,畜禽生产面临的过度依赖药物和动物亚健康等问题日益凸显,比如由于饲养密度过大或管理不当等造成的仔猪断奶腹泻和肉鸡坏死性肠炎等健康问题,对养殖业造成巨大的经济损失。饲用抗生素能较好地应对健康问题并促进畜禽生长,但滥用抗生素直接影响着肉蛋奶等动物源的食品安全,对人类的健康造成潜在的危害[1],国内外正逐步禁止使用抗生素作为饲料生长促进剂[2]。因此,开发高效安全、无污染、无药物残留的免疫调节剂将是我国畜牧业目前研究的热点,是改善养殖业畜禽健康问题的一条重要途径。
植物提取物因具有低毒副、来源广、无残留等特性, 受到研究人员的广泛关注。没食子酸(gallic acid)是一种天然有机酚酸,具有多酚类和酸类物质的通性,是多种植物的主要活性成分,通常以游离酸或形成酯类化合物的形式广泛存在于茱萸叶、大叶桉、石榴皮等植物中[3-4]。作为一种有机酚酸,没食子酸具有较强的还原性,易与蛋白质、酶以及生物碱发生反应,发挥抑菌、抗氧化及抗炎等生物学作用,此外还具有抗肿瘤、抗突变、抗自由基等特性[5]。目前以没食子酸为主要活性成分的植物源饲料添加剂在畜禽生产中调控动物生长和健康以及减少抗生素使用方面已经取得了一定的效果。本文就没食子酸在动物体内的生物学功能及调控畜禽生产的效果作一综述,旨在为研究没食子酸在动物营养上的应用提供参考。
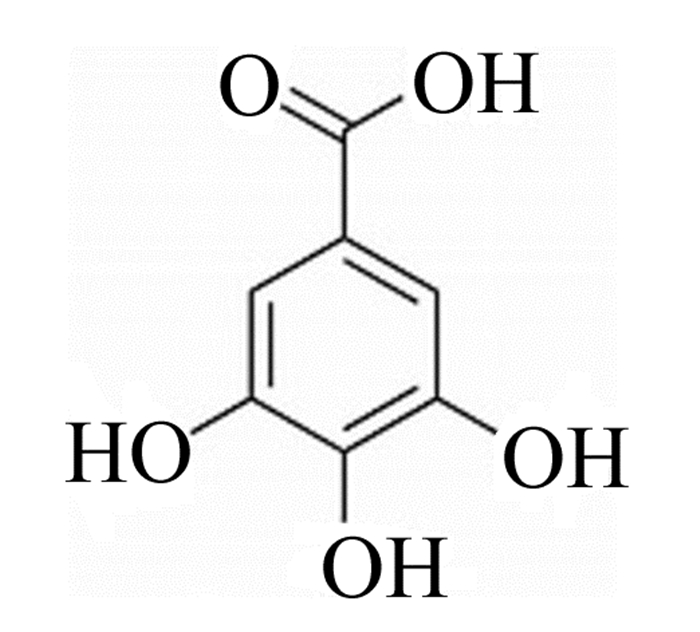
1 没食子酸的分子结构与代谢途径 1.1 没食子酸的分子结构没食子酸又名3, 4, 5-三羟基苯甲酸、五倍子酸,分子式为C6H2(OH)3COOH,分子结构如图 1所示,含有3个酚羟基和1个羧基。没食子酸可在酸、碱、酶等催化条件下制备,提取物为白色或浅褐色的针状或棱状晶体,常以一水合物的状态存在,相对分子质量为170.12[3-4]。
|
图 1 没食子酸的分子结构 Fig. 1 The molecular structure of gallic acid |
没食子酸在动物体内的代谢与多酚化合物的代谢规律基本一致。没食子酸进入机体后,在体内肠道细菌各种酶的作用下,容易发生脱羧和甲基化反应,产物主要以甲基硫酸化、葡萄糖醛酸化、硫酸化的形式存在[6-7]。代谢产物部分通过葡萄糖醛酸转移酶等从肠段转运至浆膜吸收进入血液循环,部分形成糖苷在小肠被动扩散吸收。还有的类黄酮代谢物经肠肝循环排泄至胆汁,并从肠道重新吸收[8]。目前,没食子酸在动物体内的代谢途径方面研究有限,其具体的分子转化代谢机制还有待进一步研究。
2 没食子酸的生物学功能 2.1 抑菌作用大量体外研究证实没食子酸具有显著的抑菌活性[9-13]。没食子酸对6种常见食源性致病菌和腐败菌(金黄色葡萄球菌、枯草芽孢杆菌、蜡状芽孢杆菌、巨大芽孢杆菌、单增李斯特菌、大肠杆菌)具有显著的抑制作用,对单增李斯特菌的抑制作用最好,4 mg/mL的没食子酸对以上病菌的生长曲线都有不同程度的影响[9-10]。此外,没食子酸对体外常见的沙门氏菌、铜绿假单胞菌、幽门螺旋杆菌等致病菌也有一定的生长抑制作用[11-13]。与各类抗生素相比,从抑菌直径来看,浓度为0.09 g/mL的没食子酸对金黄葡萄球菌、大肠杆菌、沙门氏菌的抑菌效果略低于0.1 g/mL的庆大霉素,显著高于0.1 g/mL的乙酰螺旋霉素,总体来说没食子酸的抑菌活性略低于庆大霉素,但要高于乙酰螺旋霉素;没食子酸对上述病原菌(如大肠杆菌、沙门氏菌、金黄色葡萄球菌等)的生物膜完整性和通透性有显著的影响,这对畜牧业中滥用抗生素引发的诸如耐药性、药物残留等问题提供了新的解决方法[11, 14]。
研究表明没食子酸的抑菌机制主要有以下2个方面:1)破坏细菌的结构完整性。没食子酸通过改变细胞表面的疏水性、负电荷减少和细胞膜局部破裂,致使膜的性质(电荷、胞内外通透性及物理化学性质)发生不可逆变化,同时胞浆中蛋白质类、离子类等细胞内容物发生渗漏,细菌出现明显的皱缩形态,体积缩小结成团,结构和功能都受到不同程度的破坏,影响细菌生长与繁殖[10, 12, 15];2)抑制细菌生物膜的体外形成。没食子酸含有酚羟基和羧基结构,具有较强的还原性,易与蛋白质和酶类等作用,从而改变细菌的代谢活动。体外厌氧培养小鼠肠道菌群的代谢模型中,没食子酸在肠道细菌酶的作用下,易发生脱羧和甲基化反应,使细菌细胞膜形态发生改变[5, 16]。
2.2 抗氧化作用没食子酸在清除自由基方面作用显著,可有效清除机体产生的多余活性氧类,保护和抑制蛋白质、脂质和DNA等受到的氧化损伤[17]。试验表明,与维生素C(VC)相比,没食子酸在一定浓度范围内,对2,2-联苯-1-苦基肼(DPPH)自由基、羟自由基有显著的清除作用,清除能力显著高于VC;对脂质过氧化作用的抑制效应也优于VC,对一氧化氮(NO)的清除能力只是略低于VC[18]。在线粒体抗氧化试验中,没食子酸能够维持线粒体膜内外的电位和渗透压,抑制和清除氧化磷酸化过程中产生的活性氧,发挥保护线粒体DNA(mtDNA)和减少蛋白质羰基化的作用[9]。
没食子酸的分子结构具有芳香环和羟基,通过共振可提高转移电子的效率,从而快速中和自由基。研究表明,没食子酸在体内往往不是直接与过氧化物作用,而是通过自身对自由基的强亲和力,发挥抗自由基的特性。所以推断没食子酸在发挥抗氧化作用的机制可能是酚羟基与自由基发生抽氢反应[9, 18-20]。另有报道称,没食子酸通过有效地下调活性氧代谢和保持较高的还原型谷胱甘肽(GSH)/氧化型谷胱甘肽(GSSG)来发挥抗氧化特性[21]。
2.3 抗炎作用没食子酸可抑制多种炎性因子的表达和活性,从而发挥抗炎作用。在小鼠足肿胀模型中,没食子酸可增强多形核白细胞(PMNs)的体外吞噬活性,通过PMNs进一步抑制髓过氧化物酶的活性,并且没食子酸的抗炎活性呈剂量依赖性[22];黄丽华等[23]用脂多糖(LPS)体外刺激RAW264.7巨噬细胞后再给予没食子酸干预,发现胞内肿瘤坏死因子-α(TNF-α)、白细胞介素(IL)-6、IL-1分泌量显著减少,细胞膜上Toll样受体4(TLR4)的表达量也有所下降,核因子-κB(NF-κB)抑制蛋白(IκB)的磷酸化水平显著降低,并抑制了NF-κB的活化。在用LPS刺激猪嗜中性粒细胞时,没食子酸发挥抗炎作用主要是通过抑制细胞磷酸二酯酶4(PDE4)的活性和减少TNF-α来介导,但与PDE4的表达量没有直接的关系[24]。在葡聚糖硫酸钠诱导的小鼠结肠炎模型中,没食子酸可有效抑制信号转录与转导因子p-STAT3Y705的激活以及在细胞核内的积累,阻止结肠黏膜中IκB的降解并抑制p65-NF-κB复合物转移进核内[25]。没食子酸还能通过抑制NF-κB和蛋白激酶B(Akt)信号通路的激活以及环氧合酶、核糖核苷酸还原等酶的活性,从而防止炎性肿瘤的发生[26]。
没食子酸的衍生物也具有抗炎作用。壳聚糖和没食子酸的衍生物可通过磷酸化丝裂原活化蛋白激酶(MAPK)通路抑制激活蛋白-1(AP-1)活性,发挥抗炎作用[27];没食子酸甲酯可抑制中性粒细胞的募集、炎症介质的分泌、炎症通路关键蛋白的磷酸化等[28],这说明没食子酸可通过多条炎症通路发挥抗炎作用。大量的细胞学研究已经证明没食子酸可抑制NF-κB的活化以及下游各种炎症因子表达水平,但其抗炎的确切分子机制还未完全阐明。
2.4 抗肿瘤作用没食子酸可通过抑制肿瘤细胞生长和诱导肿瘤细胞凋亡而发挥抗肿瘤特性[29]。体外试验表明,没食子酸在10 μmol/L以上浓度可发挥抗肿瘤作用,并在一定范围内呈剂量依赖性[30]。没食子酸抗肿瘤机制主要通过以下几点:1)细胞毒性作用。没食子酸对多种肿瘤细胞具有选择性的细胞毒性,对正常细胞生长没有影响,这主要与肿瘤细胞内转铁蛋白受体含量的增加、代谢能力异于正常细胞有关[30-31]。2)消耗GSH,诱导胞内产生活性氧。没食子酸诱导的细胞凋亡可能与活性氧和线粒体功能障碍引起的氧化应激有关,并诱导蛋白和脂类等大分子发生氧化损伤,引起肿瘤细胞死亡[32]。没食子酸也可通过消耗GSH使DNA发生氧化损伤,这主要与酶活性以及相关酶蛋白的表达量减少相关[33]。3)诱导细胞凋亡。研究表明,没食子酸可通过上调BCL2-associated X蛋白(Bax)和下调B淋巴细胞瘤-2(Bcl-2)表达诱导3T3-L1前脂肪细胞和HeLa细胞的凋亡[34-35],并且诱导细胞内效应半胱氨酸蛋白酶的活化和级联效应[36]。半胱氨酸蛋白酶是引起细胞凋亡的关键酶,一旦被信号通路激活,就能通过切割蛋白、引发核纤层和细胞骨架崩解诱导细胞凋亡[34]。此外,没食子酸还可通过诸如抗血管生成、抑制环氧合酶活性作用等方面发挥抗癌作用[27]。
3 没食子酸在畜禽生产中的应用没食子酸在欧盟可作为饲料添加剂使用,欧盟食品安全局(EFSA)全面评估了畜禽饲粮中添加没食子酸的安全性和有效性,并给出其在畜禽饲粮中的添加剂量为25 mg/kg以下[37]。我国《饲料添加剂品种目录(2013)》中规定,没食子酸丙酯可作为抗氧化剂用于养殖动物生产,而没食子酸不在饲料添加剂之列,但国内已有厂家在积极申请将没食子酸作为饲料添加剂使用。没食子酸因具有较好的抗氧化、抗炎症和抑菌等功能,且不会导致动物产生耐药性等优点,在畜禽生产中具有较强的应用前景。在畜禽生产中具有较强的应用前景。前期研究表明,饲粮中添加适量没食子酸或相关混合物可调控畜禽的生长和健康。
3.1 促生长作用在肉鸡和仔猪饲粮中添加适量的没食子酸,可促进动物生长并提高饲料转化率。Starčević等[38]研究表明,饲粮中添加5 g/kg的没食子酸可改善肉仔鸡(1~35日龄)饲料转化率。Mašek等[39]在肉仔鸡饲粮中添加5 g/kg的没食子酸,肉仔鸡1~35日龄的料重比显著降低。Samuel等[40]在肉仔鸡饲粮中添加剂量更低(25~150 mg/kg)的没食子酸,发现75或100 mg/kg的没食子酸能显著改善肉仔鸡1~42日龄的饲料转化率。Salaheen等[41]在肉仔鸡饮水中添加0.1 g/L的没食子酸,常规饲养42 d后,肉仔鸡的体重增加5.8%。韩国清等[42]在断奶仔猪饲粮中分别添加100、300、500 mg/kg的没食子儿茶素没食子酸酯,仔猪的采食量和增重显著提高。
3.2 抗氧化作用饲粮中添加没食子酸能提高机体的抗氧化性,清除体内产生的过多活性氧类物质,维持机体氧化还原系统的平衡。Samuel等[40]研究证实,在饲粮中添加75~100 mg/kg的没食子酸可改善肉仔鸡的血浆抗氧化性。Lee等[43]在肉鸡饲粮中添加0.05%和0.10%没食子酸和亚油酸混合物(1 : 1,摩尔比),机体清除DPPH自由基的活性增强,同时鸡肉的抗氧化性提高。Jung等[44]研究发现在蛋鸡饲粮中添加0.05%和0.10%没食子酸和亚油酸(1 : 1,摩尔比)混合物,鸡蛋的抗氧性提高,并且蛋黄的脂肪酸组成改善,蛋黄胆固醇水平降低。韩国清等[42]报道,没食子酸酯可降低仔猪血液中丙二醛(MDA)浓度,并提高超氧化物歧化酶和过氧化氢酶(CAT)活性。Hanczakowska等[45]将42头三元杂交育肥猪按体重分为3组,在没食子酸试验组中添加50 mg/kg的没食子酸,饲喂周期从猪体重60~113 kg,结果发现饲喂没食子酸可改善猪肉的抗氧化性,可显著降低冷冻6个月后的猪肉中硫代巴比妥酸反应物质含量。赵广永[46]在肉牛饲粮中添加5.3、10.5、21.1 g/kg DM的没食子酸,发现血浆CAT活性呈线性升高。此外,含有没食子酸及其衍生物的多酚类物质添加于动物饲粮中,对机体抗氧化机能具有改善作用。Yang等[47]研究表明,在肉仔鸡饲粮中添加7.5或15.0 mg/kg的葡萄原花青素(一种儿茶素、表儿茶素和它们的没食子酸酯的低聚物),可显著提高21和42日龄肉仔鸡的血浆超氧化物歧化酶(SOD)活性并降低42日龄肉仔鸡的MDA浓度。
3.3 改善肠道健康饲粮没食子酸可改善动物肠道形态并调节微生物多样性,从而调控动物肠道的吸收功能和健康。Mašek等[39]在肉鸡基础饲粮中添加5 g/kg没食子酸能显著提高体内总短链脂肪酸和乙酸浓度,并改善肉鸡盲肠内容物的发酵。Samuel等[40]在得出没食子酸改善肉仔鸡生长和抗氧化的同时,还发现饲粮中添加50、75、100 mg/kg的没食子酸能通过降低空肠绒毛隐窝深度并提高绒毛高度/隐窝深度(VCR),改善肉仔鸡的空肠上皮形态。Salaheen等[41]研究发现,在饮水中添加0.1 g/L的没食子酸可调节肉仔鸡的微生物菌群的多样性,增加盲肠中硬壁菌门数量并减少拟杆菌门数量,提高硬壁菌门/拟杆菌门,从而促进肉仔鸡生长。此外,饲粮添加含有没食子酸及其衍生物的多酚类物质(葡萄原花青素)也能改善肉仔鸡的肠道健康。Viveros等[48]在肉仔鸡饲粮中分别添加60 g/kg的葡萄原花青素,可丰富21日龄肉仔鸡盲肠内微生物的生物多样性,并显著提高肉仔鸡空肠的VCR。Yang等[47]研究发现,饲粮添加7.5和15.0 mg/kg的葡萄原花青素能显著降低21和42日龄肉仔鸡的空肠隐窝深度并提高空肠的VCR。
3.4 降低甲烷排放饲粮中添加一定量的没食子酸可减少反刍动物瘤胃甲烷和粪污中氧化亚氮的排放,一方面能够提高反刍动物对饲料能量的利用效率,另一方面也减少温室气体的排放改善生态环境,对反刍动物生产和环境保护都起到重要作用。赵广永[46]研究发现,与对照组相比,没食子酸添加量≥10.5 g/kg DM组降低了甲烷产量和产甲烷菌的相对丰度,线性降低了乙酸/丙酸;没食子酸添加量≥5.3 g/kg DM组改变了氮的排泄类型,提高了粪氮/尿氮,降低了尿中尿素/尿氮,这表明饲粮中添加没食子酸有利于减少肉牛甲烷和氧化亚氮的排放[49]。这与Gerrkens等[50]以干草为底物的体外培养试验中添加没食子酸抑制了甲烷生成的研究结果一致。因此,没食子酸可以作为一种潜在的肉牛瘤胃甲烷排放抑制剂。魏晨[51]报道,肉牛饲粮中添加21.1 g/kg DM的没食子酸可通过降低尿液中尿素排放、尿氮/排泄氮和尿素氮/排泄氮改变氮排泄类型。此外,没食子酸具有结合饲料蛋白质,防止微生物对蛋白质降解的效果。
4 小结与展望没食子酸的生物学功能(抑菌、抗氧化、抗炎症、抗肿瘤等)已被充分阐明,其作用机制在体外模型中也有较多的研究,并且在畜禽饲粮中适量对添加对动物的生长和机体健康也展现出较好的改善作用。因此,没食子酸在畜禽生产中应用前景广阔。
当前,没食子酸在畜禽生产中的研究和应用尚处于起步阶段,大规模的田间试验和精细的动物饲喂试验报告还很匮乏。为了在养殖生产中更好地应用没食子酸,尚需要从应用和理论研究2方面开展工作。在应用研究方面,前期研究仅限于没食子酸促进肉仔鸡和断奶仔猪生长的研究,在不同动物(蛋鸡、肉牛、肉鸭等)不同生理阶段(哺乳、生长和育肥等阶段)的应用效果有待于进一步研究。在理论研究方面,应集中于机体和肠道健康,除了常规的健康指标,还应关注没食子酸的抗炎和调控肠道健康的机理研究,包括肠道炎性因子表达和信号通路、肠道屏障中紧密连接的分子结构和蛋白表达以及黏膜免疫中效应分子的形成。通过加强没食子酸在畜禽生产中的应用效果及其作用机制的研究,可为开发应用没食子酸这种绿色添加剂提供理论依据,对提高畜禽生产效益具有重要科学意义。
| [1] |
PAPATSIROS V G, CHRISTODOULOPOULOS G, FILIPPOPOULOS L C. The use of organic acids in monogastric animals (swine and rabbits)[J]. Journal of Cell and Animal Biology, 2012, 6(10): 154-159. |
| [2] |
CASTANON J I R. History of the use of antibiotic as growth promoters in European poultry feeds[J]. Poultry Science, 2007, 86(11): 2466-2471. DOI:10.3382/ps.2007-00249 |
| [3] |
柯发敏. 没食子酸的研究进展[J]. 泸州医学院学报, 2011, 34(4): 440-442. DOI:10.3969/j.issn.1000-2669.2011.04.044 |
| [4] |
郑曙明, 黄建军, 吴青, 等. 复方五倍子有效成分的分离鉴定及抑菌活性研究[J]. 水生生物学报, 2010, 34(1): 57-64. |
| [5] |
高雅, 李骅, 王四旺, 等. 没食子酸的药理作用及其药物代谢动力学研究进展[J]. 西北药学杂志, 2014, 29(4): 435-438. DOI:10.3969/j.issn.1004-2407.2014.04.035 |
| [6] |
罗媛, 杨武, 孙慧园, 等. 没食子酸和原儿茶酸在大鼠肠道菌群中的代谢研究[J]. 沈阳药科大学学报, 2017, 34(1): 43-47. |
| [7] |
孙慧园, 覃小丽, 梅朝叶, 等. 头花蓼有效组分中没食子酸、原儿茶酸在模式生物斑马鱼中的代谢研究[J]. 中国药理学通报, 2017, 33(3): 388-393. DOI:10.3969/j.issn.1001-1978.2017.03.019 |
| [8] |
LIPIŃ SKI K, MAZUR M, ANTOSZKIEWICZ Z, et al. Polyphenols in monogastric nutrition-a review[J]. Annals of Animal Science, 2017, 17(1): 41-58. |
| [9] |
张雅丽, 李建科, 刘柳, 等. 五倍子没食子酸研究进展[J]. 食品工业科技, 2013, 34(10): 386-390. |
| [10] |
SHAO D Y, LI J, LI J, et al. Inhibition of gallic acid on the growth and biofilm formation of Escherichia coli and Streptococcus mutans[J]. Journal of Food Science, 2015, 80(6): M1299-M1305. DOI:10.1111/1750-3841.12902 |
| [11] |
LÍPEZ-ROMERO J C, VALENZUELA-MELENDRES M, JUNEJA V K, et al. Effects and interactions of gallic acid, eugenol and temperature on thermal inactivation of Salmonella spp.in ground chicken[J]. Food Research International, 2017, 103: 289-294. |
| [12] |
BORGES A, FERREIRA C, SAAVEDRA M J, et al. Antibacterial activity and mode of action of ferulic and gallic acids against pathogenic bacteria[J]. Microbial Drug Resistance, 2013, 19(4): 256-265. DOI:10.1089/mdr.2012.0244 |
| [13] |
DÍAZ-GÍMEZ R, LÍPEZ-SOLÍS R, OBREQUE-SLIER E, et al. Comparative antibacterial effect of gallic acid and catechin against Helicobacter pylori[J]. LWT-Food Science and Technology, 2013, 54(2): 331-335. DOI:10.1016/j.lwt.2013.07.012 |
| [14] |
王广娟.五倍子没食子酸的提取、纯化及抑菌效果研究[D].硕士学位论文.保定: 河北农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-11920-2010138575.htm
|
| [15] |
张雅丽.五倍子没食子酸的制备、抑菌作用及机理研究[D].硕士学位论文.西安: 陕西师范大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10718-1014106273.htm
|
| [16] |
KANG M S, OH J S, KANG I C, et al. Inhibitory effect of methyl gallate and gallic acid on oral bacteria[J]. Journal of Microbiology, 2008, 46(6): 744-750. DOI:10.1007/s12275-008-0235-7 |
| [17] |
YEN G C, DUH P D, TSAI H L. Antioxidant and pro-oxidant properties of ascorbic acid and gallic acid[J]. Food Chemistry, 2002, 79(3): 307-313. DOI:10.1016/S0308-8146(02)00145-0 |
| [18] |
谢晓艳, 刘洪涛, 张吉, 等. 没食子酸体外抗氧化作用研究[J]. 重庆医科大学学报, 2011, 36(3): 319-322. |
| [19] |
FLORA S J S. Structural, chemical and biological aspects of antioxidants for strategies against metal and metalloid exposure[J]. Oxidative Medicine and Cellular Longevity, 2009, 2(4): 191-206. DOI:10.4161/oxim.2.4.9112 |
| [20] |
VERGAUWEN H, PRIMS S, DEGROOTE J, et al. In vitro investigation of six antioxidants for pig diets[J]. Antioxidants, 2016, 5(4): E41. DOI:10.3390/antiox5040041 |
| [21] |
KIM Y J. Antimelanogenic and antioxidant properties of gallic acid[J]. Biological and Pharmaceutical Bulletin, 2007, 30(6): 1052-1055. DOI:10.1248/bpb.30.1052 |
| [22] |
KROES B H, VAN DEN BERG A J, VAN UFFORD H C Q, et al. Anti-inflammatory activity of gallic acid[J]. Planta Medica, 1992, 58(6): 499-504. DOI:10.1055/s-2006-961535 |
| [23] |
黄丽华, 侯林, 薛海南, 等. 没食子酸通过拮抗脂多糖诱导的TLR4/NF-κB活化抑制RAW264.7巨噬细胞炎性反应[J]. 细胞与分子免疫学杂志, 2016, 32(12): 1610-1614. |
| [24] |
JIANG D X, ZHANG M H, ZHANG Q, et al. Influence of gallic acid on porcine neutrophils phosphodiesterase 4, IL-6, TNF-α and rat arthritis model[J]. Journal of Integrative Agriculture, 2015, 14(4): 758-764. DOI:10.1016/S2095-3119(14)60824-8 |
| [25] |
PANDURANGAN A K, MOHEBALI N, ESA N M, et al. Gallic acid suppresses inflammation in dextran sodium sulfate-induced colitis in mice:possible mechanisms[J]. International Immunopharmacology, 2015, 28(2): 1034-1043. |
| [26] |
VERMA S, SINGH A, MISHRA A. Gallic acid:molecular rival of cancer[J]. Environmental Toxicology and Pharmacology, 2013, 35(3): 473-485. DOI:10.1016/j.etap.2013.02.011 |
| [27] |
AHN C B, JUNG W K, PARK S J, et al. Gallic Acid-g-chitosan modulates inflammatory responses in LPS-stimulated RAW264.7 cells via NF-κB, AP-1, and MAPK pathways[J]. Inflammation, 2016, 39(1): 366-374. |
| [28] |
CORREA L B, PÁDUA T A, SEITO L N, et al. Anti-inflammatory effect of methyl gallate on experimental arthritis:inhibition of neutrophil recruitment, production of inflammatory mediators, and activation of macrophages[J]. Journal of Natural Products, 2016, 79(6): 1554-1566. DOI:10.1021/acs.jnatprod.5b01115 |
| [29] |
YOU B R, PARK W H. Gallic acid-induced lung cancer cell death is related to glutathione depletion as well as reactive oxygen species increase[J]. Toxicology in Vitro, 2010, 24(5): 1356-1362. DOI:10.1016/j.tiv.2010.04.009 |
| [30] |
KAUR M, VELMURUGAN B, RAJAMANICKAM S, et al. Gallic acid, an active constituent of grape seed extract, exhibits anti-proliferative, pro-apoptotic and anti-tumorigenic effects against prostate carcinoma xenograft growth in nude mice[J]. Pharmaceutical Research, 2009, 26(9): 2133-2140. DOI:10.1007/s11095-009-9926-y |
| [31] |
李沐涵, 殷美琦, 冯靖涵, 等. 没食子酸抗肿瘤作用研究进展[J]. 中医药信息, 2011, 28(1): 109-111. |
| [32] |
CHEN H M, WU Y C, CHIA Y C, et al. Gallic acid, a major component of Toona sinensis leaf extracts, contains a ROS-mediated anti-cancer activity in human prostate cancer cells[J]. Cancer Letters, 2009, 286(2): 161-171. DOI:10.1016/j.canlet.2009.05.040 |
| [33] |
KOBAYASHI H, OIKAWA S, HIRAKAWA K, et al. Metal-mediated oxidative damage to cellular and isolated DNA by gallic acid, a metabolite of antioxidant propyl gallate[J]. Mutation Research/Genetic Toxicology and Environmental Mutagenesis, 2004, 558(1/2): 111-120. |
| [34] |
HSU C L, LO W H, YEN G C. Gallic acid induces apoptosis in 3T3-L1 pre-adipocytes via a fas-and mitochondrial-mediated pathway[J]. Journal of Agricultural and Food Chemistry, 2007, 55(18): 7359-7365. DOI:10.1021/jf071223c |
| [35] |
YOU B R, HWAJIN M, HAN Y H, et al. Gallic acid inhibits the growth of HeLa cervical cancer cells via apoptosis and/or necrosis[J]. Food and Chemical Toxicology, 2010, 48(5): 1334-1340. DOI:10.1016/j.fct.2010.02.034 |
| [36] |
GREEN D R, REED J C. Mitochondria and apoptosis[J]. Science, 1998, 281(5381): 1309-1312. DOI:10.1126/science.281.5381.1309 |
| [37] |
EFSA Panel on Additives and Products or Substances Used in Animal Feed (FEEDAP). Scientific Opinion on the safety and efficacy of benzyl alcohols, aldehydes, acids, esters and acetals (chemical group 23) when used as flavourings for all animal species[J]. EFSA Journal, 2012, 10(7): 2785. |
| [38] |
STARČEVIĆ K, KRSTULOVIĆ L, BROZIĆ D, et al. Production performance, meat composition and oxidative susceptibility in broiler chicken fed with different phenolic compounds[J]. Journal of the Science of Food and Agriculture, 2015, 95(6): 1172-1178. DOI:10.1002/jsfa.2015.95.issue-6 |
| [39] |
MAŠEK T, STAR ČEVIĆ K, MIKULECŽ. The influence of the addition of thymol, tannic acid or gallic acid to broiler diet on growth performance, serum malondialdehyde value and cecal fermentation[J]. European Poultry Science, 2014, 78: 1-8. |
| [40] |
SAMUEL K G, WANG J, YUE H Y, et al. Effects of dietary gallic acid supplementation on performance, antioxidant status, and jejunum intestinal morphology in broiler chicks[J]. Poultry Science, 2017, 96(8): 2768-2775. |
| [41] |
SALAHEEN S, KIM S W, HALEY B J, et al. Alternative growth promoters modulate broiler gut microbiome and enhance body weight gain[J]. Front in Microbiology, 2017, 8: 2088. DOI:10.3389/fmicb.2017.02088 |
| [42] |
韩国清, 朱晓彤, 束刚, 等. 自由基清除剂对仔猪生长及血液氧化代谢相关指标的影响[J]. 畜牧与兽医, 2012, 44(Suppl.1): 274-275. |
| [43] |
LEE K H, JUNG S, KIM H J, et al. Effect of dietary supplementation of the combination of gallic and linoleic acid in thigh meat of broilers[J]. Asian-Australasian Journal of Animal Sciences, 2012, 25(11): 1641-1648. DOI:10.5713/ajas.2012.12260 |
| [44] |
JUNG S, HAN B H, NAM K, et al. Effect of dietary supplementation of gallic acid and linoleic acid mixture or their synthetic salt on egg quality[J]. Food Chemistry, 2011, 129(3): 822-829. DOI:10.1016/j.foodchem.2011.05.030 |
| [45] |
HANCZAKOWSKA E, ŚWIATKIEWICZ M. Gallic acid or sage extract supplement in feed mixtures for finishing pigs[J]. Journal of Animal and Feed Sciences, 2005, 14(1): 353-356. |
| [46] |
赵广永.没食子酸对肉牛瘤胃发酵、营养物质消化及氮排放的影响[C]//中国畜牧兽医学会动物营养学分会第十二次动物营养学术研讨会论文集.北京: 中国农业大学出版社, 2016: 489.
|
| [47] |
YANG J Y, ZHANG H J, WANG J, et al. Effects of dietary grape proanthocyanidins on the growth performance, jejunum morphology and plasma biochemical indices of broiler chicks[J]. Animal, 2016, 11(5): 762-770. |
| [48] |
VIVEROS A, CHAMORRO S, PIZARRO M, et al. Effects of dietary polyphenol-rich grape products on intestinal microflora and gut morphology in broiler chicks[J]. Poultry Science, 2011, 90(3): 566-578. DOI:10.3382/ps.2010-00889 |
| [49] |
WEI C, YANG K, ZHAO G Y, et al. Effect of dietary supplementation of gallic acid on nitrogen balance, nitrogen excretion pattern and urinary nitrogenous constituents in beef cattle[J]. Archives of Animal Nutrition, 2016, 70(5): 416-423. DOI:10.1080/1745039X.2016.1214345 |
| [50] |
GEERKENS C H, SCHWEIGGERT R M, STEINGASS H, et al. Influence of apple and citrus pectins, processed mango peels, a phenolic mango peel extract, and gallic acid as potential feed supplements on in vitro total gas production and rumen methanogenesis[J]. Journal of Agricultural and Food Chemistry, 2013, 61(24): 5727-5737. DOI:10.1021/jf401544v |
| [51] |
魏晨.没食子酸和缩合单宁对体外瘤胃发酵及肉牛营养物质消化、甲烷产量和氮代谢影响的研究[D].博士学位论文.北京: 中国农业大学, 2017. http://cdmd.cnki.com.cn/Article/CDMD-10019-1017157057.htm
|




