2. 甘肃农业大学动物科技学院, 兰州 730020
2. College of Animal Science and Technology, Gansu Agricultural University, Lanzhou 730020, China
断奶应激是犊牛饲育过程中必须面对的一个问题,过去十多年的研究报道证明断奶应激对犊牛的生长发育和生产性能有不利影响,包括生长速度减慢和消化率降低[1-3]。近年来,人们越来越关注犊牛早期的免疫状况和健康问题,断奶应激不仅会损害断奶犊牛的固有免疫,增加其患病风险[4-6],还会引起自发性免疫系统疾病[7],导致生产能力下降甚至死亡。血液中免疫细胞数量的变化可体现断奶应激引起的免疫应答[8-10]。断奶应激还会引起血浆中去甲肾上腺素和皮质醇水平的升高[7-8, 11],急性期蛋白分泌量的增加[8, 11]和促炎性细胞因子基因表达量的上调[10, 12]。断奶应激损害犊牛免疫功能的研究报道越来越受到重视,但目前关于断奶应激影响犊牛健康和免疫功能的研究中尚存在争议。尽管已有文献综述了断奶应激对幼龄反刍动物免疫系统的影响[13],但一般综述存在主观定性并且不能对研究之间的变异性给出解释的缺点。Meta分析是针对同一科学问题而开展的多个独立研究结果进行方差合并及定量分析的统计学方法,是一种客观定量的研究方法。因此,本文使用Meta分析方法定量化地合并断奶应激对犊牛免疫功能的影响,旨在为缓解断奶应激、保护动物健康以及相关研究提供科学依据。
1 材料与方法 1.1 文献检索在Web of Science、PubMed、Elsevier、Science Direct、Wiley Online Library、Springer、Taylor & Francis Online等英文数据库中输入“weaning”、“calves”和“immunity”等关键词;在中国知网、万方数据库、维普数据库、中国科学引文数据库(CSCD)等中文数据库输入“断奶”、“犊牛”和“免疫”等关键词。检索时间范围为2000—2018年,查阅相关文献(不包括会议论文、未发表论文和非核心期刊论文)。
1.2 文献筛选根据关键词检索发表时间为2000—2018年的文献,对获得的文献按照以下标准进行筛选:1)文献研究目的是断奶应激对免疫功能的影响;2)研究中不包含有促生长、抗氧化和抗生素等功能的添加剂,以牛奶或代乳粉为主要饲粮,同时可补饲开食料;3)研究中包含血细胞分型测定、皮质醇激素测定和急性期蛋白测定数据; 4)文献语言为中文或英文。所有文献的筛选和提取资料由2名研究者独立完成并进行复核。按照文献检索规则检索到的文献共2 565篇,其中排除重复文献、会议论文、未发表论文、非核心期刊论文和非SCI论文1 426篇。通过阅读文献题目和摘要排除非断奶应激、非犊牛文献和综述781篇。进一步阅读全文,排除不符合纳入标准的文献347篇,最终纳入研究的文献有11篇,即文献[7-12, 14-18]。
1.3 数据提取从被选用的文献中提取以下数据:试验设计、试验处理、动物品种、断奶日龄、动物体重、动物数量、试验结果(每微升血液中白细胞、中性粒细胞、淋巴细胞、单核细胞数量以及皮质醇、触珠蛋白、纤维蛋白原浓度,提取各文献资料的平均值和标准差)。其中,4篇文献(文献[7-8, 16-17])包含2个不同处理的试验组,所以分为2个研究提取数据和分析,并在文中用(1)和(2)进行区分,例如Hickey等[8](1)、Hickey等[8](2)。
1.4 数据特征本研究共纳入11篇文献,包括15个研究,共293头犊牛。所有纳入的单独研究中不包含任何添加剂。其中7篇文献(文献[7-9, 12, 14-16])使用的试验动物是荷斯坦奶牛或荷斯坦杂交牛,3篇文献(文献[10, 17-18])使用的是西门塔尔牛,1篇文献(文献[11])使用的是阿基坦杂种牛。有8篇文献(文献[8-11, 14, 16-18])中犊牛断奶日龄大于200日龄,3篇文献(文献[7, 12, 15])中犊牛断奶日龄小于100日龄。所有文献中只有1篇文献(文献[12])使用了代乳粉,其他文献均为母乳饲喂。所有研究都排除了患病、严重腹泻和使用药物的犊牛。
1.5 统计方法采用Stata 14.0软件对所提取的数据资料进行Meta分析。1)效应尺度选择:由于所纳入文献结局指标为连续性变量,且各研究测定方法、时间及表达单位不完全一致,故选择标准化均数差(standardized mean difference, SMD)为效应尺度,并计算其95%置信区间(confidence interval, CI)。根据纳入文献中的观测时间分为断奶后1~3 d、5~8 d和11~14 d 3个时间段。2)Meta分析:采用Inverse Variance法合并效应量[19]。3)异质性检验和处理:各纳入研究结果间的异质性采用X2检验,当异质性检验结果为P<0.100、I2>50%时,认为纳入的多个研究结果间有异质性[20],根据异质性检验结果选择固定效应模型或随机效应模型,采用Meta回归分析探讨异质性产生的原因。4)敏感性分析:分别将效应量偏离明显的研究排除或者纳入,评价其对合并效应量和异质性的影响,评价结果稳定性。5)发表偏倚:采用漏斗图分析的方法检验是否存在发表偏倚。当P < 0.05时认为差异显著。
2 结果与分析 2.1 断奶后犊牛血液中白细胞数量的Meta分析犊牛断奶后3个时间段血液中白细胞数量变化不存在研究间异质性(1~3 d:P=0.086,I2=39.4%;5~8 d:P=0.165,I2=28.5%;11~14 d:P=0.174,I2=31.8%),故采用固定效应模型合并效应量(图 1)。结果表明,断奶应激对断奶后1~3 d、5~8 d和11~14 d犊牛血液中白细胞数量无显著影响(P>0.05)。
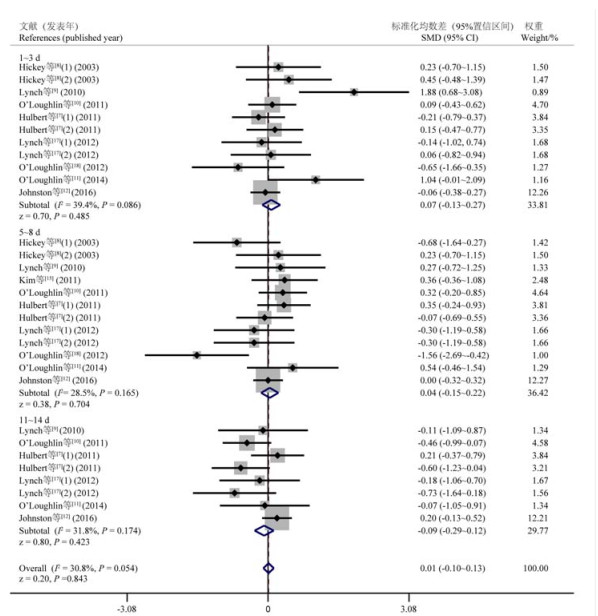
|
Subtotal:亚组分析结果subgroup analysis result;Overall:总体分析结果total analysis result。下图同The same as below 图 1 断奶后3个时间段血液中白细胞数量变化的森林图 Fig. 1 Forest plot of blood total leukocyte number changes in three post-weaning periods |
异质性检验结果显示断奶后3个时间段各研究间存在异质性(1~3 d:P=0.024,I2=51.4%;5~8 d:P<0.001,I2=77.0%;11~14 d:P=0.043,I2=51.7%)。Meta回归分析结果表明发表年份是异质性来源(P=0.008),并解释了73.48%的异质性来源,故采用随机效应模型合并效应量(图 2)。结果表明,断奶应激可导致断奶后1~3 d犊牛血液中中性粒细胞数量显著升高(P < 0.001),断奶应激对断奶后5~8 d和11~14 d犊牛血液中中性粒细胞数量无显著影响(P>0.05)。
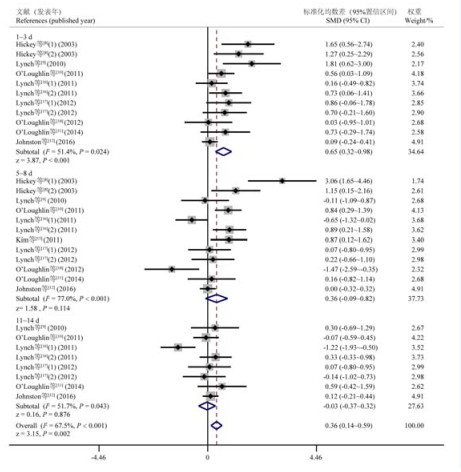
|
图 2 断奶后3个时间段血液中中性粒细胞数量变化的森林图 Fig. 2 Forest plot of blood neutrophil number changes in three post-weaning periods |
异质性检验结果显示断奶后3个时间段各研究间存在异质性(1~3 d:P<0.001,I2=71.1%;5~8 d:P<0.001,I2=70.7%;11~14 d:P=0.016,I2=59.2%)。Meta回归分析结果表明发表年份是异质性来源(P=0.024),并解释了71.18%的异质性来源,故采用随机效应模型合并效应量(图 3)。结果表明,断奶应激可导致断奶后1~3 d犊牛血液中淋巴细胞数量显著降低(P < 0.001),断奶应激对断奶后5~8 d和11~14 d犊牛血液中淋巴细胞数量无显著影响(P>0.05)。
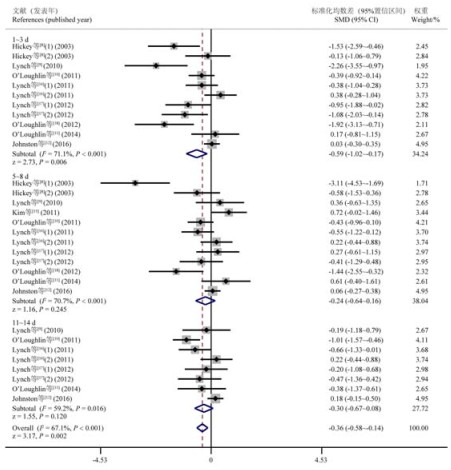
|
图 3 断奶后3个时间段血液中淋巴细胞数量变化的森林图 Fig. 3 Forest plot of blood lymphocyte number changes in three post-weaning periods |
异质性检验结果显示断奶后3个时间段各研究间不存在异质性(P>0.100,I2 < 50%),故采用固定效应模型合并效应量(图 4)。结果表明,断奶应激对断奶后1~3 d和5~8 d犊牛血液中单核细胞数量无显著影响(P>0.05),断奶应激可导致断奶后11~14 d犊牛血液中单核细胞数量显著降低(P=0.015)。
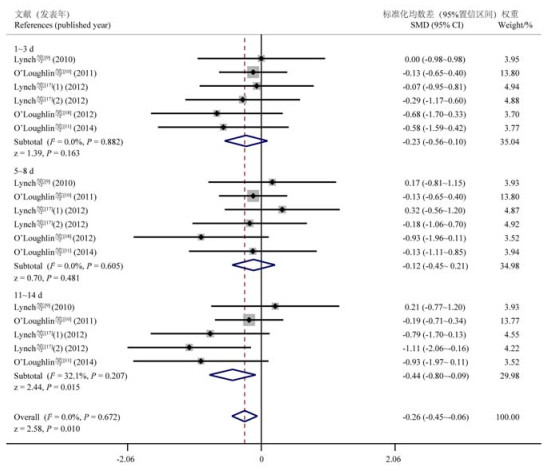
|
图 4 断奶后3个时间段血液中单核细胞数量变化的森林图 Fig. 4 Forest plot of blood monocyte number changes in three post-weaning periods |
异质性检验结果显示断奶后2个时间段各研究间存在异质性(1~3 d:P=0.016,I2=61.5%;5~8 d:P=0.021,I2=59.7%)。Meta回归分析结果表明发表年份、样本数量、断奶日龄、初始体重和品种因素的P值均大于0.1,都未能解释异质性来源,因此采用随机效应模型合并效应量(图 5)。结果表明,断奶应激可导致断奶后1~3 d犊牛血液中皮质醇浓度显著升高(P=0.046),断奶应激对断奶后5~8 d犊牛血液中皮质醇浓度无显著影响(P>0.05),断奶应激可使断奶后11~14 d犊牛血液中皮质醇浓度显著升高(P=0.001)。
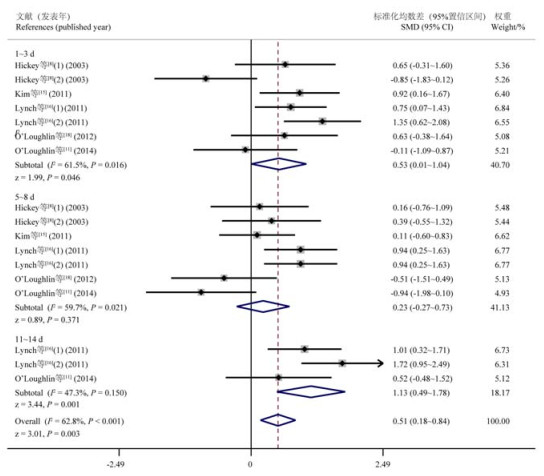
|
图 5 断奶后3个时间段皮质醇浓度变化的森林图 Fig. 5 Forest plot of blood cortisol concentration changes in three post-weaning periods |
异质性检验结果显示断奶后2个时间段各研究间存在异质性(5~8 d:P<0.001,I2=75.2%;11~14 d:P=0.003,I2=72.1%)。Meta回归分析结果表明发表年份、样本数量、断奶日龄、初始体重和品种因素的P值均大于0.1,都未能解释异质性来源,因此采用随机效应模型合并效应量(图 6)。结果表明,断奶应激可导致断奶后1~3 d(P<0.001)、5~8 d(P=0.007)和11~14 d(P=0.006)犊牛血液中触珠蛋白浓度显著升高。
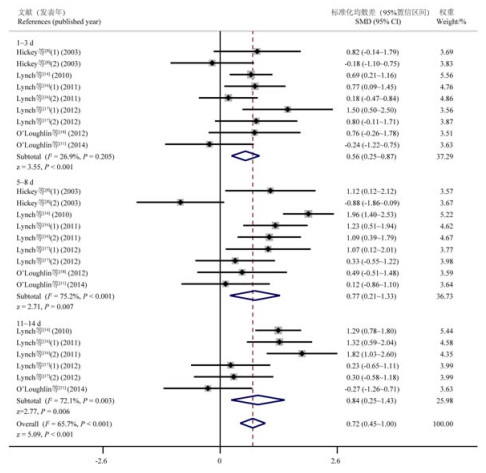
|
图 6 断奶后3个时间段触珠蛋白浓度变化的森林图 Fig. 6 Forest plot of blood haptoglobin concentration changes in three post-weaning periods |
异质性检验结果显示断奶后11~14 d各研究间存在异质性(P=0.072,I2=53.4%)。Meta回归分析结果表明发表年份、样本数量、断奶日龄、初始体重和品种因素的P值均大于0.100,都未能解释异质性来源,因此采用随机效应模型合并效应量(图 7)。结果表明,断奶应激可导致断奶后1~3 d(P < 0.001)、5~8 d(P < 0.001)和11~14 d(P<0.001)犊牛血液中纤维蛋白原浓度显著升高。
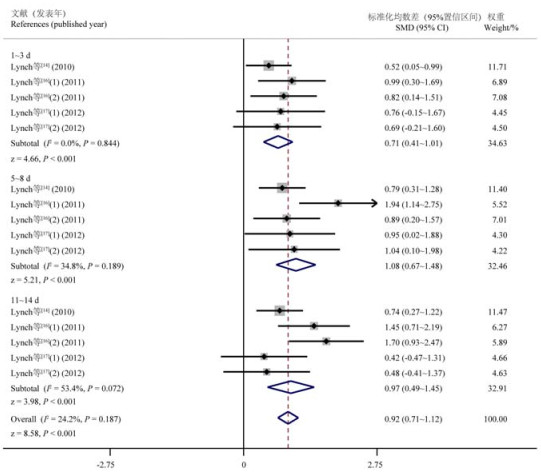
|
图 7 断奶后3个时间段血液中纤维蛋白原浓度变化的森林图 Fig. 7 Forest plot of blood fibrinogen concentration changes in three post-weaning periods |
断奶应激显著地影响了犊牛血液中中性粒细胞、淋巴细胞数量及皮质醇、触珠蛋白和纤维蛋白原浓度,但部分结果中异质性较高(表 1),需评估结果的稳定性和可信度。敏感性分析结果表明中性粒细胞数量在断奶后1~3 d和11~14 d敏感性分析中分别有1个研究的合并效应量明显偏离了总体的合并效应量,断奶后1~3 d剔除Johnston等[12]的研究和断奶后11~14 d剔除Lynch等[16]的研究后发现,断奶后1~3 d(P=0.024 vs. P=0.198,I2=51.4% vs. I2=26.7%)和11~14 d(P=0.043 vs. P=0.900,I2=51.7% vs. I2=0.0%)的中性粒细胞数量异质性发生改变,但并未影响断奶后1~3 d(P < 0.001 vs. P < 0.001)和11~14 d(P=0.876 vs. P=0.292)的结果,说明结果敏感性低且稳定。对淋巴细胞数量的敏感性分析表明,断奶后5~8 d和11~14 d存在合并效应量明显偏离总体的研究,断奶后1~3 d剔除Hickey等[8]和O’Loughlin等[18]的研究和断奶后11~14 d剔除O’Loughlin等[10]的研究后发现,断奶后1~3 d(P=0.001 vs. P=0.125,I2=70.7% vs. I2=35.4%)和11~14 d(P=0.016 vs. P=0.307,I2=59.2% vs. I2=16.1%)的淋巴细胞数量异质性发生了改变,但并未影响断奶后5~8 d(P=0.245 vs. P=0.964)和11~14 d(P=0.120 vs. P=0.512)的结果,说明结果敏感性低且可信度高。对皮质醇浓度的敏感性分析表明,断奶后1~3 d和5~8 d分别有2个研究的合并效应量明显偏离了总体的合并效应量,断奶后1~3 d剔除Hickey等[8]的研究和断奶后5~8 d剔除O’Loughlin等[11]的研究后发现,断奶后1~3 d(P=0.016 vs. P=0.327,I2=61.5% vs. I2=13.6%)和5~8 d(P=0.021 vs. P=0.126,I2=59.7% vs. I2=41.9%)的皮质醇浓度异质性发生了改变,但并未影响断奶后1~3 d(P=0.046 vs. P < 0.001)和5~8 d(P=0.371 vs. P=0.066)的结果,说明结果敏感性低且可信度高。对触珠蛋白浓度的敏感性分析表明,断奶后5~8 d有1个研究的合并效应量明显偏离了总体,将其剔除后异质性有所降低(P=0.001 vs. P=0.016,I2=75.2% vs. I2=59.3%),但剔除后并未影响结果(P=0.007 vs. P < 0.001),说明结果稳定可信。对纤维蛋白原浓度的敏感性分析表明,断奶后11~14 d有1个研究的合并效应量明显偏离了总体,将其剔除后异质性有所降低(P=0.072 vs. P=0.239,I2=53.4% vs. I2=28.9%),但剔除后并未影响结果(P<0.001 vs. P < 0.001),说明结果稳定性好,可信度高。
|
|
表 1 通过Meta分析总结断奶应激对犊牛免疫功能的影响 Table 1 Summary of effect of weaning stress on immunity of calves from Meta-analysis |
使用Stata 14软件对纳入的研究制作漏斗图,结果如图 8所示。对于单核细胞数量的研究均在漏斗图内部,但对称性差且分布在漏斗图下部,说明研究的样本量少且试验的精确度较低。对于中性粒细胞和淋巴细胞数量的研究,在3个时间段均有研究不在漏斗图内,但多数研究分布于漏斗图上部且向中间集中,说明研究的样本量大且试验的精确度高。对于触珠蛋白、纤维蛋白原和皮质醇浓度的研究,均有不在漏斗图内部的研究,且研究大多分布于漏斗图下部且对称性差,说明研究存在少量的发表偏倚。
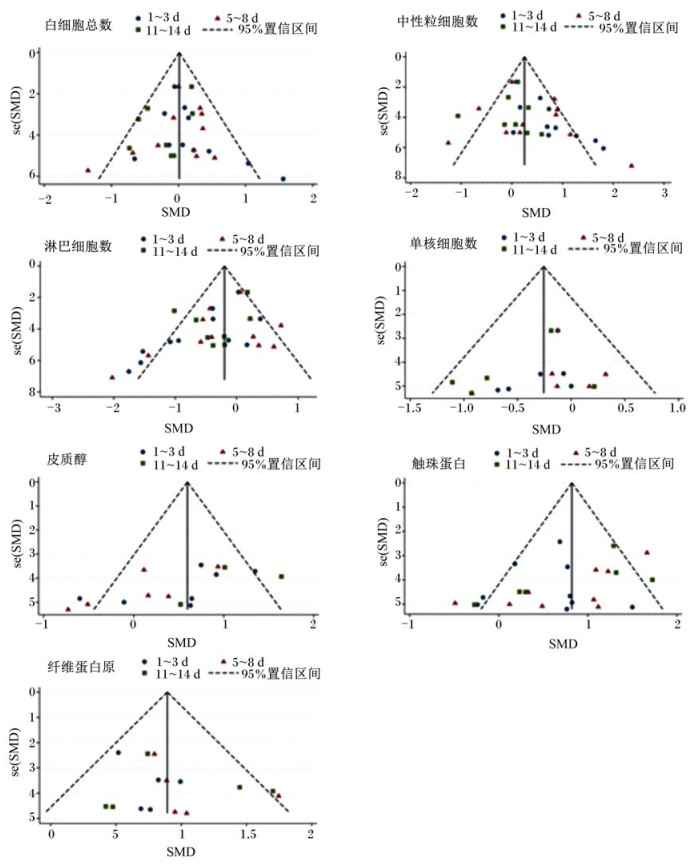
|
图 8 断奶后3个时间段95%置信区间的漏斗图 Fig. 8 Funnel plot with pseudo 95% CI for three post-weaning periods |
犊牛断奶时,应激主要是通过糖皮质激素和其受体影响免疫系统功能[21]。应激和炎症因子可通过刺激下丘脑-垂体-肾上腺(HPA)轴引起交感神经兴奋[22],下丘脑释放促肾上腺皮质激素释放激素(CRH)和血管增压素(VP),二者协同调控肾上腺皮质分泌糖皮质激素[23-24]。糖皮质激素通过自由扩散的方式穿过细胞膜进入靶细胞,激活细胞质中的糖皮质激素受体(GR),GR进入细胞核对靶基因进行核转录调控从而影响反刍动物的免疫系统[25]。本研究中,Meta分析结果表明断奶应激可导致犊牛断奶后1~3 d和11~14 d血液中皮质醇浓度显著升高。但断奶后1~3 d和5~8 d各研究间存在异质性,且Meta回归分析未能解释异质性来源。根据敏感性分析结果,有2个研究的合并效应量明显偏离了总体的合并效应量,将其剔除后结果未发生改变,但异质性明显降低。分析其原因,在Hickey等[8]的研究中显示犊牛断奶后设置的血液采集时间点未能观察到皮质醇浓度在血液中的变化,这可能是造成其结果与其他研究不一致的原因。在O’Loughlin等[11]的研究中显示,断奶后犊牛血液中皮质醇浓度的检测结果可能受到频繁采样的影响;此外,在此研究中断奶前犊牛以放牧方式饲养,断奶时转为舍饲,这可能是导致对照组血液中皮质醇浓度升高的一个原因。
3.2 断奶应激对血液中免疫细胞数量的影响犊牛断奶时免疫系统尚未发育完全,以固有免疫为主,因此血液中免疫细胞数量的变化可直接反映机体的生理和免疫状态[7-12, 14-18]。本研究中,Meta分析结果表明断奶应激可以导致犊牛断奶后1~3 d血液中中性粒细胞数量显著升高,是断奶应激诱导炎症反应的有力证据[26]。炎症可刺激骨髓中干细胞分化[27],大量成熟的中性粒细胞进入循环血液是血液中性粒细胞数量升高的原因之一。中性粒细胞数量各研究间存在异质性,Meta回归分析结果表明发表年份是其主要的异质性来源。敏感性分析表明有2个研究的合并效应量明显偏离了总体的合并效应量,将其剔除后不影响结果,但可明显降低研究间的异质性。分析其原因,在Johnston等[12]的研究中,犊牛采用逐渐断奶方式断奶,这种断奶方式可能降低了犊牛的应激反应,这可能是产生异质性的原因。在Lynch等[16]的研究中,断奶后由放牧转为舍饲饲养,这可能是导致中性粒细胞数量结果不同于其他研究的原因。Meta分析结果表明断奶应激可导致犊牛断奶后1~3 d血液中淋巴细胞数量显著降低。血液中淋巴细胞数减少的原因,一方面是糖皮质激素抑制胸腺细胞成熟和分化,并且诱导淋巴细胞过早凋亡[28];另一方面是炎症可诱导淋巴细胞游离出血管,进入发生炎症组织或受感染部位发挥其免疫学功能[29]。
3.3 断奶应激对血液中急性期蛋白浓度的影响急性期蛋白(蛋白酶抑制剂、触珠蛋白、纤维蛋白原等)对免疫系统有调节功能,如激活巨噬细胞和参与组织修复重建等[30]。当未受到刺激时急性期蛋白通常处于稳定状态[31],断奶应激可通过调控白细胞介素-1(IL-1)和肿瘤坏死因子-α(TNF-α)等促炎性细胞因子的分泌,刺激肝脏大量分泌急性期蛋白。在先前的研究中,Arthington等[32]和Horadagoda等[33]提出急性期蛋白可作为判断免疫应激的一个稳定指标。但是,由于相关研究结果的不一致以及缺乏统一的判断标准,目前少见使用急性期蛋白作为应激反应判断标志物的研究[8, 14-18]。本研究中,Meta分析结果表明断奶应激可以使血液中触珠蛋白和纤维蛋白原浓度显著升高,并且可持续到断奶后2周,这一结论支持了Arthington等[32]和Horadagoda等[33]的观点。虽然对急性期蛋白的研究存在异质性,但敏感性分析结果表明,剔除Hickey等[8]和O’Loughlin等[10]的研究后,结果稳定可靠,同时异质性明显降低。因此,可以考虑将血液触珠蛋白和纤维蛋白原浓度作为潜在应激标志物应用于反刍动物应激反应的研究中。
3.4 本研究的局限性本研究存在一定的局限性,首先,断奶应激影响幼龄反刍动物免疫系统功能的文献资料偏少,符合纳入标准的研究数量较少,并且纳入的研究缺少既定的质量评分标准,无法对文献质量进行科学评价;其次,触珠蛋白浓度的分析结果异质性较高,对数据进行Meta回归分析后仍无法明确其异质性来源,但敏感性分析表明结果稳定可靠,且剔除合并效应量明显偏离总体的研究后异质性明显降低,考虑研究间的异质性可能源于试验动物品种的不同;最后,本文纳入的研究中,断奶策略各有不同,断奶日龄以及犊牛断奶体重有很大差异,造成的研究结果的不一致,这可能会对Meta分析的结果造成一定的影响。因此,在今后有必要对断奶应激和幼龄反刍动物的免疫系统功能进行更多的研究,已提供更加准确、结果更加可靠的科学证据。
4 结论① Meta分析结果表明,断奶应激可导致犊牛免疫功能发生明显变化,犊牛断奶后1~3 d和11~14 d血液中皮质醇浓度显著升高,断奶后1~3 d血液中中性粒细胞数量显著升高、淋巴细胞数量显著降低,血液中单核细胞数量在断奶后11~14 d显著降低。断奶应激可导致犊牛血液中触珠蛋白和纤维蛋白原浓度显著升高,并持续到断奶后14 d。敏感性分析表明所有结果稳定可靠。漏斗图分析表明皮质醇、触珠蛋白和纤维蛋白原浓度存在少量的发表偏倚。
② Meta分析发现犊牛血液中触珠蛋白和纤维蛋白原浓度在犊牛断奶后2周仍高于断奶前水平,可以考虑将其作为潜在应激标志物应用于今后反刍动物应激反应的研究中。同时,本研究为犊牛的健康管理和疾病的预防,以及犊牛断奶应激和免疫功能的相关研究提供了科学依据。
| [1] |
BUDZYNSKA M, WEARY D M. Weaning distress in dairy calves:effects of alternative weaning procedures[J]. Applied Animal Behaviour Science, 2008, 112(1/2): 33-39. |
| [2] |
JASPER J, WEARY D M. Effects of ad libitum milk intake on dairy calves[J]. Journal of Dairy Science, 2002, 85(11): 3054-3058. DOI:10.3168/jds.S0022-0302(02)74391-9 |
| [3] |
TERRÉ M, DEVANT M, BACH A. Effect of level of milk replacer fed to Holstein calves on performance during the preweaning period and starter digestibility at weaning[J]. Livestock Science, 2007, 110(1/2): 82-88. |
| [4] |
CALLAN R J, GARRY F B. Biosecurity and bovine respiratory disease[J]. Veterinary Clinics of North America:Food Animal Practice, 2002, 18(1): 57-77. DOI:10.1016/S0749-0720(02)00004-X |
| [5] |
DUFF G C, GALYEAN M L. Board-invited review:recent advances in management of highly stressed, newly received feedlot cattle[J]. Journal of Animal Science, 2007, 85(3): 823-840. DOI:10.2527/jas.2006-501 |
| [6] |
SNOWDER G. GENETICS, environment and bovine respiratory disease[J]. Animal Health Research Reviews, 2009, 10(2): 117-119. DOI:10.1017/S1466252309990144 |
| [7] |
HULBERT L E, COBB C J, CARROLL J A, et al. The effects of early weaning on innate immune responses of Holstein calves[J]. Journal of Dairy Science, 2011, 94(5): 2545-2556. DOI:10.3168/jds.2010-3983 |
| [8] |
HICKEY M C, DRENNAN M, EARLEY B. The effect of abrupt weaning of suckler calves on the plasma concentrations of cortisol, catecholamines, leukocytes, acute-phase proteins and in vitro interferon-gamma production[J]. Journal of Animal Science, 2003, 81(11): 2847-2855. DOI:10.2527/2003.81112847x |
| [9] |
LYNCH E M, EARLEY B, MCGEE M, et al. Effect of abrupt weaning at housing on leukocyte distribution, functional activity of neutrophils, and acute phase protein response of beef calves[J]. BMC Veterinary Research, 2010, 6: 39. DOI:10.1186/1746-6148-6-39 |
| [10] |
O'LOUGHLIN A, MCGEE M, WATERS S M, et al. Examination of the bovine leukocyte environment using immunogenetic biomarkers to assess immunocompetence following exposure to weaning stress[J]. BMC Veterinary Research, 2011, 7: 45. DOI:10.1186/1746-6148-7-45 |
| [11] |
O'LOUGHLIN A, MCGEE M, DOYLE S, et al. Biomarker responses to weaning stress in beef calves[J]. Research in Veterinary Science, 2014, 97(2): 458-463. DOI:10.1016/j.rvsc.2014.06.003 |
| [12] |
JOHNSTON D, KENNY D A, KELLY A K, et al. Characterisation of haematological profiles and whole blood relative gene expression levels in Holstein-Friesian and Jersey bull calves undergoing gradual weaning[J]. Animal, 2016, 10(9): 1547-1556. DOI:10.1017/S1751731115002438 |
| [13] |
张千, 李发弟, 李飞. 断奶应激对幼龄反刍动物免疫系统的影响及其机理[J]. 动物营养学报, 2016, 28(7): 1988-1997. DOI:10.3969/j.issn.1006-267x.2016.07.003 |
| [14] |
LYNCH E M, EARLEY B, MCGEE M, et al. Characterisation of physiological and immunological responses in beef cows to abrupt weaning and subsequent housing[J]. BMC Veterinary Research, 2010, 6: 37. DOI:10.1186/1746-6148-6-37 |
| [15] |
KIM M H, YANG J Y, UPADHAYA S D, et al. The stress of weaning influences serum levels of acute-phase proteins, iron-binding proteins, inflammatory cytokines, cortisol, and leukocyte subsets in Holstein calves[J]. Journal of Veterinary Science, 2011, 12(2): 151-157. DOI:10.4142/jvs.2011.12.2.151 |
| [16] |
LYNCH E M, MCGEE M, DOYLE S, et al. Effect of post-weaning management practices on physiological and immunological responses of weaned beef calves[J]. Irish Journal of Agricultural and Food Research, 2011, 50(2): 161-174. |
| [17] |
LYNCH E M, MCGEE M, DOYLE S, et al. Effect of pre-weaning concentrate supplementation on peripheral distribution of leukocytes, functional activity of neutrophils, acute phase protein and behavioural responses of abruptly weaned and housed beef calves[J]. BMC Veterinary Research, 2012, 8: 1. DOI:10.1186/1746-6148-8-1 |
| [18] |
O'LOUGHLIN A, LYNN D J, MCGEE M, et al. Transcriptomic analysis of the stress response to weaning at housing in bovine leukocytes using RNA-seq technology[J]. BMC Genomics, 2012, 13: 250. DOI:10.1186/1471-2164-13-250 |
| [19] |
CHALMERS T C. The importance of properly executed Meta-analyses in the interpretation of clinical-trials[J]. Acta Pharmacol Tox, 1986, 59: 19. |
| [20] |
董书伟, 张世栋, 王东升, 等. 中药治疗牛子宫内膜炎的系统评价和Meta分析[J]. 畜牧兽医学报, 2015, 46(11): 2085-2096. |
| [21] |
张千, 李发弟, 李飞. 反刍动物应激反应中糖皮质激素对免疫系统的调节机理[J]. 畜牧兽医学报, 2017, 48(5): 785-792. |
| [22] |
GLASER R, KIECOLT-GLASER J K. Stress-induced immune dysfunction:implications for health[J]. Nature Reviews Immunology, 2005, 5(3): 243-251. DOI:10.1038/nri1571 |
| [23] |
RIVIER C, VALE W. Interaction of corticotropin-releasing factor and arginine vasopressin on adrenocorticotropin secretion in vivo[J]. Endocrinology, 1983, 113(3): 939-942. DOI:10.1210/endo-113-3-939 |
| [24] |
WATABE T, TANAKA K, KUMAGAE M, et al. Role of endogenous arginine vasopressin in potentiating corticotropin-releasing hormone-stimulated corticotropin secretion in man[J]. The Journal of Clinical Endocrinology & Metabolism, 1988, 66(6): 1132-1137. |
| [25] |
EVANS R M. The steroid and thyroid hormone receptor superfamily[J]. Science, 1988, 240(4854): 889-895. DOI:10.1126/science.3283939 |
| [26] |
ZAHOREC R. Ratio of neutrophil to lymphocyte counts-rapid and simple parameter of systemic inflammation and stress in critically ill[J]. Bratislavske Lekarske Listy, 2001, 102(1): 5-14. |
| [27] |
TEMPELMAN R J, SAAMA P M, FREEMAN A E, et al. Genetic variation in bovine neutrophil sensitivity to glucocorticoid challenge[J]. Acta Agriculturae Scandinavica, Section A:Animal Science, 2002, 52(4): 189-202. DOI:10.1080/090647002762381078 |
| [28] |
RODRIGUES-MASCARENHAS S, DOS SANTOS N F, RUMJANEK V M. Synergistic effect between ouabain and glucocorticoids for the induction of thymic atrophy[J]. Bioscience Reports, 2006, 26(2): 159-169. DOI:10.1007/s10540-006-9012-1 |
| [29] |
DHABHAR F S. A hassle a day may keep the pathogens away:the fight-or-flight stress response and the augmentation of immune function[J]. Integrative and Comparative Biology, 2009, 49(3): 215-236. DOI:10.1093/icb/icp045 |
| [30] |
GODSON D L, BACA-ESTRADA M E, VAN KESSEL A G, et al. Regulation of bovine acute phase responses by recombinant interleukin-1 beta[J]. Canadian Journal of Veterinary Research, 1995, 59(4): 249-255. |
| [31] |
CARROLL J A, FORSBERG N E. Influence of stress and nutrition on cattle immunity[J]. Veterinary Clinics of North America:Food Animal Practice, 2007, 23(1): 105-149. DOI:10.1016/j.cvfa.2007.01.003 |
| [32] |
ARTHINGTON J D, EICHERT S D, KUNKLE W E, et al. Effect of transportation and commingling on the acute-phase protein response, growth, and feed intake of newly weaned beef calves[J]. Journal of Animal Science, 2003, 81(5): 1120-1125. DOI:10.2527/2003.8151120x |
| [33] |
HORADAGODA N U, KNOX K M G, GIBBS H A, et al. Acute phase proteins in cattle:discrimination between acute and chronic inflammation[J]. Veterinary Record, 1999, 144(16): 437-441. DOI:10.1136/vr.144.16.437 |




