2. 天津大学化工学院, 天津 300072;
3. 西北农林科技大学动物科技学院, 杨凌 712100;
4. 中国农业科学院北京畜牧兽医研究所, 动物营养学国家重点实验室, 北京 100193
2. Institute of Chemical Technology, Tianjin University, Tianjin 300072, China;
3. College of Animal Science and Technology, Northwest A & F University, Yangling 712100, China;
4. Institute of Animal Sciences of Chinese Academy of Agricultural Sciences State Key Laboratory of Animal Nutrition, Beijing 100193, China
随着人们生活水平的不断提高,肉质鲜嫩、营养美味、绿色健康的猪肉成为人们对肉类产品的新追求。研究表明,肌内脂肪(IMF)含量及其脂肪酸组成对猪肉的嫩度、多汁性和风味具有较高的相关性[1-2]。因此,畜牧育种公司及科研工作者努力通过分子育种技术提高IMF含量。过氧化物酶体增殖物激活受体γ(PPARγ)、CCAAT/增强子结合蛋白α(C/EBPα)、解偶联蛋白1(UCP1)、肌动蛋白γ1(ACTG1)、围脂滴蛋白(perilipin)等猪脂肪沉积的候选基因在多基因聚合育种以及基因编辑技术中被广泛应用[3-8]。但目前猪IMF性状遗传与多基因调控脂肪沉积的研究进展仍十分缓慢,研究人员仍在努力寻找IMF分子调控新靶标,以生产更优质美味的猪肉产品,满足消费者需求。
研究表明,脂滴直径大小为0.05~200 μm,它以中性脂质为核心,外层被单层磷脂膜和相关蛋白包被[9-11]。脂滴广泛存在于各种生物体中,如细菌[12]、酵母[13]、线虫[14]、果蝇[15]、植物[16]、哺乳动物[10]。长期以来人们认为脂滴只是细胞中存储油脂的场所,类似于糖原。随着科学技术的发展,人们逐渐认识到脂滴并不只是一个简单的能量储存器,同时也是一个复杂的、生理活动旺盛、具有动态变化的细胞器[17]。脂滴还有许多重要的生理功能,例如脂质的代谢及运输、信号转导、膜转运以及与其他细胞器的相互作用等[18-21]。因此,脂滴生物学功能研究越来越受到科研工作者的关注。
如何高效地从猪骨骼肌中分离和纯化出脂滴是运用蛋白质组学等技术分析脂滴蛋白表达峰度、定位及其生物学功能的前提。已有研究从不同的细胞、组织、器官中分离和纯化脂滴[22-23],并且研究表明脂滴参与脂质代谢、膜生物合成、膜转运和信号转导[11, 24-25],但是目前国内外缺乏从猪骨骼肌肌内分离和纯化脂滴的可靠方法。因此,本研究拟解决的问题为探索从猪骨骼肌分离和纯化肌内脂滴的适宜条件,采用梯度超速离心法从骨骼肌分离肌内脂滴,确定高效纯化肌内脂滴的离心力及时间条件,以获得纯度较高的脂滴。本研究有助于在脂滴上发掘猪IMF沉积的新调控靶点和作用机制,为进一步从遗传育种及营养生理角度促进猪IMF沉积的研究提供新思路。
1 材料与方法 1.1 试验样品试验选择体重为(120±2) kg的“杜×长×大”三元杂交猪24头,屠宰前禁食12 h,宰前使用高压电击致昏后放血、屠宰;取背最长肌中段,除去脂肪和筋腱,将新鲜组织样品放入4 ℃保温盒,取样后立即送往实验室。
1.2 化学试剂磷酸盐缓冲液(PBS)、氯化钾(KCl)、氯化镁(MgCl2)、蔗糖、两性离子缓冲剂、羟乙基哌嗪乙硫磺酸(HEPES)、二甲基亚砜(DMSO)、蛋白酶抑制剂(PMSF)、氢氧化钾(KOH)、油红溶液、冰乙酸、无水乙醇、甲醇均购自美国Sigma公司;脂类染色荧光物(BODIPY)493/503购自美国Invitrogen公司;RIPA裂解液、考马斯亮蓝染色液及脱色液购自北京普利莱基因技术有限公司;围脂滴蛋白抗体(Anti-Perilipin)、钙联接蛋白抗体(Anti-Calnexin)、高尔基体自身蛋白抗体(Anti-GM130)、环氧酶Ⅳ抗体(Anti-COX Ⅳ)、丝裂原活化蛋白激酶激酶1抗体(Anti-MEK1)均购自美国Abcam公司;TGX Stain-FreeTM FastCastTM Acrylamide Kit购自美国BIO-RAD公司;化学发光液ChemiDoc XRS购自美国Millipore公司。
1.3 试验器材手术刀、剪刀、镊子、玻璃培养皿、40目过滤筛、10 mL离心管、JX-FSTPRP-24全自动组织研磨仪(上海净信科技实业发展有限公司)、Allegra X-5R离心机(BECKMAN COULTER,美国)、Himac-CP 80 WX日立超速离心机(HITACHI,日本)、P28S转子、P80AT转子、12PA离心管(φ1.6×7.6,10.5 mL)、40PA离心管(φ2.6×9.0,35.6 mL)、BDS200倒置生物显微镜(奥特,中国)、BX60荧光显微镜(OLYMPUS,日本)、PowerPac Universal电泳仪(BIO-RAD,美国)、Fusion Solo化学发光仪成像系统(VILBER,法国)。
1.4 试剂配制蔗糖溶液:称量400 g蔗糖溶于200 mL的去离子水中直到蔗糖全部溶解,然后用500 mL的容量瓶定容,4 ℃保存。Buffer A:称取1.79 g两性离子缓冲剂溶于400 mL的去离子水,用KOH调节pH分别为6.0、7.4、8.0。加入50 mL蔗糖溶液,500 mL的容量瓶定容,灭菌消毒,4 ℃保存。Buffer B:溶解4.77 g HEPES、7.45 g KCl和0.19 g MgCl2于180 mL的去离子水中。用KOH调节pH分别为6.0、7.4、8.0,定容至1 000 mL并灭菌消毒,4 ℃保存;PMSF溶液:溶解0.175 g PMSF于5 mL的DMSO中,分装到1 mL的离心管中[22]。
1.5 试验设计使用全自动组织研磨仪和杜恩斯匀浆器研磨猪背最长肌组织,比较2种不同的匀浆方式对分离脂滴形态的影响;配制3种pH分别为6.0、7.4、8.0的缓冲液,探讨不同的pH对脂滴形态的影响;比较4、25 ℃不同温度下匀浆骨骼肌组织及超速分离脂滴和缓冲液中有无PMSF对脂滴蛋白的影响;最后通过超速离心法筛选出纯化脂滴的最优条件。
1.6 脂滴分离步骤1) 选取猪背最长肌50 g剪碎、匀浆、过滤,50 mL离心管中加入Buffer A,1 000×g离心10 min;
2) 取1)步骤上层液转移至40PA离心管中,使用P28S转子80 000×g离心30 min;
3) 将2)步骤上层脂滴移入无菌的40PA离心管中并加入Buffer B,用移液枪小心吹打聚集成团的脂滴使其充分散开(下同),然后90 000×g离心30 min;
4) 轻轻收集3)步骤上层漂浮的脂滴移入无菌的40PA离心管中,100 000×g离心30 min;
5) 将4)步骤获得的脂滴转移至装有Buffer B的12PA离心管中进行超速离心纯化;
6) 最后将纯化后的脂滴移入1.5 mL的离心管中,-4 ℃短暂保存用于脂滴的形态观察。
收集上述步骤每次离心后的细胞浆、上清液及最后获得的脂滴0.5 mL于EP管中,-80 ℃保存,待纯度检测。
1.7 鉴定方法 1.7.1 油红O染色取少量脂滴于24孔细胞培养板中,加入1 mL的0.5%的油红O溶液孵育7~8 min。然后使用Buffer B小心清洗3次,吸取少量上层漂浮的脂滴于载玻片上,最后显微镜观察。
1.7.2 Bodipy荧光染色取待染脂滴于24孔细胞培养板中,加入Bodipy染色15 min。置水平摇床上用Buffer B小心清洗3次,吸取少量上层漂浮的脂滴于载玻片上,最后荧光显微镜下观察(避光操作)。
1.8 纯度检测 1.8.1 考马斯亮蓝染色将聚丙烯酰胺凝胶加入培养皿中,考马斯亮蓝染色液覆盖凝胶,缓慢摇动2 h。弃去染色液,用脱色液冲洗凝胶。脱色液覆盖凝胶,缓慢摇动2 h,倾去脱色液,在加入新脱色液进行脱色(过夜),直至获得清晰的蓝色条带和干净的背景。对凝胶进行照相和分析,凝胶放置于7%的乙酸中保存。
1.8.2 免疫印迹试验(Western blot)将提取的细胞浆、上清液、脂滴置于冰上用裂解缓冲液裂解,并于4 ℃, 12 000×g离心10 min后取上清液即为总蛋白溶液。将提取的上清液用二喹啉甲酸(BCA)法进行蛋白定量,定量后进行十二烷基硫酸钠聚丙烯酰胺凝胶(SDS-PAGE)电泳(上样量为9 μg),将蛋白转移至聚偏二氟乙烯(PVDF)膜,5%脱脂奶粉封闭2 h。将膜与一抗Perilipin、Calnexin、GM130、COX Ⅳ、MEK1进行孵育2 h。将膜与耦联二抗37 ℃孵育2 h,使用化学发光液ChemiDoc XRS和Fusion Solo凝胶成像系统进行检测分析,分析灰度值,进行相对定量分析。
1.9 数据统计及分析试验数据采用Excel 2007软件进行整理。使用SPSS 17.0软件中单因素方差分析(one-way ANOVA)程序进行差异显著性分析,P < 0.05为差异显著。试验数据以平均值±标准差(mean±SD)表示。
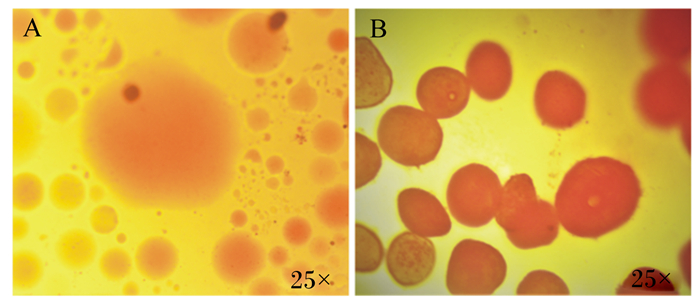
2 结果与分析 2.1 不同条件对肌内脂滴分离效果的影响 2.1.1 匀浆方法对肌内脂滴形态的影响获得形态完整的脂滴为研究其生物学功能奠定基础,本试验探索猪骨骼肌组织匀浆方法对脂滴形态影响。猪背最长肌组织匀浆时采用2种方法:一是使用手术剪将组织剪碎,然后用杜恩斯匀浆器上下反复匀浆10次。二是将组织剪成约3 mm3的碎片后装入10 mL的离心管并加入少量Buffer A及2颗中号钢珠,使用全自动组织研磨仪匀浆3 min。分别将获得的组织匀浆液按照1.6中脂滴分离步骤对肌内脂滴分离,获得的脂滴经油红O染色。从图 1可知,使用杜恩斯匀浆器匀浆的脂滴破碎率较高(图 1-A),而全自动组织研磨仪的脂滴形态较为完整(图 1-B)。结果表明,使用全自动组织研磨仪中的钢珠研磨猪骨骼肌组织对脂滴形态的破坏性低于杜恩斯匀浆器。
|
A:使用杜恩斯匀浆器匀浆的脂滴;B:使用全自动组织研磨仪的脂滴。 A: lipid droplets using Dounce homogenizer; B: lipid droplets using automatic grinderball set. 图 1 匀浆方法对脂滴形态的影响 Fig. 1 Effects of homogenate method on lipid droplets morphology |
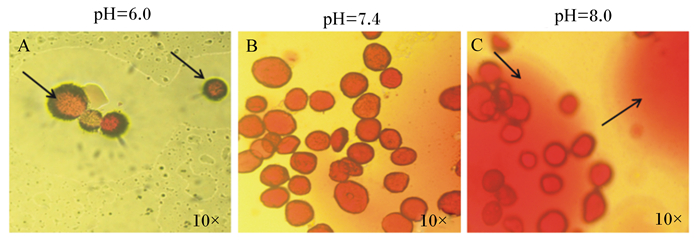
哺乳动物细胞适宜生长的环境pH约为7.4。为探究缓冲液pH对猪骨骼肌内脂滴的影响,试验配制3种缓冲液,pH分别为6.0、7.4、8.0,按照上述步骤获得的较为完整的肌内脂滴,分别加入3种不同pH的缓冲液进行显微镜观察,由图 2可知,缓冲液pH为6.0及8.0对脂滴形态的破坏性较大(图 2-A和图 2-C)。结果表明,缓冲液偏酸或偏碱对脂滴膜具有较强的破坏性,而中性则能较好地维持脂滴形态的完整性。
|
A:缓冲液pH为6.0;B:缓冲液pH为7.4;C:缓冲液pH为8.0。 A: buffer pH=6.0; B: buffer pH=7.4; C: buffer pH=8.0. 图 2 缓冲液pH对分离脂滴形态的影响 Fig. 2 Effects of pH of buffer on morphology of isolated lipid droplets |
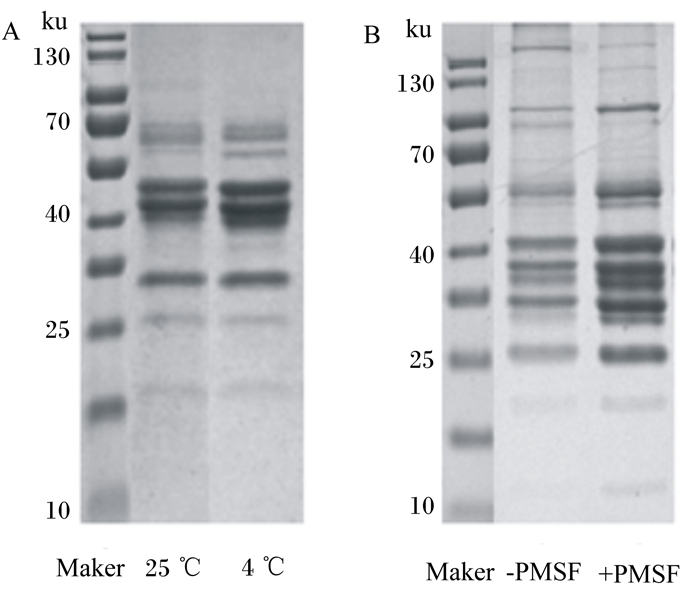
在脂滴分离及提取脂滴蛋白质过程中,分别比较不同温度及缓冲液中有无添加PMSF对脂滴蛋白的影响。经考马斯亮蓝染色后,在4 ℃条件下, 缓冲液中添加PMSF的脂滴蛋白条带较丰富、清晰(图 3)。
|
A:不同温度分离脂滴的考马斯亮蓝染色;B:有无添加PMSF分离脂滴的考马斯亮蓝染色。 A: Coomassie bright blue stain for isolated lipid droplets at different temperatures; B. Coomassie bright blue stain for isolated lipid droplets with or without PMSF. 图 3 温度及PMSF对脂滴蛋白的影响 Fig. 3 Effects of temperature and PMSF on lipid droplets protein |
超速离心力过高、离心时间较长会导致脂滴破碎,而离心力过低、离心时间过短则得不到纯化的脂滴。为获得较高质量的骨骼肌肌内脂滴,设计以下方案筛选出最佳纯化条件。使用游标卡尺测量最终纯化后12PA离心管上层脂滴的高度,确定最佳纯化脂滴的离心力及时间。由表 1可知,230 000×g离心30 min时获得脂滴高度最高,即获得脂滴量最多。
|
|
表 1 不同离心力和离心时间下获得纯化脂滴的高度 Table 1 Height of purified lipid droplets obtained under different centrifugal forces and centrifugal time |
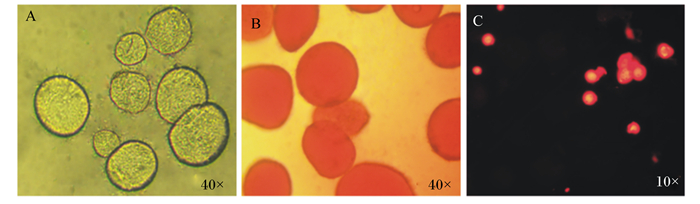
获得纯化的肌内脂滴通过光学显微镜观察到磷脂层包裹脂滴形态比较完整(图 4-A),经过油红O染色与Bodipy染色后确定观察到形态完整的肌内脂滴(图 4-B、图 4-C)。
|
A:未染色脂滴;B:油红O染色脂滴;C:Bodipy染色脂滴。 A: unstained lipid droplets; B: oil red O staining lipid droplets; C: Bodipy fluorescence staining lipid droplets. 图 4 脂滴的油红O、Bodipy荧光染色图 Fig. 4 Oil red O staining and Bodipy fluorescence staining profiles for lipid droplets |
将不同超速离心力获得的细胞浆、上清液1~5及脂滴蛋白由SDS-PAGE电泳分离蛋白后进行考马斯亮蓝染色。图 5-A显示,经过多次超速离心后获得的脂滴蛋白不同于细胞浆及上清液蛋白组成,但是第3次离心获得的上清液3蛋白表达谱开始与脂滴蛋白相似。Image J分析脂滴中蛋白条带灰度值,其中5种主要的蛋白约占总蛋白的54.24%。脂滴经过5次反复离心、清洗,最终获得的脂滴蛋白轮廓与上清液4和5的蛋白轮廓相似,与Ding等[26]研究结果一致。
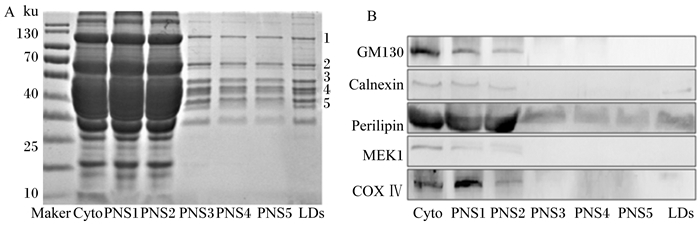
|
Marker:标记物;Cyto:细胞浆;PNS1~5:上清液1~5;LDs:脂滴;GM130:高尔基体自身蛋白; Galnexin:钙联接蛋白; Perilipin:围脂滴蛋白;MEK1:丝裂原活化蛋白激酶激酶1;COX Ⅳ:环氧酶Ⅳ。 A:细胞浆、上清液及脂滴蛋白考马斯亮蓝染色;B:Western blot检测脂滴纯度。 A: Coomassie brilliant blue staining for cytoplasm, supernatant liquid and lipid droplets protein; B. lipid droplets purity analysis by Western blot. 图 5 纯化脂滴蛋白的鉴定及纯度分析 Fig. 5 Identification and purity analysis of purified lipid droplets protein |
为了进一步验证脂滴纯度,使用Western blot技术检测不同的超离次数获得的纯化脂滴。分别检测样品中脂滴、内质网、高尔基体、线粒体、质膜的标志性蛋白。由图 5-B可知,随着超速离心力与清洗次数的增加,GM130、MEK1、COX Ⅳ蛋白量逐渐消失。分离纯化的脂滴能够检测出Perilipin2蛋白及少量的内质网Calnexin蛋白。结果表明,通过多次不同超速离心力及清洗后能够除去细胞内大部分重要的细胞器。
3 讨论脂滴是一个复杂、活动旺盛、动态变化的多功能细胞器,但其生物学功能远未揭示清楚,而目前脂滴分离和纯化技术仍不成熟,还需要进一步探索。本试验旨在探究猪骨骼肌肌内脂滴分离和纯化的最优方法,发现使用全自动组织研磨仪钢珠研磨猪骨骼肌组织对脂滴形态的保护性优于杜恩斯匀浆器,缓冲液pH为7.4时能较好地维持脂滴形态的完整性,在4 ℃条件下, 添加PMSF的缓冲液分离获得的肌内脂滴蛋白条带较丰富、清晰。Ding等[22]研究在分离小鼠骨骼肌组织脂滴时使用100×g离心力获取上清液,4 ℃、182 000×g离心1 h获得粗提脂滴,进一步纯化条件为4 ℃、270 000×g离心10 min。脂滴分离纯化条件为4 ℃、270 000×g离心10 min。而本试验根据Ding等[22]研究尝试使用P80AT的转子,270 000×g离心力纯化和分离脂滴,结果发现所得的大部分脂滴会黏附在12PA离心管侧壁上破碎,故降低了离心力及时间。通过筛选离心力及时间最后确定了4 ℃、230 000×g离心30 min时脂滴获得率最高且形态完整。这也说明了不同的生物物种、生理阶段、组织和脂滴发育程度对分离纯化脂滴时离心力及时间的要求也不同[22]。在过去的数月中,本实验室应用此条件,从“杜×长×大三元杂交猪”(体重60~130 kg)和宁乡猪(体重40~90 kg)背最长肌中进行了大量的重复性的提取脂滴工作,均获得了纯度较高、结构完整的脂滴,证明了本方法的可靠性。
研究发现脂滴与其他细胞器相互作用是脂肪细胞显著特征之一[27-29],这些细胞器经常在聚集的脂滴团中发现。蛋白质相关分析技术可以用来进一步量化脂滴纯度,检测重要细胞器标志性蛋白[30]。研究发现,COX Ⅳ是线粒体氧化呼吸链电子传递的关键分子,定位于线粒体内膜上,可作为线粒体的分子标志物。GM130分布于内质网与细胞膜之间,是高度极性的细胞器[31],被人们作为通用的高尔基体标记蛋白[32]。MEK1是激活丝分裂原激活蛋白激酶(MAPK)级联膜信号分子调节细胞外信号传输至细胞内的双特异性激酶[33],Mannik等[23]研究可用于检测质膜蛋白。围脂滴蛋白是脂滴表面最丰富的结构蛋白,其在调节中性脂质甘油三酯(TG)储存和脂解过程发挥着重要作用[34-35]。钙联接蛋白作为内质网中的一类重要的类凝集素分子伴侣,参与细胞内的许多重要生物学功能[36]。
因此,本试验通过SDS-PAGE电泳分离和纯化脂滴蛋白后进行考马斯亮蓝染色和Western blot检测表明,经过多次超速离心力及清洗后能够除去细胞内大部分细胞器,但内质网钙联接蛋白仍少量存在。其原因可能与脂滴形成与内质网有关:脂滴形成过程中脂肪酸在内质网小叶被合成TG进入内质网小叶内部,随着TG的增多内质网小叶从盘状逐渐形成球形,增大到一定程度后与内质网脱离,成为新生脂滴[37]。因此,未发育成熟的脂滴很难与内质网完全分离,与Ding等[38]和Mannik等[23]研究结果相同。
4 结论本研究建立了超速离心法分离纯化猪骨骼肌肌内脂滴的最优方案,即:使用全自动组织研磨仪匀浆猪骨骼肌,在4 ℃、缓冲液pH为7.4时超速分离清洗,纯化条件为4 ℃、230 000×g离心30 min能够获得形态最好、纯度最高的肌内脂滴。
| [1] |
WOOD J D, RICHARDSON R I, NUTE G R, et al. Effects of fatty acids on meat quality:a review[J]. Meat Science, 2003, 66(1): 21-32. |
| [2] |
FERNANDEZ X, MONIN G, TALMANT A, et al. Influence of intramuscular fat content on the quality of pig meat-1.Composition of the lipid fraction and sensory characteristics of m. longissimus lumborum[J]. Meat Science, 1999, 53(1): 59-65. DOI:10.1016/S0309-1740(99)00037-6 |
| [3] |
张恬, 张龙超, 王立刚, 等. 猪脂肪沉积候选基因AOC3、PPARG1及SOD3 DNA甲基化差异研究[J]. 中国畜牧兽医, 2016, 43(11): 2820-2825. |
| [4] |
MURÄNI E, PONSUKSILI S, SEYFERT H M, et al. Dual effect of a single nucleotide polymorphism in the first intron of the porcine secreted phosphoprotein 1, gene:allele-specific binding of C/EBP beta and activation of aberrant splicing[J]. BMC Molecular Biology, 2009, 10(1): 96. DOI:10.1186/1471-2199-10-96 |
| [5] |
ZHENG Q, LIN J, HUANG J J, et al. Reconstitution of UCP1 using CRISPR/Cas9 in the white adipose tissue of pigs decreases fat deposition and improves thermogenic capacity[J]. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(45): E9474-E9482. DOI:10.1073/pnas.1707853114 |
| [6] |
张霞, 刘晓研, 苗义良. 基因编辑技术在猪现代育种和动物模型构建中应用的研究进展[J]. 中国细胞生物学学报, 2017, 39(5): 659-667. |
| [7] |
张恬.猪肌内脂肪全基因组甲基化差异分析及候选基因研究[D].硕士学位论文.北京: 中国农业科学院, 2016: 7-40. http://cdmd.cnki.com.cn/Article/CDMD-82101-1016171393.htm
|
| [8] |
GANDOLFI G, MAZZONI M, ZAMBONELLI P, et al. Perilipin 1 and perilipin 2 protein localization and gene expression study in skeletal muscles of European cross-breed pigs with different intramuscular fat contents[J]. Meat Science, 2011, 88(4): 631-637. DOI:10.1016/j.meatsci.2011.02.020 |
| [9] |
MURPHY D J. The biogenesis and functions of lipid bodies in animals, plants and microorganisms[J]. Progress in Lipid Research, 2001, 40(5): 325-438. DOI:10.1016/S0163-7827(01)00013-3 |
| [10] |
FUJIMOTO T, OHSAKI Y, CHENG J L, et al. Lipid droplets:a classic organelle with new outfits[J]. Histochemistry and Cell Biology, 2008, 130(2): 263-279. DOI:10.1007/s00418-008-0449-0 |
| [11] |
张淑妍, 杜雅兰, 汪洋, 等. 脂滴-细胞脂类代谢的细胞器[J]. 生物物理学报, 2010, 26(2): 97-105. |
| [12] |
WÄLTERMANN M, STEINBVCHEL A. Neutral lipid bodies in prokaryotes:recent insights into structure, formation, and relationship to eukaryotic lipid depots[J]. Journal of Bacteriology, 2005, 187(11): 3607-3619. DOI:10.1128/JB.187.11.3607-3619.2005 |
| [13] |
FEI W H, SHUI G H, GAETA B, et al. Fld1p, a functional homologue of human seipin, regulates the size of lipid droplets in yeast[J]. Journal of Cell Biology, 2008, 180(3): 473-482. DOI:10.1083/jcb.200711136 |
| [14] |
ZHANG P, NA H M, LIU Z Y, et al. Proteomic study and marker protein identification of Caenorhabditis elegans lipid droplets[J]. Molecular & Cellular Proteomics, 2012, 11(8): 317-328. |
| [15] |
BELLER M, RIEDEL D, JANSCH L, et al. Characterization of the Drosophila lipid droplet subproteome[J]. Molecular & Cellular Proteomics, 2006, 5(6): 1082-1094. |
| [16] |
TZEN J T C, PENG C C, CHENG D J, et al. A new method for seed oil body purification and examination of oil body integrity following germination[J]. Journal of Biochemistry, 1997, 121(4): 762-768. DOI:10.1093/oxfordjournals.jbchem.a021651 |
| [17] |
吴华莉, 何大乾, 王惠影, 等. 脂滴在动物组织中的功能[J]. 上海农业学报, 2015(1): 118-121. |
| [18] |
FARESE R V, J r, WALTHER T C. Lipid droplets finally get a little R-E-S-P-E-C-T[J]. Cell, 2009, 139(5): 855-860. DOI:10.1016/j.cell.2009.11.005 |
| [19] |
SAMUEL V T, SHULMAN G I. Mechanisms for insulin resistance:common threads and missing links[J]. Cell, 2012, 148(5): 852-871. DOI:10.1016/j.cell.2012.02.017 |
| [20] |
DEBERARDINIS R J, THOMPSON C B. Cellular metabolism and disease:what do metabolic outliers teach us?[J]. Cell, 2012, 148(6): 1132-1144. DOI:10.1016/j.cell.2012.02.032 |
| [21] |
ZEHMER J K, HUANG Y G, PENG G, et al. A role for lipid droplets in inter-membrane lipid traffic[J]. Proteomics, 2009, 9(4): 914-921. DOI:10.1002/pmic.v9:4 |
| [22] |
DING Y F, ZHANG S Y, YANG L, et al. Isolating lipid droplets from multiple species[J]. Nature Protocols, 2013, 8(1): 43-51. DOI:10.1038/nprot.2012.142 |
| [23] |
MANNIK J, MEYERS A, DALHAIMER P. Isolation of cellular lipid droplets:two purification techniques starting from yeast cells and human placentas[J]. Journal of Visualized Experiments Jove, 2014(86). DOI:10.3791/50981 |
| [24] |
OHSAKI Y, CHENG J L, SUZUKI M, et al. Biogenesis of cytoplasmic lipid droplets:from the lipid ester globule in the membrane to the visible structure[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2009, 1791(6): 399-407. DOI:10.1016/j.bbalip.2008.10.002 |
| [25] |
YANG L, DING Y F, CHEN Y, et al. The proteomics of lipid droplets:structure, dynamics, and functions of the organelle conserved from bacteria to humans[J]. Journal of Lipid Research, 2012, 53(7): 1245-1253. DOI:10.1194/jlr.R024117 |
| [26] |
DING Y F, YANG L, ZHANG S Y, et al. Identification of the major functional proteins of prokaryotic lipid droplets[J]. Journal of Lipid Research, 2012, 53(3): 399-411. DOI:10.1194/jlr.M021899 |
| [27] |
JACQUIER N, CHOUDHARY V, MARI M, et al. Lipid droplets are functionally connected to the endoplasmic reticulum in Saccharomyces cerevisiae[J]. Journal of Cell Science, 2011, 124(14): 2424-2437. DOI:10.1242/jcs.076836 |
| [28] |
PU J, HA C W, ZHANG S Y, et al. Interactomic study on interaction between lipid droplets and mitochondria[J]. Protein & Cell, 2011, 2(6): 487-496. |
| [29] |
BRASAEMLE D L, WOLINS N E. Packaging of fat:an evolving model of lipid droplet assembly and expansion[J]. Journal of Biological Chemistry, 2012, 287(4): 2273-2279. DOI:10.1074/jbc.R111.309088 |
| [30] |
KRAHMER N, HILGER M, KORY N, et al. Protein correlation profiles identify lipid droplet proteins with high confidence[J]. Molecular & Cellular Proteomics, 2013, 12(5): 1115-1126. |
| [31] |
STEIGEMANN P, GERLICH D W. Cytokinetic abscission:cellular dynamics at the midbody[J]. Trends in Cell Biology, 2009, 19(11): 606-616. DOI:10.1016/j.tcb.2009.07.008 |
| [32] |
CHOI T, FUKASAWA K, ZHOU R, et al. The Mos/mitogen-activated protein kinase (MAPK) pathway regulates the size and degradation of the first polar body in maturing mouse oocytes[J]. Proceedings of the National Academy of Sciences of the United States of America, 1996, 93(14): 7032-7035. DOI:10.1073/pnas.93.14.7032 |
| [33] |
SEGER R, KREBS E G. The MAPK signaling cascade[J]. The FASEB Journal, 1995, 9(9): 726-35. DOI:10.1096/fasebj.9.9.7601337 |
| [34] |
ZHANG H H, SOUZA S C, MULIRO K V, et al. Lipase-selective functional domains of perilipin A differentially regulate constitutive and protein kinase A-stimulated lipolysis[J]. Journal of Biological Chemistry, 2003, 278(51): 51535-51542. DOI:10.1074/jbc.M309591200 |
| [35] |
GARCIA A, SUBRAMANIAN V, SEKOWSKI A, et al. The amino and carboxyl termini of perilipin a facilitate the storage of triacylglycerols[J]. Journal of Biological Chemistry, 2004, 279(9): 8409-8416. DOI:10.1074/jbc.M311198200 |
| [36] |
张峰. 内质网分子伴侣Calnexin的研究进展[J]. 生物学通报, 2008, 43(8): 7-10. DOI:10.3969/j.issn.0006-3193.2008.08.003 |
| [37] |
PILCH P F, SOUTO R P, LIU L B, et al. Cellular spelunking:exploring adipocyte caveolae[J]. Journal of Lipid Research, 2007, 48(10): 2103-2111. DOI:10.1194/jlr.R700009-JLR200 |
| [38] |
DING Y B, WU Y B, ZENG R, et al. Proteomic profiling of lipid droplet-associated proteins in primary adipocytes of normal and obese mouse[J]. Acta Biochimica et Biophysica Sinica, 2012, 44(5): 394-406. DOI:10.1093/abbs/gms008 |




