肌酸是最早由法国科学家Chevreul[1]在动物肌肉中发现的一种能量物质,在肌纤维收缩等活动中起作用。在畜牧科学领域,笔者前期研究表明一水肌酸(creatine monohydrate, CMH)可以显著降低生长育肥猪背膘厚度、增加眼肌面积[2];也有研究报道发现其可以刺激骨骼肌生长,增加肌肉能量储备,延缓宰后肌肉糖酵解过程,降低乳酸含量及改善肉品系水力等[3]。由于肌酸具有水合作用,长期摄入可能出现肌肉水胀、膨大现象。近年来出现了丙酮酸肌酸、苹果酸肌酸及肌酸组合制剂等产品,这些产品可在保证正常使用效果前提下降低肌酸用量及其水合作用,在人类运动领域表现出很好的应用前景。因此,本试验对CMH与相关活性成分的组合添加进行研究,为进一步完善CMH在肉质营养调控中的应用提供参考。
1 材料与方法 1.1 试验材料纯度为99.5%的食品级的CMH、纯度为99%的α-硫辛酸(alpha lipoic acid, ALA)、纯度为99%的牛磺酸(taurine, Tau)和纯度为99.5%的L-苹果酸(L-malic acid, LMA)均购自河南义多利化工产品公司;肌酸和磷酸肌酸标准品购自Sigma-Aldrich公司,纯度≥98%。肌肉生化指标检测试剂盒购自南京建成生物工程研究所,RNA提取、反转录、表达分析等分子生物学试剂(盒)购自上海硕盟东洋纺公司,其他常用化学试剂购自杭州常青化工有限公司。
1.2 试验设计与动物饲养选择60~70 kg体重的“杜×大×长”阉公猪100头,随机分为5组(每组20个重复,每个重复1头),分别饲喂基础饲粮(对照组)、CMH饲粮(在基础饲粮中添加0.5 g/kg的CMH,试验Ⅰ组)、CMH+ALA饲粮(在基础饲粮中添加0.5 g/kg的CMH和0.1 g/kg的ALA,试验Ⅱ组)、CMH+Tau饲粮(在基础饲粮中添加0.5 g/kg的CMH和0.1 g/kg的Tau,试验Ⅲ组)和CMH+LMA饲粮(在基础饲粮中添加0.5 g/kg的CMH和0.5 g/kg的LMA,试验Ⅳ组),自由采食和饮水。基础饲粮组成及营养水平见表 1。试验期50 d,记录初始和结束体重。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验结束后禁食16 h称重,每组选择接近平均体重个体8头,经30 min车程统一运至屠宰场,屠宰后测定左侧胴体重量、体斜长、3点背膘厚度;分割选取倒数第3~4胸椎背最长肌样品,测量眼肌截面长度和宽度,计算眼肌面积(长度×宽度×0.7);采集5 g左右样品,液氮保存用于测定生化与分子生物学指标;4 ℃排酸熟化24 h后测定pH、滴水损失、压榨损失、剪切力以及肉色等肉质性状。
1.4 肌肉能量代谢指标测定取200 mg冻存肌肉样品,测定时加入9倍体积(1.8 mL)生理盐水,利用高速组织分散器匀浆60 s,4 ℃ 3 500 r/min离心10 min,上清液稀释50倍。参照试剂盒说明书测定甘油三酯、游离脂肪酸、肌糖原、葡萄糖、丙酮酸及乳酸含量,测定丙酮酸脱氢酶、琥珀酸脱氢酶(SDH)、乳酸脱氢酶及肌酸激酶(CK)活性。利用微量法二喹啉甲酸(BCA)试剂盒测定样品的蛋白质含量,酶活性表示单位为“U/mg prot”。
肌酸和磷酸肌酸含量测定参照门小明等[2]描述方法。称取30 mg左右肌肉冻干粉末,加入1 mL 0.5 mmol/L高氯酸(HClO4)的混合液,冰浴匀浆后取上清液,加入等体积2.1 mmol/L碳酸氢钾(KHCO3)溶液,反应后的上清液经0.45 μm微孔滤膜过滤后备用。分别称取1 mg的肌酸和磷酸肌酸标准品,按照样品处理流程制备标样。利用外标法(Agilent 1200高效液相色谱仪)检测2种化合物含量,主要设备和条件包括Eclipse XDB-C18色谱柱(5 μm, 4.6 mm×150 mm)、G1314B VWD检测器、流动相为0.5%磷酸缓冲液:甲醇=80 : 20、0.8 mL/min的等比洗脱、检测波长为210 nm以及进样体积为20 μL。根据样品冻干系数计算单位质量新鲜组织样品中化合物含量。
1.5 基因表达检测利用试剂盒提取背最长肌总RNA,ND-1000微量紫外分光光度计测定浓度和纯度,利用ReverTra Ace qPCR RT试剂盒合成cDNA,内参和目的基因引物序列见表 2,在ABI StepOne Plus上检测Ct值。PCR反应体系包括SYBR Green Master(ROX)5 μL、无菌水3 μL、上游和下游引物各0.75 μL、cDNA 0.5 μL,升温程序为95 ℃ 30 s→95 ℃ 5 s、62 ℃ 34 s、40个循环,采用2-ΔΔCt法计算目的基因相对表达水平。
|
|
表 2 引物序列 Table 2 Primer sequences |
试验数据采用SPSS 16.0软件中单因素方差分析(one-way ANOVA)进行处理,Duncan氏法进行多重比较,显著性差异检验水平设定为P<0.05,表示形式为“平均值±标准差”。
2 结果 2.1 CMH及其组合添加物对生长育肥猪生长性能和胴体指标的影响如表 3所示,与对照组比,试验Ⅰ组~试验Ⅳ组生长育肥猪平均日增重、屠宰率和体长均无显著差异(P>0.05),背膘厚度显著降低(P < 0.05);试验Ⅱ组和试验Ⅳ组生长育肥猪眼肌面积显著提高(P < 0.05),其中前者眼肌面积最大,后者背膘厚度最低。
|
|
表 3 CMH及其组合添加物对生长育肥猪生长性能和胴体指标的影响 Table 3 Effects of CMH and its combination additives on growth performance and carcass traits of growing-finishing pigs |
如表 4所示,与对照组相比,试验Ⅰ组生长育肥猪背最长肌滴水损失、压榨损失和肉色红度(a*)值显著降低(P < 0.05),蒸煮损失和肉色亮度(L*)、黄度(b*)值显著提高(P < 0.05);试验Ⅱ组生长育肥猪背最长肌滴水损失和压榨损失显著降低(P < 0.05);试验Ⅲ组生长育肥猪背最长肌蒸煮损失、肉色L*与b*值显著提高(P < 0.05),肉色a*值显著降低(P < 0.05);试验Ⅳ组生长育肥猪背最长肌肉质性状与对照组相比无显著差异(P>0.05);4个试验组生长育肥猪背最长肌常规营养成分含量与对照组相比均无显著差异(P>0.05),水分和粗蛋白质含量在数值上高于对照组,脂肪含量在数值上低于对照组。
|
|
表 4 CMH及其组合添加物对生长育肥猪背最长肌肉质性状和常规营养成分的影响 Table 4 Effects of CMH and its combination additives on meat quality traits and common nutrient composition of growing-finishing pigs |
如表 5所示,与对照组相比,试验Ⅰ组~试验Ⅲ组生长育肥猪背最长肌SDH和CK活性、总抗氧化能力以及肌酸含量和总量均显著提高(P < 0.05),乳酸含量显著降低(P < 0.05),且各指标以试验Ⅱ组改变程度最大,试验Ⅱ组丙酮酸含量还显著增加(P < 0.05)。
|
|
表 5 CMH、CMH+ALA和CMH+Tau对生长育肥猪背最长肌能量代谢指标的影响 Table 5 Effects of CMH, CMH+ALA and CMH+Tau on energy metabolism traits in longissimus dorsi of growing-finishing pigs |
如表 6所示,与对照组相比,试验Ⅰ组和试验Ⅱ组生长育肥猪背最长肌CrT基因相对表达水平显著提高(P < 0.05),试验Ⅱ组MB和肌球蛋白重链Ⅱa(MyHCⅡa)基因相对表达水平也显著提高(P < 0.05)。
|
|
表 6 CMH和CMH+ALA对生长育肥猪背最长肌相关基因表达的影响 Table 6 Effects of CMH and CMH+ALA on related gene expression in longissimus dorsi of growing-finishing pigs |
在脊椎动物体内肌酸主要由精氨酸合成途径生成,在CK作用下以磷酸肌酸形式将高能磷酸键储存于骨骼肌中,后者在CK作用下可以快速释放高能磷酸键、生成ATP,满足能量需求[4],这一生物学过程在体内物质能量代谢和神经运动调节中发挥重要作用。根据文献报道总结外源补充肌酸对机体作用如下(图 1):1)直接增加肌肉高能磷酸化合物储备,从而减缓宰后肌肉糖酵解过程及pH下降[5];2)刺激提高线粒体CK活性,发挥清除自由基等抗氧化作用[6];3)节省甲基供体(S-腺苷甲硫氨酸),既可以用于增加蛋白质合成,也可用于促进卵磷脂(phosphatidylcholine,PC)合成,增加脂类物质转运能力、降低脂肪沉积[7-8];4)可以激活过氧化物酶增殖体激活受体α(PPARα)及下游通路基因表达,增加脂肪酸氧化和甘油三酯水解分泌[9-10];5)作为神经递质,用来修复受损神经细胞[11]。
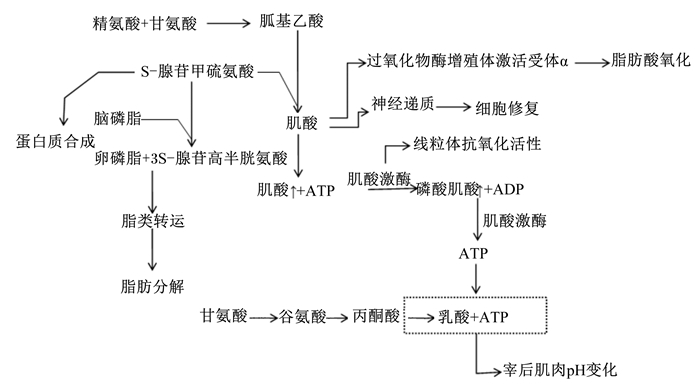
|
图 1 畜禽体内肌酸来源及主要生物功能 Fig. 1 The source of creatine and its main biological functions in livestock |
由于畜禽饲粮中缺乏动物源性饲料成分,外源补充肌酸数量非常有限[7]。以人体为例,每天内源含成的肌酸和通过食物补充的肌酸有2~4 g,其中内源生成和外源获取各1~2 g/d[4]。国内外学者将CMH作为畜禽体内肌酸的一种重要补充形式,期望能够提高动物生产性能、改善胴体及肉质性状。以猪为例,Maddock等[12]对氟烷基因杂合子和正常型肥育猪每头每天补饲25 g的CMH,持续15 d后发现体增重显著提高;James等[13]发现,低剂量长时间补饲(每头每天3 g,持续30 d)和高剂量短时间补饲(每头每天25 g,持续5 d)效果相当,但“高剂量短时间+低剂量维持”对宰后pH均有负面影响;对杜洛克猪而言,补充CMH的增重效果、肌肉pH和系水力改善均好于长白猪,并以每头每天50 g效果最好[14];对丹麦杂交猪持续补饲CMH对骨骼肌pH、肉色、保水性能、多汁性和嫩度均未表现出明显作用[15];韩剑众等[16]向育肥猪宰前45天饲粮中添加0.25‰的CMH,发现可显著改善生长性能和猪肉品质;门小明等[2]向生长育肥猪饲粮中添加0.5‰的CMH,饲喂30 d后发现可显著提高背最长肌系水力、增加肉色亮度。
在本研究中,饲粮添加CMH能显著增加生长育肥猪肌肉丙酮酸、肌酸和磷酸肌酸含量,降低乳酸含量,提高CK活性,说明非乳酸供能或磷酸原转化(ATP-PC)是饲粮CMH影响猪肉质性状的重要途径,这与上调CrT基因表达、提高肉品总抗氧化能力和系水力指标的结果相一致;饲粮添加CMH显著降低背膘厚度和增加眼肌面积,说明饲粮补充CMH可以促进机体脂肪分解,增加蛋白质沉积,这可能与甲基供体有关[7-8];饲粮添加CMH还显著增加生长育肥猪背最长肌SDH活性和促进氧化型肌纤维形成趋势,说明补充CMH相对增强肌肉氧化代谢能力,与肌酸激活PPARα信号通路报道一致[9-10]。本研究还发现,饲粮添加0.5‰的CMH增加肉色L*和b*值、降低肉色a*值。与同类研究相比,本研究饲喂剂量和饲喂时间都处于偏高水平,可能存在肌酸水合作用相对明显现象。肌肉表面水润致使其反光性增加,肉色L*值也就增加,这与结果中肌肉水分含量出现增加趋势也比较一致。因此,除品种因素以外,饲喂剂量及时间等有关CMH的饲喂制度仍是决定其实际应用效果的重要因素。
3.2 外源补充CMH与LMA的组合效应苹果酸又称2-羟基丁酸,作为体内三羧酸(TCA)循环过程直接代谢底物,被广泛用于食品或饲料添加剂。本研究在CMH基础上添加食品级LMA,结果发现CMH与LMA组合添加在所有试验组中降低背膘厚度效果最好,可能与其在骨骼肌能量代谢发挥重要作用有关。根据骨骼肌葡萄糖生化代谢途径,同时补充肌酸和苹果酸可能存在如下交叉作用途径(图 2):一方面补充肌酸能够快速产生ATP,可以相对减缓肌肉糖原无氧酵解的乳酸生成过程,促使丙酮酸倾向有氧氧化代谢去路,生成乙酰辅酶A;另一方面补充LMA可以增加消耗乙酰辅酶A,使以TCA循环为主的有氧代谢过程增强。
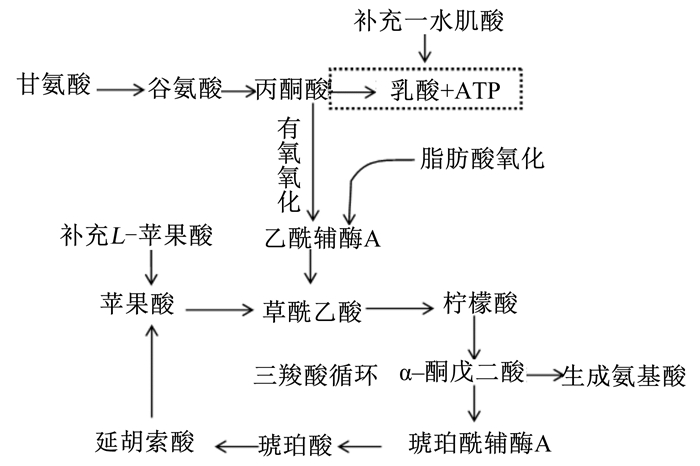
|
图 2 肌酸和苹果酸的可能协同作用途径 Fig. 2 Possible synergistic pathways of creatine and malic acid |
由此可见,同时补充CMH与LMA存在协同耦合作用,使葡萄糖和脂肪酸代谢统一向有氧氧化过程转化,满足机体对乙酰辅酶A需求,这可能是二者组合添加后进一步降低脂肪沉积作用内在机制。由于本试验侧重肉质改善作用,在后续指标分析中并没有选择CMH+LMA组进行深入,相关机制讨论也只能做理论推测,这是本文不足之处,其组合效应将在下一步研究受到关注。
3.3 外源补充CMH与Tau的组合效应Tau又称β-氨基乙磺酸,是一种广泛存在动物组织细胞内(尤其海生和哺乳动物含量丰富)的条件性必需氨基酸,与胱氨酸、半胱氨酸代谢密切相关,作为生物膜的稳定剂、参与三大营养物质代谢、抗氧化和免疫调节等[17]。Tau的营养生理功能表现在2个方面:一是促进营养物质吸收、代谢和利用,与胆酸结合促进脂肪乳化、提高脂肪酶活性、促进脂类物质消化吸收,与胰岛素结合促进葡萄糖吸收利用、降低血糖浓度;二是参与细胞膜磷脂代谢、清除自由基,可以保护细胞膜完整性、维持细胞内外渗透压和离子水平[18]。在畜牧生产中,Tau被普遍用于提高家禽、鱼类生产性能, 缓解应激损伤和改善产品质量等方面,初步用于仔猪和种公猪抗氧化、免疫调节和抗细胞凋亡等生理过程[19]。本研究在生长育肥猪上发现,Tau和CMH组合添加具有改善胴体组成作用,与单独添加CMH一样能增加背最长肌蒸煮损失,对压榨损失和蒸煮损失无显著影响,对肉色也存在同样负面影响,对背最长肌能量代谢指标影响与其他试验组方向一致。可见,CMH与Tau组合在肉质改善方面并未表现协同增加效应。
3.4 外源补充CMH与ALA的组合效应ALA又称5-(1,2-二噻茂烷基3-基)戊酸,作为丙酮酸脱氢酶和α-酮戊二脱氢酶的辅酶,具体营养生理功能如下:1)催化体内脱氢反应,维持线粒体能量氧化供能进程;2)帮助肌酸导入肌细胞,增强胰岛素敏感性[20];3)介导细胞信号通路,促进蛋白质合成和脂肪酸氧化供能[21-22];4)清除自由基,维持机体氧化还原状态,兼具脂溶性与水溶性特点,被誉为“万能抗氧化剂”。在畜牧生产领域,ALA除了被用于抗氧化剂以外,也有一些研究发现饲粮添加ALA可以促进机体蛋白质沉积和脂肪酸周转,降低腹脂、血液甘油三酯及胆固醇含量,缓解热应激对生长及肉质的负面影响[23],还可以促进肉鸡肌纤维类型向氧化型转化[24]。
本研究发现CMH与ALA组合添加后,进一步上调了CrT基因表达,与肌肉肌酸和磷酸肌酸储备含量增加相符合,这可能是其相对最大程度提高眼肌面积、增加系水力的原因之一。CMH与ALA组合添加后降低了CMH对肉色参数的负面影响,可能与肌红蛋白和氧化型肌纤维基因表达相对升高有关,这与以往研究报道结果[25]一致。由于ALA并不直接参与机体物质能量代谢调节,不能像LMA那样与CMH发挥对机体成分沉积分配(胴体组成)调控的协同作用,降低背膘程度相对较低。
4 结论① 综合上述研究结果,饲粮添加CMH、CMH+ALA或Tau或LMA均能够降低生长育肥猪屠宰背膘厚度,单独添加CMH可降低背最长肌滴水损失和压榨损失,但CMH及其与Tau组合添加均增加蒸煮损失和负面影响肉色参数;CMH+ALA组合比单独添加CMH更大程度提高背最长肌系水力,而且能够增加眼肌面积、对肉色有改善作用;CMH+LMA组合添加降低背膘效果最明显,并增加眼肌面积,但对肉质性状无显著影响。
② CMH及其组合添加物的肉质调控作用可能与它们直接或间接参与ATP-CP供能、TCA循环及能脂代谢等生理生化过程有关,尤其与ALA组合综合表现更好的胴体和肉质改善作用,并相对单独添加CMH进一步提高了肌酸转运储备、氧化代谢能力、肌红蛋白表达水平和氧化型肌纤维比例。
| [1] |
CHEVREUL E. Sur la composition chimique du bouillon de viandes (on the chemical composition of meatbroth)[J]. Journal of Pharmaceutical Sciences, 1835, 21: 231-242. |
| [2] |
门小明, 邓波, 陶新, 等. 一水肌酸对杜浙猪肉质性状、肌肉磷酸原代谢、纤维类型特征及蛋白质溶解度的影响[J]. 动物营养学报, 2015, 27(5): 1527-1533. DOI:10.3969/j.issn.1006-267x.2015.05.024 |
| [3] |
代发文, 左建军, 冯定远. 一水肌酸在畜禽生产中的应用[J]. 饲料博览, 2010(2): 21-24. DOI:10.3969/j.issn.1001-0084.2010.02.006 |
| [4] |
RIESBERG L A, WEED S A, MCDONALD T L, et al. Beyond muscles:the untapped potential of creatine[J]. International Immunopharmacology, 2016, 37: 31-42. DOI:10.1016/j.intimp.2015.12.034 |
| [5] |
徐子伟, 门小明.动物肌肉能量代谢特点及其与肉质性状的相关性[C]//2010中国畜牧兽医学会动物营养学分会第六次全国饲料营养学术研讨会论文集.杨凌: 中国畜牧兽医学会, 2010: 87-94.
|
| [6] |
MEYER L E, MACHADO L B, SANTIAGO A P S A, et al. Mitochondrial creatine kinase activity prevents reactive oxygen species generation:antioxidant role of mitochondrial kinase-dependent ADP re-cycling activity[J]. The Journal of Biological Chemistry, 2006, 281: 37361-37371. DOI:10.1074/jbc.M604123200 |
| [7] |
WYSS M, KADDURAH-DAOUK R. Creatine and creatinine metabolism[J]. Physiological Reviews, 2000, 80(3): 1107-1213. DOI:10.1152/physrev.2000.80.3.1107 |
| [8] |
DEMINICE R, DA SILVA R P, LAMARRE S G, et al. Creatine supplementation prevents the accumulation of fat in the livers of rats fed a high-fat diet[J]. The Journal of Nutrition, 2011, 141(10): 1799-1804. |
| [9] |
DA SILVA R P, KELLY K B, LEONARD K A, et al. Creatine reduces hepatic TG accumulation in hepatocytes by stimulating fatty acid oxidation[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2014, 1841(11): 1639-1646. DOI:10.1016/j.bbalip.2014.09.001 |
| [10] |
DEMINICE R, DE CASTRO G S F, FRANCISCO L V, et al. Creatine supplementation prevents fatty liver in rats fed choline-deficient diet:a burden of one-carbon and fatty acid metabolism[J]. The Journal of Nutritional Biochemistry, 2015, 26(4): 391-397. DOI:10.1016/j.jnutbio.2014.11.014 |
| [11] |
ADRIANO E, GARBATI P, SALIS A, et al. Creatine salts provide neuroprotection even after partial impairment of the creatine transporter[J]. Neuroscience, 2017, 340: 299-307. DOI:10.1016/j.neuroscience.2016.02.038 |
| [12] |
MADDOCK R J, BIDNER B S, CARR S N, et al. Creatine monohydrate supplementation and the quality of fresh pork in normal and halothane carrier pigs[J]. Journal of Animal Science, 2002, 80(4): 997-1004. DOI:10.2527/2002.804997x |
| [13] |
JAMES B W, GOODBAN R D, UNRUH J A, et al. Effect of creatine monohydrate on finishing pig growth performance, carcass characteristics and meat quality[J]. Animal Feed Science and Technology, 2002, 96(3/4): 135-145. |
| [14] |
YOUNG J F, BERTRAM H C, ROSENVOLD K, et al. Dietary creatine monohydrate affects quality attributes of Duroc but not Landrace pork[J]. Meat Science, 2005, 70(4): 717-725. DOI:10.1016/j.meatsci.2005.03.008 |
| [15] |
NISSEN P M, YOUNG J F. Creatine monohydrate and glucose supplementation to slow-and fast-growing chickens changes the postmortem pH in pectoralis major[J]. Poultry Science, 2006, 85(6): 1038-1044. DOI:10.1093/ps/85.6.1038 |
| [16] |
韩剑众, 顾振宇, 吴劲松, 等. 一水肌酸对肥育猪胴体组成和肉质的影响及机理研究[J]. 中国粮油学报, 2007, 22(3): 101-106. DOI:10.3321/j.issn:1003-0174.2007.03.026 |
| [17] |
SALZE G P, DAVIS D A. Taurine:a critical nutrient for future fish feeds[J]. Aquaculture, 2015, 437: 215-229. DOI:10.1016/j.aquaculture.2014.12.006 |
| [18] |
RIPPS H, SHEN W. Review:taurine:a "very essential" amino acid[J]. Molecular Vision, 2012, 18: 2673-2686. |
| [19] |
郝中禹, 杨加明, 肖克权, 等. 牛磺酸的生理功能及其在猪生产中的应用[J]. 动物营养学报, 2018, 30(6): 2050-2056. DOI:10.3969/j.issn.1006-267x.2018.06.005 |
| [20] |
BURKE D G, CHILIBECK P D, PARISE G, et al. Effect of α-lipoic acid combined with creatine monohydrate on human skeletal muscle creatine and phosphagen concentration[J]. International Journal of Sport Nutrition and Exercise Metabolism, 2003, 13(3): 294-302. DOI:10.1123/ijsnem.13.3.294 |
| [21] |
ROUSSEAU A S, SIBILLE B, MURDACA J, et al. α-lipoic acid up-regulates expression of peroxisome proliferator-activated receptor β in skeletal muscle:involvement of the JNK signaling pathway[J]. FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 2015, 30(3): 1287-1299. |
| [22] |
JING Y Y, CAI X C, XU Y Q, et al. α-lipoic acids promote the protein synthesis of C2C12 myotubes by the TLR2/PI3K signaling pathway[J]. Journal of Agricultural and Food Chemistry, 2016, 64(8): 1720-1729. DOI:10.1021/acs.jafc.5b05952 |
| [23] |
崔艳军.热应激和氧化应激对肥育猪骨骼肌代谢的影响及硫辛酸的调控作用[D].博士学位论文.北京: 中国农业科学院, 2016: 61-74. http://cdmd.cnki.com.cn/Article/CDMD-82101-1016174735.htm
|
| [24] |
李艳.硫辛酸对肉鸡骨骼肌发育及缓解黄曲霉毒素中毒机理的研究[D].博士学位论文.北京: 中国农业大学, 2014: 34-49. http://cdmd.cnki.com.cn/Article/CDMD-10019-1014225962.htm
|
| [25] |
汪善锋, 周光宏, 高峰, 等. α-硫辛酸对育肥猪胴体性状与肉品质的影响[J]. 家畜生态学报, 2013, 34(4): 45-48. DOI:10.3969/j.issn.1673-1182.2013.04.010 |




