当今人们的生活方式和动物的饲养模式致使人与动物暴露在一个炎症多发的环境中,易受感染而引发多种疾病。有研究报道[1],革兰氏阴性菌引起的炎症性疾病是临床上常见的高危病症,死亡率约为45%。目前临床上针对革兰氏阴性菌感染性疾病的治疗,往往只侧重于应用抗生素进行抗菌、抗炎治疗,因此造成细菌耐药性及药物残留等问题,成为了广受关注的社会热点,然而缓解该类病原引起的炎性损伤的预防与治疗却往往受到了忽视,所以天然无害的植物提取物便进入到公众视野。大量的研究表明,黄酮类化合物是一类存在于天然植物中并具有酚类结构的化合物,具有抗氧化、抗动脉粥样硬化、抗炎、抗肿瘤、抗病毒等多种生物活性[2-4]。
沙葱(Allium mongolicum Regel),学名蒙古韭,是一种生命力顽强的葱属植物[5], 其营养成分丰富,并含有多种生物活性成分,可改善绵羊瘤胃发酵,具有较好的免疫调节等作用[6]。黄酮类化合物是沙葱的主要活性物质之一,前期研究表明,沙葱黄酮(Allium mongolicum Regel flavonoids, AMF)具有抗氧化、抗菌、促进绵羊外周血淋巴细胞增殖、提高机体特异性免疫、改善羊肉风味等功能[7-9],但其是否具有抗炎活性尚待阐明。因此,本试验旨在以脂多糖(LPS)诱导的小鼠腹腔巨噬细胞(mouse peritoneal macrophages, MPM)为体外炎症模型,比较研究2种不同浓度(35%和75%)乙醇洗脱沙葱黄酮的抗炎活性及其效果,为沙葱的进一步开发和利用提供科学依据。
1 材料与方法 1.1 试验材料 1.1.1 乙醇洗脱沙葱黄酮依据文献[7]报道的超声波提取法最佳提取工艺制备乙醇洗脱沙葱黄酮,分别应用体积分数35%和75%的乙醇为洗脱流动相,采用聚酰胺柱层析法对沙葱黄酮进行分离纯化,将洗脱液浓缩后应用真空冷冻干燥机冷冻干燥,分别得到35%和75%乙醇洗脱沙葱黄酮。35%乙醇洗脱沙葱黄酮的主要组分为3’, 4’-环氧基-7-O-5甲氧基黄酮醇和7-O-5, 4’-二甲氧基-3’-羟基黄酮;75%乙醇洗脱沙葱黄酮的主要组分为金合欢素及黄酮类物质[7]。
1.1.2 试验动物试验动物为健康无特定病原体(SPF)级6~8周龄野生型雄性C57BL/6小鼠[SCXK(蒙)2015-0001)],体重18~22 g,购自内蒙古医科大学实验动物中心。
1.1.3 主要试剂及仪器主要试剂包括:RPMI-1640基础培养基、青链霉素混合液购自美国Gibco公司,磷酸盐缓冲液(PBS)购自美国HyClone公司,胎牛血清购自上海ExCell Bio公司,二甲基亚砜(DMSO)购自北京索莱宝公司,LPS(大肠杆菌O55 : B5来源)购自美国Sigma公司,液体硫乙醇酸盐培养基(TG)购自美国BD公司,细胞计数试剂盒(cell counting kit-8, CCK8)购自日本同仁化学研究所;一氧化氮(NO)测定试剂盒购自美国Promega公司,肿瘤坏死因子-α(TNF-α)、白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)酶联免疫吸附测定(ELISA)试剂盒均购自美国Biolegend公司,总RNA小量制备试剂盒购自美国Axygen公司,SYBR® Premix Ex TaqTM Ⅱ试剂盒、PrimeScriptTM RT reagent Kit均购自日本TaKaRa公司。
主要仪器包括:恒温培养箱(日本Thermo Fisher公司)、Synergy HT型多功能酶标仪(美国Biotek公司)、LightCycler® 480实时荧光定量PCR仪(瑞士罗氏公司)。
1.2 试验设计及方法 1.2.1 小鼠腹腔巨噬细胞的制备在制备小鼠原代腹腔巨噬细胞前,每只试验小鼠腹腔内注射3% TG 2 mL,3 d后采用脱颈法处死小鼠,置于75%酒精中1~2 min,于超净工作台中使用眼科直剪、眼科弯镊沿腹部中线剪一小口,沿小口轻轻撕拉皮肤使内部透明腹膜完全暴露。通过腹膜向腹腔内缓慢注入5 mL预冷的PBS,轻揉腹部,收集灌洗液,重复2~3次,低温离心机5 000 r/min离心3 min,弃掉上清,将获得的细胞重悬于含有10%胎牛血清、1%双抗(100 U/mL青霉素、100 U/mL链霉素)的完全培养基中,置于5%二氧化碳(CO2)、37 ℃恒温培养箱中进行贴壁处理,1~2 h后使用培养基轻轻冲洗细胞3次除去未贴壁细胞,进行下列相应的试验[10-12]。
1.2.2 细胞毒性的测定(CCK8法)调整细胞浓度为4×105个/mL,接种于96孔细胞培养板中,每孔100 μL。试验设空白对照组及不同浓度乙醇洗脱沙葱黄酮组,空白对照组添加含有终浓度为0.1% DMSO的完全培养基,乙醇洗脱沙葱黄酮组分别添加终浓度为25、50、100、200、400 μg/mL的35%或75%乙醇洗脱沙葱黄酮溶液,处理细胞24 h,弃去孔内培养基,每孔加入100 μL含10% CCK8溶液的完全培养基,于细胞培养箱继续培养2 h后用酶标仪检测各孔450 nm的吸光度。
1.2.3 NO含量的测定(Griess法)调整细胞浓度为5×105个/mL,接种于24孔细胞培养板,每孔500 μL。试验设空白对照组(添加含有终浓度为0.1% DMSO的完全培养基)、LPS应激模型组(添加含有终浓度为1 μg/mL LPS的完全培养基)、不同浓度乙醇洗脱沙葱黄酮组(分别加入25、50、100 μg/mL 35%或75%乙醇洗脱沙葱黄酮溶液,预处理细胞1 h,再加入终浓度为1 μg/mL LPS的完全培养基),37 ℃、5% CO2恒温培养箱中共同处理24 h后,收集细胞上清液,检测各组NO的含量,检测方法依据试剂盒说明书进行。
1.2.4 细胞因子含量的测定(ELISA法)调整细胞浓度为2.5×106个/mL,接种于6孔细胞培养板,每孔1 mL。试验分组同1.2.3,共同处理24 h后,收集细胞上清液,检测各组相关细胞因子的含量,检测方法严格按ELISA试剂盒说明书操作。
1.2.5 炎症相关基因mRNA相对表达量的测定(实时荧光定量PCR法)调整细胞浓度为2.5×106个/mL,接种于6孔细胞培养板,每孔1 mL。试验分组同1.2.3,培养4 h后,弃掉培养上清液,使用预冷的PBS洗涤细胞2次,收集细胞,根据总RNA小量制备试剂盒说明书步骤对细胞总RNA进行提取,于多功能酶标仪测定提取所得总RNA的浓度及纯度,260 nm/280 nm处吸光度于1.8~2.0内表明RNA纯度较好,可用于后续试验。根据PrimeScriptTM RT reagent Kit试剂盒说明书将总RNA反转录为cDNA,反转录体系为20 μL。使用Roche LightCycler® 480实时荧光定量PCR系统及SYBR® Premix Ex TaqTM Ⅱ试剂盒检测目的基因mRNA相对表达量,反应体系为20 μL。实时荧光定量PCR的反应程序为95 ℃ 30 s;95 ℃ 5 s;60 ℃ 20 s,40个循环;95 ℃ 15 s;60 ℃ 20 s;绘制熔解曲线。β-肌动蛋白(β-actin)作为管家基因,2-ΔΔct法计算目的基因mRNA相对表达量。引物序列及产物大小[13-14]见表 1。
|
|
表 1 引物序列及产物大小 Table 1 Primer sequences and product size |
试验数据采用GraphPad Prism 5进行数据统计及差异性分析,以平均值±标准差(mean±SD)表示,组间比较采用单因素方差分析(one-way ANOVA),Tukey’s Multiple Comparison Test程序进行多重比较,P < 0.05为差异显著,P < 0.01为差异极显著。
2 结果与分析 2.1 不同浓度乙醇洗脱沙葱黄酮的细胞毒性评价由图 1可知,与空白对照组相比,当乙醇洗脱沙葱黄酮添加浓度在25~100 μg/mL时,35%、75%乙醇洗脱沙葱黄酮均极显著提高了小鼠腹腔巨噬细胞活性(P < 0.01);当乙醇洗脱沙葱黄酮添加浓度在400 μg/mL时,小鼠腹腔巨噬细胞活性呈下降趋势,且75%乙醇洗脱组沙葱黄酮降低极显著了小鼠腹腔巨噬细胞活性(P < 0.01)。因此,选择25、50、100 μg/mL作为后期试验的乙醇洗脱沙葱黄酮添加浓度。
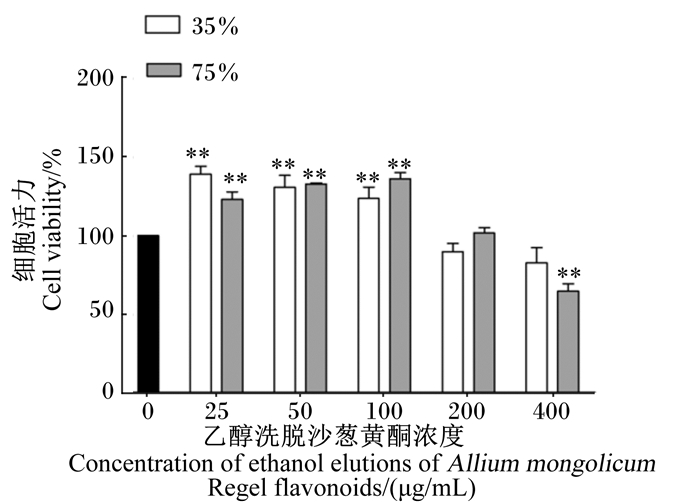
|
与空白对照组相比,*表示差异显著(P < 0.05),* *表示差异极显著(P < 0.01)。 Compared with the blank control group, * mean significant difference (P < 0.05), * * mean extremely significant difference (P < 0.01). 图 1 不同浓度乙醇洗脱沙葱黄酮对小鼠腹腔巨噬细胞活力的影响 Fig. 1 Effects of different concentration of ethanol elutions of Allium mongolicum Regel flavonoids on cell viability of mouse peritoneal macrophages |
由图 2可知,与空白对照组相比,LPS应激模型组NO含量极显著升高(P < 0.01),35%和75%乙醇洗脱沙葱黄酮均能极显著降低小鼠腹腔巨噬细胞NO含量(P < 0.01),且呈剂量依赖性。尤其当35%和75%乙醇洗脱沙葱黄酮的添加浓度在100 μg/mL时,对NO的抑制率分别为50.9%和77.8%。在LPS诱导的小鼠腹腔巨噬细胞中,75%乙醇洗脱沙葱黄酮与35%乙醇洗脱沙葱黄酮相比,更能够有效地降低小鼠腹腔巨噬细胞NO含量(P < 0.01)。
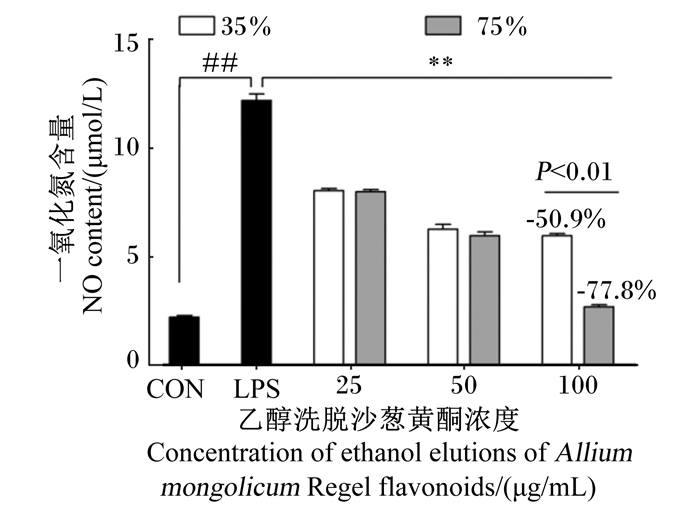
|
CON:空白对照组;LPS:LPS应激模型组。与空白对照组相比,##表示差异极显著(P < 0.01);与LPS应激模型组相比,*表示差异显著(P < 0.05),* *表示差异极显著(P < 0.01)。下图同。 CON: blank control group; LPS: LPS stress model group. Compared with the blank control group, ## mean extremely significant difference (P < 0.01); compared with the LPS stress model group, * mean significant difference (P < 0.05), * * mean extremely significant difference (P < 0.01). The same as below. 图 2 不同浓度乙醇洗脱沙葱黄酮对LPS诱导的小鼠腹腔巨噬细胞NO含量的影响 Fig. 2 Effects of different concentration of ethanol elutions of Allium mongolicum Regel flavonoids on content of NO in LPS-induced mouse peritoneal macrophages |
由图 3可知,在未经LPS诱导的空白对照组中,检测到较少的小鼠腹腔巨噬细胞TNF-α、IL-1β和IL-6含量;与空白对照组相比,LPS应激模型组的小鼠腹腔巨噬细胞TNF-α、IL-1β和IL-6含量极显著增加(P < 0.01)。与LPS应激模型组相比,不同添加浓度的35%和75%乙醇洗脱沙葱黄酮均显著或极显著降低了小鼠腹腔巨噬细胞TNF-α含量(P < 0.05或P < 0.01),其中,35%乙醇洗脱沙葱黄酮以剂量依赖性的方式抑制小鼠腹腔巨噬细胞TNF-α的分泌,且3种添加浓度对TNF-α的抑制率均高于75%乙醇洗脱沙葱黄酮(图 3-A)。对于小鼠腹腔巨噬细胞IL-1β、IL-6含量,75%乙醇洗脱沙葱黄酮并不能够抑制这2种促炎性细胞因子的释放,但35%乙醇洗脱沙葱黄酮在添加浓度为100 μg/mL时对IL-1β、IL-6的抑制率分别为35.6%、36.6%(图 3-B、图 3-C)。这表明,对于抑制促炎性细胞因子的生成,35%乙醇洗脱沙葱黄酮更优于75%乙醇洗脱沙葱黄酮。
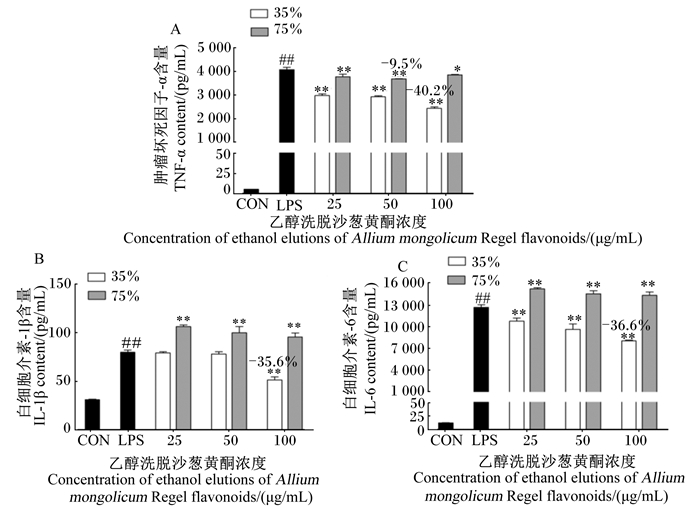
|
图 3 不同浓度乙醇洗脱沙葱黄酮对LPS诱导的小鼠腹腔巨噬细胞促炎性细胞因子含量的影响 Fig. 3 Effects of different concentration of ethanol elutions of Allium mongolicum Regel flavonoids on content of proinflammatory cytokines in LPS-induced mouse peritoneal macrophages |
由图 4可知,与空白对照组相比,LPS应激模型组小鼠腹腔巨噬细胞TNF-α、IL-1β、IL-6及诱导型一氧化氮合酶(iNOS)的mRNA相对表达量均极显著增加(P < 0.01)。与LPS应激模型组相比,不同添加浓度的35%和75%乙醇洗脱沙葱黄酮均极显著降低了小鼠腹腔巨噬细胞TNF-α mRNA相对表达量(图 4-A),35%乙醇洗脱沙葱黄酮在添加浓度为50和100 μg/mL时,其抑制作用极显著强于75%乙醇洗脱沙葱黄酮(P < 0.01);当添加浓度为100 μg/mL时,35%乙醇洗脱沙葱黄酮极显著降低了小鼠腹腔巨噬细胞IL-1β mRNA相对表达量(P < 0.01)(图 4-B);35%和75%乙醇洗脱沙葱黄酮均呈剂量依赖性极显著降低了小鼠腹腔巨噬细胞IL-6、iNOS mRNA相对表达量(P < 0.01),35%乙醇洗脱沙葱黄酮添加浓度在50 μg/mL时,其对IL-6 mRNA相对表达量的抑制作用极显著强于75%乙醇洗脱沙葱黄酮(P < 0.01)(图 4-C);各添加浓度的75%乙醇洗脱沙葱黄酮对小鼠腹腔巨噬细胞iNOS mRNA相对表达量的抑制作用均极显著强于各添加浓度的35%乙醇洗脱沙葱黄酮(P < 0.01)。
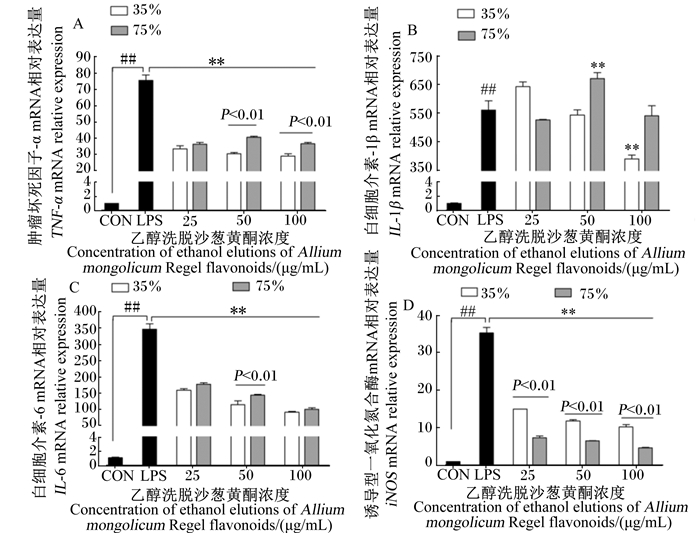
|
图 4 不同浓度乙醇洗脱沙葱黄酮对LPS诱导的小鼠腹腔巨噬细胞炎性因子mRNA相对表达量的影响 Fig. 4 Effects of f different concentration of ethanol elutions of Allium mongolicum Regel flavonoids on mRNA relative expression of inflammatory factors in LPS-induced mouse peritoneal macrophages |
植物提取物生物活性评估的先决条件是确保其不会对受试细胞及其代谢存在有害影响[15]。为了确定35%和75%乙醇洗脱沙葱黄酮对细胞活力的影响,本试验采用了CCK8法检测了其对小鼠腹腔巨噬细胞的细胞毒性并确定了试验中所使用的安全浓度范围。结果表明,25~200 μg/mL的35%和75%乙醇洗脱沙葱黄酮作用受试细胞24 h后对细胞的活性均无抑制作用,且其在25~100 μg/mL内均能极显著的提高细胞的活力,提示该浓度范围内35%和75%乙醇洗脱沙葱黄酮均无毒性作用,进一步说明本研究所使用的35%和75%乙醇洗脱沙葱黄酮在LPS诱导的细胞炎症中发挥的抗炎活性并不是通过降低细胞的增殖活性而实现的。
3.2 不同浓度乙醇洗脱沙葱黄酮对LPS诱导的小鼠腹腔巨噬细胞相关炎症因子的影响LPS是革兰氏阴性菌细胞壁的重要结构成分,可通过激活炎症反应的主要介质导致多种炎症反应,被认为是引起炎症反应的主要原因之一[16]。巨噬细胞作为免疫细胞具有多种功能,作为吞噬细胞,可以清除细胞碎片及病原体;作为分泌细胞,可分泌细胞因子、生长因子、生物活性脂质等100多种不同的介质[17]。目前,通过LPS刺激诱导巨噬细胞是一种公认的感染和炎症的试验模型,巨噬细胞受LPS刺激后导致促炎性细胞因子和其他可溶性因子的释放,这些介质可引发全身炎症,导致器官末梢损伤、脓毒症甚至死亡。此外,LPS诱导的炎症在肥胖、糖尿病和肝功能不全等代谢疾病的发病机制中同样起着重要作用[18]。
TNF-α、IL-1β、IL-6是LPS诱导巨噬细胞活化后产生的主要的细胞因子,TNF-α是炎症发生过程中的重要介质,属于早期炎症因子,也可视为细胞因子网络的启动因子,自身分泌的同时,还可刺激其他细胞因子如IL-6、白细胞介素-12(IL-12)的分泌,导致“瀑布效应”而进一步引起炎症的发生。目前认为所有的机体细胞均可以合成白细胞介素类因子,但主要由巨噬细胞产生,白细胞介素-1(IL-1)是研究最早的白细胞介素,可以激活多种免疫细胞和炎性细胞,产生与TNF-α相似的生理及代谢改变,并与TNF-α相互协同作用,是诱导炎症反应最强的炎症介质之一。IL-6是一种重要的急性期反应介质,可引起急性期炎症反应,来源于所有经过TNF-α和IL-1诱导的细胞和组织,参加机体内信号分子之间的传递,并引起炎症反应[19-20]。NO作为信使分子,参与多种生理及病理过程,当炎症病灶分泌加重时,一些细胞因子如TNF-α、IL-1β可诱导NO的限速酶iNOS生成NO,加重机体及组织损伤[21]。因此,抑制这些因子产生的天然植物提取物、药物可能具有防止炎症性疾病发生的潜力。
Kim等[3]指出,一些天然产物中的黄酮类化合物可以抑制或减少炎症的进展。Nam等[22]报道,从普通荞麦芽与苦荞芽中提取的2种黄酮类化合物可通过抑制LPS刺激的RAW264.7巨噬细胞中NO、TNF-α、IL-12等炎症介质的含量发挥抗炎作用,此外,苦荞芽提取物还可抑制核转录因子-κB(NF-κB)的活化。Joh等[23]研究了党参提取物三萜皂苷(Lancemaside A)的抗炎活性,体内及体外试验结果表明,Lancemaside A均可抑制促炎性细胞因子TNF-α、IL-1β的产生及NO、前列腺素E2(PGE2)等炎症介质的分泌。丹参酮ⅡA、安石榴苷及槲皮素可降低LPS诱导的PGE2、IL-1β、IL-6含量,抑制Toll样受体4(TLR4)-NF-κB信号通路的活化[24-26]。本试验结果显示,35%和75%乙醇洗脱沙葱黄酮均能极显著抑制由LPS诱导的巨噬细胞中NO含量及iNOS mRNA相对表达量,呈剂量依赖性,且75%乙醇洗脱沙葱黄酮的作用效果优于35%乙醇洗脱沙葱黄酮。35%乙醇洗脱沙葱黄酮对TNF-α、IL-1β、IL-6促炎性细胞因子的分泌及其mRNA的表达均具有较强的抑制作用,呈剂量依赖效应。然而,75%乙醇洗脱沙葱黄酮只对TNF-α及IL-6 mRNA的表达呈现出抑制作用,而对IL-1β的分泌无显著抑制作用。这说明35%、75%乙醇洗脱沙葱黄酮均具有抗炎活性,但抑制作用及途径并不完全相同,35%乙醇洗脱沙葱黄酮通过调节NO、iNOS、TNF-α、IL-1β、IL-6炎症介质的生成发挥抗炎症作用,而75%乙醇洗脱沙葱黄酮主要通过抑制炎症介质NO的分泌体现抗炎活性。
4 结论① 35%、75%乙醇洗脱沙葱黄酮均具有抗炎活性,并在添加浓度为25~100 μg/mL时均可提高小鼠腹腔巨噬细胞活性。
② 35%、75%乙醇洗脱沙葱黄酮能通过提高小鼠腹腔巨噬细胞活性、调控细胞因子及炎性介质的分泌而发挥抗炎作用,且35%乙醇洗脱沙葱黄酮的抗炎效果优于75%乙醇洗脱沙葱黄酮。
| [1] |
陈海松, 刘维俊. 抗内毒素药物的研究进展[J]. 国外医药(抗生素分册), 2002, 23(4): 174-178. DOI:10.3969/j.issn.1001-8751.2002.04.009 |
| [2] |
NIJVELDT R J, VAN NOOD E, VAN HOORN D E C, et al. Flavonoids:a review of probable mechanisms of action and potential applications[J]. American Journal of Clinical Nutrition, 2001, 74(4): 418-425. DOI:10.1093/ajcn/74.4.418 |
| [3] |
KIM H P, SON K H, CHANG H W, et al. Anti-inflammatory plant flavonoids and cellular action mechanisms[J]. Journal of Pharmacological Sciences, 2004, 96(3): 229-245. DOI:10.1254/jphs.CRJ04003X |
| [4] |
杨杰, 沙金丹, 高翔, 等. 黄酮类化合物的免疫调节作用及机制[J]. 动物营养学报, 2017, 29(12): 4295-4300. DOI:10.3969/j.issn.1006-267x.2017.12.008 |
| [5] |
中国科学院中国植物志编辑委员会. 中国植物志(14卷)[M]. 北京: 科学出版社, 1980: 170-172.
|
| [6] |
敖长金. 沙葱化学成分及其生物学功能研究进展[J]. 饲料工业, 2010, 31(18): 1-5. DOI:10.3969/j.issn.1001-991X.2010.18.001 |
| [7] |
萨茹丽.沙葱黄酮提取工艺优化、结构鉴定及其相关生物活性研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10129-1014375681.htm
|
| [8] |
木其尔.沙葱黄酮对肉羊机体抗氧化和免疫功能的影响及其机理研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10129-1016250444.htm
|
| [9] |
陈仁伟.沙葱黄酮对肉羊生产性能及其肉品质的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10129-1016249868.htm
|
| [10] |
RAY A, DITTEL B N. Isolation of mouse peritoneal cavity cells[J]. Journal of Visualized Experiments, 2010(35): 1488. |
| [11] |
LIU B, ZHANG N S, LIU Z C, et al. RP105 involved in activation of mouse macrophages via TLR2 and TLR4 signaling[J]. Molecular and Cellular Biochemistry, 2013, 378(1/2): 183-193. |
| [12] |
刘博.小鼠巨噬细胞TLR2、TLR4及RP105在金黄色葡萄球菌感染中的天然免疫应答机制[D].博士学位论文.长春: 吉林大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10183-1013192682.htm
|
| [13] |
SONG M, CHEN T, PROUGH R A, et al. Chronic alcohol consumption causes liver injury in high-fructose-fed male mice through enhanced hepatic inflammatory response[J]. Alcoholism Clinical & Experimental Research, 2016, 40(3): 518-528. |
| [14] |
GUO D, LI J R, WANG Y, et al. Cyclovirobuxinum D suppresses lipopolysaccharide-induced inflammatory responses in murine macrophages in vitro by blocking JAK-STAT signaling pathway[J]. Acta Pharmacologica Sinica, 2014, 35(6): 770-778. DOI:10.1038/aps.2014.16 |
| [15] |
PARK J W, KWON O K, JANG H Y, et al. A leaf methanolic extract of Wercklea insignis attenuates the lipopolysaccharide-induced inflammatory response by blocking the NF-κB signaling pathway in RAW 264.7 macrophages[J]. Inflammation, 2012, 35(1): 321-331. |
| [16] |
ZHANG X, SUN C Y, ZHANG Y B, et al. Kegan Liyan oral liquid ameliorates lipopolysaccharide-induced acute lung injury through inhibition of TLR4-mediated NF-κB signaling pathway and MMP-9 expression[J]. Journal of Ethnopharmacology, 2016, 186: 91-102. DOI:10.1016/j.jep.2016.03.057 |
| [17] |
GORDON S, TAYLOR P R. Monocyte and macrophage heterogeneity[J]. Nature Reviews Immunology, 2005, 5(12): 953-964. DOI:10.1038/nri1733 |
| [18] |
SOARES J B, PIMENTEL-NUNES P, RONCON-ALBUQUERQUE R Jr., et al. The role of lipopolysaccharide/Toll-like receptor 4 signaling in chronic liver diseases[J]. Hepatology International, 2010, 4(4): 659-672. DOI:10.1007/s12072-010-9219-x |
| [19] |
AN H J, JEONG H J, UM J Y, et al. Glechoma hederacea inhibits inflammatory mediator release in IFN-γ and LPS-stimulated mouse peritoneal macrophages[J]. Journal of Ethnopharmacology, 2006, 106(3): 418-424. DOI:10.1016/j.jep.2006.01.024 |
| [20] |
MÖLLER B, VILLIGER P M. Inhibition of IL-1, IL-6, and TNF-α in immune-mediated inflammatory diseases[J]. Springer Seminars in Immunopathology, 2006, 27(4): 391-408. DOI:10.1007/s00281-006-0012-9 |
| [21] |
LEGRAND A, FERMOR B, FINK C, et al. Interleukin-1, tumor necrosis factor α, and interleukin-17 synergistically up-regulate nitric oxide and prostaglandin E2 production in explants of human osteoarthritic knee menisci[J]. Arthritis & Rheumatology, 2001, 44(9): 2078-2083. |
| [22] |
NAM T G, LIM T G, LEE B H, et al. Comparison of anti-inflammatory effects of flavonoid-rich common and tartary buckwheat sprout extracts in lipopolysaccharide-stimulated RAW 264.7 and peritoneal macrophages[J]. Oxidative Medicine and Cellular Longevity, 2017, 2017: 9658030. |
| [23] |
JOH E H, KIM D H. Lancemaside A inhibits lipopolysaccharide-induced inflammation by targeting LPS/TLR4 complex[J]. Journal of Cellular Biochemistry, 2010, 111(4): 865-871. DOI:10.1002/jcb.22773 |
| [24] |
FAN G W, JIANG X R, WU X Y, et al. Anti-inflammatory activity of tanshinone ⅡA in LPS-stimulated RAW264.7 macrophages via miRNAs and TLR4-NF-κB pathway[J]. Inflammation, 2016, 39(1): 375-384. |
| [25] |
XU X, YIN P, WAN C, et al. Punicalagin inhibits inflammation in LPS-induced RAW264.7 macrophages via the suppression of TLR4-mediated MAPKs and NF-κB activation[J]. Inflammation, 2014, 37(3): 956-965. DOI:10.1007/s10753-014-9816-2 |
| [26] |
LIAO Y R, LIN J Y. Quercetin, but not its metabolite quercetin-3-glucuronide, exerts prophylactic immunostimulatory activity and therapeutic antiinflammatory effects on lipopolysaccharide-treated mouse peritoneal macrophages ex vivo[J]. Journal of Agricultural and Food Chemistry, 2014, 62(13): 2872-2880. DOI:10.1021/jf405630h |




