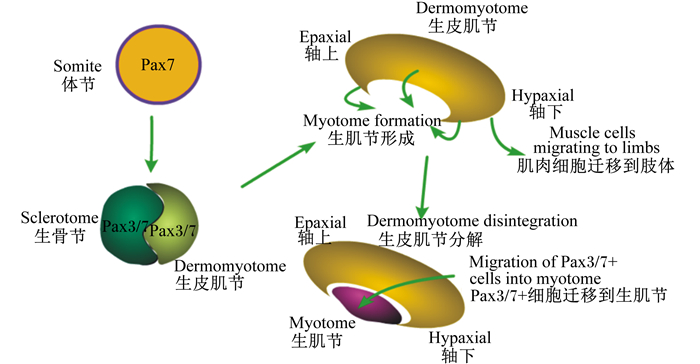
骨骼肌主要由轴旁中胚层细胞(paraxial mesoderm)发育而来。首先,轴旁中胚层的细胞分化形成体节(somite)[1-3]。其次,体节进一步发育形成生皮肌节(dermomyotome)。然后,生皮肌节四周脱落形成骨骼肌祖细胞,骨骼肌祖细胞分化融合形成生肌节。与此同时生皮肌节进一步脱落,迁移融合到生肌节,最终形成骨骼肌[4]。在这个阶段,肌纤维的数目得到确定[5-6]。体节与生肌节的形成过程如图 1所示。动物出生后,骨骼肌的生长主要依赖于肌纤维的肥大,而不是肌纤维数目的增多[7-9]。近期研究发现Wnt信号在胚胎期骨骼肌发育和成体骨骼肌稳态维持中是不可或缺的[10],Wnt信号失调将导致骨骼肌发育缺陷,并导致骨骼肌的稳态被破坏[11-15]。在胚胎发育过程中,Wnt信号主要通调控生肌调节因子家族(myogenic regulatory factors,MRFs)进而诱导肌肉的发生[16-17]。在成体骨骼肌中,经典的Wnt/β-连环蛋白(β-catenin)信号主要调节骨骼肌卫星细胞的分化,而非经典的Wnt信号主要介导骨骼肌卫星细胞的自我更新和肌纤维的生长[18-19]。近年来,Wnt信号参与调控骨骼肌生长、发育、再生和疾病发生等成为生命科学领域的研究热点。因此,本文综述了Wnt信号参与调控骨骼肌细胞增殖、分化、再生与损伤修复等方面的研究进展,以期为畜牧业生产以及肌肉疾病的治疗奠定理论基础。
|
图 1 体节与生肌节的形成过程 Fig. 1 Formation process of somites and myotomes[2] |
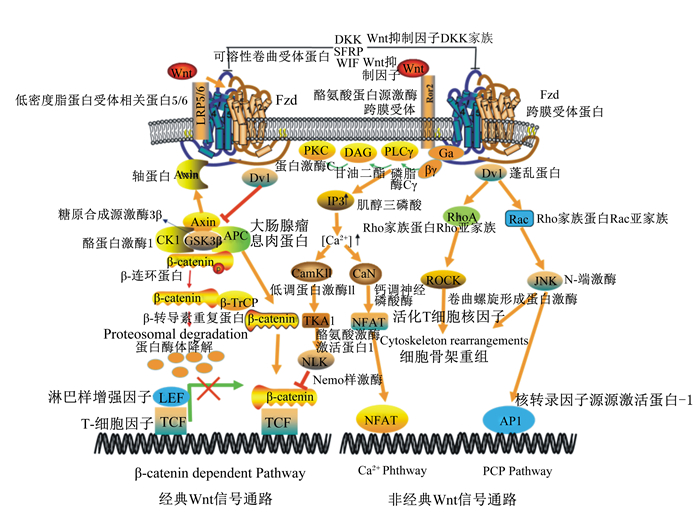
Wnt最早是在小鼠乳腺肿瘤病毒转录的过程中发现的,当时命名为Int1基因。后来发现Int1基因与果蝇的Wingless基因属于同源基因,因此将两者合称为Wnt基因[20]。在哺乳动物中,Wnt家族包括19个富含半胱氨酸的分泌型多糖,以自分泌和旁分泌的方式发挥作用,目前已经鉴定出19个Wnt配体(Wnt1、Wnt2、Wnt2b/13、Wnt3、Wnt3a、Wnt4、Wnt5a、Wnt5b、Wnt6、Wnt7a、Wnt7b、Wnt8a、Wnt8b、Wnt9a、Wnt9b、Wnt10a、Wnt10b、Wnt11和Wnt16)、10个跨膜G蛋白偶联受体(FZD1~10)和2个低密度脂蛋白受体相关蛋白(low-density lipoprotein receptor-related protein,LPR)(LPR-5和LRP-6)[21]。由Wnt配体激活的信号传导可分为2类:经典的Wnt/β-catenin依赖性途径与非经典的β-catenin非依赖性途径。但1个Wnt配体也可以激活多个途径,这取决于下游组分的表达[22]。Wnt信号的早期研究主要集中在对肿瘤形成的影响,但后来有越来越多的证据表明Wnt信号在细胞的增殖、分化以及损伤修复中发挥着重要的作用,特别是在骨骼肌的发育与再生过程中[23-25],Wnt家族通过经典的Wnt/β-catenin信号通路以及非经典的Wnt/plority、Wnt/钙离子(Ca2+)信号通路在骨骼肌的增殖、迁移、分化、融合以及损伤修复等过程发挥着重要的作用[26-27], 如图 2所示。
|
LRP5/6:低密度脂蛋白受体相关蛋白5/6 low-density lipoprotein receptor-related protein 5 or 6;Fzd:跨膜受体蛋白Frizzled;DKK:Wnt抑制因子Dickkopf;SFPR:分泌型卷曲相关蛋白secreted frizzled-related protein;WIF:Wnt抑制因子Wnt inhibitory factor;ROR2:酪氨酸蛋白激酶跨膜受体tyrosine-protein kinase transmembrane receptor;PKC:蛋白激酶C protein kinase C;DAG:甘油二酯diacylglycerol;PLCγ:磷脂酶CγPhospholipase Cγ;DVL:蓬乱蛋白dishevelled;APC:大肠腺瘤息肉蛋白casein kinase 1 adenomatous polyposis coli;Axin:轴蛋白;β-catenin:β-连环蛋白;β-TrCP:β-转导素重复蛋白β-transducinrepeats-containingproteins;LEF/TCFs:淋巴样增强因子/T-细胞因子lymphoid enhancer factor/T cell factor proteins;GSK-3β:糖原合成激酶3β glycogen synthase kinase 3β;IP3:肌醇三磷酸inositol 1,4,5-triphosphate calcineurin;CaN:钙调神经磷酸酶calmodulin-dependent protein kinases;CaMKⅡ:钙离子/钙调蛋白激酶Ⅱ calcium/calmodulin-dependent protein kinase Ⅱ;TKA1:酪氨酸激酶激活蛋白1 tyrosine kinase activator protein 1;NLK:Nemo样激酶Nemo like kinase;NFAT:活化T细胞核因子nuclear factor of activated T cells;RhoA/Rac:Rho家族蛋白;ROCK:卷曲螺旋形成蛋白激酶Rho kinase;JNK:c-Jun N-末端激酶c-Jun N-terminal kinase;AP1:激活蛋白-1 activator protein 1。 图 2 Wnt信号通路 Fig. 2 Wnt signaling pathways[22] |
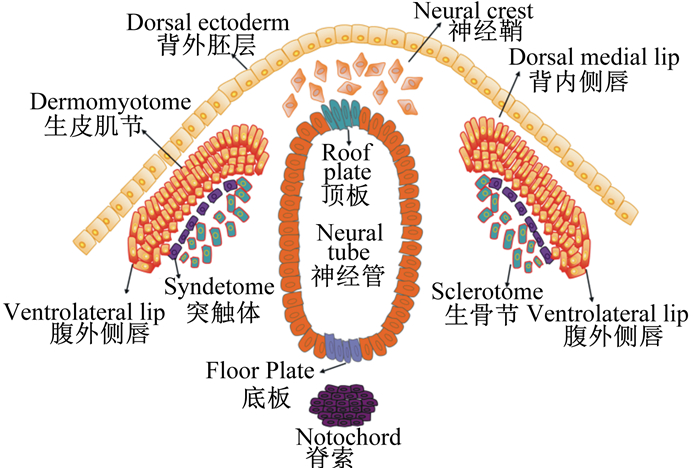
在胚胎发育过程中,Wnt信号主要通过调控MRFs的表达,来控制胚胎期骨骼肌的发育[22]。在小鼠轴旁中胚层的外植体培养物中,发现Wnt1与受体FZD1和FZD6结合通过经典的Wnt/β-catenin信号通路调节生肌因子5(myogenic factor 5,Myf-5)的表达,而Wnt7a或Wnt6通过非经典的Wnt信号通路优先激活成肌分化因子(MyoD)的表达[28]。在体节中,Wnt1、Wnt3a、Wnt4和Wnt6信号在表皮外胚层和神经管中维持配对盒基因(paired box gene,Pax)3和Pax7的表达,诱导体节向生皮肌节转化。在生皮肌节中,当小鼠的胚胎缺乏Wnt1和Wnt3a时生皮肌节将不能形成内侧室,同时伴随着Myf-5表达的减少。而缺乏Wnt6时体节中的上皮组织和生皮肌节发育受阻[29-30]。Wnt信号与胚胎期骨骼肌的起源如图 3所示。
|
图 3 Wnt信号与胚胎期骨骼肌的起源 Fig. 3 Wnt signaling and the embryonic origin of skeletal muscle[4] |
在大鼠的胚胎模型中条件性敲除β-catenin导致早期胚胎死亡,这说明β-catenin在胚胎期的发育过程中是不可或缺的[30-31]。以上研究结果表明,有多个Wnt配体通过经典或非经典的Wnt信号参与胚胎期骨骼肌的发育,但是Wnt的其他配体对胚胎期骨骼肌发育的作用机制以及各个配体之间的联系尚不清楚。此外,Wnt信号是以自分泌和旁分泌的方式发挥作用,分泌的Wnt蛋白也会影响周围组织的发育,这使得Wnt信号对骨骼肌发育调控的确切作用产生了一定的干扰[32-33],因此在未来的研究中应进一步探索各个配体之间的联系以及Wnt信号与调控骨骼肌发育信号网络的联系,为更精确地调控骨骼肌发育提供理论依据。
3 Wnt信号与出生后骨骼肌生长 3.1 Wnt信号与肌纤维肥大在成体骨骼肌中,Wnt信号对肌纤维的形成具有重要的调节作用,多项研究表明,激活经典的Wnt信号通路可以促进肌纤维的肥大。在斑马鱼中,Wnt/β-catenin信号主要通过抑制肌肉生长抑制素(myostain)分泌,增加卫星细胞数量来实现肌纤维的肥大[28]。在组织培养模型中Wnt4通过经典的Wnt信号通路上调生肌因子Myf-5、成肌素(myogenin)和MRF4的表达,同时抑制肌肉生长抑制素抑肌素(myostatin)的表达,使大量的成肌细胞分化融合到肌纤维中而引起肌纤维肥大[33-34]。与此相一致,在鸡胚中过表达Wnt4可以上调Pax7和MyoD的表达,进而促进成肌细胞的分化。相反,也有研究表明Wnt4通过非经典的Wnt信号通路可抵消C2C12细胞中经典Wnt信号的传导[35]。因此,Wnt4是通过经典或非经典的Wnt信号通路发挥作用还需要进一步的研究。最近有研究发现,在骨骼肌静息状态和细胞培养中,Wnt7a与FZD7结合,通过G蛋白磷脂酰肌醇3-激酶(PI3K)途径激活蛋白激酶B(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)的蛋白质合成代谢通路诱导肌纤维的肥大[36]。有趣的是,在该研究中抑制糖原合成酶激酶3β(GSK3β)不会诱导细胞培养模型中肌纤维的肥大。综上所述,Wnt信号是通过激活活化卫星细胞,诱导生肌因子表达,促进卫星细胞增殖、分化并融合到肌纤维而引起肌纤维的肥大。
3.2 Wnt信号与肌纤维类型动物出生后,骨骼肌在生长发育和再生过程中卫星细胞发挥着十分重要的作用,其分化及形成肌纤维的类型与肉品质密切相关[37-40],Wnt信号是调节此过程的重要信号。在禽类的研究中发现Wnt5a可诱导成肌细胞向慢速肌纤维分化,Wnt11诱导成肌细胞快速收缩型肌纤维分化[37]。另一项研究表明,在鸡胚胎中过表达Wnt4不仅导致肌肉沉积量增加,也会引起纤维类型的转变,引起快速收缩型肌纤维比例升高[35]。此外,已有研究表明,在快肌纤维中MyoD高表达,而慢肌纤维中myogenin高表达[41-42],Wnt信号可调控生肌因子家族表达,诱导胚胎期骨骼肌的发生[41],因此在胚胎期加入Wnt激动剂或抑制剂或许是调控肌纤维类型的可靠方式。综上所述,Wnt信号在肌纤维类型形成过程中具有重要作用,但现阶段的研究还不够深入,其具体机理还需要进一步研究。
4 Wnt信号与骨骼肌适应性生长 4.1 Wnt信号与运动骨骼肌是一个具有高度可塑性的动态组织,具有适应生长或训练等生理需求的能力[43-44]。大量研究证实,阻力训练(RT)可以诱导骨骼肌肥大。随着研究的深入,人们发现在RT训练诱导骨骼肌肥大的过程中Wnt信号发挥着重要作用。Armstrong等[45]发现啮齿动物在机械超负荷后跖肌质量显著增加,同时机械负荷也引起β-catenin的激活以及其下游FZD1、蓬乱蛋白1(Dvl1)和淋巴样增强因子1(Lef1)表达的上调,而在下坡跑步训练的研究中发现Wnt3a与β-catenin的mRNA表达丰度没有显著性变化,但Lef1的mRNA表达丰度显著性升高。这些研究表明Wnt信号在调节RT诱导的肌纤维肥大方面发挥着重要作用,但具体作用机制尚不清楚。但最近有研究表明Wnt信号可以通过介导肌肉合成信号通路(AKT/mTOR信号通路)调控肌纤维的肥大[45-46],而抑制Wnt信号可以诱导C2C12细胞系向脂肪细胞分化。此外,Wnt对维持卫星细胞池稳定和激活有着重要的作用,提示Wnt调节阻力训练诱导的肌纤维肥大,可能是通过调控AKT/mTOR信号通路促进卫星细胞增殖分化来实现的。
4.2 Wnt信号与骨骼肌的损伤修复动物出生后,肌肉损伤后的再生能力主要归因于骨骼肌卫星细胞。在受刺激后,骨骼肌卫星细胞被激活、增殖、分化融合到肌纤维或形成新的肌纤维,从而完成再生[46-47]。当机体受到损伤时,Wnt信号主要通过维持卫星细胞池的稳定以及促进足够的成肌细胞来维持骨骼肌的再生。在骨骼肌损伤修复的早期阶段,Wnt5a、Wnt5b和Wnt7a表达上调,而Wnt4表达下调,骨骼肌卫星细胞大量增殖[48]。在分化阶段,主要通过经典的Wnt信号来调控。已有研究证实,从Notch切换到经典的Wnt信号对于卫星细胞分化是必需的[11, 45]。在损伤修复的早期阶段,通过Wnt3a外源诱导经典的Wnt信号激活导致祖细胞过早分化,最终导致卫星细胞池耗尽,肌纤维数目减少[49]。除此之外,也需要非经典的Wnt信号来完成卫星细胞的扩增,Wnt7a通过平面细胞极性(planar cell polarity,PCP)途径诱导具有干细胞特征的卫星细胞亚群不对称分裂,通过不对称细胞分裂产生定向祖细胞,一部分祖细胞返回卫星细胞池,另一部分分化融合进肌纤维中或形成新的肌纤维,由此控制整个卫星细胞池的稳定以及骨骼肌的再生[50]。此外,当Wnt7a与骨骼肌卫星细胞中的受体FZD7结合,可刺激它们的对称分裂,也可以促进骨骼肌卫星细胞的大量增殖。在骨骼肌再生期间过表达Wnt7a不但可以增强骨骼肌的再生能力,同时也可以增加卫星细胞的数量[51]。而在Wnt7a缺陷小鼠中发现卫星细胞的数量显著降低,进一步说明Wnt7a信号在骨骼肌再生中的重要性。但截止目前为止,经典的Wnt/β-catenin信号在调控骨骼肌的再生方面仍存在争议,早期的研究表明,Wnt/β-catenin信号在离体培养中主要通过抑制myostain,激活卫星细胞分化融合到肌管中。然而,另一项离体试验发现经典的Wnt/β-catenin信号促进卫星细胞的增殖。而在活体试验中发现注射重组的Wnt蛋白可以抑制Notch信号诱导成肌细胞系的发生,有趣的是另一项活体试验结果显示,经典的Wnt/β-catenin信号在骨骼肌再生或卫星细胞的自我更新中不是必需的。Rudol等[49]通过构建β-catenin缺失或过表达的小鼠模型发现,当β-catenin缺失时会使成肌细胞的分化发生混乱,当β-catenin过表达时会使成肌细胞过早分化,也不利于骨骼肌的损伤修复。总之,在骨骼肌的损伤修复过程中经典的Wnt/β-catenin信号在诱导分化中发挥重要作用,而非经典的Wnt信号主要是维持卫星细胞池,产生大量的成肌细胞,为分化做准备。2种信号相互配合共同完成骨骼肌的再生。但目前的研究主要偏向于单方面的研究,此外,Wnt信号在损伤修复过程的表达是否存在时序性,以及Wnt信号在杜氏肌营养不良、肌少症等肌肉疾病上是否有修复作用目前尚不清楚,因此未来的研究应进一步探究Wnt信号对骨骼肌损伤修复的作用机制。
5 展望Wnt信号早在1982年就已经被发现,但早期的研究主要集中于胚胎的发育与肿瘤的发生,尽管近年来Wnt信号调控骨骼肌的发育与再生受到人们的重视,但目前对由Wnt介导的复杂调节途径认识仍有限。虽然许多研究已证实,Wnt作为一种分泌型蛋白可以调控骨骼肌生长发育的生物学过程,但其具体的调控机制以及各个配体之间的联系仍有待深入挖掘。此外,Wnt信号与其他调控因子的联系以及在治疗肌肉疾病的潜在作用,也将是今后科研工作者们的考虑的方向。对Wnt信号作用机制的进一步解析,将为畜牧业生产提供理论指导,为肌营养不良等疾病治疗提供新思路。
| [1] |
STERN H M, BROWN A M C, HAUSCHKA S D. Myogenesis in paraxial mesoderm:preferential induction by dorsal neural tube and by cells expressing Wnt-1[J]. Development, 1995, 121(11): 3675-3686. |
| [2] |
AULEHLA A, POURQUIÉ O. Signaling gradients during paraxial mesoderm development[J]. Cold Spring Harbor Perspectives in Biology, 2010, 2(2): a000869. |
| [3] |
赵晓, 莫德林, 张悦, 等. 猪的骨骼肌生长发育研究进展[J]. 生命科学, 2011, 23(1): 37-44. |
| [4] |
GREFTE S, KUIJPERS-JAGTMAN A M, TORENSMA R, et al. Skeletal muscle development and regeneration[J]. Stem Cells Development, 2007, 16(5): 857-868. DOI:10.1089/scd.2007.0058 |
| [5] |
李伯江, 李平华, 吴望军, 等. 骨骼肌肌纤维形成机制的研究进展[J]. 中国农业科学, 2014, 47(6): 1200-1207. DOI:10.3864/j.issn.0578-1752.2014.06.017 |
| [6] |
RYALL J G. Skeletal muscle development[M]. New York, NY: Springer, 2017: 1668-1674.
|
| [7] |
张勇, 王海霞. 肌肉生长发育相关因子GDF-8[J]. 国外医学(遗传学分册), 2001, 24(1): 51-53. DOI:10.3760/cma.j.issn.1673-4386.2001.01.017 |
| [8] |
VON MALTZAHN J, CHANG N C, BENTZINGER C F, et al. Wnt signaling in myogenesis[J]. Trends in Cell Biology, 2012, 22(11): 602-609. DOI:10.1016/j.tcb.2012.07.008 |
| [9] |
MANN C J, PERDIGUERO E, KHARRAZ Y, et al. Aberrant repair and fibrosis development in skeletal muscle[J]. Skeletal Muscle, 2011, 1(1): 21. DOI:10.1186/2044-5040-1-21 |
| [10] |
ABU-ELMAGD M, ROBSON L, SWEETMAN D, et al. Wnt/Lef1 signaling acts via Pitx2 to regulate somite myogenesis[J]. Developmental Biology, 2010, 337(2): 211-219. DOI:10.1016/j.ydbio.2009.10.023 |
| [11] |
WADA K I, KATSUTA S, SOYA H. Formation process and fate of the nuclear chain after injury in regenerated myofiber[J]. The Anatomical Record, 2008, 291(1): 122-128. |
| [12] |
EBERLI D, SOKER S, ATALA A, et al. Optimization of human skeletal muscle precursor cell culture and myofiber formation in vitro[J]. Methods, 2009, 47(2): 98-103. DOI:10.1016/j.ymeth.2008.10.016 |
| [13] |
DICKINS E M, SALINAS P C. Wnts in action:from synapse formation to synaptic maintenance[J]. Frontiers in Cellular Neuroscience, 2013, 7: 162. |
| [14] |
CRUCIAT C C, NIEHRS C. Secreted and transmembrane Wnt inhibitors and activators[J]. Cold Spring Harbor Perspectives in Biology, 2013, 5(3): a015081. |
| [15] |
BRACK A S, CONBOY I M, CONBOY M J, et al. A temporal switch from notch to Wnt signaling in muscle stem cells is necessary for normal adult myogenesis[J]. Cell Stem Cell, 2008, 2(1): 50-59. DOI:10.1016/j.stem.2007.10.006 |
| [16] |
JONES A E, PRICE F D, LE GRAND F, et al. Wnt/β-catenin controls follistatin signalling to regulate satellite cell myogenic potential[J]. Skeletal Muscle, 2015, 5: 14. DOI:10.1186/s13395-015-0038-6 |
| [17] |
MURPHY M M, KEEFE A C, LAWSON J A, et al. Transiently active Wnt/β-catenin signaling is not required but must be silenced for stem cell function during muscle regeneration[J]. Stem Cell Reports, 2014, 3(3): 475-488. DOI:10.1016/j.stemcr.2014.06.019 |
| [18] |
RUDNICKI M A, WILLIAMS B O. Wnt signaling in bone and muscle[J]. Bone, 2015, 80: 60-66. DOI:10.1016/j.bone.2015.02.009 |
| [19] |
HABIB S J, CHEN B C, TSAI F C, et al. A localized Wnt signal orients asymmetric stem cell division in vitro[J]. Science, 2013, 339(6126): 1445-1448. DOI:10.1126/science.1231077 |
| [20] |
ZHAN T, RINDTORFF N, BOUTROS M. Wnt signaling in cancer[J]. Oncogene, 2017, 36(11): 1461-1473. DOI:10.1038/onc.2016.304 |
| [21] |
ANAKWE K, ROBSON L, HADLEY J, et al. Wnt signalling regulates myogenic differentiation in the developing avian wing[J]. Development, 2003, 130(15): 3503-3514. DOI:10.1242/dev.00538 |
| [22] |
MAZZOTTA S, NEVES C, BONNER R J, et al. Distinctive roles of canonical and noncanonical Wnt signaling in human embryonic cardiomyocyte development[J]. Stem Cell Reports, 2016, 7(4): 764-776. DOI:10.1016/j.stemcr.2016.08.008 |
| [23] |
FAN H B, ZHAI Z Y, LI X G, et al. CDX2 Stimulates the Proliferation of porcine intestinal epithelial cells by activating the mTORC1 and Wnt/β-catenin signaling pathways[J]. International Journal of Molecular Sciences, 2017, 18(11): E2447. DOI:10.3390/ijms18112447 |
| [24] |
FERNÁNDEZ-MARTOS C M, GONZÁLEZ-FERNÁNDEZ C, GONZÁLEZ P, et al. Differential expression of Wnts after spinal cord contusion injury in adult rats[J]. PLoS One, 2011, 6(11): e27000. DOI:10.1371/journal.pone.0027000 |
| [25] |
WAN Z Y, HU G X. Relationship between the Wnt signaling pathway and liver fibrosis: recent research status[J]. World Chinese Journal of Digestology, 2011, 19(17): 1761-1766. DOI:10.11569/wcjd.v19.i17.1761 |
| [26] |
NIEHRS C. The complex world of Wnt receptor signalling[J]. Nature Reviews Molecular Cell Biology, 2012, 13(12): 767-779. DOI:10.1038/nrm3470 |
| [27] |
ZHANG Z, RANKIN S A, ZORN A M. Syndecan4 coordinates Wnt/JNK and BMP signaling to regulate foregut progenitor development[J]. Developmental Biology, 2016, 416(1): 187-199. DOI:10.1016/j.ydbio.2016.05.025 |
| [28] |
BENTZINGER C F, VON MALTZAHN J, DUMONT N A, et al. Wnt7a stimulates myogenic stem cell motility and engraftment resulting in improved muscle strength[J]. Journal of Cell Biology, 2014, 205(1): 97-111. |
| [29] |
SANCHEZ-FERRAS O, COUTAUD B, SAMANI T D, et al. Caudal-related homeobox (Cdx) protein-dependent integration of canonical Wnt signaling on paired-box 3 (Pax3) neural crest enhancer[J]. Jouranl of Biological Chemistry, 2012, 287(20): 16623-16635. DOI:10.1074/jbc.M112.356394 |
| [30] |
OTTO A, SCHMIDT C, LUKE G, et al. Canonical Wnt signalling induces satellite-cell proliferation during adult skeletal muscle regeneration[J]. Journal of Cell Science, 2008, 121(17): 2939-2950. DOI:10.1242/jcs.026534 |
| [31] |
WANG Q M, ZHANG Y, YANG K M, et al. Wnt/β-catenin signaling pathway is active in pancreatic development of rat embryo[J]. World Journal of Gastroenterology, 2006, 12(16): 2615-2619. DOI:10.3748/wjg.v12.i16.2615 |
| [32] |
DUBINSKA-MAGIERA M, ZAREMBA-CZOGALLA M, RZEPECKI R. Muscle development, regeneration and laminopathies:how lamins or lamina-associated proteins can contribute to muscle development, regeneration and disease[J]. Cellular and Molecular Life Sciences, 2013, 70(15): 2713-2741. DOI:10.1007/s00018-012-1190-3 |
| [33] |
TAKATA H, TERADA K, OKA H, et al. Involvement of Wnt4 signaling during myogenic proliferation and differentiation of skeletal muscle[J]. Developmental Dynamics, 2010, 236(10): 2800-2807. |
| [34] |
LIU Y, LV W T, YU B Y, et al. S-adenosylmethionine-induced adipogenesis is accompanied by suppression of Wnt/β-catenin and Hedgehog signaling pathways[J]. Molecular and Cellular Biochemistry, 2013, 382(1/2): 59-73. |
| [35] |
BERNARDI H, GAY S, FEDON Y, et al. Wnt4 activates the canonical β-catenin pathway and regulates negatively myostatin:functional implication in myogenesis[J]. American Journal of Physiology Cell Physiology, 2011, 300(5): C1122-C1138. DOI:10.1152/ajpcell.00214.2010 |
| [36] |
VON MALTZAHN J, BENTZINGER C F, RUDNICKI M A. Wnt7a-Fzd7 signalling directly activates the Akt/mTOR anabolic growth pathway in skeletal muscle[J]. Nature Cell Biology, 2011, 14(2): 186-191. |
| [37] |
KURODA K, KUANG S, TAKETO M M, et al. Canonical Wnt signaling induces BMP-4 to specify slow myofibrogenesis of fetal myoblasts[J]. Skeletal Muscle, 2013, 3(1): 5. DOI:10.1186/2044-5040-3-5 |
| [38] |
DIROCCO D P, KOBAYASHI A, TAKETO M M, et al. Wnt4/β-catenin signaling in medullary kidney myofibroblasts[J]. Journal of the American Society of Nephrology, 2013, 24(9): 1399-1412. DOI:10.1681/ASN.2012050512 |
| [39] |
OGAWA R, MA Y R, YAMAGUCHI M, et al. Doublecortin marks a new population of transiently amplifying muscle progenitor cells and is required for myofiber maturation during skeletal muscle regeneration[J]. Development, 2015, 142(1): 51-61. DOI:10.1242/dev.112557 |
| [40] |
ZHUANG L Z, HULIN J A, GROMOVA A, et al. Barx2 and Pax7 have antagonistic functions in regulation of Wnt signaling and satellite cell differentiation[J]. Stem Cells, 2014, 32(6): 1661-1673. DOI:10.1002/stem.1674 |
| [41] |
RIDGEWAY A G, PETROPOULOS H, WILTON S, et al. Wnt signaling regulates the function of MyoD and myogenin[J]. Journal of Biological Chemistry, 2000, 275(42): 32398-32405. DOI:10.1074/jbc.M004349200 |
| [42] |
DRAKE J C, WILSON R J, YAN Z. Molecular mechanisms for mitochondrial adaptation to exercise training in skeletal muscle[J]. FASEB Journal:Official Publication of the Federation of American Societies for Experimental Biology, 2016, 30(1): 13-22. DOI:10.1096/fj.15-276337 |
| [43] |
JI L L, KANG C H, ZHANG Y. Exercise-induced hormesis and skeletal muscle health[J]. Free Radical Biology and Medicine, 2016, 98: 113-122. DOI:10.1016/j.freeradbiomed.2016.02.025 |
| [44] |
BROOK M S, WILKINSON D J, PHILLIPS B E, et al. Skeletal muscle homeostasis and plasticity in youth and ageing:impact of nutrition and exercise[J]. Acta Physiologica, 2016, 216(1): 15-41. DOI:10.1111/apha.12532 |
| [45] |
ARMSTRONG D D, ESSER K A. Wnt/β-catenin signaling activates growth-control genes during overload-induced skeletal muscle hypertrophy[J]. American Journal of Physiology:Cell Physiology, 2005, 289(4): C853-C859. DOI:10.1152/ajpcell.00093.2005 |
| [46] |
XIONG G Y, HINDI S M, MANN A K, et al. The PERK arm of the unfolded protein response regulates satellite cell-mediated skeletal muscle regeneration[J]. eLife, 2017, 6: e22871. DOI:10.7554/eLife.22871 |
| [47] |
GUITART M, LLORETA J, MAÑAS-GARCIA L, et al. Muscle regeneration potential and satellite cell activation profile during recovery following hindlimb immobilization in mice[J]. Journal of Cellular Physiology, 2018, 233(5): 4360-4372. DOI:10.1002/jcp.v233.5 |
| [48] |
YANG Y Z, TOPOL L, LEE H, et al. Wnt5a and Wnt5b exhibit distinct activities in coordinating chondrocyte proliferation and differentiation[J]. Development, 2003, 130(5): 1003-1015. DOI:10.1242/dev.00324 |
| [49] |
RUDOL A, SCHIRWIS E, GIORDANI L, et al. β-catenin activation in muscle progenitor cells regulates tissue Repair[J]. Cell Reports, 2016, 15(6): 1277-1290. DOI:10.1016/j.celrep.2016.04.022 |
| [50] |
LE GRAND F, JONES A E, SEALE V, et al. Wnt7a activates the planar cell polarity pathway to drive the symmetric expansion of satellite stem cells[J]. Cell Stem Cell, 2009, 4(6): 535-547. DOI:10.1016/j.stem.2009.03.013 |
| [51] |
SETHI J K, VIDAL-PUIG A. Wnt signalling and the control of cellular metabolism[J]. Biochemical Journal, 2010, 427(1): 1-17. |




