由生物钟基因网络调控的昼夜生物节律是机体适应昼夜变化的一种内在代谢改变机制和适应性表现[1-2]。生物钟对机体整个代谢系统都有调控作用,可有效调节整个代谢过程中的相关信号以及组织的代谢功能;而各类代谢信号同样会反作用于生物钟,影响生物钟的运行。生物钟节律与营养素之间也具有互作调控效应。生物钟基因网络可精细地调控机体营养物质的消化吸收、生化代谢、消化器官的生理功能及其与代谢相关的行为,使其具有24 h振荡节律;而营养生理代谢节律的打破,也会引起机体相关代谢功能的紊乱[3-6]。动物体消化道栖居的大量微生物,能帮助宿主建立和保持健康。营养素的吸收与其在消化道微生物作用密切相关。研究表明,昼夜生物节律在生物体内普遍存在,因此,营养素吸收与生物钟间的互作效应也受到消化道微生物作用的影响或调控,即与微生物代谢有节律互联机制[7]。本文即综述近年来昼夜生物节律对能量代谢调控机制、消化道微生物代谢的节律性以及微生物与上皮营养素吸收的节律互联机制,为进一步研究阐明宿主动物营养素吸收的微生物和肠道互作机制提供一些基础资料。
1 昼夜生物节律对机体消化与代谢的影响前人研究发现,机体的消化与代谢存在一定的节律性。肝脏与肠道的多种功能也都存在昼夜生物节律[8-12]。绵羊机体生理活动有固有的生理节律周期[13],其中每天08:00—12.00的生理机能达到高峰,体内供氧充足,心肝功能良好,酶活性较强,消化代谢处于最佳阶段;12:00—16:00的生理机能仍然处于高峰期,但不如前述的时间段。消化系统主要是由口腔、胃部、胰腺、小肠、大肠等组织组成,消化过程分泌大量的酶。Maouyo等[14]发现,大鼠的胰液分泌呈昼夜节律性。小肠的蠕动也具有节律性,且与胰液分泌的节律相关。小肠上皮细胞转运载体寡肽转运蛋白1(oligopeptide transporter 1,PEPT1)的mRNA表达即使在非进食阶段也具有一定的节律性,其氨基酸及多肽的吸收推测受昼夜生物节律的调控[15-16]。此外,结肠的蠕动与昼夜生物节律相关。健康的哺乳动物在清晨和进食后的肠蠕动最为频繁,而在夜晚休息时肠蠕动频率处于低谷[17-20]。通过进一步的研究发现,在大鼠肠道中,葡萄糖转运蛋白2(glucose transporter 2,GLUT2)和葡萄糖转运蛋白5(glucose transporter 5,GLUT5)的mRNA表达节律性很明显[21-22],并且发现大鼠盲肠黏膜钠泵、γ上皮钠通道(γ epithelial sodium channel,γENAC)、转运蛋白和钠氢交换调节因子(Na+/H+ exchanger regulating factor 1,NHERF1)的mRNA表达也都呈现昼夜节律变化,由此我们可以推断出在大肠肠道内有多种营养物质的转运蛋白受生物钟基因调控[23]。研究也证实,当肠道生物钟发生改变时,营养物质的吸收和节律也会随之改变。对于野生型小鼠来说,在夜间吸收营养物质的吸收量远高于日间;但生物节律蛋白(CLOCK)Δ19/Δ19突变型小鼠在日间和夜间吸收的量相近,表明了CLOCKΔ19/Δ19突变型小鼠丧失了营养物质吸收的节律性[24];并且CLOCKΔ19/Δ19突变型小鼠能够持续高效的吸收碳水化合物和脂质,从而导致小鼠血脂、血糖过高和肥胖[25]。但令人意外的是,CLOCKΔ19/Δ19突变型小鼠持续吸收的肽类数量相对较低,仅与野生型小鼠在日间吸收的量相近[24]。综上,肠道葡萄糖、肽类、脂质等多种营养物质吸收及其吸收载体蛋白的表达存在节律性并受生物钟节律的调控。
2 昼夜生物节律调控机体能量代谢的机制生物钟通过对关键代谢步骤和参与者的调节实现对于代谢途径的时间调节,这种调节可以通过限速酶、核受体、营养传感器等蛋白质和生物钟机制结合来实现,而组蛋白修饰与代谢和生物钟相关,其中作为组蛋白的去乙酰化酶、沉默信息调节因子2相关酶1(silent mating type information regulation 2 homolog 1, SIRT1)是调节生物节律的关键因子,SIRT1的一个引人注目的标志是,它的酶活性是氧化态烟酰胺腺嘌呤二核苷酸(NAD+)依赖的,因此被认为是代谢活动和基因组稳定性之间的功能联系之一。单磷酸腺苷(AMP)活化蛋白激酶(AMP-activated protein kinase, AMPK)的作用是作为机体的能量感受器,它和SIRT1一同参加哺乳动物生理代谢调节[26]。
作为机体的能量感受器,AMPK受AMP/ATP的影响,例如缺血缺氧、氧化应激等能导致AMP/ATP升高,并激活AMPK,AMPK的激活开启了产生ATP的分解代谢过程,并关闭了ATP消耗过程[27]。研究发现,AMPK的活性在小鼠肝脏、下丘脑和小鼠成纤维细胞中是有规律的。AMPK可通过磷酸化隐花色素-1(crypto-chrome-1, CRY1)和酪蛋白激酶1(creatine kinase 1,CK1)来调节生物钟。CK1通过磷酸化昼夜节律蛋白(PER)和控制它们的衰老来调节昼夜节律[28-29]。AMPK的磷酸化使CRY1成为SCF(Skp1-Cullin-F-box蛋白)泛素连接酶F-box和富含亮氨酸的重复蛋白3(F-box and leucine rich repeat protein 3,FBXL3)的靶标,导致CRY1的泛素化和降解[30]。并且AMPK介导的CK1活化导致PER2降解。在失去葡萄糖和低能量状态的条件下,AMPK活化改变肌细胞增强因子(myocyte enhancer factor,MEF)中的昼夜节律基因表达。有研究表明,小鼠中AMPK异构体的缺失导致昼夜节律基因表达的组织特异性改变,另一个引人注意的地方是,AMPK激活也会导致NAD+水平升高。因此,AMPK还可以通过SIRT1激活间接调节昼夜节律基因表达。
SIRT1是在哺乳动物中最早发现的沉默信息调节因子2相关酶(silent mating type information regulation 2 homolog 2, SIRT2)的同源蛋白,在细胞中占据优势地位,并控制着关键的代谢和生理过程[31]。SIRT1通过使节律基因的启动子处的组蛋白H3第9位赖氨酸残基乙酰化(His H3 Lys 9 acetylation, H3K9ac)和组蛋白H3第14位赖氨酸残基乙酰化(His H3 Lys 14 acetylation, H3K9ac)和非组蛋白蛋白生物钟节律核心蛋白(BMAL1)和PER2去乙酰化来调节昼夜节律。CLOCK和BMAL1复合物与SIRT1相互作用并将其集中到节律基因的启动子中,并能影响钟基因转录。在NAD+的影响下,SIRT1能调控组蛋白H3和BMAL1乙酰化(图 1)。因此,SIRT1和AMPK与生物钟机制关联,将能量代谢与生物节律联系到一起。
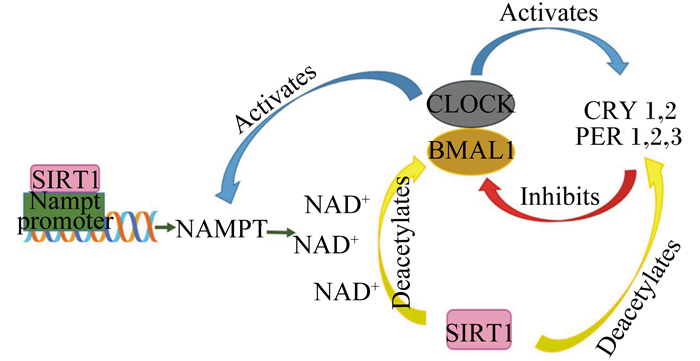
|
NAMPT:烟酰胺磷酸核糖转移酶nicotinamide phosphoribosyl transferase;Nampt promoter:烟酰胺磷酸核糖转移酶启动子;Activates:激活;Inhibits:抑制;Deacetylates:脱乙酰酶。 图 1 烟酰胺磷酸核糖转移酶/NAD+和SIRT1/CLOCK:BMAL1反馈回路 Fig. 1 NAMPT/NAD+ and SIRT1/CLOCK:BMAL1 feedback loop[32] |
机体的营养吸收和代谢与其消化道内的微生物群及其代谢无疑是密切相关的。如肠道无菌小鼠较普通小鼠的体脂肪少[33],这是因为微生物群在一定程度上提高了宿主食物的能量收获[34]。近年来的研究发现,从细菌到哺乳动物都有生物钟节律,且消化道微生物群与宿主机体代谢都受昼夜节律调控并被彼此影响,存在着节律互联互作机制[35],这些互联互作机制甚至还存在有宿主性别的特异性[36],而打破这些相互作用会导致肥胖和其他代谢疾病[37]。
研究者采用模式动物小鼠做了一些消化道微生物及其代谢昼夜生物节律的研究,并发现,在改变小鼠的饲喂时间与扰乱作息后,肠道微生物组发生改变;在CLOCK(Δ19)突变导致生物节律紊乱条件下,无论是试验饲粮组还是常规对照饲粮组,突变小鼠都出现了肠道代谢紊乱及微生物群体结构的变化[38];反之,肠道微生物的昼夜节律对宿主的营养生理代谢也有影响,包括对远肠道的组织,如肝脏基因表达随着肠道菌群的节律性而发生变化[39]。Thaiss等[7]进一步证实,小鼠肠道微生物在部分肠道黏膜组织中节律性运动,向左或向右移动几微米,而后再回到原来的位置;且通过肠道组织与不同的微生物及其代谢物互作影响着宿主的昼夜节律。Wang等[40]采用染色质免疫共沉淀技术研究发现,节律转录阻遏物孤儿核受体(nuclear receptor subfamiy1,Rev-Erbα)直接结合于昼夜节律核转录因子(NFIL3)的启动子来调控其昼夜节律性表达。NFIL3在抗生素处理肠道无菌小鼠小肠上皮细胞表达显著低于常规小鼠的,且无菌小鼠Rev-Erbα的表达较高,表明微生物群通过抑制Rev-Erbα的表达来促进NFIL3的表达。进一步敲除NFIL3基因验证发现,敲除型小鼠通过抑制上皮细胞的脂质吸收和输出,影响脂质代谢,表现出比野生型体重、体脂降低的现象,与无菌小鼠一致。从而揭示了NFIL3作为小鼠肠道微生物群、昼夜节律和宿主新陈代谢间的分子链接,调节宿主机体脂质摄取、储存的机制。Staley等[41]采用新一代高通量测序和高分辨率质谱技术分析植物根际细菌群落的研究同样也发现,根际细菌群落在一定程度上受光照周期的调控,作者认为昼夜节律变化影响了植物-菌群的碳代谢和交换,而碳代谢和交换的变化进而反馈影响了细菌群落结构。综上,微生物群体结构及其代谢与宿主养分吸收代谢之间存在节律性的互作,但这种节律性的互作受昼夜光照周期因素的调控。
4 昼夜节律调控反刍动物瘤胃上皮挥发性脂肪酸(VFA)的吸收代谢PER2是昼夜节律的振荡的核心调控因子。研究表明,PER2除对泌乳代谢的影响外,还特异性地调控糖异生代谢关键核受体过氧化物酶体增殖剂激活受体γ(peroxisome proliferator-activated receptor γ,PPARγ)[42]、脂肪酸氧化代谢调控因子过氧化物酶体增殖剂激活受体α(peroxisome proliferator-activated receptor α, PPARα),参与机体能量代谢的调控[43]。推测PER2对能量物质的吸收也有调控作用,Connor等[44]通过IPA(ingenuity pathway analysis)途径分析发现,犊牛瘤胃上皮组织PER2配体PPARα的活化对其瘤胃乳头的发育、脂肪酸的吸收和氧化代谢都至关重要,但尚没有反刍动物相关的试验研究报道。为此,本课题组前期开展了试验研究,探索了PER2与瘤胃VFA吸收的关系。采用免疫荧光技术研究发现了生物节律因子的CLOCK、PER2在瘤胃上皮细胞中的表达,并发现PER2蛋白表达与VFA吸收转运相关的单羧酸吸收等蛋白表达显著相关,分析其代谢调控通路表明,PER2正向调控阴离子交换蛋白(anionexchanger 2, AE2),但负调控单羧酸转运蛋白(monocarboxylate transporter,MCT)1和4,对瘤胃上皮VFA的吸收代谢有重要的调控作用[45],表明光照周期通过PER2参与瘤胃上皮VFA吸收代谢的调控。
5 昼夜节律调控瘤胃微生物和上皮VFA代谢的互作机制Toll样受体(TLRs)是一类保守的介导天然免疫的跨膜信号传递受体家族,肠上皮细胞通过TLRs/髓样分化因子88(MyD88,TLRs信号通路中的一个关键接头分子)通路来识别微生物群信号,将细胞外信息传递到细胞内,调控机体免疫等关键基因的表达[46]。Mukherji等[47]认为,肠道微生物群产物(MAMPs)也通过和肠道上皮细胞(IEC)TLRs间的相互作用调控小鼠机体内昼夜节律稳态。研究发现,在IEC中,孤儿核受体α(RORalpha)激活和Rev-Erbα阻遏机制调节TLRs的昼夜节律表达,并把微生物群信号转化为c-Jun氨基末端激酶(JNK,又称应激活化蛋白激酶)和抑制蛋白激酶(IKK)等的调节作用,维持IEC许多基因的定时表达和昼夜稳态节律。Wang等[40]的研究进一步发现了,MyD88-/-小鼠肠道上皮细胞的Rev-Erbα表达增加,但NFIL3表达(响应于肠道微生物生理活性)降低至无菌小鼠的表达水平,证实了肠道上皮细胞NFIL3所链接的Rev-Erbα生物节律调控级联信号,也通过MyD88或TLRs/MyD88通路发生作用。
高精料饲养导致的亚急性酸中毒状态引起了瘤胃菌属的变化和VFA代谢的变化;同时,也造成了瘤胃上皮组织的一定损伤因而又影响了其VFA的吸收[48];提示微生物种属及其代谢与瘤胃上皮组织VFA的吸收代谢存在有一定的互作效应。在Chen等[49]关于肉牛亚急性酸中毒的研究中也发现,不易感酸中毒组瘤胃上皮细菌16S rRNA基因拷贝数与总VFA浓度呈负相关现象;而且有趣的是,他们还发现了不易感酸中毒组瘤胃上皮的TLR2和TLR4基因表达量比易感酸中毒组的更高。结合上述Mukherji等[47]关于肠道微生物群产物通过和上皮细胞TLRs的相互作用调控小鼠机体内昼夜节律稳态的研究,提示瘤胃上皮有可能也通过TLRs识别瘤胃微生物的代谢物信号,但至于昼夜节律对瘤胃上皮VFA的吸收调控是否通过TLRs信号通路或其他机制识别瘤胃微生物代谢物,调控瘤胃微生物与上皮VFA的互作代谢,还有待于开展试验研究阐明。
6 小结对于昼夜生物节律对机体能量代谢的研究已经初步表明了,生物钟对动物机体的能量代谢有一定的调控作用,并且阐明是通过生物钟-食物-AMPK-生物钟反馈回路及烟酰胺磷酸核糖转移酶(NAMPT)/NAD+和SIRT1/CLOCK:BMAL1反馈回路等机制实现的。另外,也初步发现了NFIL3作为小鼠肠道微生物群、昼夜节律和宿主新陈代谢间的分子链接,调节宿主机体脂质摄取、储存的机制。但总体上看,研究结果尚不系统,还不能形成昼夜生物节律变化调控机体能量代谢的系统性指导技术;此外,昼夜生物节律调控机体内在的生物钟节律,及其进一步调控能量物质(葡萄糖、挥发性脂肪酸)吸收及其代谢等机理方面在不同畜种上的研究也不系统,不能形成相应系统的调控机制理论。今后还应进一步开展试验,研究阐明昼夜生物节律调控消化道微生物与上皮能量物质代谢互作互联的机制,以为从光照环境改善的角度来调控消化道营养素代谢、宿主生产性能等的研究提供一些基础参考资料。
| [1] |
HIROTA T, FUKADA Y. Resetting mechanism of central and peripheral circadian clocks in mammals[J]. Zoological Science, 2004, 21(4): 359-368. DOI:10.2108/zsj.21.359 |
| [2] |
SAKKOU M, WIEDMER P, ANLAG K, et al. A role for brain-specific homeobox factor Bsx in the control of hyperphagia and locomotory behavior[J]. Cell Metabolism, 2007, 5(6): 450-463. DOI:10.1016/j.cmet.2007.05.007 |
| [3] |
WU T, JIN Y X, KATO H, et al. Light and food signals cooperate to entrain the rat pineal circadian system[J]. Journal of Neuroscience Research, 2008, 86(14): 3246-3255. DOI:10.1002/jnr.v86:14 |
| [4] |
WU T, JIN Y X, NI Y H, et al. Effects of light cues on re-entrainment of the food-dominated peripheral clocks in mammals[J]. Gene, 2008, 419(1/2): 27-34. |
| [5] |
WU T, DONG Y, YANG Z Q, et al. Differential resetting process of circadian gene expression in rat pineal glands after the reversal of the light/dark cycle via a 24 h light or dark period transition[J]. Chronobiology International, 2009, 26(5): 793-807. DOI:10.1080/07420520903044208 |
| [6] |
DONG Y, WU T, NI Y H, et al. Effect of fasting on the peripheral circadian gene expression in rats[J]. Biological Rhythm Research, 2010, 41(1): 41-47. DOI:10.1080/09291010902863289 |
| [7] |
THAISS C A, LEVY M, KOREM T, et al. Microbiota diurnal rhythmicity programs host transcriptome oscillations[J]. Cell, 2016, 167(6): 1495-1510. DOI:10.1016/j.cell.2016.11.003 |
| [8] |
LEFCOURT A M, AKERS R M, WOOD D L, et al. Circadian and ultradian rhythms of peripheral prolactin concentrations in lactating dairy cows[J]. American Journal of Physiology:Regulatory, Integrative and Comparative Physiology, 1994, 267(6): R1461-R1466. DOI:10.1152/ajpregu.1994.267.6.R1461 |
| [9] |
GIANNETTO C, PICCIONE G. Daily rhythms of 25 physiological variables in Bos taurus maintained under natural conditions[J]. Journal of Applied Biomedicine, 2009, 7: 55-61. |
| [10] |
HARVATINE K J, ALLEN M S. Effects of fatty acid supplements on feed intake, and feeding and chewing behavior of lactating dairy cows[J]. Journal of Dairy Science, 2006, 89(3): 1104-1112. DOI:10.3168/jds.S0022-0302(06)72178-6 |
| [11] |
HOSSEINKHANI A, DEVRIES T J, PROUDFOOT K L, et al. The effects of feed bunk competition on the feed sorting behavior of close-up dry cows[J]. Journal of Dairy Science, 2008, 91(3): 1115-1121. DOI:10.3168/jds.2007-0679 |
| [12] |
DEVRIES T J, BEAUCHEMIN K A, VON KEYSERLINGK M A G. Dietary forage concentration affects the feed sorting behavior of lactating dairy cows[J]. Journal of Dairy Science, 2007, 90(12): 5572-5579. DOI:10.3168/jds.2007-0370 |
| [13] |
GORDON J G, MCALLISTER I K. The circadian rhythm of rumination[J]. The Journal of Agricultural Science, 1970, 74(2): 291-297. DOI:10.1017/S0021859600022905 |
| [14] |
MAOUYO D, SARFATI P, GUAN D, et al. Circadian rhythm of exocrine pancreatic secretion in rats:major and minor cycles[J]. American Journal of Physiology, 1993, 264(4): G792-G800. |
| [15] |
SAITO H, TERADA T, SHIMAKURA J, et al. Regulatory mechanism governing the diurnal rhythm of intestinal H+/peptide cotransporter 1(PEPT1)[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2008, 295(2): G395-G402. DOI:10.1152/ajpgi.90317.2008 |
| [16] |
PAN X Y, TERADA T, IRIE M, et al. Diurnal rhythm of H+-peptide cotransporter in rat small intestine[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2002, 283(1): G57-G64. DOI:10.1152/ajpgi.00545.2001 |
| [17] |
AUWERDA J J A, BAC D J, SCHOUTEN W R. Circadian rhythm of rectal motor complexes[J]. Diseases of the Colon & Rectum, 2001, 44(9): 1328-1332. |
| [18] |
BASSOTTI G, IANTORNO G, FIORELLA S, et al. Colonic motility in man:features in normal subjects and in patients with chronic idiopathic constipation[J]. American Journal of Gastroenterology, 1999, 94(7): 1760-1770. DOI:10.1111/ajg.1999.94.issue-7 |
| [19] |
FREXINOS J, BUENO L, FIORAMONTI J. Diurnal changes in myoelectric spiking activity of the human colon[J]. Gastroenterology, 1985, 88(5): 1104-1110. DOI:10.1016/S0016-5085(85)80067-6 |
| [20] |
RAO S S C, SADEGHI P, BEATY J, et al. Ambulatory 24-h colonic manometry in healthy humans[J]. American Journal of Physiology-Gastrointestinal and Liver Physiology, 2001, 280(4): G629-G639. DOI:10.1152/ajpgi.2001.280.4.G629 |
| [21] |
LEHNEN A M, LEGUISAMO N M, DIAS L D, et al. Changes in renal glucose transporters in an animal model of metabolic syndrome[J]. Hormone and Metabolic Research, 2013, 45(11): 840-843. DOI:10.1055/s-00000025 |
| [22] |
WOOD I S, TRAYHURN P. Glucose transporters (GLUT and SGLT):expanded families of sugar transport proteins[J]. British Journal of Nutrition, 2003, 89(1): 3-9. DOI:10.1079/BJN2002763 |
| [23] |
SOTÁK M, POLIDAROVÁ L, MUSÍLKOVÁ J, et al. Circadian regulation of electrolyte absorption in the rat colon[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2011, 301(6): G1066-G1074. DOI:10.1152/ajpgi.00256.2011 |
| [24] |
PAN X Y, HUSSAIN M M. Clock is important for food and circadian regulation of macronutrient absorption in mice[J]. Journal of Lipid Research, 2009, 50(9): 1800-1813. DOI:10.1194/jlr.M900085-JLR200 |
| [25] |
ARBLE D M, BASS J, LAPOSKY A D, et al. Circadian timing of food intake contributes to weight gain[J]. Obesity, 2009, 17(11): 2100-2102. DOI:10.1038/oby.2009.264 |
| [26] |
张红胜, 周玥, 许菲. AMPK, SIRT1与能量代谢[J]. 国际病理科学与临床杂志, 2009, 29(3): 202-206. |
| [27] |
HARDIE D G. AMP-activated/SNF1 protein kinases:conserved guardians of cellular energy[J]. Nature Reviews Molecular Cell Biology, 2007, 8(10): 774-785. DOI:10.1038/nrm2249 |
| [28] |
AKASHI M, TSUCHIYA Y, YOSHINO T, et al. Control of intracellular dynamics of mammalian period proteins by casein kinase I ε (CKIε) and CKIδ in cultured cells[J]. Molecular and Cellular Biology, 2002, 22(6): 1693-1703. DOI:10.1128/MCB.22.6.1693-1703.2002 |
| [29] |
SHIROGANE T, JIN J P, ANG X L, et al. SCFβ-TRCP controls clock-dependent transcription via casein kinase 1-dependent degradation of the mammalian period-1(Per1) protein[J]. The Journal of Biological Chemistry, 2005, 280(29): 26863-26872. DOI:10.1074/jbc.M502862200 |
| [30] |
LAMIA K A, SACHDEVA U M, DITACCHIO L, et al. AMPK regulates the circadian clock by cryptochrome phosphorylation and degradation[J]. Science, 2009, 326(5951): 437-440. DOI:10.1126/science.1172156 |
| [31] |
CHENG H L, MOSTOSLAVSKY R, SAITO S, et al. Developmental defects and p53 hyperacetylation in Sir2 homolog (SIRT1)-deficient mice[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(19): 10794-10799. DOI:10.1073/pnas.1934713100 |
| [32] |
RAMSEY K M, YOSHINO J, BRACE C S, et al. Circadian clock feedback cycle through NAMPT-mediated NAD+ biosynthesis[J]. Science, 2009, 324(5927): 651-654. |
| [33] |
BÄCKHED F, DING H, WANG T, et al. The gut microbiota as an environmental factor that regulates fat storage[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(44): 15718-15723. DOI:10.1073/pnas.0407076101 |
| [34] |
TURNBAUGH P J, LEY R E, MAHOWALD M A, et al. An obesity-associated gut microbiome with increased capacity for energy harvest[J]. Nature, 2006, 444(7122): 1027-1031. DOI:10.1038/nature05414 |
| [35] |
THAISS C A, ZEEVI D, LEVY M, et al. Transkingdom control of microbiota diurnal oscillations promotes metabolic homeostasis[J]. Cell, 2014, 159(3): 514-529. DOI:10.1016/j.cell.2014.09.048 |
| [36] |
LIANG X, BUSHMAN F D, FITZGERALD G A. Rhythmicity of the intestinal microbiota is regulated by gender and the host circadian clock[J]. Proceedings of the National Academy of Sciences of the United States of America, 2015, 112(33): 10479-10484. DOI:10.1073/pnas.1501305112 |
| [37] |
LEONE V, GIBBONS S M, MARTINEZ K, et al. Effects of diurnal variation of gut microbes and high-fat feeding on host circadian clock function and metabolism[J]. Cell Host & Microbe, 2015, 17(5): 681-689. |
| [38] |
VOIGT R M, SUMMA K C, FORSYTH C B, et al. The Circadian clock mutation promotes intestinal dysbiosis[J]. Alcoholism:Clinical and Experimental Research, 2016, 40(2): 335-347. DOI:10.1111/acer.12943 |
| [39] |
CHEN P, MIYAMOTO Y, MAZAGOVA M, et al. microbiota protects mice against acute alcohol-induced liver injury[J]. Alcoholism:Clinical and Experimental Research, 2015, 39(12): 2313-2323. DOI:10.1111/acer.12900 |
| [40] |
WANG Y H, KUANG Z, YU X F, et al. The intestinal microbiota regulates body composition through NFIL3 and the circadian clock[J]. Science, 2017, 357(6354): 912-916. DOI:10.1126/science.aan0677 |
| [41] |
STALEY C, FERRIERI A P, TFAILY M M. Diurnal cycling of rhizosphere bacterial communities is associated with shifts in carbon metabolism[J]. Microbiome, 2017, 5: 65. DOI:10.1186/s40168-017-0287-1 |
| [42] |
GRIMALDI B, BELLET M M, KATADA S, et al. PER2 controls lipid metabolism by direct regulation of PPARγ[J]. Cell Metabolism, 2010, 12(5): 509-520. DOI:10.1016/j.cmet.2010.10.005 |
| [43] |
HAYASHIDA S, KURAMOTO Y, KOYANAGI S, et al. Proxisome proliferator-activated receptor-α mediates high-fat, diet-enhanced daily oscillation of plasminogen activator inhibitor-1 activity in mice[J]. Chronobiology International, 2010, 27(10): 1735-1753. |
| [44] |
CONNOR E E, BALDWIN VI R L, LI C J, et al. Gene expression in bovine rumen epithelium during weaning identifies molecular regulators of rumen development and growth[J]. Functional & Integrative Genomics, 2013, 13(1): 133-142. |
| [45] |
高健.瘤胃上皮挥发性脂肪酸吸收与生物钟因子表达关系的研究[D].硕士学位论文.扬州: 扬州大学, 2017.
|
| [46] |
O'NEILL L A J, BOWIE A G. The family of five:TIR-domain-containing adaptors in Toll-like receptor signalling[J]. Nature Reviews Immunology, 2007, 7(5): 353-364. DOI:10.1038/nri2079 |
| [47] |
MUKHERJI A, KOBⅡTA A, YE T, et al. Homeostasis in intestinal epithelium is orchestrated by the circadian clock and microbiota cues transduced by TLRs[J]. Cell, 2013, 153(4): 812-827. DOI:10.1016/j.cell.2013.04.020 |
| [48] |
WANG M, ZHOU Z, KHAN M J, et al. Clock circadian regulator (CLOCK) gene network expression patterns in bovine adipose, liver, and mammary gland at 3 time points during the transition from pregnancy into lactation[J]. Journal of Dairy Science, 2015, 98(7): 4601-4612. DOI:10.3168/jds.2015-9430 |
| [49] |
CHEN Y H, OBA M, GUAN L L. Variation of bacterial communities and expression of toll-like receptor genes in the rumen of steers differing in susceptibility to subacute ruminal acidosis[J]. Veterinary Microbiology, 2012, 159(3/4): 451-459. |




