2. 中国科学院高原生物适应与进化重点实验室, 西宁 810008;
3. 中国科学院大学, 北京 100049
2. Key Laboratory of Adaptation and Evolution of Plateau Biota, Chinese Academy of Sciences, Xining 810008, China;
3. University of Chinese Academy of Science, Beijing 100049, China
牦牛(Bos grunniens)是长发牛属动物中唯一生活在海拔3 000 m以上高寒地区的特有牛种[1],是高寒牧区重要反刍家畜之一。瘤胃是反刍动物消化饲粮的重要场所,瘤胃里面栖息着大量微生物,微生物间彼此相互作用,使瘤胃内环境处于相对稳定的状态,微生物能很好地利用粗纤维进行发酵,为动物提供能量。研究发现,动物品种、日龄、饲粮结构和季节等都会对瘤胃微生物产生影响[2],放牧家畜的饲草来源主要是天然牧草,所以放牧家畜的生长、代谢、消化及健康状况都与牧草营养价值息息相关。青海省的草场大多属于高寒草甸类型,牧草枯黄时间长,生长时间短,牧草饲用价值受季节变化影响很大,瘤胃中微生物的种类及瘤胃内环境会随着牧草营养成分的改变而变化。淡瑞芳等[3]采用聚合酶链式反应-变性梯度凝胶电泳(PCR-DGGE)技术研究了放牧季节对瘤胃微生物及瘤胃内环境的影响,表明瘤胃微生物及发酵参数随着季节的变化而变化。当前对不同营养水平及不同年龄变化对瘤胃内环境影响的研究[4-5]较多,且对于青藏高原牦牛瘤胃微生物的研究多集中在舍饲及半舍饲情况下,而对于全放牧情况下牧草营养条件、瘤胃内环境及瘤胃微生物之间关系的研究较少。高通量测序(high-throughout sequencing,HTS)技术是近年来发展起来的一种研究微生物生态学的全新技术手段,能全面地反映样品微生物的结构与组成。本试验拟研究不同物候期牧草对放牧牦牛瘤胃内环境参数及瘤胃微生物多样性的影响,从而揭示牧草营养成分与瘤胃内环境参数及瘤胃微生物多样性的关系,旨在为改善高寒牧区牦牛的生产力提供科学依据。
1 材料与方法 1.1 样品采集 1.1.1 牧草以青海省海南州贵南县森多乡高寒草甸草原作为牧草采集地,样地内海拔3 265 m(N35°31′ E100°55′),在返青期、青草期及枯草期的主要牧草种类及比例情况见表 1,地上生物量在7月达到最高,为146.56 g/m2,优质牧草占地上生物量的比例为55%~61%,草地主要优势种为垂穗披碱草(Elymus nutans)、草地早熟禾(Poa pratensi)、矮嵩草(Kobresia humili)等,伴生种为二烈委陵菜(Potentill abifurca)、美丽风毛菊(Saussurea pulchra)、细叶亚菊(Ajania tenuifolia)等。牧草样品分别于返青期(2017年5月2日)、青草期(2017年7月12日)、枯草期(2017年12月7日)采集,放牧样地内随机扔10个(1 m×1 m)样方框,用剪刀采集样方框中的混合牧草,采集后带回实验室,所有样品均在60 ℃烘箱中恒温烘(24 h)至恒重,测定其常规营养成分含量。
|
|
表 1 不同物候期牧草种类及比例情况 Table 1 Species and proportion of forage grass in different phenological periods |
选取平均体重为(108.06±2.86) kg的10只3岁全年放牧的健康青藏高原牦牛(Qinghai and Tibetan plateau yak)(公母各5只)进行序号标记,在放牧草场进行放牧,10头牛无补饲处理,全年放牧,自由饮水,按照标记序号在上述3个取样期时,清晨放牧前空腹经口腔采集瘤胃液75 mL,瘤胃内容物用4层纱布过滤,立即测定瘤胃液pH,取约50 mL用来测定氨态氮(NH3-N)和挥发性脂肪酸(VFA)含量,20 mL备用,其中2 mL用来进行DNA的提取及下一步的测序分析,分装完毕后立即储存到液氮中,带回实验室备用。
1.2 化学分析 1.2.1 牧草常规营养成分含量测定所采集的牧草样品制成风干样后,依据《饲料分析及饲料质量检测技术》[6]测定干物质(DM)含量,并在干物质基础上测定粗蛋白质(CP)、粗脂肪(EE)[7]、酸性洗涤纤维(ADF)和中性洗涤纤维(NDF)含量[8]。
1.2.2 瘤胃内环境参数测定瘤胃液的pH采用pHSJ-3F仪测定,挥发性脂肪酸含量采用气相色谱法测定,氨态氮含量采用Broderick等[9]的方法测定。
1.2.3 气相色谱仪参数采用安捷伦气相色谱仪Agilent 7890A GC System(Agilent,Hewlett Packard,美国)进行检测,色谱仪内装氢离子火焰检测器(FID),载气为高纯氮气,柱温箱参数:程序升温75~190 ℃,检测器参数:氢气流量30 mL/min,空气流量400 mL/min,氢火焰离子化检测器温度为300 ℃。
1.2.4 DNA提取及MiSeq高通量测序DNA的提取采用十六烷基三甲基溴化铵(CTAB)/十二烷基硫酸钠(SDS)法,DNA的浓缩及纯化在1%的琼脂糖凝胶上进行,DNA用无菌水按照1 ng/μL进行稀释,根据细菌16S rDNA基因V4区保守序列,设计通用引物为515F(5’-GTGCCAGCMGCCGCGGTAA-3’)和806R(5’-GGACTACCAGGGTATCTAAT-3’),PCR反应程序为:94 ℃预变性3 min;94 ℃变性40 s,56 ℃退火60 s,72 ℃延伸30 s,进行30个循环,最后72 ℃延伸10 min。PCR扩增产物用2%琼脂糖凝胶电泳进行检测,样品主条带在400~450 bp间的用于后续试验,并用纯化试剂盒(Qiagen Gel Extraction Kit,Qiagen,德国)纯化回收,回收的PCR产物用Qubit® 2.0 Fluorometer (Thermo Scientific)和Agilent Bioanalyzer 2100 System定量,最后按照测序要求混合后送到诺和生物科技有限公司利用Illumina Miseq 2500高通量测序平台进行测序。
1.3 数据分析测序结束后,经过Flash 1.2.7进行reads拼接,Qiime 1.7.0进行tags质控过滤,Uchime algorithm进行去嵌合体处理,根据barcode确定对应样品,去除barcode和引物序列,在97%的相似度下用Qiime 1.7.0将序列归为多个分类操作单元(operational taxonomic unit, OTU),对序列进行比对分析,挑选每个OTU中丰度最高的序列为代表序列,使用RDP classifier 2.2进行物种注释,得到OTU的分类学信息,利用Qiime 1.7.0和R software 2.15.3计算多样性指数Chao1、Shannon、Simpson、ACE指数及覆盖率(coverage),统计各个样品每个OUT中的丰度信息,获得Unweight Unifrac距离矩阵,利用非加权平均(UPGMA)法进行聚类,利用R语言作图,同时对微生物群落进行Unifrac分析,判断不同样品遗传学上距离的远近,比较样品间的差异。
试验数据采用Excel 2007整理,组间各菌群相对丰度差异显著性分析采用SPSS 22.0软件进行,牧草常规营养成分含量、瘤胃发酵参数和瘤胃维生素多样性指数采用一般线性模型进行分析,并采用Duncan法进行多重比较,P<0.05表示差异显著。
2 结果与分析 2.1 高寒草地不同物候期牧草常规营养成分含量的动态变化由表 2可知,牧草的粗蛋白质含量在青草期显著高于返青期和枯草期(P < 0.05),牧草的粗脂肪含量在返青期显著低于青草期和枯草期(P < 0.05),牧草的中性洗涤纤维含量在枯草期要高于其他2个时期,但差异未达到显著水平(P>0.05),牧草的酸性洗涤纤维含量在青草期显著低于返青期和枯草期(P < 0.05)。
|
|
表 2 不同物候期牧草常规营养成分含量 Table 2 Common nutrient contents of forage grass in different phenological periods |
由表 3可知,瘤胃内环境参数随着牧草物候期的变化呈现不同的趋势。氨态氮含量在青草期显著高于返青期和枯草期(P < 0.05);总挥发性脂肪酸、乙酸、丙酸、丁酸含量均在枯草期显著低于返青期与青草期(P < 0.05);异丁酸含量在青草期显著高于返青期和枯草期(P < 0.05),在返青期显著高于枯草期(P < 0.05);戊酸含量在返青期高于青草期和枯草期,但组间差异不显著(P>0.05);与返青期和青草期相比,枯草期乙酸比例显著增加(P < 0.05);丙酸比例在返青期显著高于青草期和枯草期(P < 0.05);异丁酸比例在青草期显著高于返青期和枯草期(P < 0.05);丁酸比例在青草期显著高于枯草期(P < 0.05);戊酸比例以返青期最高,但不同物候期之间无显著差异(P>0.05);乙酸/丙酸在青草期和枯草期显著高于返青期(P < 0.05);在牧草3个物候期中,返青期pH最高,显著高于青草期(P < 0.05),但返青期与枯草期以及青草期与枯草期之间均无显著差异(P>0.05)。
|
|
表 3 不同物候期牧草对放牧牦牛瘤胃内环境参数的影响 Table 3 Effects of forage grass in different phenological periods on ruminal environmental parameters of free-range yak |
通过高通量测序后,群落物种丰富度用Chao1、ACE指数表示,群落结构多样性用Shannon和Simpson指数表示。由表 4可以看出,返青期所能观测的物种数多余其他2个时期,并与青草期的差异达到显著水平(P < 0.05);丰富度指数Chao1、ACE指数均表现为返青期>枯草期>青草期,并且返青期与青草期和枯草期的差异均达到显著水平(P < 0.05);Shannon和Simpson指数在不同物候期之间没有显著差异(P>0.05),但在数值上枯草期Shannon指数大于返青期与青草期;本次测序覆盖率均不低于98%,表示测序范围能涵盖大部分区域。
|
|
表 4 瘤胃微生物丰富度和多样性指数 Table 4 Rumen microbial richness and diversity indexes |
对3个物候期瘤胃微生物在属水平上的相似性利用非加权配对算术平均法(UPGMA)进行聚类分析,结果如图 1所示。青草期牦牛瘤胃微生物能清晰地与返青期与枯草期相区分,返青期与枯草期由于相似性较高,聚在一起,青草期与其他2个物候期分成2大簇。该结果说明不同物候期放牧,由于牧草营养品质的改变,对瘤胃内微生物种类产生了一定的影响。
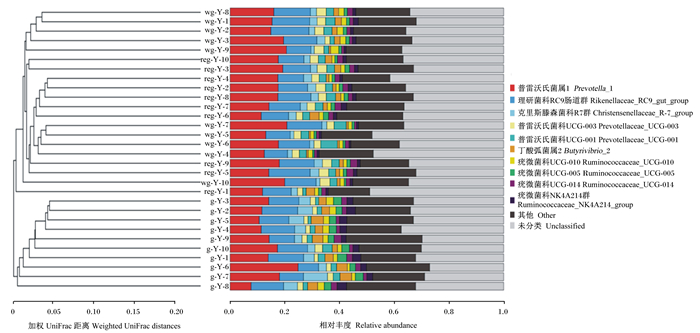
|
reg-Y-1、reg-Y-2、reg-Y-3、reg-Y-4、reg-Y-5、reg-Y-6、reg-Y-7、reg-Y-8、reg-Y-9和reg-Y-10为返青期瘤胃液样品;g-Y-1、g-Y-2、g-Y-3、g-Y-4、g-Y-5、g-Y-6、g-Y-7、g-Y-8、g-Y-9和g-Y-10为青草期瘤胃液样品;wg-Y-1、wg-Y-2、wg-Y-3、wg-Y-4、wg-Y-5、wg-Y-6、wg-Y-7、wg-Y-8、wg-Y-9和wg-Y-10为枯草期瘤胃液样品。 reg-Y-1, reg-Y-2, reg-Y-3, reg-Y-4, reg-Y-5, reg-Y-6, reg-Y-7, reg-Y-8, reg-Y-9 and reg-Y-10 were rumen fluid samples of regreen stage; g-Y-1, g-Y-2, g-Y-3, g-Y-4, g-Y-5, g-Y-6, g-Y-7, g-Y-8, g-Y-9 and g-Y-10 were rumen fluid samples of grassy stage; wg-Y-1, wg-Y-2, wg-Y-3, wg-Y-4, wg-Y-5, wg-Y-6, wg-Y-7, wg-Y-8, wg-Y-9 and wg-Y-10 were rumen fluid samples of withering stage. 图 1 瘤胃微生物属水平上相似性的聚类分析 Fig. 1 Clustering analysis of rumen microbial similarity at genus level |
微生物相对丰度在门水平上>0.1%的物种见表 5。在门水平上,相对丰度>0.1%的门共有15个,各组中还有0.08%~0.14%的序列无法进行归类。在3个物候期均是拟杆菌门(Bacteroidetes)和厚壁菌门(Firmicutes)占主导地位,拟杆菌门的相对丰度为49.60%~52.99%,其中青草期相对丰度最低,厚壁菌门的相对丰度为27.93%~40.42%,其中枯草期显著低于返青期和青草期(P < 0.05);枯草期疣微菌门(Verrucomicrobia)及迷踪菌门(Elusimicrobia)的相对丰度显著高于返青期和青草期(P < 0.05);枯草期变形菌门(Proteobacteria)、蓝菌门(Cyanobacteria)、纤维杆菌门(Fibrobacteres)、浮霉菌门(Planctomycetes)、Saccharibacteria、互养菌门(Synergistetes)、广古菌门(Euryarchaeota)的相对丰度均不同程度地高于其他2个物候期;软壁菌门(Tenericutes)和螺旋体门(Spirochaetae)在青草期的相对丰度高于其他2个物候期,SR1在返青期的相对丰度高于2个物候期,但差异均未达显著水平(P>0.05)。
|
|
表 5 微生物相对丰度在门水平上>0.1%的物种 Table 5 Relative abundance >0.1% of microbial species at phylum level |
微生物相对丰度在属水平上>1%的物种见表 6。在属水平上,相对丰度>1%的有11个属,普雷沃氏菌属1(Prevotella_1)和理研菌科RC9肠道群(Rikenellaceae_RC9_gut_group)是相对丰度较高的2个属,这2个属相对丰度均为枯草期>返青期>青草期。克里斯滕森菌科R7群(Christensenellaceae_R-7_group)、丁酸弧菌属2(Butyrivibrio_2)、月形单胞菌属1(Selenomonas_1)在青草期的相对丰度均显著高于返青期与枯草期(P < 0.05);普雷沃氏菌科UCG-003(Prevotellaceae_UCG-003)和普雷沃氏菌科UCG-001(Prevotellaceae_UCG-001)在青草期的相对丰度低于其他2个时期(P < 0.05),疣微菌科UCG-005(Ruminococcaceae_UCG-005)、疣微菌科NK4A214群(Ruminococcaceae_NK4A214_group)在青草期相对丰度显著高于其他2个时期(P < 0.05)。
|
|
表 6 微生物相对丰度在属水平上>1%的物种 Table 6 Relative abundance >1% of microbial species at genus level |
在种水平上,相对丰度>0.01%的物种如表 7所示。相对丰度最高的栖瘤胃普雷沃氏菌(Prevotella ruminicola)在枯草期达到最高,但是3个物候期之间差异不显著(P>0.05);溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)、Oscillospira guilliermondii的相对丰度在青草期显著高于其他2个物候期(P < 0.05);产琥珀酸丝状杆菌(Fibrobacter succinogenes)的相对丰度在青草期显著低于返青期和枯草期(P < 0.05);黄色瘤胃球菌(Ruminococcus_flavefaciens)、白色瘤胃球菌(Ruminococcus_albus)的相对丰度在返青期均高于其他2个物候期,其中白色瘤胃球菌相对丰度的差异达到显著水平(P < 0.05);短普雷沃氏菌(Prevotella brevis)的相对丰度在青草期最低,显著低于其他2个物候期(P < 0.05)。
|
|
表 7 微生物相对丰度在种水平上>0.01%的物种 Table 7 Relative abundance >0.01% of microbial species at species level |
影响牧草营养价值的因素很多,牧草的品种及牧草的物候期是重要的影响因素[10]。余苗等[11]研究表明,随着生育期的推迟,牧草粗蛋白质含量逐渐增加,酸性洗涤纤维、中性洗涤纤维含量逐渐减少,牧草中粗蛋白质含量越高纤维含量越低,放牧羊的喜食性就越高。牧草的粗蛋白质含量与瘤胃中干物质的降解率、瘤胃壁对营养物质的吸收及食糜在瘤胃中的排空速度均相关[12]。本研究表明,牧草粗蛋白质含量在青草期最高,枯草期最低,这与张盼盼等[13]、杜雪燕等[14]的研究结果相同。牧草在生长初期,叶片生长迅速,光合作用逐渐增强,有利于氨基酸的合成产生更多蛋白质,随着牧草生长枝叶的枯萎,植株的木质化加剧,细胞壁成分增加,导致中性洗涤纤维含量增加。红敏[15]研究发现,在放牧营养条件下,12%~13%的饲粮粗蛋白质含量可以保证最大微生物生长量的需要,本试验测定枯草期牧草中粗蛋白质含量低于12%,需要补饲才能满足牦牛生长的需求。反刍动物通过瘤胃中微生物的发酵作用,将采食的牧草分解为挥发性脂肪酸、微生物蛋白和氨等物质[16],给动物提供能量;乙酸占机体总氧化代谢的25%~40%,丙酸被认为是反刍动物葡萄糖异生的主要前体,参与各种代谢。本试验中,乙酸、丙酸、丁酸、异丁酸及总挥发性脂肪酸含量在夏季(青草期)显著高于冬季(枯草期),这可能是由于夏季牧草非结构性碳水化合物含量较高,易于消化,形成快速发酵而造成的,而冬季牧草粗蛋白质含量低,缺乏氮源,纤维降解菌以氨态氮为氮源发酵结构性碳水化合物的产物挥发性脂肪酸的含量也降低,这与淡瑞芳等[17]的研究结果相似。随着季节变化,在枯草期,牧草中结构性碳水化合物含量较高,中性洗涤纤维含量高于青草期和返青期,纤维含量较高,乙酸发酵为主,导致枯草期乙酸比例最高且乙酸/丙酸高于青草期,这与魏德泳等[18]的研究结果相同。本研究中,牧草中中性洗涤纤维和酸性洗涤纤维含量的变化趋势不同,其原因主要是中性洗涤纤维和酸性洗涤纤维组成成分不同所致,中性洗涤纤维主要包含纤维素、半纤维素和细胞壁镶嵌的蛋白质硅酸盐等,酸性洗涤纤维主要包含纤维素和木质素。瘤胃氨态氮含量在一定程度上反映了瘤胃微生物分解含氮物质产氨的速度及其对氨的摄取利用情况,同时也可反映特定饲粮组成下蛋白质降解与合成之间的平衡关系[19]。本研究结果表明,瘤胃液氨态氮含量在青草期显著高于返青期和枯草期,原因可能是由于随着非结构性碳水化合物/结构性碳水化合物的增加,饲粮可发酵能增多,易降解的蛋白质增加,微生物活力增强,瘤胃液氨态氮含量增多[20-21],这与常维毅等[22]的研究结果相同,夏季(青草期)牧草中含有丰富的蛋白质,牦牛每天摄入的蛋白质量较高,瘤胃内可发酵氮量增加,最终使得瘤胃中氨态氮含量在青草期显著高于其他2个物候期期。研究表明反刍动物瘤胃液的最佳pH介于6.5~6.8[23],而本研究中3个牧草物候期期瘤胃液pH均高于7.0,一小部分原因可能是由于高寒牧草中纤维含量较高的缘故[24],但主要原因为本试验是通过口腔瘤胃导管抽取瘤胃液,瘤胃液内黏附了少量唾液,从而导致pH偏高[25]。
3.2 不同物候期牧草对放牧牦牛瘤胃微生物多样性的影响粗饲料是一种重要的饲粮成分,在饲粮中添加一定的粗饲料可使梅花鹿瘤胃微生物发挥最大的生产力[26]。Qin等[27]和Ley等[28]的研究均表明反刍动物瘤胃微生物中的优势菌群为厚壁菌门和拟杆菌门,本试验得到相同的研究结果,即瘤胃中厚壁菌门和拟杆菌门占有绝大比例,但是在牧草的不同物候期,其相对丰度又有所不同:拟杆菌门的相对丰度为49.60%~52.99%,其在青草期最低,厚壁菌门的相对丰度为27.93%~40.42%,其在枯草期显著低于返青期和青草期。非纤维物质经瘤胃微生物发酵后丙酸产量增加,此时瘤胃发酵类型主要是丙酸型,而纤维类物质经瘤胃微生物发酵后乙酸产量增加,此时瘤胃发酵类型主要是乙酸型[29]。厚壁菌门是分解纤维的主要菌门,含有大量的分解纤维素的菌属[30],本研究中、克里斯滕森菌科R7群、丁酸弧菌属2、月形单胞菌属1的相对丰度在青草期均显著高于其他2个物候期,这些菌属对可溶性蛋白质非纤维植物组成成分的降解做出了较大贡献。牧草粗蛋白质含量与可降解蛋白质的菌属相对丰度呈正相关,普雷沃氏菌属可达瘤胃微生物数量的60%~70%[31]。本研究中普雷沃氏菌属1和理研菌科RC9肠道群在属水平上占比较大,Tajima等[32]发现普雷沃氏菌属的数量随饲粮中中性洗涤纤维含量的增加而降低,这与本研究结果不一致,本研究显示普雷沃氏菌属1的数量随着牧草中性洗涤纤维含量的增加而增加,这可能是由于普雷沃氏菌属既拥有高活性的半纤维素分解菌,又对植物非纤维多糖和蛋白质的降解至关重要[33],放牧草场上,普雷沃氏菌属主要是起降解纤维的作用。在种水平上,徐俊[34]研究指出,黄色瘤胃球菌更倾向吸附于黑麦草叶的表皮和韧皮边缘,因为胞壁降解程度和微生物与底物的吸附程度等相关。布氏密螺旋体只在苜蓿样品中发现[35]。Fondevila等[36]研究发现,在分解纤维素的过程中,栖瘤胃普雷沃氏菌、产琥珀酸丝状杆菌、黄色瘤胃球菌是主要的纤维降解菌,栖瘤胃普雷沃氏菌对纤维物质的降解能力均高于另外两者单独作用,这与本研究结果相一致,即瘤胃中栖瘤胃普雷沃氏菌相对丰度最高。本研究发现,栖瘤胃普雷沃氏菌、产琥珀酸丝状杆菌、黄色瘤胃球菌、短普雷沃氏菌、白色瘤胃球菌的相对丰度在枯草期均高于其他2个物候期。
3.3 牧草常规营养成分含量、瘤胃内环境参数及瘤胃微生物多样性的关系因牧草的生长受季节的影响,牧草中营养成分含量亦随季节的不同有很大的变化。本研究中,牧草营养成分含量随着物候期的变化而变化,枯草期时,牧草中纤维、半纤维、木质素含量较青草期和返青期时增加,瘤胃液乙酸、丙酸、丁酸、氨态氮含量均在枯草期为最低,这是因为:一方面,枯草期牧草粗蛋白质含量降低,氮源减少,降低了瘤胃微生物的活性和数量,故瘤胃内挥发性脂肪酸含量减少;另一方面,由于枯草期牧草中中性洗涤纤维含量增加,导致生成的挥发性脂肪酸含量减少,通过肝糖元异生形成的葡萄糖的量减少,机体需要消耗更多的热量去维持正常的生命代谢,所以分解纤维素的微生物的多样性增加,以便分解更多纤维素及半纤维素,产生挥发性脂肪酸,为牦牛生长提供能量。本研究中瘤胃微生物多样性表现为枯草期>返青期>青草期,丰富度指数表现为返青期>枯草期>青草期,含非结构性碳水化合物较多的青草期牧草,瘤胃微生物多样性及丰富度反而减少。本试验采用加权UniFrac距离(weighted UniFrac distances)矩阵做UPGMA聚类分析研究不同样品间的相似性,并将聚类结果与各样品在门水平上的物种相对丰度整合展示,结果表明由于不同物候期牧草常规营养成分含量的不同,3个物候期瘤胃微生物多样性有所变化,青草期瘤胃液样品能明显的与返青期与枯草期样品相分开,说明不同物候期牧草对瘤胃微生物多样性有影响。
4 结论① 不同物候期牧草常规营养成分含量的变化引起了牦牛瘤胃内环境参数的变化,在青草期瘤胃液氨态氮及总挥发性性脂肪酸含量最高,瘤胃微生物中厚壁菌门的相对丰度最高,普雷沃氏菌属1和理研菌科RC9肠道群含量丰富,主要以分解纤维素的栖瘤胃普雷沃氏菌、溶纤维丁酸弧菌为主;在枯草期瘤胃液总挥发性性脂肪酸含量下降,能量源减少,因此在枯草期应对放牧牦牛进行补饲才能保证牦牛生长。
② 由于不同物候期牧草常规营养成分含量存在差异,采用UPGMA聚类分析表明,物候期对瘤胃微生物多样性产生了影响,在枯草期瘤胃微生物多样性最高。
| [1] |
LESLIE D M, Jr, SCHALLER G B. Bos grunniens and Bos mutus (Artiodactyla:Bovidae)[J]. Mammalian Species, 2009, 836(4): 1-17. |
| [2] |
徐琴.饲粮和品种对山羊瘤胃微生物多样性的影响[D].硕士学位论文.雅安: 四川农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10626-1016051181.htm
|
| [3] |
淡瑞芳, 张海涛, 龙瑞军, 等. 藏系绵羊瘤胃细菌数量及其放牧地牧草养分随季节变化的研究[J]. 草业学报, 2009, 18(1): 100-104. DOI:10.3321/j.issn:1004-5759.2009.01.015 |
| [4] |
赵辛, 韩正康. 灌注和日粮添喂挥发性脂肪酸及其盐类对山羊瘤胃代谢及自由采食量的影响[J]. 南京农业大学学报, 1986, 9(1): 74-83. |
| [5] |
王月, 王志新, 李金泉, 等. 季节和地区对内蒙古白绒山羊瘤胃发酵特性的影响[J]. 中国畜牧杂志, 2015, 51(7): 65-69. DOI:10.3969/j.issn.0258-7033.2015.07.015 |
| [6] |
张丽英. 饲料分析及饲料质量检测技术[M]. 3版. 北京: 中国农业大学出版社, 2007: 48-50.
|
| [7] |
AOAC.Official methods of analysis of AOAC[S].15th ed.Arlington: Association of Official Analytical Chemists, 1990.
|
| [8] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [9] |
BRODERICK G A, KANG J H. Automated simultaneous determination of ammonia and total amino acids in ruminal fluid and in vitro media[J]. Journal of Dairy Science, 1980, 63(1): 64-75. DOI:10.3168/jds.S0022-0302(80)82888-8 |
| [10] |
BUXTON D R. Quality-related characteristics of forages as influenced by plant environment and agronomic factors[J]. Animal Feed Science and Technology, 1996, 59(1/2/3): 37-49. |
| [11] |
余苗, 钟荣珍, 周道玮, 等. 不同生育期虎尾草的体外发酵产气特性[J]. 草业科学, 2014, 31(5): 956-964. |
| [12] |
LI C Q, ALATENGDALAI, XUE S Y, et al. Estimation of herbage intake and digestibility of grazing sheep in Zhenglan banner of inner Mongolia by using n-alkanes[J]. Animal Nutrition, 2015, 1(4): 324-328. DOI:10.1016/j.aninu.2015.11.004 |
| [13] |
张盼盼, 薛树媛, 金海, 等. 不同物候期牧草对放牧绵羊瘤胃发酵指标的影响[J]. 中国畜牧兽医, 2018, 45(3): 698-704. |
| [14] |
杜雪燕, 柴沙驼, 王迅, 等. 河南县高山嵩草草地牧草营养价值与载畜量研究[J]. 河南农业科学, 2015, 44(11): 141-146. |
| [15] |
红敏. 不同生长阶段天然牧草品质评定比较研究[J]. 饲料研究, 2012(12): 79-81. DOI:10.3969/j.issn.1002-2813.2012.12.028 |
| [16] |
SHARP W M, JOHNSON R R, OWENS F N. Ruminal VFA production with steers fed whole or ground corn grain[J]. Journal of Animal Science, 1982, 55(6): 1505-1514. DOI:10.2527/jas1982.5561505x |
| [17] |
淡瑞芳, 张海涛, 龙瑞军, 等. 季节变化对放牧藏系绵羊瘤胃发酵特性及产甲烷菌的影响[J]. 西北农业学报, 2013, 22(2): 1-6. |
| [18] |
魏德泳, 朱伟云, 毛胜勇. 日粮不同NFC/NDF比对山羊瘤胃发酵与瘤胃微生物区系结构的影响[J]. 中国农业科学, 2012, 45(7): 1392-1398. |
| [19] |
李小娜, 高艳霞, 李秋凤, 等. 盛花期甘农3号苜蓿干草营养成分及瘤胃降解特性研究[J]. 中国畜牧杂志, 2012, 48(12): 54-58. DOI:10.3969/j.issn.0258-7033.2012.12.013 |
| [20] |
MCDONALD P, EDWARDS R A, GREENHALGH J F D. Animal nutrition[M]. 4th ed. New York: Longman, 1988.
|
| [21] |
凌虹, 陈红跃, 官继承. 日粮碳水化合物结构对瘤胃发酵及消化代谢影响的研究进展[J]. 中国畜牧兽医, 2012, 39(9): 134-137. DOI:10.3969/j.issn.1671-7236.2012.09.034 |
| [22] |
常维毅, 郑雪, 王晓旭, 等. 不同季节日粮组成对狍瘤胃内环境的影响[J]. 中国兽医学报, 2012, 32(11): 1712-1715. |
| [23] |
郭春华, 张均, 王康宁, 等. 高寒草地生物量及牧草养分含量年度动态研究[J]. 中国草地学报, 2007, 29(1): 1-5. |
| [24] |
韩正康, 陈伟华, 陆天水. 三种饲养制度下山羊瘤胃内pH、氨氮和蛋白质含量的变化[J]. 南京农业大学学报, 1982, 5(3): 118-124. |
| [25] |
申军士.日粮能氮释放同步性对奶牛瘤胃代谢、生产效率与性能的影响研究[D].博士学位论文.杭州: 浙江大学, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10335-1013186929.htm
|
| [26] |
魏园, 赵晨旭, 李心慰, 等. 不同粗纤维源日粮对梅花鹿瘤胃微生物区系的影响[J]. 中国兽医学报, 2018, 38(1): 217-221, 229. |
| [27] |
QIN J J, LI R Q, RAES J, et al. A human gut microbial gene catalogue established by metagenomic sequencing[J]. Nature, 2010, 464(7285): 59-65. DOI:10.1038/nature08821 |
| [28] |
LEY R E, LOZUPONE C A, HAMADY M, et al. Worlds within worlds:evolution of the vertebrate gut microbiota[J]. Nature Reviews Microbiology, 2008, 6(10): 776-788. DOI:10.1038/nrmicro1978 |
| [29] |
EVANS N J, BROWN J M, MURRAY R D, et al. Characterization of novel bovine gastrointestinal tract Treponema isolates and comparison with bovine digital dermatitis treponemes[J]. Applied and Environmental Microbiology, 2011, 77(1): 138-147. DOI:10.1128/AEM.00993-10 |
| [30] |
MATSUI H, OGATA K, TAJIMA K, et al. Phenotypic characterization of polysaccharidases produced by four Prevotella type strains[J]. Current Microbiology, 2000, 41(1): 45-49. DOI:10.1007/s002840010089 |
| [31] |
MEYER M, STENZEL U, HOFREITER M. Parallel tagged sequencing on the 454 platform[J]. Nature Protocols, 2008, 3(2): 267-278. DOI:10.1038/nprot.2007.520 |
| [32] |
TAJIMA K, AMINOV R I, NAGAMINE T, et al. Diet-dependent shifts in the bacterial population of the rumen revealed with real-time PCR[J]. Applied and Environmental Microbiology, 2001, 67(6): 2766-2774. DOI:10.1128/AEM.67.6.2766-2774.2001 |
| [33] |
李莉, 沈明华, 俞红贤, 等. 含1/4野血犊牦牛血红蛋白、肌红蛋白含量的测定[J]. 青海大学学报(自然科学版), 2005, 23(6): 42-44. DOI:10.3969/j.issn.1006-8996.2005.06.013 |
| [34] |
徐俊.不同牧草来源的NDF在瘤胃中降解特性及其对细菌群落结构的影响[D].博士学位论文.扬州: 扬州大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-11117-1014355859.htm
|
| [35] |
LATHAM M J, BROOKER B E, PETTIPHER G L, et al. Adhesion of Bacteroides succinogenes in pure culture and in the presence of Ruminococcus flavefaciens to cell walls in leaves of perennial ryegrass (Lolium perenne)[J]. Applied and Environmnetal Microbiology, 1978, 35(6): 1166-1173. |
| [36] |
FONDEVILA M, DEHORITY B A. Interactions between Fibrobacter succinogenes, Prevotella ruminicola, and Ruminococcus flavefaciens in the digestion of cellulose from forages[J]. Journal of Animal Science, 1996, 74(3): 678-684. DOI:10.2527/1996.743678x |




