2. 广东省水禽健康养殖重点实验室, 广州 510225
2. Guangdong Province Key Laboratory of Waterfowl Healthy Breeding, Guangzhou 510225, China
雏鹅免疫系统发育尚未成熟,易受环境刺激而产生强烈的应激反应,诱发各种疫病,导致生产性能下降,影响经济效益,因此在雏鹅饲养阶段注重增强雏鹅抗应激及免疫调节能力,是提高养鹅质量的关键环节。肝脏是机体固有免疫功能的主要执行者,调节固有免疫和适应性免疫之间的平衡关系,是机体防御侵害的重要天然屏障。细菌、病毒、药物、毒物等可引起肝脏发生脂肪变性、纤维化、坏死、炎性细胞浸润等损伤,导致肝功能障碍[1],在这些病理过程中,固有免疫系统接收受损肝细胞的危险信号,介导炎症反应,进一步加剧肝脏氧化损伤,因此,保持肝脏抗氧化功能正常,对机体的免疫功能也有协同作用。补益类中药如人参、黄芪、白术、当归、灵芝、枸杞等对机体免疫功能有明显的促进作用[2-4],现代药理学研究发现,多糖是中药发挥免疫增强作用的主要活性成分,白术多糖(polysaccharide of Atractylodes macrocephala Koidz,PAMK)有明显的促免疫、抗氧化、抗肿瘤等作用,本课题组前期研究中也证实了PAMK能正向调节机体的免疫应答能力,保持机体内环境稳态[5-8]。基于上述原因,本研究以1日龄马岗鹅雏鹅为研究对象,利用环磷酰胺(cyclophosphamide,CTX)制备雏鹅肝损伤模型,饲喂400 mg/kg PAMK,通过检测肝脏组织损伤指标、肝脏抗氧化功能及Toll样受体4(Toll-like receptor 4,TLR4)通路中相关基因mRNA的相对表达量,分析PAMK对雏鹅肝损伤的保护作用及可能机制,为开发利用无毒、高效的免疫增强剂,降低饲养成本,提高养殖户的经济效益提供参考。
1 材料与方法 1.1 试验材料PAMK(含量70%)购自西安市天园生物制剂厂;注射用环磷酰胺(0.2 g/瓶,国药准字H32020857),购自江苏盛迪医药有限公司。
1.2 试验动物及饲粮试验动物为180只健康的1日龄马岗鹅雏鹅(雄性),购自清远市金羽丰鹅业有限公司。参照我国《无公害食品鹅饲养管理技术规范》(NY/T 5267—2004)和NRC(1994)肉鹅营养需要配制玉米-豆粕型基础饲粮,其组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验采用单因素完全随机分组试验设计,将180只健康的1日龄马岗鹅雏鹅随机分成3组,每组3个重复,每个重复20只,各重复初始体重无显著差异(P>0.05)。3组分别为对照组、环磷酰胺组(CTX组)、白术多糖+环磷酰胺组(PAMK+CTX组),进行28 d的饲养试验。PAMK+CTX组从4日龄开始在基础饲粮中添加400 mg/kg的PAMK,直至试验结束。19、20、21日龄,对照组雏鹅腿肌注射0.5 mL生理盐水(NS),其余2组雏鹅分别腿肌注射40 mg/kg BW的CTX溶液,28日龄宰杀取样(宰杀前禁食12 h)。全程饲养规程、免疫程序及环境控制标准均按广东省地方标准《马岗鹅肉鹅饲养管理技术规范》(DB 44/T 1595—2015)执行。
1.4 样品采集及测定 1.4.1 雏鹅肝脏和胆囊指数测定每个重复随机选取6只试验雏鹅,于28日龄活体称重,颈静脉放血宰杀,新洁尔灭溶液浸泡1 min,75%酒精溶液喷洒腹部消毒处理,快速开腹摘取整个肝脏和胆囊,分别称重,按照以下公式进行肝脏和胆囊指数计算:

|
正置显微镜观察肝脏组织结构:剪取0.5 cm3的肝脏组织块,固定于福尔马林溶液,制备石蜡切片,切片取3 μm厚度,苏木精-伊红(HE)染色,中性树胶封片,CCD采集图像。透射电子显微镜(TEM)观察肝脏组织超微结构:肝脏组织用剪刀及镊子取1~2 mm2的近似长方体小块,固定于2.5%中性戊二醛溶液,置于4 ℃保存,送广州金域医学检验中心制备电镜标本。
1.4.3 肝脏抗氧化指标及8-羟基脱氧鸟苷(8-OHdG)含量测定取约0.1 g肝脏组织,磷酸盐缓冲液洗涤2次,加入9倍NS,匀浆机均浆(少于1 min),组织匀浆3 000 r/min离心15 min,取上清进行检测。肝脏超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、诱导型一氧化氮合酶(iNOS)活性及丙二醛(MDA)、8-OHdG含量采用试剂盒检测,试剂盒购自南京建成生物工程研究所。
1.4.4 肝脏TLR4信号通路中相关基因mRNA的相对表达量检测 1.4.4.1 总RNA抽提和反转录使用TRIzol reagent Invitrogen提取肝脏组织总RNA,DNaseⅠ消化,电泳检测RNA完整性。逆转录cDNA,分装于-20 ℃保存,备用。
1.4.4.2 实时定量荧光PCR根据NCBI数据库序列,设计合成的引物序列信息见表 2。反应体系:稀释后的cDNA 2.0 μL,上游引物0.5 μL,下游引物0.5 μL,2×SYBR Green qPCR SuperMix 10 μL,dH2O补至20 μL。反应条件:50 ℃ 2 min,95 ℃ 30 s,95 ℃ 5 s、60 ℃ 34 s,40个循环。利用2-△△Ct方法计算肝脏TLR4信号通路中相关基因[TLR4、髓样分化因子88(myeloid differentiation primary response,MyD88)、肿瘤坏死因子受体相关因子6(tumor necrosis factor receptor-associated factor 6,TRAF6)、细胞外信号调节激酶激酶1(mitogen activated protein kinase kinase 1,MEKK1)、丝裂原活化蛋白激酶激酶(mitogen-activated protein kinase kinase,MKK)3、MKK6、IκB激酶(inhibitor of nuclear factor kappa-B kinase,IKK)ε、IKKα、核因子κB抑制蛋白α(inhibitor of nuclear factor-κB α,IκBα)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase,p38MAPK)]mRNA的相对表达量,以β-肌动蛋白(β-actin)作为内参基因。
|
|
表 2 引物序列信息 Table 2 Primer sequence information |
试验数据均采用Prism 5.0软件进行单因素方差分析,Tukey多重比较法进行组间比较。结果用“平均值±标准差”表示。
2 结果与分析 2.1 PAMK对CTX诱导的雏鹅肝脏和胆囊指数的影响CTX组雏鹅肝脏剖检可见肝脏颜色偏红黄,是胆汁潴留的典型表现,肝脏肿胀、横切面钝圆,胆囊明显萎缩。由表 3可见,与对照组相比,CTX组雏鹅肝脏指数显著升高(P < 0.05),胆囊指数显著下降(P < 0.05);PAMK+CTX组肝脏指数和胆囊指数与对照组相比无显著差异(P>0.05)。这表明饲粮中添加400 mg/kg PAMK后,雏鹅肝脏和胆囊指数均恢复正常,说明CTX对肝脏有损伤作用,可能是由于CTX主要代谢产物丙烯醛对肝脏产生的毒性作用,而PAMK能够显著减轻肝脏损伤程度,从外观肝脏颜色及肝脏和胆囊指数结果上看,均与对照组无明显差异。
|
|
表 3 雏鹅肝脏和胆囊指数变化 Table 3 Changes of liver and gallbladder indexes of goslings |
肝脏组织石蜡切片结果显示,对照组雏鹅肝脏背膜完整,肝小叶分解不明显,汇管区结构完整,高倍镜下显示,肝索排列整齐,肝血窦大小适中,窦内可见库普弗细胞、淋巴细胞及异嗜性粒细胞,肝细胞形态良好,胞核呈近圆形,双核肝细胞较多,小叶间胆管管壁结构正常,周围结缔组织厚度正常,微胆管结构正常。
CTX组雏鹅肝脏实质部分结构疏松,肝内静脉有严重的红细胞聚集现象,淋巴细胞炎性浸润现象严重,出现大量炎性小灶,汇管区血管壁结构剥离分层,部分小胆管管壁结构缺失,汇管区结缔组织大量增生,纤维化现象严重,肝血窦空隙增大,内含大量红细胞。高倍镜下显示,肝索排列不整齐,结构模糊,细胞间空隙明显增大,肝细胞胞浆淡染,胞核内染色质缺失、染色质固缩现象多见,胞核形态各异,有的呈现皱缩现象,胞浆内充斥大量脂肪滴,肝小叶周边肝细胞胞浆内有红染物质聚集,中央小静脉周围的肝细胞脂肪变情况加重,双核肝细胞数量较对照组急剧减少,微胆管内有胆汁淤积,肝血窦壁结构消失,汇管区周围聚集大量较小的再生肝细胞,小叶间胆管壁细胞排列不整齐,管壁增厚,大量纤维组织增生。
PAMK+CTX组的肝脏组织在低倍镜下观察发现形态与对照组接近,肝实质结构恢复正常,组织排列整齐,小叶间静脉及肝小叶中央静脉内血细胞数量明显减少,淋巴细胞浸润情况较CTX组有明显好转,但肝实质中依然有纤维化现象,可能是炎性浸润消退后的组织增生所致,汇管区结缔组织也较对照组稍多,但比CTX组明显变少,小的再生肝细胞仅出现在部分汇管区周围。高倍镜下显示,肝索排列整齐,肝血窦形态恢复正常,内部红细胞稍多于对照组,肝细胞脂肪变程度明显减轻,肝细胞形态及完整性与对照组无差异,出现较多双核肝细胞,肝血窦内库普弗细胞数量较多,肝实质边缘部位偶见1~2个炎性小灶,淤胆现象较CTX组明显减少,汇管区小叶间静脉、动脉及小胆管结构正常,管壁细胞排列整齐,无纤维增生现象。

|
对照组、环磷酰胺组及白术多糖+环磷酰胺组从上到下依次为:100×、400×、1 000×;CV:终末肝小静脉;Ly:淋巴细胞;箭头:再生小肝细胞。 Control group, CTX group and PAMK+CTX group from top to bottom were: 100×, 400× and 1 000×, respectively; CV: terminal hepatic venule; Ly: lymphocytes; arrow: regenerating small hepatocyte. 图 1 雏鹅肝脏组织结构(苏木精-伊红染色) Fig. 1 Liver structure of goslings (HE staining) |
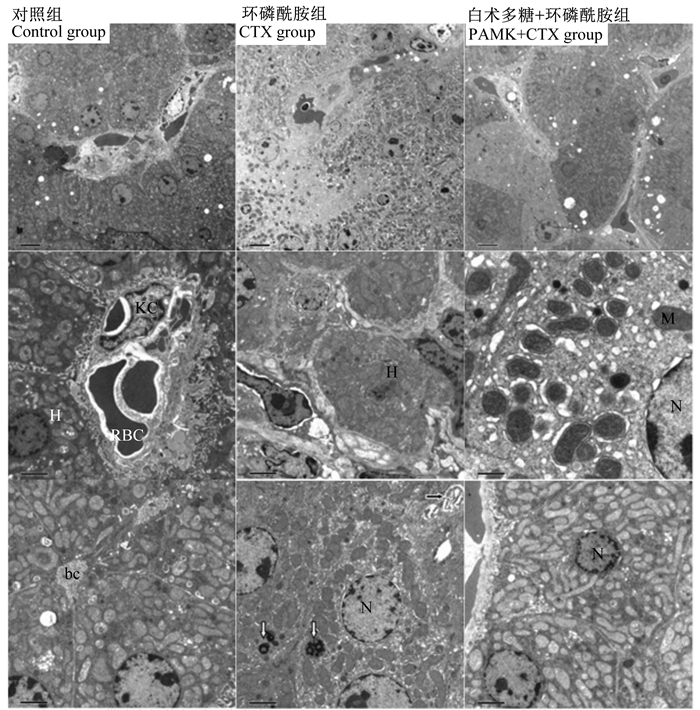
TEM观察内部超微结构发现,对照组雏鹅肝细胞胞质内线粒体丰富,形态正常,嵴结构清晰可见,核内常染色质多,分布均匀,异染色质较少,核仁结构可见,电子密度正常,可见较多双核肝细胞,肝细胞之间膜结构清晰,排列整齐,肝窦内皮细胞附着于肝细胞表面微绒毛顶端,肝窦内有库普弗细胞、形态正常的红细胞,微胆管结构正常,可见微绒毛突向管腔。
CTX组肝细胞内部结构缺失严重,细胞基质空虚,电子密度降低,内含较多小脂滴,胞质内线粒体变圆、肿胀,嵴结构消失,内有色素颗粒沉着,并有明显的髓样小体,肝细胞核固缩现象多见,异染色质大量聚集成块或边集,表明细胞处于凋亡早期,有的肝细胞胞核消失,肝细胞膜增厚,微胆管结构不清,内充满胆汁,肝细胞之间有淋巴细胞浸润。
PAMK+CTX组肝细胞膜清晰,间隙中微绒毛明显,胞质内含有丰富线粒体,未见肿胀变圆,但有嵴溶解现象,线粒体基质电子密度增大,胞质内有色素沉积颗粒及脂肪空泡,肝细胞核核膜完整,核周隙增大,胞核内常染色质电子致密度正常,异染色质延核周分布,核仁清晰,双核肝细胞多见,偶见皱缩的肝细胞,肝细胞之间有淋巴细胞浸润,肝窦内有肝巨噬细胞和红细胞,形态均正常,但肝窦内有淡染均匀的物质。
|
对照组、环磷酰胺组从上到下依次为:1 500×、5 000×、5 000×;白术多糖+环磷酰胺组从上到下依次为:1 500×、10 000×、5 000×。KC:库普弗细胞;H:肝细胞;RBC:红细胞;N:细胞核;M:线粒体;bc:微胆管;白色箭头:色素颗粒;黑色箭头:髓样小体。 Control group and CTX group from top to bottom were: 1 500×, 5 000× and 5 000×, respectively; PAMK+CTX group from top to bottom were: 1 500×, 10 000× and 5 000×, respectively. KC: Kupffer cells; H: hepatocytes; RBC: red blood cells; N: nucleus M: mitochondria; BC: Micro bile duct; white arrow: pigment granules; black arrow: medullary corpuscle. 图 2 雏鹅肝脏超微结构(透射电子显微镜) Fig. 2 Liver ultrastructure of goslings (TEM) |
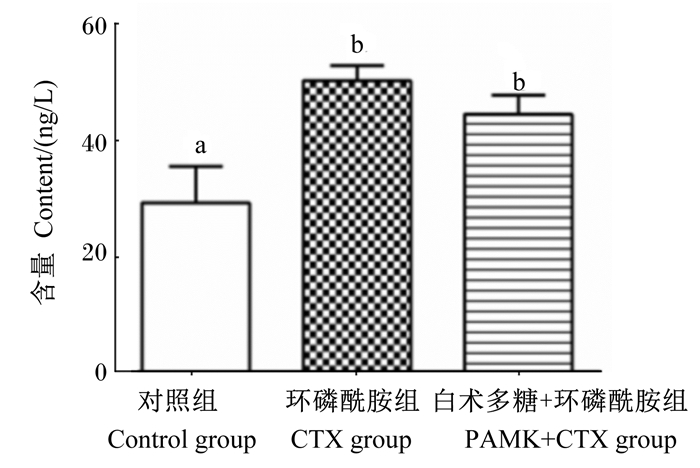
8-OHdG是细胞DNA氧化损伤程度的生物标志物,由图 3可见,CTX组肝脏中的8-OHdG含量显著高于对照组(P < 0.05),比对照组高出71.88%,表明CTX可造成肝细胞的DNA氧化损伤。而PAMK+CTX组肝脏中8-OHdG含量仅比CTX组降低了11.44%(P>0.05),比对照组高出52.22%(P < 0.05)。
|
数据柱标相同小写字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P<0.05)。下图同。 Value columns with the same small letter mean no significant difference (P > 0.05), while with different small letters mean significant difference (P < 0.05). The same as below. 图 3 雏鹅肝脏中8-OHdG含量 Fig. 3 Content of 8-OHdG in liver of goslings |
MDA、SOD、GSH-Px、CAT及iNOS是检测肝脏损伤的代表性指标,由表 4可见,与对照组相比,CTX组肝脏中MDA含量显著升高(P < 0.05),抗氧化相关酶类SOD、GSH-Px、CAT和iNOS活性显著降低(P < 0.05)。PAMK+CTX组肝脏中MDA含量显著低于CTX组(P < 0.05),与对照组无显著差异(P>0.05);PAMK+CTX组肝脏中GSH-Px和iNOS活性显著高于CTX组(P < 0.05),与对照组无显著差异(P>0.05);PAMK+CTX组肝脏中SOD活性显著高于CTX组(P < 0.05),但仍显著低于对照组(P < 0.05);PAMK+CTX组肝脏中CAT活性显著高于对照组和CTX组(P < 0.05)。这提示PAMK可显著降低有害代谢产物MDA的含量,提稿抗氧化酶类的活性,对肝脏的抗氧化功能有促进作用。
|
|
表 4 雏鹅肝脏中抗氧化指标结果 Table 4 Results of liver antioxidant indexes of goslings |
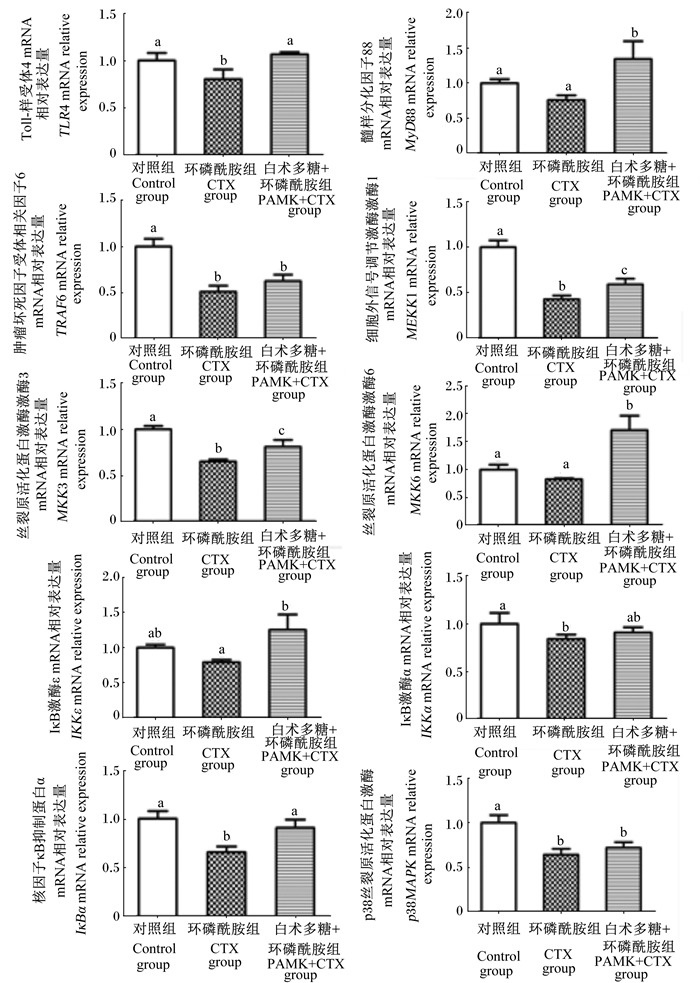
由图 4可见,CTX组肝脏TLR4、TRAF6、MEKK1、MKK3、p38MAPK、IκBα、IKKα mRNA的相对表达量显著低于对照组(P < 0.05),MyD88、MKK6、IKKε mRNA的相对表达量低于对照组,但差异不显著(P>0.05),表明CTX对TLR4信号通路有较强的负性调节作用。PAMK+CTX组肝脏TLR4信号通路中相关基因mRNA的相对表达量均高于CTX组,其中TLR4、MyD88、MEKK1、MKK3、MKK6、IKKε、IκBα mRNA的相对表达量显著高于CTX组(P < 0.05)。PAMK+CTX组肝脏MyD88、MKK6 mRNA的相对表达量显著高于对照组(P < 0.05),TRAF6、MEKK1、MKK3、p38MAPK mRNA的相对表达量显著低于对照组(P>0.05),TRAF6、IKKα、p38MAPK mRNA的相对表达量与CTX组无显著差异(P>0.05)。
|
图 4 雏鹅肝脏TLR4信号通路中相关基因mRNA的相对表达量 Fig. 4 mRNA relative expression of related genes in liver TLR4 signaling pathway of goslings |
CTX对肝脏的毒性作用较大[9-10],本试验中,CTX组雏鹅肝脏肿大呈黄红色,胆囊萎缩,肝细胞坏死、凋亡现象严重,说明CTX诱导的雏鹅肝脏损伤模型制备成功,饲粮添加400 mg/kg PAMK后,能明显缓解CTX引起的肝损伤症状,显著降低膜脂过氧化标志物MDA含量,提高抗氧化酶活性。已有研究表明,CTX对大鼠、小鼠等模式动物肝脏的损伤主要集中在细胞变性、脂肪变性、纤维化及大量炎性细胞浸润等方面[11-12],发现CTX造成的肝脏损伤在不同物种间的差异性小,不同来源的多糖对这种损伤都有明显的缓解能力。但本试验发现,PAMK对细胞DNA氧化损伤标志物8-OHdG含量无影响,说明PAMK不能修复已受损的肝细胞,可能是通过提高肝细胞的再生能力、加速清除坏死细胞等途径,使PAMK+CTX组雏鹅肝脏的形态及超微结构都有了明显改善。不同来源的多糖对受损肝脏的抗氧化功能也有提高作用[13-14],可通过增强肝细胞及库普弗细胞抗氧化酶的合成能力,来提高机体内酶的活性,从而减轻氧化应激损伤,这种作用与TLR4信号通路密切相关。
TLR4信号通路是免疫与炎症研究中的一条重要细胞信号转导通路,与固有免疫应答过程密切相关,目前已经在许多物种的肝细胞及肝脏固有免疫细胞表面检测到了TLR4蛋白,TLR4信号通路激活后产生的炎性细胞因子、趋化因子[15]是形成损伤的公认机制[16-18]。本试验从肝脏组织学和抗氧化功能上明确了PAMK对雏鹅肝损伤有缓解作用,通过检测TLR4信号通路相关基因,发现PAMK主要通过TLR4/MyD88/IKKε-IκBα途径解除CTX对TLR4信号通路的负性调节,这也可能是PAMK提高肝脏免疫及抗氧化功能的作用机制之一。单独利用多糖对组织和细胞的免疫及抗氧化能力也有明显的正向调节作用,关于调节途径的报道很多,大部分研究发现TLR4介导的MyD88依赖途径起主要作用,Li等[13]证实富硒食用菇多糖可提高小鼠血清中MDA含量及SOD、CAT、GSH-Px活性,并发现这种免疫活性调节作用可能是通过丝裂原活化蛋白激酶(MAPKs)信号通路实现的,Ji等[19]和Yoon等[20]利用多糖在体外激活RAW264.7细胞,发现通过活化核因子-κB(NF-κB),可以促进一氧化氮(NO)、iNOS、肿瘤坏死因子-α(tumor necrosis factor,TNF-α)及γ-干扰素(interferon-γ,IFN-γ)的分泌。上述研究充分证明了多糖类免疫增强剂的作用效果。针对免疫抑制、炎症及肿瘤等模型动物,多糖[19, 21-23]发挥调控作用是通过TLR4介导的MyD88依赖途径和β干扰素TIR结构域衔接蛋白(TIR-domain-containing adaptor inducing interferon-β, TRIF)依赖途径的共同参与来实现的,可见TLR4信号转导通路在多糖免疫调节机制中发挥了关键作用,基于TLR4信号转导与各种交叉点的复杂性,不同种类多糖在TLR4信号通路中调控的具体途径都不相同,我们并没有找到完全符合本试验结论的相关报道,仅能从体内试验角度证实PAMK也能通过TLR4信号转导通路来正向调节CTX诱导造成的雏鹅肝损伤,提高肝脏中抗氧化酶的活性,鉴于鹅源基因报道的匮乏,不能对全部调控途径中的关键基因进行测定,因此,PAMK是否对TRIF依赖途径也具有调控作用,还有待在后续的研究中确认。
4 结论PAMK能减轻CTX诱导形成的雏鹅肝脏损伤程度,消除肝脏肿大、胆汁淤积及胆囊萎缩现象,维持肝脏组织结构完整,提高肝脏抗氧化功能,但对肝细胞DNA损伤的作用不明显,这种调节作用可能是通过TLR4/MyD88/IKKε-IκBα途径来实现。
| [1] |
鲍轶. 免疫细胞在非酒精性脂肪性肝病中的作用机制及研究进展[J]. 中华肝脏病杂志, 2017, 25(7): 553-556. DOI:10.3760/cma.j.issn.1007-3418.2017.07.018 |
| [2] |
XI Q Y, JIANG Y, ZHAO S, et al. Effect of ginseng polysaccharides on the immunity and growth of piglets by dietary supplementation during late pregnancy and lactating sows[J]. Animal Science Journal, 2017, 88(6): 863-872. DOI:10.1111/asj.2017.88.issue-6 |
| [3] |
ZHU N, LV X C, WANG Y Y, et al. Comparison of immunoregulatory effects of polysaccharides from three natural herbs and cellular uptake in dendritic cells[J]. International Journal of Biological Macromolecules, 2016, 93: 940-951. DOI:10.1016/j.ijbiomac.2016.09.064 |
| [4] |
SUN W J, MENG K, QI C H, et al. Immune-enhancing activity of polysaccharides isolated from Atractylodis macrocephalae Koidz[J]. Carbohydrate Polymers, 2015, 126: 91-96. DOI:10.1016/j.carbpol.2015.03.034 |
| [5] |
XU D N, LI W Y, HUANG Y M, et al. The effect of selenium and polysaccharide of Atractylodes macrocephala Koidz. (PAMK) on immune response in chicken spleen under heat stress[J]. Biological Trace Element Research, 2014, 160(2): 232-237. |
| [6] |
XU D N, TIAN Y B. Selenium and polysaccharides of Atractylodes macrocephala Koidz play different roles in improving the immune response induced by heat stress in chickens[J]. Biological Trace Element Research, 2015, 168(1): 235-241. |
| [7] |
XU D N, LI W Y, LI B X, et al. The effect of selenium and polysaccharide of Atractylodes macrocephala Koidz. (PAMK) on endoplasmic reticulum stress and apoptosis in chicken spleen induced by heat stress[J]. RSC Advances, 2017, 7(13): 7519-7525. DOI:10.1039/C6RA27730F |
| [8] |
XU D N, LI B X, CAO N, et al. The protective effects of polysaccharide of Atractylodes macrocephala Koidz (PAMK) on the chicken spleen under heat stress via antagonizing apoptosis and restoring the immune function[J]. Oncotarget, 2017, 8(41): 70394-70405. |
| [9] |
MOIGNET A, HASANALI Z, ZAMBELLO R, et al. Cyclophosphamide as a first-line therapy in LGL leukemia[J]. Leukemia, 2014, 28(5): 1134-1136. DOI:10.1038/leu.2013.359 |
| [10] |
HABIBI E, SHOKRZADEH M, CHABRA A, et al. Protective effects of Origanum vulgare ethanol extract against cyclophosphamide-induced liver toxicity in mice[J]. Pharmaceutical Biology, 2015, 53(1): 10-15. DOI:10.3109/13880209.2014.908399 |
| [11] |
MANSOUR D F, SALEH D O, MOSTAFA R E. Genistein ameliorates cyclophosphamide-induced hepatotoxicity by modulation of oxidative stress and inflammatory mediators[J]. Open Access Macedonian Journal of Medical Sciences, 2017, 5(7): 836-843. DOI:10.3889/oamjms.2017.093 |
| [12] |
ZHOU Y L, CHEN X Y, YI R K, et al. Immunomodulatory effect of tremella polysaccharides against cyclophosphamide-induced immunosuppression in mice[J]. Molecules, 2018, 23(2): E239. DOI:10.3390/molecules23020239 |
| [13] |
LI Q, CHEN G Y, CHEN H, et al. Se-enriched G. frondosa polysaccharide protects against immunosuppression in cyclophosphamide-induced mice via MAPKs signal transduction pathway[J]. Carbohydrate Polymers, 2018, 196: 445-456. DOI:10.1016/j.carbpol.2018.05.046 |
| [14] |
LIN S T, HAO G X, LONG M, et al. Oyster (Ostrea plicatula Gmelin) polysaccharides intervention ameliorates cyclophosphamide-induced genotoxicity and hepatotoxicity in mice via the Nrf2-ARE pathway[J]. Biomedicine & Pharmacotherapy, 2017, 95: 1067-1071. |
| [15] |
SZABO G, DOLGANIUC A, MANDREKAR P. Pattern recognition receptors:a contemporary view on liver diseases[J]. Hepatology, 2006, 44(2): 287-298. DOI:10.1002/(ISSN)1527-3350 |
| [16] |
GUSTOT T, LEMMERS A, MORENO C, et al. Differential liver sensitization to toll-like receptor pathways in mice with alcoholic fatty liver[J]. Hepatology, 2006, 43(5): 989-1000. DOI:10.1002/(ISSN)1527-3350 |
| [17] |
STÄRKEL P, DE SAEGER C, STRAIN A J, et al. NFκB, cytokines, TLR 3 and 7 expression in human end-stage HCV and alcoholic liver disease[J]. European Journal of Clinical Investigation, 2010, 40(7): 575-584. DOI:10.1111/eci.2010.40.issue-7 |
| [18] |
SCHWABE R F, SEKI E, BRENNER D A. Toll-like receptor signaling in the liver[J]. Gastroenterology, 2006, 130(6): 1886-1900. DOI:10.1053/j.gastro.2006.01.038 |
| [19] |
JI G Q, CHEN R Q, ZHENG J X. Macrophage activation by polysaccharides from Atractylodes macrocephala Koidz through the nuclear factor-κB pathway[J]. Pharmaceutical Biology, 2015, 53(4): 512-517. DOI:10.3109/13880209.2014.929152 |
| [20] |
YOON Y D, HAN S B, KANG J S, et al. Toll-like receptor 4-dependent activation of macrophages by polysaccharide isolated from the radix of Platycodon grandiflorum[J]. International Immunopharmacology, 2003, 3(13/14): 1873-1882. |
| [21] |
KIM S J, PARK H J, SHIN H J, et al. Suppression of TRIF-dependent signaling pathway of toll-like receptors by allyl isothiocyanate in RAW 264.7 macrophages[J]. International Immunopharmacology, 2012, 13(4): 403-407. DOI:10.1016/j.intimp.2012.05.017 |
| [22] |
ZHOU L J, LIU Z J, WANG Z X, et al. Astragalus polysaccharides exerts immunomodulatory effects via TLR4-mediated MyD88-dependent signaling pathway in vitro and in vivo[J]. Scientific Reports, 2017, 7: 44822. DOI:10.1038/srep44822 |
| [23] |
BORAZJANI N J, TABARSA M, YOU S G, et al. Purification, molecular properties, structural characterization, and immunomodulatory activities of water soluble polysaccharides from Sargassum angustifolium[J]. International Journal of Biological Macromolecules, 2018, 109: 793-802. DOI:10.1016/j.ijbiomac.2017.11.059 |




