2. 农业部淡水渔业和种质资源利用重点实验室, 中国水产科学研究院淡水渔业研究中心, 无锡 214081
2. Key Laboratory of Freshwater Fisheries and Germplasm Resources Utilization, Ministry of Agriculture, Freshwater Fisheries Research Center, Chinese Academy of Fishery Sciences, Wuxi 214081, China
在集约化水产养殖中,鱼类经常遭到各种不良环境因子的胁迫,如密度过高、水质恶化、病原侵袭、消毒剂和药物的滥用及不适当的管理方法等都会对其产生应激[1-2]。鱼体在应激状态下,组织或细胞内氧自由基生成增加,而清除能力降低,导致产生大量的活性氧(ROS),如超氧阴离子自由基(O2-·)、羟自由基(·OH)、过氧化氢(H2O2)和氮氧自由基(NO·)等,过多ROS攻击生物膜、蛋白质和核酸,造成细胞质外流、酶失活、遗传复制错误等氧化损伤[2]。这种机体内氧化增强而抗氧化减弱的不平衡状态称之为氧化应激[3-4]。氧化应激是很多应激损伤的本质所在,也是众多病害发生的病理生理基础[2-4],过强或长期的氧化应激会造成鱼体生长发育缓慢、免疫力下降、发病率升高等危害,并降低饲料效率和水产品品质,给水产养殖业造成严重的经济损失[5-7]。
近年来的研究发现,核因子E2相关因子2(Nrf2)是氧化应激的感受器,在参与细胞抗氧化应激和外源性有毒物质诱导的主要防御机制中发挥重要作用[8]。Nrf2通过与抗氧化反应元件(ARE)特异性结合,调节编码抗氧化蛋白,Nrf2/ARE信号通路是迄今为止发现的最为重要的内源性抗氧化应激通路[8-9]。在正常生理状态下,Nrf2在细胞质中与其接头蛋白——Kelch样环氧氯丙烷相关蛋白1(Keap1)相结合,通过泛素介导的蛋白降解系统维持较低的转录活性;当细胞受到氧化应激或激活剂的信号攻击后,Nrf2与Keap1解偶联,活化的Nrf2转运进入细胞核,与Maf蛋白结合形成异源二聚体后与ARE结合,进而激活多种抗氧化基因、Ⅱ相解毒酶基因和分子伴侣类基因的转录与表达,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GSH-Px)、谷胱甘肽还原酶(GR)和谷胱甘肽S-转移酶(GST)等参与ROS的清除[10-11],维持细胞内氧化还原的平衡状态,降低氧化应激损伤[12]。
姜黄素是从姜黄(Curcuma longa L.)根茎中提取出来的一种脂溶性酚类化合物,是姜黄的主要活性成分,其色泽稳定且几乎无毒[13]。研究表明,姜黄素具有广泛的药理作用,如抗炎、抗氧化、抗菌、抗肿瘤、调节血脂、促进消化和增强免疫等功能[14-16]。Ahsan等[17]研究发现姜黄素通过清除羟基自由基保护DNA,防止了基因发生突变。姜黄素是转录因子Nrf2抗氧化信号通路的一种重要的诱导剂,可激活Nrf2及其下游抗氧化相关基因的表达[18]。李强等[19]通过姜黄素促进人肝细胞Nrf2核转位,降低细胞内活性氧的水平,从而减轻肝细胞氧化应激损伤。姜黄素通过Keap1-Nrf2/ARE信号通路介导的抗氧化系统,对重金属引起的肝损伤起保护作用[20]。在水产动物的研究中发现,饲料中添加适量姜黄素可促进大黄鱼(Pseudosciaena crocea)[21]、鲫鱼(Carassius auratus)[22]和罗非鱼(Oreochromis niloticus)[23]的生长,增强其免疫力和抗氧化能力,提高鲫鱼肠道消化酶的活性,可抑制攀鲈(Anabas testudineus)肝脏脂质过氧化[24],减少四氯化碳(CCl4)引起的建鲤(Cyprinus carpio var. Jian)肝损伤[25]和缓解黄曲霉毒素B1诱导的罗非鱼肝毒性[26]。然而,目前姜黄素对草鱼(Ctenopharyngodon idella)抗氧化应激方面的研究还鲜见报道。
草鱼是我国主要的淡水养殖鱼类,营养丰富,经济价值高。据《2017中国渔业统计年鉴》[27]报道,我国草鱼养殖年产量为589.88万t,居“四大家鱼”养殖产量之首,约占全国淡水养殖总产量的18.55%,年产值在800亿元以上。然而,草鱼是低等脊椎动物,容易受水体不良环境因子的胁迫而诱发氧化应激损伤,导致病害的暴发性流行,从鱼苗养到成鱼成活率不到30%。因此,本试验通过在草鱼饲料中添加不同剂量的姜黄素,研究其对草鱼幼鱼生长性能的影响,并在养殖试验结束后腹腔注射敌草快(Diquat)诱导建立急性氧化应激模型,旨在探讨姜黄素对草鱼抗氧化应激及Nrf2/ARE信号通路相关基因表达的影响,为姜黄素在水产饲料中的应用提供科学依据。
1 材料与方法 1.1 试验材料与饲料姜黄素购自Sigma-Aldrich公司(美国),纯度≥98%。
以进口鱼粉、豆粕、菜籽粕和棉籽粕为蛋白质源,面粉为糖源,豆油为脂肪源,配制与实际生产相近的基础饲料,基础饲料组成及营养水平见表 1。在基础饲料中分别添加0(对照)、200、400、600和800 mg/kg姜黄素配制成5种试验饲料,用高效液相色谱法测得5种试验饲料中姜黄素含量分别为0、198.11、395.67、594.23和792.34 mg/kg。各种干原料分别粉碎过60目筛,采用逐级扩大法添加微量成分,使各组分充分混匀后,加入豆油再次混匀,再添加适量水搅拌均匀,最后用小型饲料造粒机制成粒径2 mm的颗粒饲料,置于40 ℃烘箱烘干至水分含量为10%左右,用自封袋封装后于-20 ℃保存备用。
|
|
表 1 基础饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验用草鱼幼鱼购自浙江省湖州市吴兴丰溢现代水产养殖场,为人工孵化培育的同一批幼鱼。试验鱼在本校“浙江省水生生物资源养护与开发技术研究重点实验室”的室内暂养池驯化1周后,选择525尾体质健壮、规格基本一致的草鱼幼鱼,初体质量为(5.11±0.08) g,随机分成5组,每组设3个重复,分别饲养于室内循环水养殖系统的15个桶中,每桶放养35尾鱼。
每天饱食投喂2次(08:00、16:30),每次投饲1 h后收集残饵并烘干称重。控制每桶水流速为1.5 L/min,并用气石持续充气增氧,养殖试验持续60 d。饲养期间水温为26~29 ℃,pH为7.2~7.8,溶解氧含量>6 mg/L,氨氮含量 < 0.01 mg/L。
1.3 急性氧化应激试验饲养试验结束后,禁食24 h,从各养殖桶中选择体质量基本一致的草鱼15尾,然后腹腔注射敌草快(Sigma-Aldrich公司, 美国)进行急性氧化应激试验。敌草快用生理盐水溶解稀释后,每尾鱼腹腔注射敌草快10 mg/kg BW,然后放养于另一组同样的循环水养殖桶中,保证充足的溶氧,分别于注射前(0 h)和注射后24 h采集草鱼血液、肝脏样品留待分析用,并观察草鱼的死亡情况。敌草快的注射剂量及试验鱼的采样时间参考相关文献[4, 29-30]并根据前期的预试验确定,预试验结果表明,草鱼幼鱼(体质量约24 g)腹腔注射敌草快24 h,其半数致死量(LD50)=25.71 mg/kg BW。本试验在注射敌草快24 h后可诱导草鱼幼鱼在活体水平上的急性氧化应激,但未引起草鱼死亡。
1.4 样品采样与处理养殖试验结束后,禁食24 h,将各桶鱼称重计数。在草鱼腹腔注射敌草快前和注射24 h后,每桶随机选取3尾体质量相近的草鱼,用浓度为100 mg/L的MS-222作快速深度麻醉,用一次性医用注射器从尾静脉采血。血样在4 ℃冰箱中静置1~2 h后,以4 ℃、3 000 r/min离心10 min制备血清,-80 ℃冻存备用。鱼体采血后立即剖开腹腔,剥离出内脏和肝胰脏并称重,取适量肝脏用于检测分析,并以-80 ℃保存。
1.5 测定指标与方法 1.5.1 生长与形体指标的测定

|
式中:W0为初始体质量(g);Wt为终末体质量(g);t为试验天数(d);Wf为摄入饲料干重(g);N0为初始鱼尾数(尾);Nt为终末鱼尾数(尾);Wh为鱼肝脏质量(g);Wv为鱼内脏质量(g);Wb为鱼体质量(g);L为鱼体长(cm)。
1.5.2 血清生化指标的测定血清皮质醇(COR)含量参考Brock等[31]的方法采用放射免疫法(RIA)测定;血清葡萄糖(GLU)含量、谷丙转氨酶(ALT)和谷草转氨酶(AST)活性在美国贝克曼全自动生化分析仪(DxC 600型)上测定,试剂盒购于美国贝克曼库尔特公司。
1.5.3 肝脏抗氧化相关指标的测定肝脏样品解冻后,用冷生理盐水冲洗干净并用滤纸吸干后称重,肝脏样品与匀浆介质(pH 7.4,0.01 mol/L Tris-HCl,0.000 1 mol/L乙二胺四乙酸二钠盐,0.01 mol/L蔗糖,0.8%氯化钠溶液)按1 : 9(质量体积比)的比例冰浴匀浆,然后4 ℃、3 800 r/min离心10 min,取上清液用于分析。该待测液的蛋白质含量采用考马斯亮蓝法进行测定。SOD、CAT、GSH-Px和GR活性,总抗氧化能力(T-AOC),还原型谷胱甘肽(GSH)、ROS和丙二醛(MDA)含量按照南京建成生物工程研究所试剂盒说明书进行测定。
1.5.4 肝脏Nrf2/ARE信号通路相关基因mRNA的表达分析草鱼肝脏总RNA使用组织/细胞RNA快速提取试剂盒(Aidlab,中国)抽提,具体操作按试剂盒说明书进行,然后用1%琼脂糖凝胶电泳检测所提RNA的完整性,同时用NanoDrop ND-2000(Thermo Scientific,美国)核酸蛋白测定仪检测RNA的纯度和浓度,RNA样品应具有清晰完整的条带、OD260 nm/OD280 nm为1.8~2.0。用PrimeScriptTM反转录试剂盒(TaKaRa,日本)将总RNA反转录合成cDNA,并于-20 ℃保存备用。用于Nrf2、Keap1、铜与锌超氧化物歧化酶(Cu-ZnSOD)、锰超氧化物歧化酶(MnSOD)、CAT、GSH-Px、GR和诱导型热休克蛋白70(HSP70)mRNA的表达分析。
根据GenBank上草鱼抗氧化相关基因Nrf2、Keap1、Cu-ZnSOD、MnSOD、CAT、GSH-Px、GR和HSP70的核苷酸序列,利用Primer 5.0设计上述基因及管家基因β-肌动蛋白(β-actin)的特异性引物,引物序列见表 2。所有引物均由上海英潍捷基(Invitrogen)公司合成。
|
|
表 2 实时定量PCR引物 Table 2 Primers used for quantitative real-time PCR |
采用SYBR Green Ⅰ实时荧光定量PCR技术,反应体系为20 μL,包括2×SYBR预混液10 μL,10 μmol/L的上、下游引物各0.8 μL,cDNA模板1 μL和ddH2O 7.4 μL。根据SYBR Premix Ex Taq (TaKaRa,日本)试剂盒说明书,利用CFX96实时定量PCR检测系统(Bio-Rad,美国)进行PCR扩增反应。扩增条件为:95 ℃预变性30 s;95 ℃变性5 s,在各基因最佳退火温度下退火20 s(表 2),共40个循环;PCR反应后绘制熔解曲线以判断扩增产物的正确性,温度以0.5 ℃/5 s的速度从60 ℃上升到95 ℃。以β-肌动蛋白为内参,对得到的各样品CT值进行均一化处理,在各靶基因与β-肌动蛋白的扩增效率基本一致条件下,以对照组氧化应激前基因mRNA的表达水平为基准,通过2-ΔΔCT法[32]对相关基因mRNA的表达水平进行比较分析。
1.6 数据统计与分析试验数据采用SPSS 18.0统计软件包中的单因素方差分析(one-way ANOVA)进行统计,Tukey’s多重比较以及独立样本t检验进行分析,P < 0.05表示差异显著。
2 结果 2.1 姜黄素对草鱼生长性能的影响由表 3可知,随着饲料中姜黄素添加量的增加,增重率、特定生长率和存活率均先升高后下降,而饲料系数和肝体指数则先下降后升高;400和600 mg/kg组间增重率和特定生长率差异不显著(P>0.05),但显著高于其他各组(P < 0.05),400、600、800 mg/kg组间饲料系数差异不显著(P>0.05),但显著高于其他各组(P < 0.05);各组间脏体指数和肥满度差异均不显著(P>0.05)。当饲料中姜黄素添加量为400、600 mg/kg时,草鱼的生长性能较好。
|
|
表 3 姜黄素对草鱼生长及形体指标的影响 Table 3 Effects of curcumin on growth and body indices of grass carp |
由图 1可知,草鱼腹腔注射敌草快前(0 h),各组间血清皮质醇和葡萄糖含量均无显著差异(P>0.05)。草鱼腹腔注射敌草快24 h后,随着饲料中姜黄素添加量的增加,血清皮质醇含量先下降后升高,当饲料姜黄素添加量为400、600 mg/kg时,血清皮质醇含量达到较低水平,显著低于对照组(P < 0.05),但姜黄素添加量为400、600 mg/kg时, 组间差异不显著(P>0.05)(图 1-A);而当饲料姜黄素添加量为200、400、600、800 mg/kg时,血清葡萄糖含量均显著低于对照组(P < 0.05),但姜黄素添加量为200、400、600、800 mg/kg时, 组间差异不显著(P>0.05)(图 1-B)。在同一剂量组,草鱼应激后血清皮质醇和葡萄糖含量均显著高于应激前(P < 0.05)。
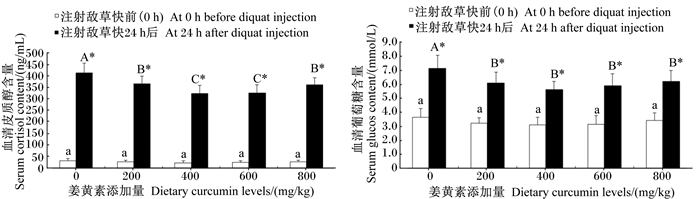
|
不同小、大写字母分别表示不同剂量组间在注射敌草快前(0 h)、注射24 h后Tukey’s多重比较的结果,相同字母表示差异不显著(P>0.05),不同字母表示差异显著(P < 0.05);*表示相同剂量组在注射敌草快前(0 h)、注射24 h后t-检验的结果,*表示差异显著(P < 0.05)。下图同。 Among different dose groups, different small and capital letters indicate the results of Tukey's test before (0 h) and after (24 h) diquat injection, the same letters mean no significant difference (P>0.05), while different letters mean significant difference (P < 0.05). In the same dose group, * indicate the results of t-test between before (0 h) and after (24 h) diquat injection, * mean significant difference (P < 0.05). The same as below. 图 1 姜黄素对草鱼注射敌草快后血清皮质醇和葡萄糖含量的影响 Fig. 1 Effects of curcumin on serum cortisol and glucose contents of grass carp injected with diquat |
由图 2可知,草鱼腹腔注射敌草快前,各组间血清ALT和AST活性差异均不显著(P>0.05)。在草鱼腹腔注射敌草快24 h后,随着饲料中姜黄素添加量的增加,血清ALT和AST活性均呈先下降后升高的变化趋势,其中姜黄素添加量为400、600、800 mg/kg时, 血清ALT和AST的活性显著低于对照组(P < 0.05),且在同一剂量组中,应激后血清ALT和AST的活性均显著高于应激前(P < 0.05)。
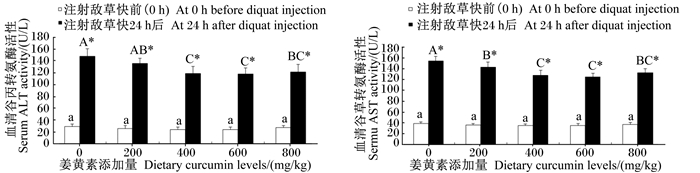
|
图 2 姜黄素对草鱼注射敌草快后血清ALT和AST活性的影响 Fig. 2 Effects of curcumin on serum ALT and AST activities of grass carp injected with diquat |
由图 3-A~图 3-C、图 3-E~图 3-F可知,草鱼腹腔注射敌草快前、注射24 h后,随着饲料中姜黄素添加量的增加,肝脏SOD、CAT、GSH-Px活性,T-AOC和GSH含量呈先升高后下降的变化趋势,且在饲料中姜黄素添加量为400、600 mg/kg时达到较高水平,显著高于对照组(P < 0.05);肝脏GR活性(图 3-D)在注射敌草快前各组之间的差异不显著(P>0.05),在注射敌草快24 h后,400、600、800 mg/kg组则显著高于对照组(P < 0.05);在同一剂量组中,在应激后上述指标的活性或含量均显著低于应激前(P < 0.05)。
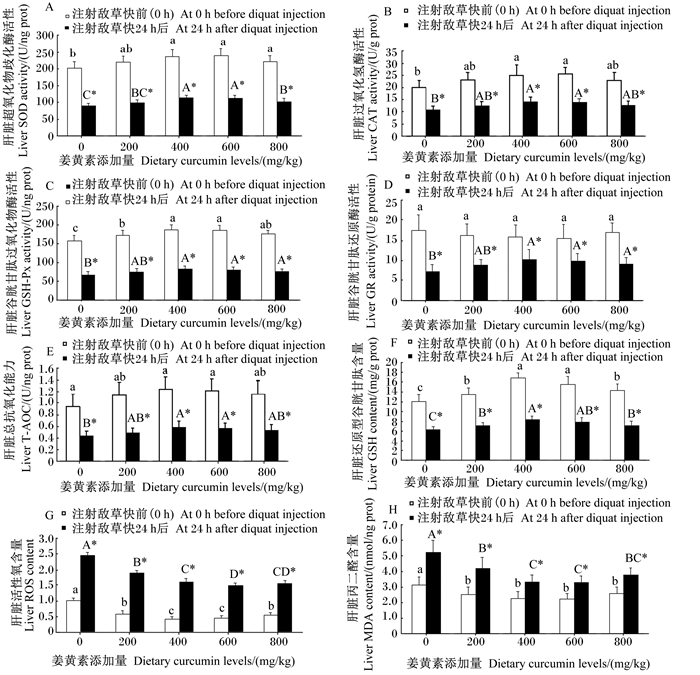
|
图 3 姜黄素对草鱼注射敌草快后肝脏抗氧化相关指标影响 Fig. 3 Effects of curcumin on liver antioxidant indexes of grass carp injected with diquat |
由图 3-G~图 3-H可知,草鱼腹腔注射敌草快前、注射24 h后,随着饲料中姜黄素添加量的增加,肝脏ROS、MDA含量均呈先下降后升高的变化趋势,当饲料姜黄素添加量为400、600 mg/kg时,肝脏ROS和MDA含量均达到较低的水平,显著低于对照组(P < 0.05),且在同一剂量组中应激后ROS和MDA含量均显著高于应激前(P < 0.05)。
2.5 姜黄素对草鱼腹腔注射敌草快后Nrf2/ARE信号通路相关基因表达的影响由图 4-A、图 4-H可知,草鱼腹腔注射敌草快前、注射24 h后,Nrf2和HSP70 mRNA的表达水平均呈先升高后下降的变化趋势,当饲料中姜黄素添加量为400、600 mg/kg时达到较高水平,显著高于对照组(P < 0.05),且在同一剂量组,二者应激后的水平均显著高于应激前的水平(P < 0.05);而Keap1 mRNA的表达水平呈先下降后升高的变化趋势(图 4-B),当饲料中姜黄素添加量为400、600 mg/kg时达到较低水平,显著低于对照组(P < 0.05)。在同一剂量组中,除对照组应激后Keap1 mRNA的表达水平显著高于应激前外(P < 0.05),其他各组间应激前后的差异均不显著(P>0.05)。
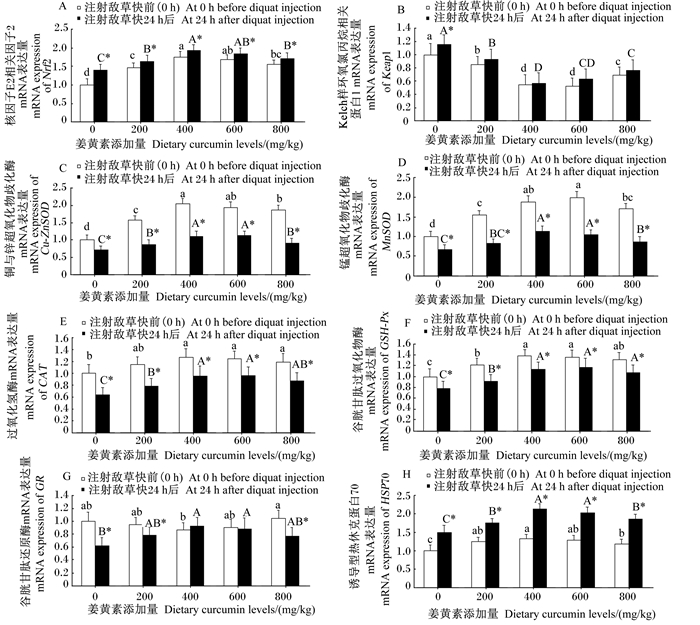
|
图 4 姜黄素对草鱼腹腔注射敌草快后肝脏Nrf2/ARE信号通路相关基因表达的影响 Fig. 4 Effects of curcumin on Nrf2/ARE signal pathway related genes expression of grass carp injected with diquat |
由图 4-C~图 4-F可知,草鱼腹腔注射敌草快前、注射24 h后,随着姜黄素添加量的增加,肝脏Cu-Zn SOD、MnSOD、CAT和GSH-Px mRNA的表达水平均呈先升高后下降的变化趋势,当饲料中姜黄素添加量为400、600 mg/kg时均达到较高水平,显著高于对照组(P < 0.05),且在同一剂量组,应激后Nrf2下游抗氧化酶基因mRNA的表达水平均显著低于应激前(P < 0.05)。如图 4-G所示,GR mRNA的表达水平在应激前呈先下降后升高的变化趋势,当饲料中姜黄素添加量为400 mg/kg时达到最低水平,显著低于对照组(P < 0.05);而在应激后GR mRNA的表达水平随着姜黄素添加量的增加呈先升高后下降的变化趋势,当饲料中姜黄素添加量为400、600 mg/kg时达到较高水平,显著高于对照组(P < 0.05);在同一剂量组,当饲料中姜黄素添加量为400、600 mg/kg时,应激前GR mRNA的表达水平与应激后无显著差异(P>0.05)。
3 讨论 3.1 姜黄素对草鱼生长性能的影响本研究在草鱼幼鱼饲料中添加400、600 mg/kg姜黄素可提高其增重率、特定生长率和存活率,降低饲料系数。这与在大黄鱼[21]、鲫鱼[22]和罗非鱼[23]饲料中添加适量姜黄素可促进其生长、提高饲料效率的报道是基本一致的,但王雅慧等[33]研究表明,饲料中添加姜黄素对大菱鲆(Scophthalmus maximus)幼鱼的特定生长率和存活率没有显著影响。不同研究者得出不同的结论,可能与试验鱼类的品种、规格、饲料组成、投饲频率、养殖环境等因素有关。姜黄素的促生长作用可能与其提高鱼体肝胰腺和肠道消化酶的活性[22]以及机体的免疫力等[21, 23]有关。本研究发现,随着饲料中姜黄素添加量的增加,草鱼幼鱼的增重率和特定生长率均先升高后下降,当姜黄素的添加量为400、600 mg/kg时达到较高水平。在罗非鱼中也有类似的情况,当饲料中姜黄素添加量为50 mg/kg时促生长效果较好[23]。由此可见,饲料中添加适量的姜黄素可以促进草鱼幼鱼的生长,过高剂量姜黄素反而有负面效应,这可能与高剂量的姜黄素具有促氧化作用有关[34]。
3.2 姜黄素对草鱼抗氧化应激及Nrf2/ARE信号通路相关基因表达的影响在氧化应激研究中,构建氧化应激模型对于揭示动物氧化应激机理以及研究抗应激物质的作用机制等具有重要意义。目前,有关动物氧化应激模型的研究主要集中在畜禽等动物方面,如断奶仔猪腹腔注射敌草快或饲喂氧化鱼油饲料可诱导建立活体氧化应激模型[29, 35]。敌草快是双吡啶除草剂,可以利用分子氧产生单线氧(1O2)和H2O2,诱导动物产生氧化应激,其主要靶器官是肝脏。与畜禽动物相比,水生动物氧化应激模型的研究还很不成熟,目前尚未建立起可利用的鱼类氧化应激模型,仅见一些有关鱼类氧化应激毒理方面的报道。目前作为水生动物氧化应激源的物质主要有过渡金属离子(如铁、铜、铬、汞和砷)、农药类(如杀虫剂、除草剂和杀真菌剂)等[2]。其中,除草剂作为鱼类氧化应激源的研究相对较多,如草甘膦除草剂剌激诱导蓝点石斑(Channa punctatus)的氧化应激[36];百草枯可诱导翠鳢(Channa punctata)[37]和虹鳟(Oncorhynchus mykiss)[38]的氧化应激;敌草快同样也可以剌激鲤细胞株[39]和虹鳟[4]的氧化应激。近年来,随着草甘膦和百草枯的禁限用范围的扩大,敌草快的使用量快速上升,因此在本研究中选用敌草快作为氧化应激源。
皮质醇是鱼体在受到外界刺激后,通过下丘脑-垂体-肾间组织(HPI)轴所分泌的一种重要的应激激素,血液皮质醇含量的升高被视为鱼类应激的灵敏信号[40]。在本研究中,草鱼腹腔注射敌草快24 h后,各组草鱼血清皮质醇和葡萄糖的含量均显著高于应激前,表明敌草快可诱导草鱼的急性氧化应激,草鱼血清葡萄糖含量升高可能在于皮质醇能激活糖异生中的关键酶如葡萄糖-6-磷酸酶,从而促进糖异生和糖原分解[40-41],以满足鱼体在应激状态下对能量需求的增加。本研究中,在草鱼腹腔注射敌草快24 h后,各姜黄素添加组草鱼血清皮质醇和葡萄糖的含量均显著低于对照组,当饲料姜黄素添加量为400、600 mg/kg时效果较佳。目前还没有姜黄素对敌草快诱导鱼类急性氧化应激影响的报道,仅见一些相关的文献:如在断奶仔猪饲粮中添加姜黄素(8 mg/kg),饲喂21 d后进行运输应激,结果表明,姜黄素可以缓解运输应激引起猪血清皮质醇含量的升高[42];四氧嘧啶诱导的糖尿病小鼠饲喂姜黄素(饲粮中添加量为50或100 mg/kg)可降低其空腹的血清葡萄糖含量[43]。
ALT和AST为肝脏内2种转氨酶,当肝细胞受到损伤或膜的通透性增大时,细胞内ALT和AST的溢出量显著增高,释放到血液中导致血清转氨酶的活性升高[44]。ALT和AST是肝细胞是否损伤的经典性指标,其活性变化亦反映鱼体的健康状况[44-45]。本研究中,在草鱼腹腔注射敌草快24 h后,其血清ALT和AST的活性均显著高于应激前,表明肝细胞受到氧化应激损伤,而饲料中姜黄素添加量为400、600 mg/kg时显著降低了血清ALT和AST的活性,这表明姜黄素在保护草鱼氧化应激损伤肝细胞和恢复细胞膜功能方面起着重要作用。李强等[19]研究发现,姜黄素可降低葡萄糖氧化酶干预人肝细胞后ALT和AST活性。Cao等[25]也有类似的研究报道,姜黄素可抑制CCl4诱导建鲤肝损伤而引起血清ALT和AST活性的升高。
动物机体在新陈代谢过程中,ROS自由基(O2-·、·OH、H2O2和NO·等)的产生和消除保持着动态平衡。过多的自由基会引起脂质过氧化反应,MDA是脂质过氧化物的主要成分,具有很强的生物毒性,会破坏细胞的结构和功能[46-47]。鱼类与陆生动物一样,在进化中形成了酶和非酶的抗氧化防御系统,如SOD、CAT、GSH-Px和GR等是重要的抗氧化酶,GSH则是一种重要的非酶抗氧化剂,以保护机体免受氧化损伤[48]。在本研究中,草鱼腹腔注射敌草快24 h后,各组草鱼肝脏SOD、CAT、GSH-Px、GR活性,T-AOC和GSH含量均显著低于应激前,而肝脏ROS和MDA含量则显著高于应激前,表明敌草快诱导了草鱼的急性氧化应激损伤。
在草鱼腹腔注射敌草快前、注射24 h后,饲料中添加400、600 mg/kg的姜黄素均可显著提高草鱼肝脏SOD、CAT、GSH-Px活性,T-AOC和GSH含量,降低肝脏ROS和MDA含量,从而增强草鱼的抗氧化应激能力。以前也有类似的研究报道,在饲料中添加适量的姜黄素可提高大黄鱼[21]和罗非鱼[23]的血清、鲫鱼[22]的肠道、攀鲈[24]的肝脏等抗氧化酶活性或GSH含量,降低MDA等含量;Cao等[25]研究发现,CCl4可诱导建鲤肝组织的显著损伤,而其饲料中添加1%的姜黄素可抑制建鲤肝脏SOD活性、GSH含量和T-AOC的降低及MDA含量的升高。Akdemir等[49]报道,饲料中添加200或400 mg/kg的姜黄素可抑制高密度(100 kg/m3)拥挤胁迫而导致虹鳟血清和肝脏MDA含量的升高。GSH是生物体内含量最丰富的三肽非酶类抗氧化物,可直接消除ROS,同时作为谷胱甘肽过氧化物酶的底物,在清除细胞内H2O2及脂质过氧化物中发挥重要作用,在此过程中GSH本身被氧化生成氧化型谷胱甘肽(GSSG),而GSSG可在GR的催化下还原为GSH[47, 50]。本研究中,草鱼肝脏GR的活性在应激前各组间无显著差异;在草鱼腹腔注射敌草快24 h后,当饲料中姜黄素添加量为400、600、800 mg/kg时,GR的活性达到较高水平,这可能在于姜黄素增强了草鱼在应激状态下GR还原GSSG为GSH的能力,从而增强机体的抗氧化应激能力,Madkour等[51]在大鼠中也有类似的报道。姜黄素的抗氧化作用可能与其化学结构中存在酚羟基和甲氧基有关,这2种基团相互作用能够清除ROS,从而抑制脂质过氧化反应,提高机体的抗氧化能力[52]。本研究中,在草鱼腹腔注射敌草快前、注射24 h后,随着饲料中姜黄素添加量的增加,草鱼肝脏SOD、CAT、GSH-Px活性,T-AOC和GSH含量呈先升高后下降的变化趋势,而肝脏ROS、MDA含量均呈先下降后升高的变化趋势,当饲料中姜黄素的添加量为800 mg/kg时,草鱼抗氧化能力反而有所下降。Hatcher等[53]研究报道,姜黄素是一种自由基清除剂和氢供体,显示出亲氧化剂和抗氧化剂的双重活性。因此,姜黄素在氧化应激状态下可能不是一种彻底的抗氧化剂,而具有一定的促氧化活性[34, 54],姜黄素从抗氧化到促氧化之间的相互转换是受其质量浓度调控的[55]。高添加量的姜黄素对罗非鱼[23]、大菱鲆[33]和人的血细胞[34, 55]等也有类似的促氧化作用,而其他一些抗氧化剂如GSH[47]、维生素C[56]等也表现出类似的现象。
Nrf2/ARE信号通路的重要作用在于其激活后能够启动下游多种保护性基因的表达,这些基因包括抗氧化蛋白酶类基因、Ⅱ相解毒酶基因和分子伴侣类基因等,其中Nrf2是关键的转录因子[11-12]。研究表明,Nrf2能调控抗氧化酶类基因的表达[57],如Nrf2的上调表达可以增强建鲤肌肉中SOD1、GSH-Px和GR mRNA的表达[58]。在本研究中,草鱼腹腔注射敌草快24 h后,各组肝脏Nrf2和HSP70 mRNA的表达水平均显著高于应激前的水平,而抗氧化酶类基因(Cu-ZnSOD、MnSOD、CAT和GSH-Px)mRNA的表达水平均显著低于应激前的水平,这表明敌草快诱导草鱼急性氧化应激可激活Nrf2/ARE信号通路,增强Nrf2和诱导型HSP70基因的表达水平,但对抗氧化酶类基因的表达有一定的抑制作用,这与Akdemir等[49]的报道类似,高密度拥挤胁迫抑制虹鳟肝脏血红素加氧酶1(HO-1)mRNA的表达水平。本试验中,草鱼腹腔注射敌草快前、注射24 h后,饲料中添加400、600 mg/kg的姜黄素均不同程度提高了Nrf2、HSP70和抗氧化酶类基因的表达水平,且抗氧化酶类基因与其相应抗氧化酶活性的变化趋势基本一致,表明饲料中添加适量的姜黄素可增强草鱼的抗氧化应激能力,而抗氧化酶类基因的上调表达,可能与姜黄素激活Nrf2/ARE信号通路促进草鱼肝脏Nrf2的上调表达相关[18, 22-23, 49]。
Keap1是Nrf2的抑制因子,它们在胞质中相互结合,可阻止Nrf2转位进入细胞核,并通过蛋白酶体促进Nrf2降解[10-11, 57-58]。研究表明,HaCaT细胞中Keap1基因的下调表达可抑制Nrf2的内源性降解,从而上调其下游抗氧化基因的表达[59]。本研究中,草鱼腹腔注射敌草快前、注射24 h后,饲料中添加400、600 mg/kg的姜黄素均显著降低了Keap1 mRNA的表达水平,从而降低了机体的氧化应激损伤,这与李强等[19]在人肝细胞的相关报道是一致的。研究发现Nrf2基因敲除小鼠的基础及诱导性抗氧化基因的表达明显降低,而氧化应激损伤明显增加,提示Nrf2/ARE是调节细胞内氧化还原状态的关键通路[60]。Nrf2是内源性抗氧化反应的开关[61],其在细胞氧化应激中起关键的保护作用,Nrf2缺乏或激活障碍,会引起细胞的功能障碍, 甚至凋亡,而Nrf2的激活能够降低氧化产物的表达,但Nrf2/ARE介导姜黄素对草鱼抗氧化应激的作用机制还需要进一步的研究。
4 结论在饲料中添加姜黄素400、600 mg/kg可促进草鱼幼鱼的生长,降低饲料系数,提高其抗氧化应激能力,对敌草快诱导的急性氧化应激损伤具有保护作用。饲料中添加适量的姜黄素能激活草鱼Nrf2/ARE信号通路,增强Nrf2及其下游抗氧化蛋白酶类和分子伴侣类基因的表达。
| [1] |
BARTON B A. Stress in fishes:a diversity of responses with particular reference to changes in circulating corticosteroids[J]. Integrative and Comparative Biology, 2002, 42(3): 517-525. DOI:10.1093/icb/42.3.517 |
| [2] |
LUSHCHAK V I. Environmentally induced oxidative stress in aquatic animals[J]. Aquatic Toxicology, 2011, 101(1): 13-30. |
| [3] |
SHI X J, ZHOU B S. The role of Nrf2 and MAPK pathways in PFOS-induced oxidative stress in zebrafish embryos[J]. Toxicological Sciences, 2010, 115(2): 391-400. DOI:10.1093/toxsci/kfq066 |
| [4] |
HOOK S E, SKILLMAN A D, SMALL J A, et al. Gene expression patterns in rainbow trout, Oncorhynchus mykiss, exposed to a suite of model toxicants[J]. Aquatic Toxicology, 2006, 77(4): 372-385. DOI:10.1016/j.aquatox.2006.01.007 |
| [5] |
MCCORMICK S D, SHRIMPTON J M, CAREY J B, et al. Repeated acute stress reduces growth rate of Atlantic salmon parr and alters plasma levels of growth hormone, insulin-like growth factor I and cortisol[J]. Aquaculture, 1998, 168(1/2/3/4): 221-235. |
| [6] |
NDONG D, CHEN Y Y, LIN Y H, et al. The immune response of tilapia Oreochromis mossambicus and its susceptibility to Streptococcus iniae under stress in low and high temperatures[J]. Fish & Shellfish Immunology, 2007, 22(6): 686-694. |
| [7] |
FAST M D, HOSOYA S, JOHNSON S C, et al. Cortisol response and immune-related effects of Atlantic salmon (Salmo salar Linnaeus) subjected to short-and long-term stress[J]. Fish & Shellfish Immunology, 2008, 24(2): 194-204. |
| [8] |
LI W G, KONG A N. Molecular mechanisms of Nrf2-mediated antioxidant response[J]. Molecular Carcinogenesis, 2009, 48(2): 91-104. DOI:10.1002/mc.v48:2 |
| [9] |
LEE J M, JOHNSON J A. An important role of Nrf2-ARE pathway in the cellular defense mechanism[J]. Journal of Biochemistry and Molecular Biology, 2004, 37(2): 139-143. |
| [10] |
NITURE S K, KASPAR J W, SHEN J, et al. Nrf2 signaling and cell survival[J]. Toxicology and Applied Pharmacology, 2010, 244(1): 37-42. DOI:10.1016/j.taap.2009.06.009 |
| [11] |
MAGESH S, CHEN Y, HU L Q. Small molecule modulators of Keap1-Nrf2-ARE pathway as potential preventive and therapeutic agents[J]. Medicinal Research Reviews, 2012, 32(4): 687-726. DOI:10.1002/med.2012.32.issue-4 |
| [12] |
KANG K W, LEE S J, KIM S G. Molecular mechanism of Nrf2 activation by oxidative stress[J]. Antioxidants & Redox Signaling, 2005, 7(11/12): 1664-1673. |
| [13] |
SHISHODIA S, SETHI G, AGGARWAL B B. Curcumin:getting back to the roots[J]. Annals of the New York Academy of Sciences, 2005, 1056(1): 206-217. DOI:10.1196/annals.1352.010 |
| [14] |
LI M, ZHANG Z, Hill D L, et al. Curcumin, a dietary component, has anticancer, chemosensitization, and radiosensitization effects by down-regulating the MDM2 oncogene through the PI3K/mTOR/ETS2 pathway[J]. Cancer Research, 2007, 67(5): 1988-1996. DOI:10.1158/0008-5472.CAN-06-3066 |
| [15] |
SRIVASTAVA R M, SINGH S, DUBEY S K, et al. Immunomodulatory and therapeutic activity of curcumin[J]. International Immunopharmacology, 2011, 11(3): 331-341. DOI:10.1016/j.intimp.2010.08.014 |
| [16] |
AK T, GÜLÇIN I. Antioxidant and radical scavenging properties of curcumin[J]. Chemico-Biological Interactions, 2008, 174(1): 27-37. DOI:10.1016/j.cbi.2008.05.003 |
| [17] |
AHSAN H, PARVEEN N, KHAN N U, et al. Pro-oxidant, anti-oxidant and cleavage activities on DNA of curcumin and its derivatives demethoxycurcumin and bisdemethoxycurcumin[J]. Chemico-Biological Interactions, 1999, 121(2): 161-175. DOI:10.1016/S0009-2797(99)00096-4 |
| [18] |
BALOGUN E, HOQUE M, GONG P F, et al. Curcumin activates the haem oxygenase-1 gene via regulation of Nrf2 and the antioxidant-responsive element[J]. Biochemical Journal, 2003, 371(3): 887-895. DOI:10.1042/bj20021619 |
| [19] |
李强, 赵曙光, 王旭霞, 等. 姜黄素激活转录因子Nrf2对人肝细胞氧化应激的影响[J]. 胃肠病学和肝病学杂志, 2010, 19(2): 154-156. DOI:10.3969/j.issn.1006-5709.2010.02.016 |
| [20] |
GARCÍA-NIÑO W R, PEDRAZA-CHAVERRÍ J. Protective effect of curcumin against heavy metals-induced liver damage[J]. Food and Chemical Toxicology, 2014, 69: 182-201. DOI:10.1016/j.fct.2014.04.016 |
| [21] |
俞军, 陈庆堂, 李宋钰, 等. 姜黄素对大黄鱼生长及非特异性免疫功能的影响[J]. 南方农业学报, 2015, 46(7): 1315-1321. DOI:10.3969/j:issn.2095-1191.2015.7.1315 |
| [22] |
JIANG J, WU X Y, ZHOU X Q, et al. Effects of dietary curcumin supplementation on growth performance, intestinal digestive enzyme activities and antioxidant capacity of crucian carp Carassius auratus[J]. Aquaculture, 2016, 463: 174-180. DOI:10.1016/j.aquaculture.2016.05.040 |
| [23] |
MAHMOUD H K, AL-SAGHEER A A, REDA F M, et al. Dietary curcumin supplement influence on growth, immunity, antioxidant status, and resistance to Aeromonas hydrophila in Oreochromis niloticus[J]. Aquaculture, 2017, 475: 16-23. DOI:10.1016/j.aquaculture.2017.03.043 |
| [24] |
MANJU M, AKBARSHA M A, OOMMEN O V. In vivo protective effect of dietary curcumin in fish Anabas testudineus(Bloch)[J]. Fish Physiology and Biochemistry, 2012, 38(2): 309-318. DOI:10.1007/s10695-011-9508-x |
| [25] |
CAO L P, DING W D, DU J L, et al. Effects of curcumin on antioxidative activities and cytokine production in Jian carp (Cyprinus carpio var.Jian) with CCl4-induced liver damage[J]. Fish & Shellfish Immunology, 2015, 43(1): 150-157. |
| [26] |
MAHFOUZ M E. Ameliorative effect of curcumin on aflatoxin B1-induced changes in liver gene expression of Oreochromis niloticus[J]. Molecular Biology, 2015, 49(2): 275-286. DOI:10.1134/S0026893315020089 |
| [27] |
农业部渔业渔政管理局. 2017中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2017: 25.
|
| [28] |
STEFFENS W. Principles of fish nutrition[M]. New York: Ellis Horwood Press, 1989: 256-258.
|
| [29] |
DENG Q L, XU J, YU B, et al. Effect of dietary tea polyphenols on growth performance and cell-mediated immune response of post-weaning piglets under oxidative stress[J]. Archives of Animal Nutrition, 2010, 64(1): 12-21. DOI:10.1080/17450390903169138 |
| [30] |
WANG X H, SOUDERS II C L, ZHAO Y H, et al. Mitochondrial bioenergetics and locomotor activity are altered in zebrafish (Danio rerio) after exposure to the bipyridylium herbicide diquat[J]. Toxicology Letters, 2018, 283: 13-20. DOI:10.1016/j.toxlet.2017.10.022 |
| [31] |
BROCK P, ELDRED E W, WOISZWILLO J E, et al. Direct solid-phase 125I radioimmunoassay of serum cortisol[J]. Clinical Chemistry, 1978, 24(9): l595-1598. |
| [32] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△CT method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [33] |
王雅慧, 王裕玉, 麦康森, 等. 饲料中添加姜黄素对大菱鲆幼鱼生长、体组成及抗氧化酶活力的影响[J]. 水产学报, 2016, 40(9): 1299-1308. |
| [34] |
BANERJEE A, KUNWAR A, MISHRA B, et al. Concentration dependent antioxidant/pro-oxidant activity of curcumin:studies from AAPH induced hemolysis of RBCs[J]. Chemico-Biological Interactions, 2008, 174(2): 134-139. DOI:10.1016/j.cbi.2008.05.009 |
| [35] |
YUAN S B, CHEN D W, ZHANG K Y, et al. Effects of oxidative stress on growth performance, nutrient digestibilities and activities of antioxidative enzymes of weanling pigs[J]. Asian-Australasian Journal of Animal Sciences, 2007, 20(10): 1600-1605. DOI:10.5713/ajas.2007.1600 |
| [36] |
NWANI C D, NAGPURE N S, KUMAR R, et al. DNA damage and oxidative stress modulatory effects of glyphosate-based herbicide in freshwater fish, Channa punctatus[J]. Environmental Toxicology and Pharmacology, 2013, 36(2): 539-547. DOI:10.1016/j.etap.2013.06.001 |
| [37] |
PARVEZ S, RAISUDDIN S. Effects of paraquat on the freshwater fish Channa punctata(Bloch):non-enzymatic antioxidants as biomarkers of exposure[J]. Archives of Environmental Contamination and Toxicology, 2006, 50(3): 392-397. DOI:10.1007/s00244-005-5083-4 |
| [38] |
STEPHENSEN E, STURVE J, FÖRLIN L. Effects of redox cycling compounds on glutathione content and activity of glutathione-related enzymes in rainbow trout liver[J]. Comparative Biochemistry and Physiology Part C:Toxicology & Pharmacology, 2002, 133(3): 435-442. |
| [39] |
WRIGHT J, GEORGE S, MARTINEZ-LARA E, et al. Levels of cellular glutathione and metallothionein affect the toxicity of oxidative stressors in an established carp cell line[J]. Marine Environmental Research, 2000, 50(1/2/3/4/5): 503-508. |
| [40] |
MOMMSEN T P, VIJAYAN M M, MOON T W. Cortisol in teleosts:dynamics, mechanisms of action, and metabolic regulation[J]. Reviews in Fish Biology and Fisheries, 1999, 9(3): 211-268. DOI:10.1023/A:1008924418720 |
| [41] |
ORTUÑO J, ESTEBAN M A, MESEGUER J. Effects of short-term crowding stress on the gilthead seabream (Sparus aurata L.) innate immune response[J]. Fish & Shellfish Immunology, 2001, 11(2): 187-197. |
| [42] |
WEI S, XU H, XIA D, et al. Curcumin attenuates the effects of transport stress on serum cortisol concentration, hippocampal NO production, and BDNF expression in the pig[J]. Domestic Animal Endocrinology, 2010, 39(4): 231-239. DOI:10.1016/j.domaniend.2010.06.004 |
| [43] |
GARKUWA U A, ALHASSAN A W, TANKO Y. Effect of curcumin on blood glucose level and some neurobehavioral responses in alloxan-induced diabetic swiss albino mice[J]. Journal of Advances in Medical and Pharmaceutical Sciences, 2017, 14(1): 1-7. |
| [44] |
WANG Y, XIONG L, YANG K J, et al. Effect of beta-cypermethrin on GPT and GOT activities of crucian serum[J]. Agricultural Science & Technology, 2005, 6(1): 20-23. |
| [45] |
LEE C Y, PENG W H, CHENG H Y, et al. Hepatoprotective effect of Phyllanthus in Taiwan on acute liver damage induced by carbon tetrachloride[J]. The American Journal of Chinese Medicine, 2006, 34(3): 471-482. DOI:10.1142/S0192415X06004004 |
| [46] |
FREEMAN B A, CRAPO J D. Biology of disease:free radicals and tissue injury[J]. Laboratory Investigation, 1982, 47(5): 412-426. |
| [47] |
MING J H, YE J Y, ZHANG Y X, et al. Effects of dietary reduced glutathione on growth performance, non-specific immunity, antioxidant capacity and expression levels of IGF-I and HSP70 mRNA of grass carp (Ctenopharyngodon idella)[J]. Aquaculture, 2015, 438: 39-46. DOI:10.1016/j.aquaculture.2014.12.038 |
| [48] |
MARTÍNEZ-ÁLVAREZ R M, MORALES A E, SANZ A. Antioxidant defenses in fish:biotic and abiotic factors[J]. Reviews in Fish Biology and Fisheries, 2005, 15(1/2): 75-88. |
| [49] |
AKDEMIR F, ORHAN C, TUZCU M, et al. The efficacy of dietary curcumin on growth performance, lipid peroxidation and hepatic transcription factors in rainbow trout Oncorhynchus Mykiss(Walbaum) reared under different stocking densities[J]. Aquaculture Research, 2017, 48(8): 4012-4021. DOI:10.1111/are.2017.48.issue-8 |
| [50] |
DEPONTE M. Glutathione catalysis and the reaction mechanisms of glutathione-dependent enzymes[J]. Biochimica Biophysica Acta, 2013, 1830(5): 3217-3266. DOI:10.1016/j.bbagen.2012.09.018 |
| [51] |
MADKOUR N K. Protective effect of curcumin on oxidative stress and DNA fragmentation against lambda cyhalothrin-induced liver damage in rats[J]. Journal of Applied Pharmaceutical Science, 2012, 2(12): 76-81. |
| [52] |
PRIYADARSINI K I, MAITY D K, NAIK G H, et al. Role of phenolic O-H and methylene hydrogen on the free radical reactions and antioxidant activity of curcumin[J]. Free Radical Biology and Medicine, 2003, 35(5): 475-484. DOI:10.1016/S0891-5849(03)00325-3 |
| [53] |
HATCHER H, PLANALP R, CHO J, et al. Curcumin:from ancient medicine to current clinical trials[J]. Cellular and Molecular Life Sciences, 2008, 65(11): 1631-1652. DOI:10.1007/s00018-008-7452-4 |
| [54] |
GALATI G, SABZEVARI O, WILSON J X, et al. Prooxidant activity and cellular effects of the phenoxyl radicals of dietary flavonoids and other polyphenolics[J]. Toxicology, 2002, 177(1): 91-104. DOI:10.1016/S0300-483X(02)00198-1 |
| [55] |
SANDUR S K, ICHIKAWA H, PANDEY M K, et al. Role of pro-oxidants and antioxidants in the anti-inflammatory and apoptotic effects of curcumin (diferuloylmethane)[J]. Free Radical Biology and Medicine, 2007, 43(4): 568-580. DOI:10.1016/j.freeradbiomed.2007.05.009 |
| [56] |
汤蓉, 汤强, 黄开勋. 维生素C的促氧化作用[J]. 生命的化学, 2004, 24(3): 197-199. DOI:10.3969/j.issn.1000-1336.2004.03.007 |
| [57] |
MA Q. Role of nrf2 in oxidative stress and toxicity[J]. Annual Review of Pharmacology and Toxicology, 2013, 53: 401-426. DOI:10.1146/annurev-pharmtox-011112-140320 |
| [58] |
JIANG W D, LIU Y, JIANG J, et al. Copper exposure induces toxicity to the antioxidant system via the destruction of Nrf2/ARE signaling and caspase-3-regulated DNA damage in fish muscle:amelioration by myo-inositol[J]. Aquatic Toxicology, 2015, 159: 245-255. DOI:10.1016/j.aquatox.2014.12.020 |
| [59] |
DEVLING T W P, LINDSAY C D, MCLELLAN L I, et al. Utility of siRNA against Keap1 as a strategy to stimulate a cancer chemopreventive phenotype[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(20): 7280-7285. DOI:10.1073/pnas.0501475102 |
| [60] |
ENOMOTO A, ITOH K, NAGAYOSHI E, et al. High sensitivity of Nrf2 knockout mice to acetaminophen hepatotoxicity associated with decreased expression of ARE-regulated drug metabolizing enzymes and antioxidant genes[J]. Toxicological Sciences, 2001, 59(1): 169-177. DOI:10.1093/toxsci/59.1.169 |
| [61] |
CHO H Y, REDDY S P, KLEEBERGER S R. Nrf2 defends the lung from oxidative stress[J]. Antioxidants & Redox Signaling, 2006, 8(1/2): 76-87. |




