沙葱(Allium mongolicum Regel)属百合科葱属植物,又称蒙古韭,广泛分布于我国西北和内蒙古荒漠地区,是一种可以食用的野生蔬菜,地上的部分可入蒙药[1]。沙葱富含蛋白质、氨基酸、脂肪、矿物质、微量元素、多糖、黄酮类化合物等营养物质,食用时有降血压、开胃、提高免疫力、抗氧化、抗衰老、抗菌、抗病毒等作用[2-5]。植物黄酮类化合物是广泛存在于植物体内的复杂的酚类次生代谢物,主要分布在植物的皮、根、茎、叶及果实中。国内外研究已证实,植物中的黄酮具有清除体内自由基、抗氧化、抗衰老、抗癌、抗肿瘤和免疫调节等诸多功效[6]。研究发现,从杨梅中分离出的花青素可以减少活性氧(reactive oxygen species,ROS)的产生并防止其对胰岛细胞的氧化损伤[7]。
血液循环中自由基和氧气(O2)的浓度相对较丰富,富含不饱和脂肪酸的红细胞膜与O2接触机率高,易受ROS攻击而产生脂质过氧化反应并最终导致溶血[8]。由于红细胞对氧化反应的易感性,常被用作细胞模型来探讨生物膜的氧化损伤[9-10];其中红细胞溶血试验作为经典的生物学方法常用于抗氧化活性的评价[11]。目前发现侧柏叶中黄酮类化合物、黑鹰嘴豆壳提取物、蛋白质水解物、金樱子多糖和绿茶多酚等多种成分均对自由基诱导的红细胞溶血具有保护作用[12-16]。黄酮类化合物是沙葱的重要活性成分之一,研究发现,沙葱总黄酮对小鼠机体抗氧化能力有一定的提高作用[17],可提高肉羊血清及组织中抗氧化酶活性,能够有效地防止体内脂质过氧化物的形成[18]。但是有关沙葱总黄酮在细胞水平上的抗氧化机制尚无研究报道。因此,本试验以沙葱总黄酮为研究对象,选择阿尔巴斯绒山羊红细胞为细胞模型,以过氧化氢(H2O2)为损伤因素,利用体外试验的方法探究沙葱总黄酮对H2O2诱导的红细胞氧化损伤的保护作用,为进一步开发利用沙葱资源提供理论基础。
1 材料与方法 1.1 试验材料 1.1.1 沙葱总黄酮的制备试验所用沙葱粉从阿拉善盟浩海生物科技有限公司购买,采用文献[19]报道的超声波提取方法制备沙葱总黄酮(得率为12.85 mg/g),为黄色粉末,难溶于水,其主要组分包括3′, 4′-环氧基-7-O-5-甲氧基黄酮醇、7-O-5, 4′-二甲氧基-3氧基羟基黄酮、糖类、卢丁、木犀草素-5′-O-糖葡萄糖-4-羟基苯丙酸、异槲皮苷糖类、金合欢素及黄酮类物质[19]。将100 mg沙葱总黄酮粉末溶于1 mL二甲基亚砜(DMSO)中,制成100 mg/mL沙葱总黄酮储备溶液,-20 ℃分装冻存。
1.1.2 主要试剂与仪器红细胞内抗氧化指标[超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物(GSH-Px)、丙二醛(MDA)]采用试剂盒测定,试剂盒购自南京建成生物工程研究所,按照说明书方法使用A-5082型酶标仪(奥地利TECAN公司)进行测定。
1.2 试验方法 1.2.1 试验设计及取样选取健康阿尔巴斯绒山羊,使用含有肝素钠抗凝采血管颈静脉无菌采血,700×g离心10 min,弃血浆,用pH为7.4的磷酸盐缓冲液(PBS)重悬红细胞,700×g离心10 min,重复洗涤3次。最后1次洗涤完后将红细胞用PBS配制成体积分数为5%的细胞悬液,每次使用前现采现配。
根据红细胞溶血率的变化筛选出H2O2的最佳作用时间及作用浓度,并同时筛选出沙葱总黄酮安全浓度范围,保证沙葱总黄酮自身对红细胞无毒害作用,在此基础上将试验分为空白对照组、H2O2损伤组及不同浓度沙葱总黄酮组,每组均9个重复,通过考察红细胞溶血率及抗氧化指标的变化,评价沙葱总黄酮对H2O2诱导的红细胞氧化损伤的保护作用。
1.2.2 H2O2诱导红细胞氧化损伤模型的建立在体积分数为5%的红细胞悬浮液里加入不同浓度(10、30、50、70、90 mmol/L)的H2O2溶液,引发溶血,空白对照组添加等体积的PBS,每组9个重复,期间轻轻摇动。每隔0.5 h取出适量的反应混合液,用PBS稀释15倍,700×g离心10 min将红细胞分离,取上清液测定其在405 nm处的吸光值(A1)。同样取适量的反应混合液,用15倍双蒸水稀释使红细胞完全溶血,在相同条件下离心,在405 nm处测其吸光值(A2)。
溶血率(%)=(A1/A2)×100。
1.2.3 沙葱总黄酮对红细胞溶血率的影响为保证试验的有效性,首先考察不同浓度沙葱总黄酮是否对红细胞具有一定的损伤或毒性作用,以排除沙葱总黄酮自身对试验的干扰,根据沙葱总黄酮对红细胞溶血率的影响筛选出沙葱总黄酮安全剂量范围。将试验分为空白对照组及不同浓度沙葱总黄酮组,每组9个重复。沙葱总黄酮浓度范围参考刘兵等[20]的研究结果。取0.3 mL细胞悬液加入0.3 mL不同浓度沙葱总黄酮溶液中,使沙葱总黄酮在细胞悬液中的终浓度分别为30、130、260、390、520、650和780 μg/mL,空白对照组添加等体积的PBS,反应体系为37 ℃下孵育1 h,再加入0.3 mL PBS,混合物孵育时间由1.2.2确定,取出适量的反应混合液,使用1.2.2的方法测定溶血率,根据溶血率的变化筛选出安全浓度范围。
1.2.4 沙葱总黄酮对H2O2诱导的红细胞氧化损伤的保护作用 1.2.4.1 沙葱总黄酮对H2O2诱导的红细胞氧化性溶血的抑制作用为探究沙葱总黄酮对H2O2诱导红细胞溶血率的影响,将试验分为空白对照组、H2O2损伤组、不同浓度沙葱总黄酮组,每组9个重复,取0.3 mL红细胞悬液加入0.3 mL不同浓度沙葱总黄酮溶液(30、130、260、390和520 μg/mL)中,空白对照组和H2O2损伤组加入等体积的PBS,37 ℃孵育1 h后,加入0.3 mL 70 mmol/L H2O2,空白对照组添加等体积的PBS,孵育2 h时间后,取出适量混合液,使用1.2.2的方法测定溶血率。为了试验的有效性,根据此试验中溶血率的变化,挑选出总黄酮低、中、高3个梯度浓度,用于后续试验的研究,并将其剩余反应终体系,于-20 ℃冰箱分装冻存。
1.2.4.2 沙葱总黄酮对H2O2诱导的红细胞内抗氧化指标的测定为了进一步证实沙葱总黄酮对H2O2诱导红细胞溶血率的抑制作用是否通过其抗氧化能力来发挥作用,本试验在H2O2诱导红细胞氧化损伤模型的基础上,考察了沙葱总黄酮对维持氧化还原平衡的关键酶SOD、CAT、GSH-Px活性及脂质氧化终产物MDA含量的影响。将试验分为空白对照组、H2O2损伤组、低浓度沙葱总黄酮组、中浓度沙葱总黄酮组、高浓度沙葱总黄酮组,每组9个重复,测定SOD、CAT、GSH-Px活性及MDA含量。
1.3 数据统计分析数据分析使用SAS 9.0软件统计分析,采用单因素方差分析方法,分析结果以“平均值±标准差”表示,显著性定义为P < 0.05。并将试验数据利用GraphPad prism 5.0软件作图。
2 结果与分析 2.1 H2O2诱导红细胞氧化损伤模型的建立由表 1可知,在空白对照组(0 mmol/L H2O2)中,红细胞在2.5 h内没有溶血发生,溶血率保持稳定。随着H2O2浓度的增加,红细胞溶血率逐渐上升,当H2O2与红细胞作用时间为2.0、2.5 h时,H2O2浓度为50、70 mmol/L组的红细胞溶血率无显著差异(P < 0.05)。H2O2浓度为50、70 mmol/L,作用时间2.0 h时,红细胞溶血率达85%以上,达到氧化性溶血的要求。因此,本试验选取70 mmol/L H2O2,作用时间2.0 h用于后续的研究。
|
|
表 1 不同浓度H2O2在不同作用时间时对红细胞溶血率的影响 Table 1 Effects of different concentrations of H2O2 at different time of action on hemolysis rate of erythrocytes |
由图 1可知,与空白对照组相比,沙葱总黄酮浓度为30 μg/mL组的红细胞溶血率差异不显著(P > 0.05);沙葱总黄酮浓度为130~520 μg/mL组的红细胞溶血率显著降低(P < 0.05),沙葱总黄酮浓度为520 μg/mL组的溶血率降到最低;沙葱总黄酮浓度为650~780 μg/mL组的红细胞溶血率显著升高(P < 0.05),沙葱总黄酮浓度为780 μg/mL组的红细胞溶血率上升至最高。因此,本试验选取30、130、260、390和520 μg/mL的沙葱总黄酮安全浓度进行后续试验。
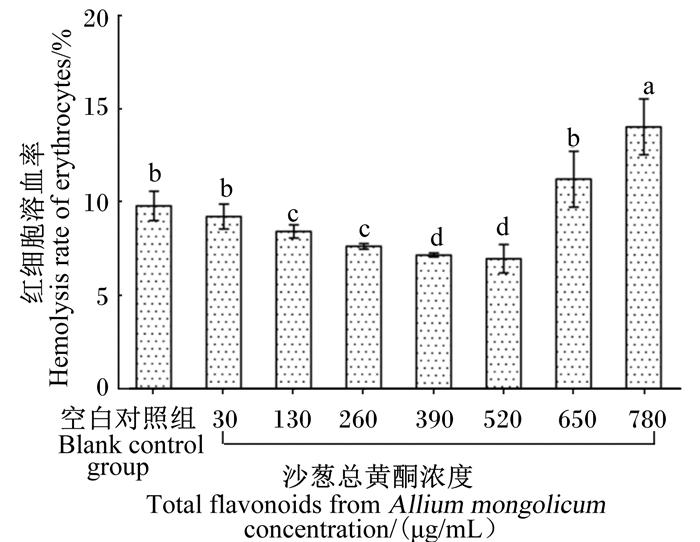
|
数据柱形标注相同小写字母表示差异不显著(P > 0.05),不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with the same small letter superscripts mean no significant difference (P > 0.05), while with different small letter superscripts mean significant difference (P < 0.05). The same as below. 图 1 沙葱总黄酮对红细胞溶血率的影响 Fig. 1 Effects of total flavonoids from Allium mongolicum Regel on hemolysis rate of erythrocytes |
由图 2可知,H2O2损伤组溶血率为95%,与空白对照组差异显著(P < 0.05),表示造模成功。随着沙葱总黄酮浓度的增加,红细胞溶血率逐渐降低,说明沙葱总黄酮的抑制作用随浓度的增加而加强,具有剂量依赖性,沙葱总黄酮浓度为30、130、260和390 μg/mL组之间差异显著(P < 0.05)。总黄酮浓度为520 μg/mL组红细胞溶血率降低至14%,与空白对照组相比差异不显著(P > 0.05)。因此,从此试验中选择130、260和520 μg/mL作为后期试验的低、中、高3个梯度浓度。
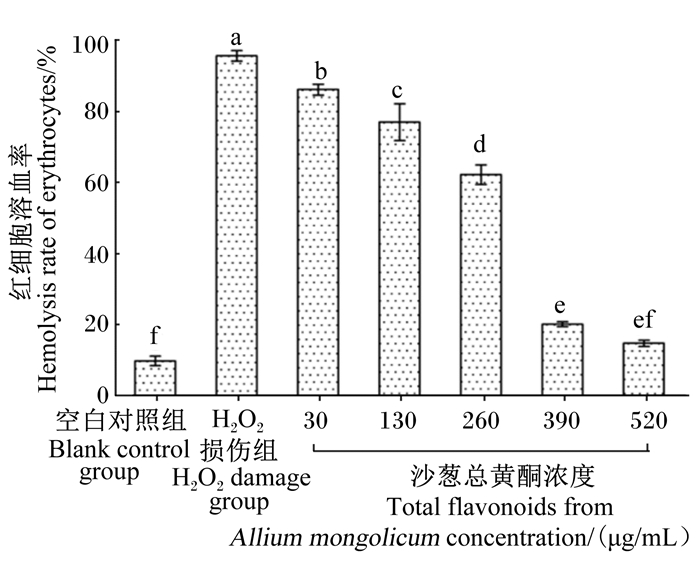
|
图 2 沙葱总黄酮对红细胞氧化性溶血的抑制作用 Fig. 2 Inhibition effects of total flavonoids from Allium mongolicum Regel on oxidative hemolysis of erythrocytes |
由表 2可知,与H2O2损伤组相比,各浓度沙葱总黄酮均能够显著提高H2O2诱导状态下红细胞中SOD、CAT和GSH-Px活性(P < 0.05),呈浓度依赖性关系,但均显著低于空白对照组(P < 0.05)。与空白对照组相比,H2O2诱导状态下红细胞中MDA含量显著升高(P < 0.05),说明细胞膜存在相关的氧化损伤;与H2O2损伤组相比,各浓度沙葱总黄酮能够显著降H2O2诱导状态下红细胞中MDA含量(P < 0.05),但均显著高于对照组(P < 0.05)。
|
|
表 2 沙葱总黄酮对H2O2诱导的红细胞中抗氧化指标的影响 Table 2 Effects of total flavonoids from Allium mongolicum Regel on antioxidant index in erythrocytes induced by H2O2 |
氧化反应是机体生命活动的基础,在生物体内,线粒体氧化呼吸电子传递链是产生自由基最常见的途径[21]。自由基的种类很多,研究多集中于以氧(O)、氮(N)为中心的活性基团,其中又以ROS自由基的研究最多。适度的ROS自由基对机体具有抗菌、血管扩张、信号传导等生理作用[22-23],并且体内的抗氧化系统会消除过量ROS自由基,使内环境处于稳定的状态。但是,机体内过多的ROS自由基会诱发细胞产生氧化损伤,破坏蛋白质、DNA等大分子物质,进而引起一系列与氧化损伤有关的疾病[24]。H2O2是一种自由基,已被广泛应用于体外细胞氧化应激模型建立试验当中,H2O2极易穿透细胞膜,并通过芬顿(Fenton)反应形成具有铁分子的高反应性自由基[25],从而引起细胞正常结构和功能的损伤。在本试验中,当H2O2浓度为70 mmoL/L,作用时间2.0 h时,红细胞溶血率达到95%,氧化应激导致红细胞产生溶血,达到试验要求,因此选择此浓度进行后续的试验。
3.2 黄酮类化合物的抗氧化作用虽然很多化学物质如维生素C等均能够减少氧化应激,但天然抗氧化剂仍然是一个研究的热点。黄酮类化合物作为一种天然的抗氧化剂,其主要作用为通过电子转移或者作为氢供体的方式实现清除自由基、增强还原力,抑制脂质过氧化,且清除自由基的能力与药理活性密切相关[26]。蒙萍等[27]通过对大苞雪莲总黄酮体外抗氧化活性试验发现,其大苞雪莲总黄酮能够有效地清除2, 2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS)、1, 1-二苯基-2-三硝基苯肼(DPPH)、羟基(—OH)、一氧化氮(NO)和超氧阴离子(O2-)等自由基,具有较强的体外抗氧化活性。MDA作为细胞膜脂质过氧化产物,是自由基致细胞损伤的标记物之一。MDA的含量能直接地反映体内自由基水平及脂质过氧化程度。Yamakoshi等[28]研究发现,葡萄籽提取物中的黄酮类物质能够螯合金属离子,清除自由基,是脂质过氧化反应的抑制剂。侧柏叶中黄酮类化合物能够抑制H2O2引起的人红细胞溶血和MDA含量[12]。本试验结果表明,羊红细胞经H2O2处理2.0 h后,红细胞中MDA含量显著升高,而在作用浓度范围内,沙葱总黄酮能够显著降低红细胞的氧化性溶血率以及氧化产物MDA含量,沙葱总黄酮浓度达到520 μg/mL时效果最好。这说明沙葱总黄酮的抗氧化作用涉及抑制过氧化反应,能够保护红细胞免受自由基的损伤。
3.3 沙葱总黄酮的抗氧化效果红细胞内的SOD、CAT、GSH-Px、谷胱甘肽(GSH)、抗坏血酸、还原型辅酶Ⅱ等抗氧化活性物质,在糖酵解途径、磷酸戊糖旁路代谢、2, 3-二磷酸甘油酸支路代谢途径、Touster通路代谢途径实现抗氧化物质的循环。SOD是重要的含金属离子抗氧化酶,是抗氧化系统中的第1道防线,能够将高活性O2-催化为低活性的H2O2和O2。CAT能够催化H2O2分解为H2O和O2,进一步清除H2O2,是生物体抗氧化系统中的末端酶。GSH-Px为体内过氧化物分解酶,GSH-Px、SOD、CAT相互作用,保护细胞膜功能与结构的完整性。因此本试验测定了SOD、CAT、GSH-Px的活性,研究沙葱总黄酮对H2O2氧化损伤红细胞内抗氧化酶活性的影响。研究表明,红细胞经H2O2处理2.0 h后,红细胞中GSH-Px、SOD、CAT活性显著降低,而各浓度沙葱总黄酮组红细胞中GSH-Px、SOD、CAT活性均显著提高,但是不能达到空白对照组的正常水平。Tebib等[29]研究发现,膳食中的多聚原花青素能够提高不同组织中抗氧化酶如CAT、GSH-Px、SOD的活性并降低MDA含量,与维生素E效果类似。松花粉提取物、葡萄籽提取物、竹叶黄酮能提高H2O2氧化损伤PC12细胞内SOD、CAT、GSH-Px活性[30]。这说明,沙葱总黄酮可通过提高机体抗氧化酶活性来发挥抗氧化作用。
在本试验中,红细胞经沙葱总黄酮预孵育后,因H2O2氧化损伤造成的溶血及MDA含量升高均得到明显抑制,数据中显示,当沙葱总黄酮浓度较高时,能增加红细胞溶血率,表明沙葱总黄酮浓度过高时能对细胞产生一定的损伤,具有毒性作用。因此筛选出沙葱总黄酮的安全浓度范围是本试验的重点。由于沙葱总黄酮类化合物种类较多,其生理活性(如抗氧化能力)可能各不相同,这些因素对红细胞抗氧化的具体作用机制仍需进行系统性深入研究。
4 结论① 沙葱总黄酮浓度在30~520 μg/mL均能够抑制H2O2氧化损伤引起的红细胞溶血,降低红细胞中MDA含量,提高红细胞中GSH-Px、SOD、CAT活性,且呈剂量效应性关系。
② 沙葱总黄酮可通过降低氧化产物及提高抗氧化酶活性保护红细胞免受氧化损伤。
| [1] |
包颖. 内蒙古葱属植物的地理分布[J]. 内蒙古师大学报(自然科学版), 2000, 29(2): 130-134. |
| [2] |
燕玲, 王六英, 李红. 内蒙古10种葱属植物染色体数目及核型分析[J]. 中国草地, 1999(5): 73-75. |
| [3] |
李亚蕾, 罗瑞明. 沙葱提取物抗菌效果的研究[J]. 安徽农业科学, 2008, 36(33): 14596-14597, 14618. DOI:10.3969/j.issn.0517-6611.2008.33.101 |
| [4] |
凌关庭. 天然抗氧化剂及其消除氧自由基的进展[J]. 食品工业, 2000(3): 19-22. |
| [5] |
缪亚娟.沙葱异黄酮含量测定及其对机体抗氧化与非特异性免疫影响的研究[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2009. http://cdmd.cnki.com.cn/article/cdmd-10129-2009131409.htm
|
| [6] |
BARRECA D, LAGANÀ G, TELLONE E, et al. Influences of flavonoids on erythrocyte membrane and metabolic implication through anionic exchange modulation[J]. Journal of Membrane Biology, 2009, 230(3): 163-171. DOI:10.1007/s00232-009-9197-x |
| [7] |
张波.杨梅花色苷对胰岛细胞氧化应激损伤的保护作用及其机制探讨[D].博士学位论文.杭州: 浙江大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10335-2010116035.htm
|
| [8] |
SADRZADEH S M, GRAF E, PANTER S S, et al. Hemoglobin.A biologic fenton reagent[J]. Journal of Biological Chemistry, 1984, 259(23): 14354-14356. |
| [9] |
HONZEL D, CARTER S G, REDMAN K A, et al. Comparison of chemical and cell-based antioxidant methods for evaluation of foods and natural products:generating multifaceted data by parallel testing using erythrocytes and polymorphonuclear cells[J]. Journal of Agricultural and Food Chemistry, 2008, 56(18): 8319-8325. DOI:10.1021/jf800401d |
| [10] |
BUEHLER P W, ALAYASH A I. Redox biology of blood revisited:the role of red blood cells in maintaining circulatory reductive capacity[J]. Antioxidants & Redox Signaling, 2005, 7(11/12): 1755-1760. |
| [11] |
何佳易.红细胞氧化模型评价抗氧化活性的方法学研究[D].硕士学位论文.扬州: 扬州大学, 2013. http://cdmd.cnki.com.cn/article/cdmd-11117-1014112464.htm
|
| [12] |
丁航, 刘慧明, 梁统, 等. 侧柏叶中黄酮类化合物对H2O2诱导的人红细胞氧化作用的影响[J]. 实用临床医学, 2003, 4(3): 23-24. DOI:10.3969/j.issn.1009-8194.2003.03.010 |
| [13] |
GIRISH T K, VASUDEVARAJU P, PRASADA RAO U J S. Protection of DNA and erythrocytes from free radical induced oxidative damage by black gram (Vigna mungo L.) husk extract[J]. Food and Chemical Toxicology, 2012, 50(5): 1690-1696. DOI:10.1016/j.fct.2012.01.043 |
| [14] |
赵磊, 郝添阳, 王旋, 等. 蛋白水解物对DNA和红细胞氧化损伤的保护作用[J]. 中国食品学报, 2016, 16(8): 7-15. |
| [15] |
皮建辉, 胡朝暾, 郑晴, 等. 金樱子多糖体外抗脂质过氧化和红细胞溶血作用研究[J]. 怀化学院学报, 2012, 30(5): 11-15. DOI:10.3969/j.issn.1671-9743.2012.05.003 |
| [16] |
马兰萍, 刘在群, 周波, 等. 绿茶多酚对自由基诱导的红细胞氧化性溶血的抑制作用[J]. 科学通报, 2000, 45(12): 1271-1275. DOI:10.3321/j.issn:0023-074X.2000.12.008 |
| [17] |
赵春艳.沙葱中黄酮类化合物的分离纯化、结构鉴定及其对小鼠免疫抗氧化机能影响的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10129-2008131914.htm
|
| [18] |
木其尔.沙葱黄酮对肉羊机体抗氧化和免疫功能的影响及其机理研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10129-1016250444.htm
|
| [19] |
萨茹丽.沙葱黄酮提取工艺优化、结构鉴定及其相关生物活性研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10129-1014375681.htm
|
| [20] |
刘兵, 苑博, 宁天一, 等. 沙棘总黄酮对过氧化氢损伤人血管内皮细胞的保护作用[J]. 中华中医药学刊, 2017, 35(8): 2158-2160. |
| [21] |
FEDERICO A, CARDAIOLI E, DA POZZO P, et al. Mitochondria, oxidative stress and neurodegeneration[J]. Journal of the Neurological Sciences, 2012, 322(1/2): 254-262. |
| [22] |
RÓTH E. Oxygen free radicals and their clinical implications[J]. Acta Chirurgica Hungarica, 1997, 36(1/2/3/4): 302-305. |
| [23] |
NATHAN C. Nitric oxide as a secretory product of mammalian cells[J]. The FASEB Journal, 1992, 6(12): 3051-3064. DOI:10.1096/fasebj.6.12.1381691 |
| [24] |
SALUCCI S, BURATTINI S, BATTISTELLI M, et al. Ultraviolet B (UVB) irradiation-induced apoptosis in various cell lineages in vitro[J]. International Journal of Molecular Sciences, 2012, 14(1): 532-546. DOI:10.3390/ijms14010532 |
| [25] |
张玲莉, 邱振鹏. 黄芩提取物对红细胞抗氧化作用研究[J]. 中国药师, 2011, 14(11): 1572-1575. DOI:10.3969/j.issn.1008-049X.2011.11.004 |
| [26] |
ARBOS K A, ClARO L M, BORGES L, et al. Human erythrocytes as a system for evaluating the antioxidant capacity of vegetable extracts[J]. Nutrition Research, 2008, 28(7): 457-463. DOI:10.1016/j.nutres.2008.04.004 |
| [27] |
蒙萍, 马慧萍, 王宁, 等. 大苞雪莲总黄酮体外抗氧化活性[J]. 中国实验方剂学杂志, 2015, 21(17): 92-95. |
| [28] |
YAMAKOSHI J, SANO A, TOKUTAKE S, et al. Oral intake of proanthocyanid in-rich extract from grape seeds improves chloasma[J]. Phytotherapy Research, 2004, 18(11): 895-899. DOI:10.1002/(ISSN)1099-1573 |
| [29] |
TEBIB K, ROUANET J M, BESANÇON P. Antioxidant effects of dietary polymeric grape seed tannins in tissues of rats fed a high cholesterol-vitamin E-deficient diet[J]. Food Chemistry, 1997, 59(1): 135-141. DOI:10.1016/S0308-8146(96)00253-1 |
| [30] |
王丹丹.三种植物提取物对H2O2诱导PC12细胞氧化损伤的保护作用研究[D].硕士学位论文.济南: 山东师范大学, 2016.
|




