2. 动物胚胎工程及分子育种湖北省重点实验室, 武汉 430064;
3. 农业部畜禽细菌病防治制剂创制重点实验室, 武汉 430064
2. Key Laboratory of Animal Embryo Engineering and Molecular Breeding of Hubei Province, Wuhan 430064, China;
3. Key Laboratory of Prevention and Control Agents for Animal Bacteriosis(Ministry of Agriculture), Wuhan 430064, China
植物化学物质(phytochemicals)是植物代谢活动中产生的一系列次级代谢产物的统称,它们是植物药物或添加剂发挥生理调节作用的主要有效活性成分,在动物体中发挥抗氧化、抗细菌炎症、抗肿瘤和免疫增强等生理功能[1]。植物化学物质依照其代谢来源及化学结构可以分为:植物多糖、植物黄酮、醌类、生物碱、萜类以及皂苷类等。随着研究的不断深入,植物化学物质表现出的良好的生理调节功能往往通过对关键信号通路的调节来实现。因此,明确植物化学物质在机体细胞内的作用机制,了解其代谢调节程序和作用靶标,对强化我们对植物化学物质的认识,促进药物和添加剂产品的开发有着重要的提振作用。本文综合归纳了植物化学物质对生理代谢调节可能的4种模式:细胞表面受体-激酶级联模式、激酶级联通路调节模式、关键作用转录因子调节模式及核受体激活调节模式(图 1),并对其生理调节作用所经由的关键信号通路进行了综述。
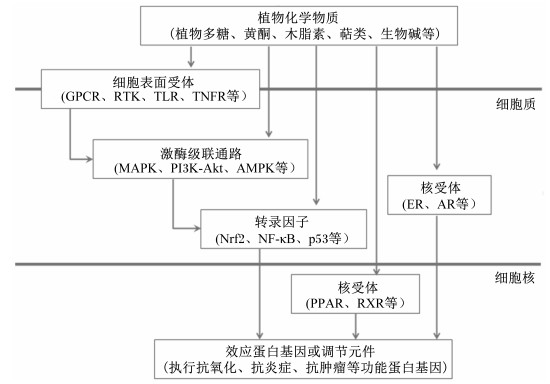
|
GPCR:G蛋白偶联受体G protein-coupled receptor;RTK:受体酪氨酸激酶receptor tyrosine kinase;TLR:Toll样受体Toll-like receptor;TNFR:肿瘤坏死因子受体tumor necrosis factor receptor;MAPK:丝裂原活化蛋白激酶mitogen-activated protein kinase;PI3K-Art:磷脂酰肌醇3激酶-蛋白激酶B phosphoinositide-3-kinase and protein kinase B;AMPK:腺苷酸活化蛋白激酶adenosine 5′-monophosphate (AMP)-activated protein kinase;Nrf2:核转录因子E2相关因子2 nuclear factor-erythroid 2 related factor 2;NF-κB:核因子-κB nuclear factor-κB;ER:雌激素受体estrogen receptor;AR:雄激素受体androgen receptor;PPAR:过氧化物酶体增殖体激活受体peroxisome proliferator-activated receptor;PXR:孕烷X受体pregnant X receptor。 图 1 植物化学物质对生理代谢的调节模式 Fig. 1 Regulation pattern of physiological metabolism by phytochemicals |
植物化学物质发挥生理调节功能的第1步是对细胞受体的激活,实现细胞对环境的识别。这1步也是细胞外信号传导到细胞内并发挥作用的第1步。植物化学物质能够引起多种细胞受体的激活,包括G蛋白偶联受体(G protein-coupled receptor,GPCR)、离子通道受体、受体酪氨酸激酶(receptor tyrosine kinase,RTK)、Toll样受体(Toll-like receptor,TLR)和肿瘤坏死因子受体(tumor necrosis factor receptor,TNFR)等。
1.1 GPCRGPCR蛋白是一类通常具有7个跨膜结构的膜蛋白,能够广泛地参与多种神经递质或激素信号的感受,约有超过34%的药物选择GPCR作为靶标[2]。当配体与受体结合时,可以引起GPCR构象变化,并通过与之偶联的G蛋白的不同亚基,引起多种信使分子的释放,如环腺苷酸(cAMP)、1, 4, 5-三磷酸肌醇和甘油二酯等[3]。多种神经递质、肽类激素和趋化因子的受体及味觉、嗅觉中接受外源理化因素的受体均属于GPCR,植物化学物质往往通过干扰GPCR与配体的结合以影响后续的生物学进程。血小板活化因子(platelet activating factor,PAF)受体属于GPCR家族,能够识别细胞外的PAF并发挥其生物学活性,植物化学物质中的苯丙素类,如四氢呋喃、木脂酚等;萜类,如银杏内脂、款冬素等;皂苷类,如圣高草素-7-氧-β-D-葡萄糖甙等都能够作为PAF受体的拮抗剂[4-5],引起受体封闭,抑制PAF的聚集。毒蕈碱型乙酰胆碱(muscarinic acetylcholine,mACh)受体也属于GPCR,能够在乙酰胆碱刺激下产生副交感神经兴奋效应,调节心脏、支气管平滑肌等收缩以及影响记忆等,Swaminathan等[6]的研究表明多种植物黄酮,如毛果芸香碱、木犀草素以及商陆素等,与mACh受体结合的亲和性与乙酰胆碱相当,可以竞争性抑制乙酰胆碱对受体的激活。此外,东莨菪碱也是mACh受体的拮抗剂,小鼠饲粮中添加可以引起学习能力和短期记忆能力的损伤[7]。
1.2 离子通道型受体离子通道型受体主要存在于神经、肌肉等可兴奋细胞,其信号分子主要为神经递质。离子通道型受体的主要作用在于调整各种水溶性离子、糖类及细胞代谢废物等向膜内或膜外的快速转移,从而快速调节细胞各项生物进程[8]。已知受体中N型乙酰胆碱(nicotinic acetylcholine,nAch)、γ-氨基丁酸(γ-aminobutyric acid,GABA)以及谷氨酸、甘氨酸、天门冬氨酸等的受体都属于这一类。离子通道型受体对神经和肌肉的兴奋性具有关键的调节功能,植物化学物质通过对这些受体的调节对机体各种行为产生影响。加兰他敏(galantamine,GAL)是由夏雪片莲球茎和花中提取得到的一类合成型异喹啉生物碱,是一种选择性、竞争可逆性的乙酰胆碱酯酶抑制剂,Koola等[9]研究表明,GAL可以通过对nAch受体的变构调节,增加突触处乙酰胆碱的浓度,发挥神经镇痛作用。N-甲基-D-天冬氨酸(N-methyl-D-aspartate,NMDA)受体是一种谷氨酸激动受体,这一受体的激活对大脑的学习与记忆具有促进作用。小檗碱是一种异喹啉生物碱,是黄连等中药植物的有效成分,能够通过NMDA受体调节胶质细胞中线粒体数量和半胱天冬酶(caspase)蛋白的表达[10]。甘氨酸是一种抑制性氨基酸神经递质,因此,甘氨酸受体的拮抗剂往往具有神经毒性,如番木鳖碱,这种自马钱属树木中提取的吲哚生物碱,其晶体结构显示能与甘氨酸受体结合,发挥甘氨酸抑制作用,引发反射亢进[11]。
1.3 RTKRTK是存在于细胞膜上的另一大类受体,是一种酶联受体,既是受体,也具有蛋白酪氨酸激酶活性,能够在与配体结合后,介导自身或下游蛋白酪氨酸残基的磷酸化。多种生长激素,如血小板衍生生长因子(platelet derived growth factor,PDGF)、血管内皮生长因子(vascular endothelial growth factor,VEGF)、表皮细胞生长因子(epidermal growth factor,EGF)和胰岛素样生长因子-Ⅰ(IGF-Ⅰ)等都能经由RTK参与细胞生长与发育的调节。Paramashivam等[12]通过体内药代动力学与分子对接研究在黄杨中发现了靛蓝、黏液醇和靛蓝二乙酸等生物类黄酮以及赤藓二醇X和Y是VEGF受体2和PDGFβ受体的抑制剂。而研究显示,槲皮素和木犀草素对EGF受体的酪氨酸激酶活性的封闭能够导致胰岛癌细胞的生长抑制及凋亡发生[13]。Ganugapati等[14]研究表明绿茶黄酮是一种胰岛素类似物,其中的儿茶素可以作为胰岛素受体的激活剂,减少由于进入细胞中胰岛素的不足所引发的糖或能量代谢障碍。Wan等[15]发现在骨肉瘤细胞系中,鹿蹄草中的梅笠草素能够通过阻断IGF-Ⅰ受体信号,抑制炎症反应并引起细胞凋亡。植物化学物质可以通过对RTK的激活和竞争性抑制作用从而发挥其抗炎抗肿瘤作用,为相关药物的开发提供适合的靶标。
1.4 TLRTLR是一种模式识别受体(pattern recognition receptors,PRRs),主要表达于巨噬细胞、树突状细胞和上皮细胞表面,能够直接识别并结合细菌、病毒和真菌等表达的病原体相关分子模式(pathogen-associated molecular pattern,PAMP),引发固有免疫反应,在病原体感染性疾病中发挥重要作用。TLR信号转导途径主要有髓样分化蛋白88(myeloid differentiation primary response protein 88,MyD88)依赖和非依赖途径。在MyD88依赖的信号途径中,TLR通过MyD88分子将细胞信号转导至下游的白细胞介素-1受体相关激酶(interleukin-1 receptor associated kinase,IRAK)、转化生长因子β激酶1(transforming growth factor β-activated kinase 1,TAK1)等,并进一步激活核因子-κB(NF-κB)抑制蛋白激酶(inhibitor of nuclear factor-κB kinase,IKK)复合体,最终引起转录因子NF-κB的激活。植物多糖是当前植物化学物质研究的热点之一,其主要功效是激活并强化吞噬细胞的免疫反应,进而发挥免疫调节、抗肿瘤和抗炎症等功效。已有的报道显示,植物多糖可以有效地激活吞噬细胞的免疫反应,促进一氧化氮(NO)、白细胞介素-1β(interleukin-1β,IL-1β)、白细胞介素-6(interleukin-6,IL-6)、干扰素-γ(interferon-γ,IFN-γ)等细胞因子的表达[16],这一促进作用是由于植物多糖与某些病原体表面多糖具有相似的细胞表面受体,这使得这些植物多糖可以作为无致病性的免疫刺激剂,通过与吞噬细胞表面的PRRs,如TLR、补体受体、清道夫受体和甘露糖受体等结合,表现出有益的免疫调节特性[16]。此外,章超群等[17]研究显示白芍总苷能够降低糖尿病小鼠肾组织TLR信号通路蛋白TLR2、TLR4、MyD88、p-IRAK1和NF-κB等蛋白的表达,表明白芍总苷可经由TLR信号通路减轻糖尿病大鼠早期肾脏损害。彭丽娜[18]在抗感染中药筛选中发现甘草次酸和淫羊藿苷刺激Ana-1细胞后能提高TLR2、TLR3、TLR4、TLR7和TLR9等受体分子的表达。姜黄素处理可以抑制脂多糖(LPS)刺激引起的小胶质细胞内TLR4及其下游分子MyD88、NF-κB等蛋白表达上调,显示出姜黄素可以通过TLR在创伤性脑损伤急性炎症损伤中发挥保护效应[19]。
1.5 TNFRTNFR属于肿瘤坏死因子受体超家族(tumor necrosis factor receptor superfamily,TNFRSF),是一类细胞因子受体,用来特异性的识别并结合肿瘤坏死因子(tumor necrosis factors,TNFs)。TNF-α是所有TNFs中研究最早的,是一种免疫调节和前炎性因子,具有强大的促炎和免疫调节功能,同时这一细胞因子与多种疾病的发生以及病程的发展密切相关,使之成为多种疾病的治疗靶点。目前已有部分关于TNFR封闭剂和TNF-α抑制剂药物的研究,但这些药物多为人工合成小分子以及靶向TNFR的单抗类药物,如infliximab、针对受体TNFRSF9的urelumab和PF-05082566、针对TNFRSF4的MEDI6469等[20]。植物化学物质主要通过对丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)、NF-κB等通路的抑制作用,抑制TNF-α的生成。植物中多种黄酮、木脂素、生物碱以及萜类等都能通过对NF-κB和MAPK磷酸化激活的抑制,抑制炎症诱导条件下TNF-α的表达[21],这些研究显示植物化学物质是TNF-α抑制剂的良好来源。此外,有少量报道提示植物化学物质对TNFR的调节作用,陈明亮等[22]研究显示白藜芦醇可能通过抑制TNFR1表达,进而抑制TNF-α刺激引起的炎性因子释放,减轻内皮炎性损伤。
2 激酶级联通路调节模式植物化学物质在刺激受体活化后,往往经由一系列的级联通路将受体信号转导至其对应的效应靶标,同时植物化学物质也可以直接调节这些级联通路中激酶的活性,引起转录因子和相关效应蛋白的表达。这样的通路包括MAPK信号通路、Janus激酶-信号传导和转录活化因子(Janus kinase-signal transducer and activator of transcription,JAK-STAT)信号通路、磷脂酰肌醇3激酶-蛋白激酶B(phosphoinositide-3-kinase and protein kinase B,PI3K-Akt)信号通路以及腺苷酸活化蛋白激酶信号通路等。
2.1 MAPK信号通路MAPK是一组丝氨酸/苏氨酸蛋白激酶,能够被细胞外不同的刺激激活,实现细胞膜受体信号向细胞内靶标的传递。MAPK能够作为多种受体信号的下游通路,其所具有的3级激酶系统,可以实现细胞外信号的特异性呈递和放大。在这一信号通路中,多种激酶构成了4类不同的级联通路,以识别不同细胞信号,其中,细胞外调节蛋白激酶1/2(extracellular regulated protein kinase 1/2,ERK1/2)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)、p38丝裂原活化蛋白激酶(p38 mitogen-activated protein kinases,p38 MAPK)和大丝裂原活化蛋白激酶1(big MAP kinase 1,BMK1,又称为ERK5)等的研究最为广泛。植物化学物质对MAPK信号通路的激活表现出复杂的调节活性。在一项RAW264.7细胞试验中,使用当归多糖处理细胞能显著激活ERK1/2和p38信号通路,却不影响JNK的活性[23]。然而另有研究显示,刺五加多糖对ERK、JNK和p38这3条通路均具有激活作用[24]。同样地,双氢杨梅苷是藤茶提取物的主要活性成分之一,能够特异性的抑制由LPS诱导的RAW264.7细胞中p38和JNK的磷酸化激活,促进抗炎症细胞因子白细胞介素-10(interleukin-10,IL-10)的表达[25]。此外,植物黄酮中木犀草素、原花青素、橙皮苷等参与ERK的活化与上调表达[26-28],槲皮素、漆黄素等可以激活p38蛋白[29-30],而山奈酚则能作为JNK的激活剂[31]。植物化学物质对MAPK不同通路的选择作用可以为不同压力和应激条件下生理活动的精确调节提供方向。
2.2 PI3K-Akt信号通路PI3K-Akt信号通路是与MAPK信号通路类似的另一级联通路激酶系统。PI3K是磷脂激酶中的一个家族,其主要作用是完成膜上磷脂酰肌醇4, 5-二磷酸(phosphatidylinositol 4, 5-bisphosphate,PIP2)向磷脂酰肌醇3, 4, 5-三磷酸(phosphatidylinositol 3, 4, 5-trisphosphate,PIP3)的转化,以释放信使分子PIP3参与机体代谢调节。Akt是一种丝氨酸/苏氨酸激酶,也是PI3K激酶的主要效应蛋白[32]。激活的Akt能调节其下游底物磷酸化,通过哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin,mTOR)信号通路调节蛋白质的合成和细胞生长,也可通过调节糖原合成酶激酶3β(glycogen synthase kinase 3β,GSK3β)的活性进而调节细胞糖代谢[33]。植物化学物质参与PI3K-Akt通路的调节多是通过对Akt蛋白的磷酸化水平的调节而实现。成纤维细胞生长因子处理的HUVEC细胞中,人参皂苷能够下调Akt的磷酸化水平[34]。染料木素和表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)都能够抑制Akt的磷酸化,诱导GSK3β的表达,进而介导β-连环蛋白的磷酸化及后续降解[35]。此外,植物黄酮类中异荭草苷和紫铆亭能通过PI3K-Akt通路依赖的方式调节核因子E2相关因子2(nuclear factor-erythroid 2 related factor 2,Nrf2)转录,调节细胞抗氧化酶的表达[36-37]。
2.3 JAK-STAT信号通路JAK-STAT信号通路是一种进化保守的,参与膜信号至细胞核快速转导的级联通路[38]。在JAK-STAT信号通路中,受体本身不发挥激酶活性,但其胞内片段与JAK蛋白可相互结合。当受体与配体结合时,受体多聚构象的改变使得与受体偶联的JAK激酶相互接近并通过交互的酪氨酸磷酸化作用而活化,进而通过STAT蛋白调节基因的转录与翻译[39]。JAK-STAT信号通路是一条与疾病、癌症等具有高度相关性的通路[40],因此,这一通路的抑制剂可以作为疾病与癌症治疗药物的良好靶标。在哮喘模型小鼠中,染料木素调节Th1/Th2型细胞因子的不同表达,通过抑制STAT6的转录以减缓过敏性支气管炎症[41]。在胆管癌细胞中,槲皮素和EGCG能够抑制JAK-STAT通路介导的促炎性因子IL-6和干扰素6(interferon 6,IFN6)的表达,并剂量依赖的抑制STAT1和STAT3的磷酸化[42]。此外,Song等[43]报道,银杏酰亚胺B能够显著性抑制脊髓损伤小鼠体内的JAK2和STAT3的磷酸化水平,抑制凋亡蛋白caspase-3的表达,缓解疾病状态。
2.4 AMPK信号通路AMPK是细胞内能量感受与调节的核心蛋白,能够感应腺苷酸(AMP)含量的变化,调节细胞内能量代谢的平衡。这一激酶能够开启分解相关的多个通路,如脂肪酸的氧化和糖酵解,同时也能关闭多个合成相关的通路,如脂肪酸、甘油三酯和蛋白质的合成。通过对合成通路的闭合作用,AMPK参与减缓细胞内的炎症反应,调节肿瘤抑制作用。肝激酶B1(liver kinase B1,LKB1)和钙调素依赖蛋白激酶激酶β(calmodulin-dependent protein kinase kinase β,CaMKKβ)是AMPK的上游激酶,能够响应细胞内AMP/ATP、钙离子流量等信号,调节AMPK的磷酸化激活[44-45]。激活后的AMPK通过对下游靶蛋白,如固醇调节元件结合蛋白(SREBP)-1c、乙酰辅酶A羧化酶(ACC)等的磷酸化调节,影响糖、脂质和蛋白质的代谢过程。
植物化学物质通过对AMPK通路的激活作用参与脂质生成、肥胖和糖尿病相关进程的调节。可可碱、银杏内酯C、苦丁冬青苷D等都能够通过AMPK通路抑制3T3-L1细胞中脂肪生成[46-48]。同时,上游通路对植物化学物质对AMPK的激活过程中具有重要的传递作用。研究显示肉桂酸甲酯和熊果酸对AMPK的激活作用分别经由CaMKKβ和LKB1的介导,并随后发挥对3T3-L1细胞中脂肪生成的抑制作用[49-50]。AMPK还是植物化学物质抗肿瘤作用的关键通路,白杨素能够激活AMPK以调节A459肺癌细胞的生长抑制及凋亡发生[51]。在HepG2细胞中,高良姜素对AMPK的激活可以诱导细胞自噬作用进而抑制细胞增殖[52]。此外,木犀草素和槲皮素都能抑制内质网应激相关炎性小体的激活,减缓内皮细胞的炎症反应状态,这一过程中AMPK具有关键的调节作用[53]。
3 关键作用转录因子调节模式参与植物化学物质生理调节作用的关键作用转录因子包括Nrf2、NF-κB和p53等,它们是效应基因的直接调节因子。植物化学物质的抗氧化、炎症免疫调节、肿瘤抑制以及生长调控功能的实现最终是通过对Nrf2、NF-κB和p53及对应的效应基因的调节而实现。
3.1 Nrf2Nrf2是调节细胞内抗氧化系统的关键信号分子,属于CNC(cap ‘n’ collar)家族转录因子,其转移入核能够与抗氧化反应元件(antioxident responseelement,ARE)结合,诱导ARE依赖的Ⅱ相抗氧化基因的转录表达。Kelch样ECH相关蛋白1(Kelch-like ECH-associated protein 1,Keap1)能够与Nrf2蛋白偶联,并通过与胞浆肌动蛋白的结合将Nrf2锚定于胞浆中或介导Nrf2在蛋白酶体中降解,从而抑制Nrf2介导的抗氧化功能的激活[54]。当细胞经受过氧化物侵袭时,Nrf2与Keap1发生解偶联并转移入核,调节ARE的转录活性,以诱导γ-谷氨酰半胱氨酸合成酶、谷胱甘肽过氧化物酶、谷胱甘肽S-转移酶、血红素氧合酶-1(heme oxygenase-1,HO-1)、还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)奎宁氧化还原酶1等抗氧化酶的表达,发挥抗氧化功效[55]。
植物化学物质对Nrf2的调控具有多种形式:Keap1依赖和非依赖的通路。在Keap1依赖的调控通路中,植物化学物质通过对Keap1上的氨基酸残基的修饰作用介导了Nrf2的活化,其中,半胱氨酸残基(Cys)-151、Cys-273和Cys-288是Keap1功能发挥重要节点。在十字花科蔬菜中广泛存在的萝卜硫素(sulforaphane,SFP)是一种有效的天然ARE活化剂,Hu等[56]基于质谱数据的相关研究显示,SFP对Keap1蛋白的修饰作用主要是通过Cys-115位点实现的。此外,槲皮素能通过对Keap1蛋白多个位点的修饰作用,促进Nrf2与Keap1的解离,进而激活Nrf2-ARE通路[57]。而Keap1非依赖的调控通路中,植物化学物质可以通过对细胞内的激酶通路、转录因子和表观遗传修饰因子的调节而调控Nrf2的激活。白藜芦醇、木犀草素、原花青素B2、SFP、EGCG和表儿茶素等植物化学物质可以通过对ERK、p38、JNK以及PI3K等激酶的激活调节Nrf2信号通路,发挥抗氧化功效[58]。Jun二聚体蛋白2(Jun dimerization protein 2,JDP2)也是一种亮氨酸拉链家族转录因子,能够在SFP的诱导下促进Nrf2-ARE通路的活化[59]。此外,在小鼠前列腺癌模型中,SFP、蒿本内酯和姜黄素等能够抑制DNA甲基转移酶和组蛋白去乙酰化酶的表达,介导Nrf2启动子的去甲基化以及Nrf2的再激活[60-61]。
3.2 NF-κBNF-κB属于Rel蛋白转录因子家族,是炎症反应调节的核心蛋白,能够调控多种炎症因子的产生,其上游调节蛋白包括TAK1、NF-κB诱导激酶(NF-κB inducing kinase,NIK)、IKK复合物以及核因子-κB抑制剂(inhibitor of nuclear factor-κB,IκB)等。植物化学物质对炎症反应的调节作用多是通过对NF-κB及其上游蛋白的调节而实现。植物化学物质中某些黄酮、木脂素、萜类和生物碱类物质具有TNF-α抑制剂功效,这一功能的实现可能是基于对NF-κB信号通路的调节。Castro等[62]研究表明染料木素能够通过抑制NF-κB的激活抑制TNF-α的表达,桉叶素和木兰脂素则能通过抑制NF-κB通路抑制由LPS诱导的TNF-α的表达[63]。白前提取物中的萜类组分能够通过抑制ERK和NF-κB信号通路,进而抑制吞噬细胞的活化[64]。而在HBE16支气管上皮细胞中,烟碱通过抑制MyD88蛋白的表达,抑制IκBα的表达,最终引起NF-κB活性的降低,从而抑制炎症因子的表达[65]。此外,在NF-κB信号通路中IKK复合体也是众多植物化学物质的靶点蛋白,通过抑制该复合体的激活发挥抗炎抗肿瘤功效。小白菊内酯能够靶向IKK复合体抑制NF-κB信号通路[66]。另外,雷公藤红素和蟛蜞菊内酯都是IKK复合体的抑制剂,而研究显示这2种抑制剂均能通过抑制上游激酶对IKK复合体磷酸化作用,抑制W256细胞的增殖和转移[67]。
3.3 p53p53基因是一种抑癌基因,其蛋白可以作为转录因子,通过对细胞周期、DNA修复和细胞凋亡等重要过程的调节介导癌细胞生长的停滞与凋亡。p53的调节信号主要来自于2大类激酶,分别是MAPK和DNA损伤相关激酶。植物化学物质的抗肿瘤作用多与p53信号的激活相关。白叶藤碱是拓扑异构酶的抑制剂,可以直接与DNA结合,引起DNA损伤。Pal等[68]研究显示在非黑素瘤性皮肤癌(non melanoma skin cancer,NMSC)细胞中,白叶藤碱可通过引起DNA损伤以激活p53信号,造成细胞生长的抑制。共济失调毛细血管扩张突变基因(ataxia telangiectasia-mutated gene,ATM)属于PI3K基因家族成员,ATM蛋白的激活能够介导p53的磷酸化活化,导致细胞周期的停滞。ATM的激活是植物化学物质抗肿瘤作用的一个重要方面,白藜芦醇、EGCG、姜黄素、棕矢车菊素、葫芦素、芹菜素和染料木素等能够于不同的癌细胞中激活ATM[69]。此外,鼠双微体(murine double minute 2,MDM2)蛋白是一种E3泛素连接蛋白,其核心疏水区含有与p53互作的结合位点,能够影响p53的转录活性和稳定性。因此,在进行p53激动剂筛选时可利用MDM2蛋白的核心疏水结构,获取p53的竞争性激活剂。Riaz等[70]在植物化学物质数据库中通过靶向MDM2蛋白进行了p53-MDM2结合潜在抑制剂的筛选,发现ECGC等4种植物化学物质可与MDM2疏水结构结合,是p53的潜在激活剂。
4 核受体激活调节模式核受体是动物体内含量最丰富、配体依赖的转录调节因子之一,它们在新陈代谢、性别决定与分化、生殖发育和稳态的维持等方面发挥着重要的功能。依据配体的类型不同,核受体可以分为类固醇激素受体、非类固醇激素受体和孤儿核受体,包括肝X受体(liver X receptor,LXR)、类视黄醇受体(retinoid X receptor,RXR)、过氧化物酶体增殖体激活受体(peroxisome proliferator-activated receptor,PPAR)和法尼醇X受体(farnesoid X receptor,FXR)等受体都是研究较为广泛的核受体。核受体的功能障碍将导致一系列疾病如癌症、不育、肥胖、糖尿病等,因此其功能调节机制和配体的探索对营养与代谢功能的维持具有重要的意义。目前研究认为某些植物化学物质可以作为配体直接与核受体结合,或间接影响核受体的活性,进而参与细胞功能的调节。试验表明:大豆黄酮中雌马酚、大豆黄素等是雌激素受体(estrogen receptor,ER)的激活剂,而植物雌激素葛根素也可以通过ER调节PI3K的磷酸化激活,并经由Nrf2调节HO-1的表达[71]。Rinwa等[72]研究发现姜黄素能够刺激阿尔茨海默病(Alzheimer’s disease, AD)小鼠的抗炎症反应,并且这种促进作用在加入PPARγ受体拮抗剂后被阻断,表明PPARγ受体对姜黄素的抗炎症反应是必须的。同样,淫羊藿苷可以减少自噬,增加FXR表达且能被FXR的抑制剂所阻断,表明淫羊藿苷对自噬的调节与FXR有关[73]。此外,也有研究显示槲皮素、白藜芦醇和姜黄素都能作为芳香烃受体的间接激活剂[27]。植物化学物质可以作为核受体的来源,但利用植物提取物作为核受体的研究依然较少,同时,相较于化学合成的配体,目前发现的可作用于核受体的植物化学物质的活性依然较低。
5 小结植物化学物质是药物与添加剂产品的良好来源,其天然无污染、安全高效的特性成为药物和饲料资源开发的热点。我国具有2 000多年使用植物药物的历史,积累了大量的实践经验和知识,然而因为科学归纳和整合的缺乏,这其中也存在着大量的缺漏和误判。随着植物化学物质在通路调节、营养代谢中功能研究的不断深入,植物化学物质及其调控靶基因正在逐渐成为畜禽健康调节和药物预测与筛选的新靶点,这为新型饲用添加剂的开发及精细化的畜禽营养和疾病调控策略的制定提供了新思路,具有重要的理论研究价值和应用前景。
| [1] |
KOTECHA R, TAKAMI A, ESPINOZA J L. Dietary phytochemicals and cancer chemoprevention:a review of the clinical evidence[J]. Oncotarget, 2016, 7(32): 52517-52529. |
| [2] |
HAUSER A S, ATTWOOD M M, RASK-ANDERSEN M, et al. Trends in GPCR drug discovery:new agents, targets and indications[J]. Nature Reviews Drug Discovery, 2017, 16(12): 829-842. DOI:10.1038/nrd.2017.178 |
| [3] |
WETTSCHURECK N, OFFERMANNS S. Mammalian G proteins and their cell type specific functions[J]. Physiological Reviews, 2005, 85(4): 1159-1204. DOI:10.1152/physrev.00003.2005 |
| [4] |
ISHⅡ I, IZUMI T, TSUKAMOTO H, et al. Alanine exchanges of polar amino acids in the transmembrane domains of a platelet-activating factor receptor generate both constitutively active and inactive mutants[J]. The Journal of Biological Chemistry, 1997, 272(12): 7846-7854. DOI:10.1074/jbc.272.12.7846 |
| [5] |
陈泽乃. 药用植物中抗血小板活化因子成分的研究进展[J]. 中国中药杂志, 1993, 18(6): 323-326. DOI:10.3321/j.issn:1001-5302.1993.06.004 |
| [6] |
SWAMINATHAN M, CHEE C F, CHIN S P, et al. Flavonoids with M1 muscarinic acetylcholine receptor binding activity[J]. Molecules, 2014, 19(7): 8933-8948. DOI:10.3390/molecules19078933 |
| [7] |
MOLCHAN S E, MARTINEZ R A, HILL J L, et al. Increased cognitive sensitivity to scopolamine with age and a perspective on the scopolamine model[J]. Brain Research Reviews, 1992, 17(3): 215-226. DOI:10.1016/0165-0173(92)90017-G |
| [8] |
CAMERINO D C, DESAPHY J F, TRICARICO D, et al. Therapeutic approaches to ion channel diseases[J]. Advances in Genetics, 2008, 64: 81-145. DOI:10.1016/S0065-2660(08)00804-3 |
| [9] |
KOOLA M M, BUCHANAN R W, PILLAI A, et al. Potential role of the combination of galantamine and memantine to improve cognition in schizophrenia[J]. Schizophrenia Research, 2014, 157(1/2/3): 84-89. |
| [10] |
KYSENIUS K, BRUNELLO C A, HUTTUNEN H J. Mitochondria and NMDA receptor-dependent toxicity of berberine sensitizes neurons to glutamate and rotenone injury[J]. PLoS One, 2014, 9(9): e107129. DOI:10.1371/journal.pone.0107129 |
| [11] |
HUANG X, CHEN H, MICHELSEN K, et al. Crystal structure of human glycine receptor-α3 bound to antagonist strychnine[J]. Nature, 2015, 526(7572): 277-280. DOI:10.1038/nature14972 |
| [12] |
PARAMASHIVAM S K, ELAYAPERUMAL K, NATARAJAN B B, et al. In silico pharmacokinetic and molecular docking studies of small molecules derived from Indigofera aspalathoides Vahl targeting receptor tyrosine kinases[J]. Bioinformation, 2015, 11(2): 73-84. DOI:10.6026/bioinformation |
| [13] |
LEE L T, HUANG Y T, HWANG J J, et al. Blockade of the epidermal growth factor receptor tyrosine kinase activity by quercetin and luteolin leads to growth inhibition and apoptosis of pancreatic tumor cells[J]. Anticancer Research, 2002, 22(3): 1615-1627. |
| [14] |
GANUGAPATI J, MUKKAVALLI S. Docking studies of green tea flavonoids as insulin mimetics[J]. International Journal of Computer Applications, 2013, 30(4): 48-52. |
| [15] |
WAN D Q, WANG C D, QU X H, et al. Chimaphilin inhibits proliferation and induces apoptosis in multidrug resistant osteosarcoma cell lines through insulin-like growth factor-Ⅰ receptor (IGF-ⅠR) signaling[J]. Chemico-Biological Interactions, 2015, 237: 25-30. DOI:10.1016/j.cbi.2015.05.008 |
| [16] |
SCHEPETKIN I A, QUINN M T. Botanical polysaccharides:macrophage immunomodulation and therapeutic potential[J]. International Immunopharmacology, 2006, 6(3): 317-333. DOI:10.1016/j.intimp.2005.10.005 |
| [17] |
章超群, 武晓旭, 吴永贵, 等. 白芍总苷对糖尿病大鼠肾组织Toll样受体信号通路调节的研究[J]. 中国药理学通报, 2014, 30(3): 354-359. DOI:10.3969/j.issn.1001-1978.2014.03.014 |
| [18] |
彭丽娜.以Toll样受体为靶标分子的抗感染中药成分筛选方法的建立[D].硕士学位论文.福州: 福建农林大学, 2010: 41-62. http://cdmd.cnki.com.cn/Article/CDMD-10389-2010181705.htm
|
| [19] |
朱海涛.TLR4在创伤性脑损伤急性炎症损伤中的作用机制及姜黄素的保护效应研究[D].博士学位论文.重庆: 第三军医大学, 2016: 53-72. http://cdmd.cnki.com.cn/Article/CDMD-90031-1016277494.htm
|
| [20] |
MAHONEY K M, RENNERT P D, FREEMAN G J. Combination cancer immunotherapy and new immunomodulatory targets[J]. Nature Reviews Drug Discovery, 2015, 14(8): 561-584. DOI:10.1038/nrd4591 |
| [21] |
IQBAL M, VERPOORTE R, KORTHOUT H A A J, et al. Phytochemicals as a potential source for TNF-α inhibitors[J]. Phytochemistry Reviews, 2013, 12(1): 65-93. |
| [22] |
陈明亮, 易龙, 金鑫, 等.白藜芦醇对TNF-α诱导的血管内皮细胞炎性反应的影响及机制研究[C]//2012第二届中韩植物化学物国际学术研讨会论文集.北京: 中国营养学会, 2012: 1-2. http://www.wanfangdata.com.cn/details/detail.do?_type=conference&id=8550221
|
| [23] |
YU R, CHEN C, MO Y Y, et al. Activation of mitogen-activated protein kinase pathways induces antioxidant response element-mediated gene expression via a Nrf2-dependent mechanism[J]. The Journal of Biological Chemistry, 2000, 275(51): 39907-39913. DOI:10.1074/jbc.M004037200 |
| [24] |
HAN S B, YOON Y D, AHN H J, et al. Toll-like receptor-mediated activation of B cells and macrophages by polysaccharide isolated from cell culture of Acanthopanax senticosus[J]. International Immunopharmacology, 2003, 3(9): 1301-1312. DOI:10.1016/S1567-5769(03)00118-8 |
| [25] |
HOU X L, TONG Q, WANG W Q, et al. Suppression of inflammatory responses by dihydromyricetin, a flavonoid from Ampelopsis grossedentata, via inhibiting the activation of NF-κB and MAPK signaling pathways[J]. Journal of Natural Products, 2015, 78(7): 1689-1696. DOI:10.1021/acs.jnatprod.5b00275 |
| [26] |
CHEN M C, YE Y Y, JI G, et al. Hesperidin upregulates heme oxygenase-1 to attenuate hydrogen peroxide-induced cell damage in hepatic L02 cells[J]. Journal of Agricultural and Food Chemistry, 2010, 58(6): 3330-3335. DOI:10.1021/jf904549s |
| [27] |
MOHAMMADI-BARDBORI A, BENGTSSON J, RANNUG U, et al. Quercetin, resveratrol, and curcumin are indirect activators of the aryl hydrocarbon receptor (AHR)[J]. Chemical Research in Toxicology, 2012, 25(9): 1878-1884. DOI:10.1021/tx300169e |
| [28] |
RODRÍGUEZ-RAMIRO I, RAMOS S, BRAVO L, et al. Procyanidin B2 induces Nrf2 translocation and glutathione S-transferase P1 expression via ERKs and p38-MAPK pathways and protect human colonic cells against oxidative stress[J]. European Journal of Nutrition, 2012, 51(7): 881-892. DOI:10.1007/s00394-011-0269-1 |
| [29] |
LEE S E, JEONG S I, YANG H N, et al. Fisetin induces Nrf2-mediated HO-1 expression through PKC-δ and p38 in human umbilical vein endothelial cells[J]. Journal of Cellular Biochemistry, 2011, 112(9): 2352-2360. DOI:10.1002/jcb.v112.9 |
| [30] |
YAO P, NUSSLER A, LIU L G, et al. Quercetin protects human hepatocytes from ethanol-derived oxidative stress by inducing heme oxygenase-1 via the MAPK/Nrf2 pathways[J]. Journal of Hepatology, 2007, 47(2): 253-261. DOI:10.1016/j.jhep.2007.02.008 |
| [31] |
CALDERON-MONTANO J M, BURGOS-MORON E, PEREZ-GUERRERO C, et al. A review on the dietary flavonoid kaempferol[J]. Mini-Reviews in Medicinal Chemistry, 2011, 11(4): 298-344. DOI:10.2174/138955711795305335 |
| [32] |
THORPE L M, YUZUGULLU H, ZHAO J J. PI3K in cancer:divergent roles of isoforms, modes of activation and therapeutic targeting[J]. Nature Reviews Cancer, 2015, 15(1): 7-24. DOI:10.1038/nrc3860 |
| [33] |
CROSS D A E, ALESSI D R, COHEN P, et al. Inhibition of glycogen synthase kinase-3 by insulin mediated by protein kinase B[J]. Nature, 1995, 378(6559): 785-789. DOI:10.1038/378785a0 |
| [34] |
JEONG A, LEE H J, JEONG S J, et al. Compound K inhibits basic fibroblast growth factor-induced angiogenesis via regulation of p38 mitogen activated protein kinase and AKT in human umbilical vein endothelial cells[J]. Biological & Pharmaceutical Bulletin, 2010, 33(6): 945-950. |
| [35] |
KIM Y S, FARRAR W, COLBURN N H, et al. Cancer stem cells:potential target for bioactive food components[J]. The Journal of Nutritional Biochemistry, 2012, 23(7): 691-698. DOI:10.1016/j.jnutbio.2012.03.002 |
| [36] |
LIM J H, PARK H S, CHOI J K, et al. Isoorientin induces Nrf2 pathway-driven antioxidant response through phosphatidylinositol 3-kinase signaling[J]. Archives of Pharmacal Research, 2007, 30(12): 1590-1598. DOI:10.1007/BF02977329 |
| [37] |
ZHANG R, CHAE S, LEE J H, et al. The cytoprotective effect of butin against oxidative stress is mediated by the up-regulation of manganese superoxide dismutase expression through a PI3K/Akt/Nrf2-dependent pathway[J]. Journal of Cellular Biochemistry, 2012, 113(6): 1987-1997. DOI:10.1002/jcb.v113.6 |
| [38] |
VILLARINO A V, KANNO Y, O'SHEA J J. Mechanisms and consequences of Jak-STAT signaling in the immune system[J]. Nature Immunology, 2017, 18(4): 374-384. DOI:10.1038/ni.3691 |
| [39] |
JATIANI S S, BAKER S J, SILVERMAN L R, et al. JAK/STAT pathways in cytokine signaling and myeloproliferative disorders:approaches for targeted therapies[J]. Genes & Cancer, 2010, 1(10): 979-993. |
| [40] |
THOMAS S J, SNOWDEN J A, ZEIDLER M P, et al. The role of JAK/STAT signalling in the pathogenesis, prognosis and treatment of solid tumours[J]. British Journal of Cancer, 2015, 113(3): 365-371. DOI:10.1038/bjc.2015.233 |
| [41] |
GAO F, WEI D, BIAN T, et al. Genistein attenuated allergic airway inflammation by modulating the transcription factors T-bet, GATA-3 and STAT-6 in a murine model of asthma[J]. Pharmacology, 2012, 89(3-4): 229-236. DOI:10.1159/000337180 |
| [42] |
SENGGUNPRAI L, KUKONGVIRIYAPAN V, PRAWAN A, et al. Quercetin and EGCG exhibit chemopreventive effects in cholangiocarcinoma cells via suppression of JAK/STAT signaling pathway[J]. Phytotherapy Research, 2014, 28(6): 841-848. DOI:10.1002/ptr.v28.6 |
| [43] |
SONG Y X, ZENG Z Y, JIN C Y, et al. Protective effect of ginkgolide B against acute spinal cord injury in rats and its correlation with the Jak/STAT signaling pathway[J]. Neurochemical Research, 2013, 38(3): 610-619. DOI:10.1007/s11064-012-0959-y |
| [44] |
WOODS A, JOHNSTONE S R, DICKERSON K, et al. LKB1 is the upstream kinase in the AMP-activated protein kinase cascade[J]. Current Biology, 2003, 13(22): 2004-2008. DOI:10.1016/j.cub.2003.10.031 |
| [45] |
HAWLEY S A, PAN D A, MUSTARD K J, et al. Calmodulin-dependent protein kinase kinase-β is an alternative upstream kinase for AMP-activated protein kinase[J]. Cell Metabolism, 2005, 2(1): 9-19. DOI:10.1016/j.cmet.2005.05.009 |
| [46] |
CHE Y Y, WANG Q H, XIAO R Y, et al. Kudinoside-D, a triterpenoid saponin derived from Ilex kudingcha suppresses adipogenesis through modulation of the AMPK pathway in 3T3-L1 adipocytes[J]. Fitoterapia, 2018, 125: 208-216. DOI:10.1016/j.fitote.2017.11.018 |
| [47] |
LIOU C J, LAI X Y, CHEN Y L, et al. Ginkgolide C suppresses adipogenesis in 3T3-L1 adipocytes via the AMPK signaling pathway[J]. Evidence-Based Complementary and Alternative Medicine, 2015, 2015: 298635. |
| [48] |
JANG Y J, KOO H J, SOHN E H, et al. Theobromine inhibits differentiation of 3T3-L1 cells during the early stage of adipogenesis via AMPK and MAPK signaling pathways[J]. Food & Function, 2015, 6(7): 2365-2374. |
| [49] |
CHEN Y Y, LEE M H, HSU C C, et al. Methyl cinnamate inhibits adipocyte differentiation via activation of the CaMKK2-AMPK pathway in 3T3-L1 preadipocytes[J]. Journal of Agricultural and Food Chemistry, 2012, 60(4): 955-963. DOI:10.1021/jf203981x |
| [50] |
HE Y, LI Y, ZHAO T, et al. Ursolic acid inhibits adipogenesis in 3T3-L1 adipocytes through LKB1/AMPK pathway[J]. PLoS One, 2013, 8(7): e70135. DOI:10.1371/journal.pone.0070135 |
| [51] |
SHAO J J, ZHANG A P, QIN W, et al. AMP-activated protein kinase (AMPK) activation is involved in chrysin-induced growth inhibition and apoptosis in cultured A549 lung cancer cells[J]. Biochemical and Biophysical Research Communications, 2012, 423(3): 448-453. DOI:10.1016/j.bbrc.2012.05.123 |
| [52] |
ZHANG H T, LI N, WU J, et al. Galangin inhibits proliferation of HepG2 cells by activating AMPK via increasing the AMP/TAN ratio in a LKB1-independent manner[J]. European Journal of Pharmacology, 2013, 718(1/2/3): 235-244. |
| [53] |
WU J J, XU X S, YI L, et al. Quercetin, luteolin and epigallocatechin gallate alleviate TXNIP and NLRP3-mediated inflammation and apoptosis with regulation of AMPK in endothelial cells[J]. European Journal of Pharmacology, 2014, 745: 59-68. DOI:10.1016/j.ejphar.2014.09.046 |
| [54] |
KASPAR J W, NITURE S K, JAISWAL A K. Antioxidant-induced INrf2(Keap1) tyrosine 85 phosphorylation controls the nuclear export and degradation of the INrf2-Cul3-Rbx1 complex to allow normal Nrf2 activation and repression[J]. Journal of Cell Science, 2012, 125: 1027-1038. DOI:10.1242/jcs.097295 |
| [55] |
KANG M I, KOBAYASHI A, WAKABAYASHI N, et al. Scaffolding of Keap1 to the actin cytoskeleton controls the function of Nrf2 as key regulator of cytoprotective phase 2 genes[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(7): 2046-2051. DOI:10.1073/pnas.0308347100 |
| [56] |
HU C Q, EGGLER A L, MESECAR A D, et al. Modification of Keap1 cysteine residues by sulforaphane[J]. Chemical Research in Toxicology, 2011, 24(2): 515-521. |
| [57] |
TANIGAWA S, FUJⅡ M, HOU D X. Action of Nrf2 and Keap1 in ARE-mediated NQO1 expression by quercetin[J]. Free Radical Biology and Medicine, 2007, 42(11): 1690-1703. DOI:10.1016/j.freeradbiomed.2007.02.017 |
| [58] |
QIN S, HOU D X. The biofunctions of phytochemicals and their applications in farm animals:the Nrf2/Keap1 system as a target[J]. Engineering, 2017, 3(5): 738-752. DOI:10.1016/J.ENG.2017.03.011 |
| [59] |
TANIGAWA S, LEE C H, LIN C S, et al. Jun dimerization protein 2 is a critical component of the Nrf2/MafK complex regulating the response to ROS homeostasis[J]. Cell Death & Disease, 2014, 4(11): e921. |
| [60] |
KHOR T O, HUANG Y, WU T Y, et al. Pharmacodynamics of curcumin as DNA hypomethylation agent in restoring the expression of Nrf2 via promoter CpGs demethylation[J]. Biochemical Pharmacology, 2011, 82(9): 1073-1078. DOI:10.1016/j.bcp.2011.07.065 |
| [61] |
SHANKAR S, KUMAR D, SRIVASTAVA R K. Epigenetic modifications by dietary phytochemicals:implications for personalized nutrition[J]. Pharmacology & Therapeutics, 2013, 138(1): 1-17. |
| [62] |
CASTRO S B R, JUNIOR C O R, ALVES C C S, et al. Synthesis of lipophilic genistein derivatives and their regulation of IL-12 and TNF-α in activated J774A.1 cells[J]. Chemical Biology & Drug Design, 2012, 79(3): 347-352. |
| [63] |
KIM J Y, LIM H J, LEE D Y, et al. In vitro anti-inflammatory activity of lignans isolated from Magnolia fargesii[J]. Bioorganic & Medicinal Chemistry Letters, 2009, 19(3): 937-940. |
| [64] |
LIU J X, TANG J S, ZUO Y H, et al. Stauntoside B inhibits macrophage activation by inhibiting NF-κB and ERK MAPK signalling[J]. Pharmacological Research, 2016, 111: 303-315. DOI:10.1016/j.phrs.2016.06.022 |
| [65] |
LI Q, ZHOU X D, KOLOSOV V P, et al. Nicotine reduces TNF-α expression through a α7 nAChR/MyD88/NF-κB pathway in HBE16 airway epithelial cells[J]. Cellular Physiology and Biochemistry, 2011, 27(5): 605-612. DOI:10.1159/000329982 |
| [66] |
HEHNER S P, HOFMANN T G, DRÖGE W, et al. The antiinflammatory sesquiterpene lactone parthenolide inhibits NF-kappa B by targeting the I kappa B kinase complex[J]. Journal of Immunology, 1999, 163(10): 5617-5623. |
| [67] |
IDRIS A I, LIBOUBAN H, NYANGOGA H, et al. Pharmacologic inhibitors of IkappaB kinase suppress growth and migration of mammary carcinosarcoma cells in vitro and prevent osteolytic bone metastasis in vivo[J]. Molecular Cancer Therapeutics, 2009, 8(8): 2339-2347. DOI:10.1158/1535-7163.MCT-09-0133 |
| [68] |
PAL H C, KATIYAR S K. Cryptolepine, a plant alkaloid, inhibits the growth of non-melanoma skin cancer cells through inhibition of topoisomerase and induction of DNA damage[J]. Molecules, 2016, 21(12): E1758. DOI:10.3390/molecules21121758 |
| [69] |
FAROOQI A A, WU S J, CHANG Y T, et al. Activation and inhibition of ATM by phytochemicals:awakening and sleeping the guardian angel naturally[J]. Archivum Immunologiae et Therapiae Experimentalis, 2015, 63(5): 357-366. DOI:10.1007/s00005-015-0346-x |
| [70] |
RIAZ M, ASHFAQ U A, QASIM M, et al. Screening of medicinal plant phytochemicals as natural antagonists of p53-MDM2 interaction to reactivate p53 functioning[J]. Anti-cancer Drugs, 2017, 28(9): 1032-1038. DOI:10.1097/CAD.0000000000000548 |
| [71] |
HWANG Y P, JEONG H G. Mechanism of phytoestrogen puerarin-mediated cytoprotection following oxidative injury:estrogen receptor-dependent up-regulation of PI3K/Akt and HO-1[J]. Toxicology and Applied Pharmacology, 2008, 233(3): 371-381. DOI:10.1016/j.taap.2008.09.006 |
| [72] |
RINWA P, KAUR B, JAGGI A S, et al. Involvement of PPAR-gamma in curcumin-mediated beneficial effects in experimental dementia[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2010, 381(6): 529-539. DOI:10.1007/s00210-010-0511-z |
| [73] |
杨如会, 刘丙进, 吴松泉. 淫羊藿苷通过FXR降低LPS/TLR4诱导的肝星状细胞自噬和活化[J]. 中国药学杂志, 2016, 51(9): 708-714. |




