2. 四川农业大学动物科技学院, 成都 611130
2. College of Animal Science and Technology, Sichuan Agricultural University, Chengdu 611130, China
早在1958年,人们就发现了饮水对猪生长发育的重要性[1]。水作为一种重要的营养素,广泛参与了机体的各种生理生化功能,在体温调节、消化道发育、泌尿系统健康等方面,水起了至关重要的作用[2],遗憾的是,目前对水的营养的研究较少。在规模化养殖中,为了保障猪场的高效运转,良好的饮水管理,如水质控制、饮水器选择等就显得至关重要,而关于饮水温度(DWT)和流速(DWF)等方面参数常被忽略。研究发现,低温环境下给猪直接饮用冷水,会引起猪的冷应激,使生长性能下降,造成巨大经济损失[3]。而适当提高DWT,可在一定程度上改善猪的生长性能,但同时也带来了用水量的上升[4],加重了我国目前的水资源压力[5],同时,适宜DWT改善仔猪生长性能的有关机理也尚未探明。此外,Li等[6]研究发现,不同的DWF对生长育肥猪的用水总量、饮水实际摄入量和水浪费量等都有影响。但我国多数猪场未对DWF加以控制,造成了水资源的浪费。因此,本试验旨在通过研究DWT和DWF对断奶仔猪应激、生长性能、用水量和养分表观消化率等的影响,从DWT和DWF方面探究如何达到节约成本、提高养猪效益的目的,为现代养猪业的饮水系统的升级换代和高效利用提供依据。
1 材料与方法 1.1 试验设计和饲粮采用2×2二因子试验设计,DWT为13 ℃(实测自来水温度平均值)和30 ℃(参照Vajrabukka等[7]设定),DWF为300 mL/min(参照Barber等[8]设定)和700 mL/min(参照Leibbrandt等[9]设定)。选取平均体重为(8.60±0.50) kg的30日龄“杜×长×大”断奶仔猪64头,按体重、性别比例一致的原则分为4组,各组DWT和DWF分别为13 ℃+300 mL/min、13 ℃+700 mL/min、30 ℃+300 mL/min、30 ℃+700 mL/min,每组4个重复,每个重复4头猪,试验期共28 d。所有组均采用玉米-豆粕型饲粮,饲粮参照NRC(2012)猪营养需要和我国《猪饲养标准》(NY/T 65—2004)进行配制,基础饲粮组成及营养水平见表 1。试验期间各组饲粮一致。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验期间仔猪自由采食,自由饮水。试验期间圈舍温度控制在8~17 ℃,相对湿度控制在55%~65%。其他免疫、消毒等按猪场常规饲养管理程序进行。
1.3 饮水管理DWT为30 ℃组采用空气能热水器供给饮水,热水器拥有恒温控制单元,于饮水末端加装实时电子温度感应器,当检测到DWT低于预设温度时,水被抽回重新加热,从而可以保证持续提供30 ℃温水;DWT为13 ℃组采用自来水直接供给,试验期间实测其平均温度为13 ℃。DWF调节通过加压泵和截止阀共同实现:在空气能饮水器出水口安装加压泵,使饮水长期保持恒定压力,并且在饮水乳头上游15 cm处加装截止阀门,通过调整截止阀门来控制DWF。
1.4 样品采集饲粮及粪样的采集:试验末期连续4 d收集饲粮样品和粪样。鲜粪每100 g加入10%盐酸10 mL以防止氨氮逸出,混匀后于-20 ℃保存待测。
血液样品的采集:于试验第14天和第28天的22:00统一对仔猪断水、断料,做禁食处理,第2天08:00,每重复选取1头平均体重的试验猪,共16头,前腔静脉采血10 mL,3 000 r/min离心15 min,取上层血清于EP管中,-20 ℃保存待测。
组织样品的采集:于试验第29天早上,对仔猪进行称重并记录后,每重复选取最接近平均体重的1头猪麻醉屠宰,不同猪只取相同位置的十二指肠、空肠、回肠样各5 cm,置于4%多聚甲醛溶液,4 ℃保存待测;取部分心脏、肝脏和胃,置于冻存管-80 ℃保存待测。
1.5 检测指标与方法 1.5.1 应激指标血清皮质醇含量及心脏、肝脏和胃中热应激蛋白70(Hsp70)含量均采用酶联免疫吸附测定(ELISA)试剂盒测定,试剂盒购自北京诚林生物技术有限公司。
1.5.2 生长性能和饮水摄入量生长性能:试验开始和结束时,对试验猪进行称重,计算试验期平均日增重(ADG)。以重复为单位记录喂料量,计算平均日采食量(ADFI)。根据ADG和ADFI计算料重比(F/G)。
饮水摄入量:每个圈的饮水乳头上方30 cm处加装精密水表,每日08:00读取1次水表,前后2 d读数之差即为当日的用水总量。每个圈的饮水乳头下方加装漏水收集盆,用以收集浪费水,每日对浪费水进行称重(kg),按1 : 1的比例换算成体积(L),即为浪费水量(L)。
饮水摄入量=用水总量-浪费水量。
1.5.3 肠道形态和养分表观消化率肠道形态:将固定的小肠组织经脱水、透明、包埋、切片、苏木精-伊红染色处理后于光学显微镜下观察,采用数码摄像显微镜(BA400Digital,麦克奥迪实业集团有限公司)采集切片图片,测量绒毛高度、隐窝深度,并计算绒毛高度/隐窝深度(V/C)[10]。每个样本观察3张非连续切片,每张切片选取3个完整、典型的绒毛视野,每个视野测定10个绒毛高度和隐窝深度,其平均值作为1个测定数据。
养分表观消化率:试验结束后,粪样65 ℃烘干,粉碎,同一重复的样混合,采用内源指示剂法测定其表观消化率。参照GB/T 6432—1994、GB/T 6433—2006和GB/T 6438—2007的方法对饲粮及粪中粗蛋白质、粗灰分、粗脂肪含量进行测定。参照张丽英[11]的方法对能量进行测定。饲粮及粪中的盐酸不溶灰分含量检测方法参照GB/T 23742—2009《饲料中盐酸不溶灰分的测定》。养分表观消化率的计算公式如下:

|
所有数据采用SPSS 21.0进行双因素方差分析和Duncan氏法多重比较,以P < 0.05为差异显著,数据均以平均值±标准误表示。
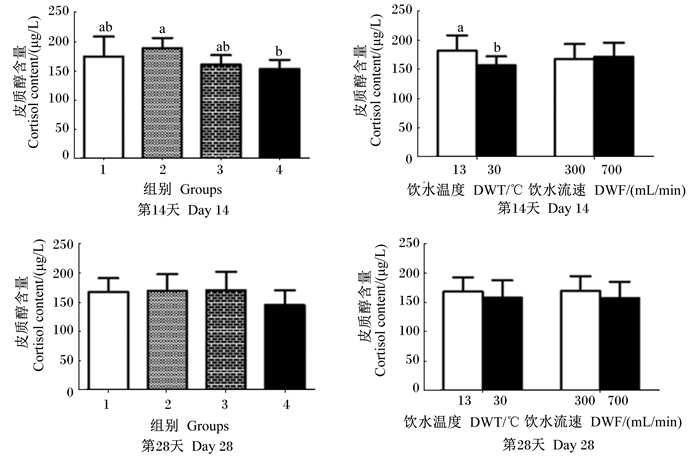
2 结果 2.1 DWT和DWF对断奶仔猪应激的影响由图 1可知,第14天时,13 ℃+700 mL/min组仔猪血清皮质醇含量显著高于30 ℃+700 mL/min组(P < 0.05),而其余各组间血清皮质醇含量差异不显著(P>0.05)。饮用30 ℃水使仔猪血清皮质醇含量显著降低(P < 0.05),DWF对血清皮质醇含量无显著影响(P>0.05);第28天时,4组间仔猪血清皮质醇含量无显著差异(P>0.05),DWT和DWF对仔猪血清皮质醇含量均无显著影响(P>0.05)。
|
1组group 1:13 ℃+300 mL/min;2组group 2:13 ℃+700 mL/min;3组group 3:30 ℃+300 mL/min;4组group 4:30 ℃+700 mL/min。下图同。The same as below. 数据柱标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 DWT和DWF对断奶仔猪血清皮质醇含量的影响 Fig. 1 Effects of DWT and DWF on serum cortisol content in weaned piglets |
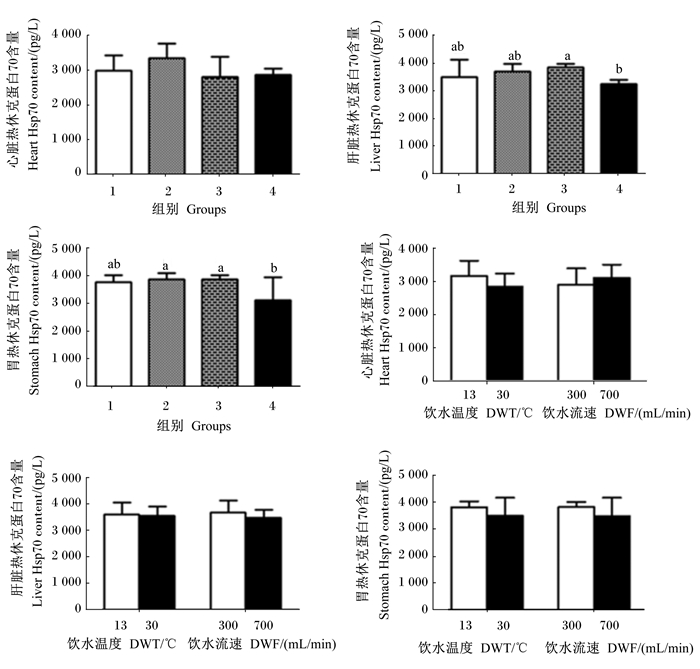
由图 2可知,4组间仔猪心脏Hsp70含量无显著差异(P>0.05)。30 ℃+700 mL/min组仔猪肝脏Hsp70含量显著低于30 ℃+300 mL/min组(P < 0.05)。30 ℃+700 mL/min组仔猪胃Hsp70含量显著低于13 ℃+700 mL/min组和30 ℃+300 mL/min组(P < 0.05)。
|
图 2 DWT和DWF对断奶仔猪组织中Hsp70含量的影响 Fig. 2 Effects of DWT and DWF on tissue Hsp70 content in weaned piglets |
DWT和DWF对仔猪心脏、肝脏、胃中Hsp70含量无显著影响(P>0.05)。但DWT和DWF对仔猪肝脏Hsp70含量有显著交互影响(P < 0.05):当饮用13 ℃水时,提高DWF使仔猪肝脏Hsp70含量有上升趋势,而饮用30 ℃水时,提高DWF使仔猪肝脏Hsp70含量有下降的趋势。
2.2 DWT和DWF对断奶仔猪生长性能和用水量的影响由表 2可知,30 ℃+300 mL/min组和30 ℃+700 mL/min组ADG显著高于13 ℃+700 mL/min组(P < 0.05);30 ℃+300 mL/min组和30 ℃+700 mL/min组F/G显著低于13 ℃+700 mL/min组(P < 0.05);30 ℃+300 mL/min组和30 ℃+700 mL/min组腹泻率显著低于13 ℃+300 mL/min组和13 ℃+700 mL/min组;30 ℃+700 mL/min组用水总量和饮水摄入量显著高于13 ℃+300 mL/min组(P < 0.05)。
|
|
表 2 DWT和DWF对断奶仔猪生长性能和用水量的影响 Table 2 Effects of DWT and DWF on growth performance and water consumption in weaned piglets |
DWT显著影响ADG、F/G、腹泻率、用水总量和饮水摄入量(P < 0.05),对ADFI、浪费水量和浪费率无显著影响(P>0.05),DWT和DWF交互作用对生长性能和用水量指标均无显著影响(P>0.05)。
2.3 DWT和DWF对断奶仔猪小肠形态和养分消化率的影响由表 3可知,仔猪十二指肠绒毛高度、隐窝深度、V/C各组间无显著差异(P>0.05)。30 ℃+300 mL/min组和30 ℃+700 mL/min组仔猪空肠绒毛高度显著高于13 ℃+700 mL/min组(P < 0.05);30 ℃+300 mL/min组仔猪空肠V/C显著高于13 ℃+700 mL/min组(P < 0.05);仔猪空肠隐窝深度组间无显著差异(P>0.05)。13 ℃+700 mL/min组仔猪回肠绒毛高度显著高于13 ℃+300 mL/min组(P < 0.05);仔猪回肠隐窝深度和V/C组间差异均不显著(P>0.05)。
|
|
表 3 DWT和DWF对断奶仔猪小肠形态的影响 Table 3 Effects of DWT and DWF on intestinal morphology in weaned piglets |
DWT对仔猪十二指肠和回肠的绒毛高度、隐窝深度和V/C均无显著影响(P>0.05),可显著影响仔猪空肠绒毛高度和V/C(P < 0.05)。DWF对仔猪十二指肠和回肠绒毛高度、隐窝深度和V/C无显著影响(P>0.05),可显著影响仔猪空肠绒毛高度(P < 0.05)。DWT和DWF对仔猪小肠形态无显著交互作用(P>0.05)。
由表 4可知,30 ℃+300 mL/min组和30 ℃+700 mL/min组仔猪粗蛋白质表观消化率显著高于13 ℃+300 mL/min组和13 ℃+700 mL/min组(P < 0.05),30 ℃+300 mL/min组和30 ℃+700 mL/min组仔猪粗脂肪和能量表观消化率显著高于13 ℃+700 mL/min组(P < 0.05)。
|
|
表 4 DWT和DWF对断奶仔猪养分表观消化率的影响 Table 4 Effects of DWT and DWF on nutrient apparent digestibility in weaned piglets |
DWT对仔猪粗蛋白质、粗脂肪、能量表观消化率有显著影响(P < 0.05);DWF对仔猪粗蛋白质、粗灰分、粗脂肪和能量表观消化率无显著影响(P>0.05);DWT和DWF对仔猪养分表观消化率无显著交互作用(P>0.05)。
3 讨论 3.1 DWT和DWF对断奶仔猪应激的影响皮质醇是一种典型的、用来评价应激水平的重要指标[12]。有研究表明,在动物遭受冷应激后血清皮质醇含量会显著上升[13]。本试验中,第14天时,DWT对断奶仔猪血清皮质醇含量有显著影响,饮用30 ℃水使仔猪血清皮质醇含量显著降低了13.56%,说明冬天长期饮用13 ℃水已经对仔猪造成了较严重的冷应激,而给仔猪饮用30 ℃水则有助于缓解冷应激。第28天时,仔猪经过一定时间的生长发育,其对环境的适应能力得到提高,抵抗应激的能力得到加强,因此,DWT和DWF对仔猪血清皮质醇含量以及心脏、肝脏、胃组织中的Hsp70含量均无显著影响。Hsp70是一种高度保守内源性保护蛋白,细胞在遭受冷热应激时迅速表达,保护脏器免受冷应激引起的炎症损害[14]。近年来的研究发现,哺乳动物在遭受冷应激后,会激活Hsp70诱导的相关通路,以调节机体免受冷应激伤害[15]。本研究中,DWT和DWF对仔猪肝脏Hsp70含量有交互作用:当饮用13 ℃水时,仔猪肝脏Hsp70含量随DWF的提高而提高了5.42%,而在饮用30 ℃水时,肝脏Hsp70含量随DWF的升高而降低了15.29%。出现这种情况的原因可能是因为在饮用13 ℃水时,高DWF的水造成的冷应激更大,从而产生更多的Hsp70用以保护肝脏免受应激损伤;而饮用30 ℃水时,高DWF的水为仔猪提供了更多温水,从而缓解仔猪冷应激,使Hsp70分泌降低。综合来看,饮用30 ℃水有助于缓解冷应激,DWF对仔猪应激无显著影响。
3.2 DWT和DWF对断奶仔猪生长性能和用水量的影响断奶后仔猪的水源由温热的母乳变成了冷水,容易引起腹泻,影响生长发育。有报道指出,当水温低于猪的体温时,需要摄入额外的能量来使饮入的水升温[16]。Neinaber等[17]在5 ℃的环境温度下给断奶仔猪饮用30 ℃水,结果显示相比较于冷水,仔猪增重显著。本试验具有相似的结果,相比较于饮用13 ℃水,饮用30 ℃水使仔猪的腹泻率显著降低,ADG显著提高,F/G显著降低。给断奶仔猪饮用温水,仔猪可以将能量更多地用于满足其生长发育。同时饮用30 ℃水还提高了用水总量和饮水摄入量,而饮水摄入量的提高,又进一步促进了仔猪的生长发育。因此,饮用30 ℃水可以有效减少仔猪断奶后对寒冷环境的适应期,降低腹泻率,提高仔猪饮水摄入量,降低F/G,促进仔猪生长发育。
Leibbrandt等[9]指出,DWF对母猪和仔猪的生长性能也很重要[9]。Nienber等[17]研究表明,DWF对猪的影响效果与环境温度有关,在35 ℃的环境温度下,猪ADG随着DWF的升高而显著提高,而当环境温度为5 ℃时,ADG则随DWF的升高而显著降低。这提示DWT和DWF应该共同探讨,在本试验中,DWT和DWF对仔猪生长性能的影响效果类似于环境温度和DWF对生长性能的影响,当DWT为13 ℃时提高DWF使生长性能有所降低,而DWT为30 ℃时,提高DWF则对生长性能有促进作用。出现这种差异的原因可能是因为在寒冷的环境里,较高的DWF对仔猪造成了更强的冷应激,从而降低生长性能。从腹泻率和用水量来看,DWF对仔猪腹泻率、用水总量、饮水摄入量和浪费率均无显著影响。Fraser等[18]研究发现,母猪的饮水时间与DWF呈负相关,在降低DWF时,仔猪可能会通过提高饮水时间和频率来保证自身获得充足的饮水,因此饮水摄入量并未改变。Li等[6]研究指出,52.6~71.9 kg生长育肥猪的口腔最大可以直接饮用795 mL/min的水而使浪费率不超过10%,本试验中仔猪水浪费率均超过了25%,这可能是因为本试验中仔猪体重更小,口腔可直接饮用的DWF也远低于795 mL/min。本试验中,降低DWF使水浪费率有降低的趋势。因此将DWF降低到300 mL/min是可行的,并不会对断奶仔猪生长性能产生负面影响,同时还可以在一定程度上减少水的浪费率。
3.3 DWT和DWF对断奶仔猪肠道形态及养分表观消化率的影响肠道形态是衡量小肠健康状况的重要指标,其中绒毛高度与小肠消化吸收表面积密切相关,隐窝深度反映肠上皮细胞成熟率和分泌功能的强弱,V/C则反映小肠的消化吸收能力[19]。本试验中30 ℃+300 mL/min组和30 ℃+700 mL/min组仔猪空肠绒毛高度显著高于13 ℃+700 mL/min组,30 ℃+300 mL/min组仔猪空肠V/C显著高于13 ℃+700 mL/min组,这表明长期饮用13 ℃水对空肠肠道形态造成了损伤,饮用30 ℃水使空肠绒毛上皮细胞数量增多,改善了空肠肠道形态,有助于消化吸收,这与前面饮用30 ℃水有助于缓解应激、提高生长性能的结果相一致。当饮用13 ℃水时,提高DWF使仔猪空肠绒毛高度显著降低,这可能是因为在饮用冷水时,高DWF的冷水对仔猪空肠造成的应激更大,损伤更严重,这与前面的应激结果相一致。综合来说,DWT和DWF对仔猪十二指、回肠的肠道形态结构无显著影响,饮用30 ℃水可以显著改善空肠肠道形态结构,而提高DWF则对空肠的肠道形态造成了一定程度的损伤。小肠在养分的消化吸收利用过程中扮演了重要角色,养分大部分在小肠部位被消化吸收利用[20]。肠道的健康与养分消化率密切相关。饮用30 ℃水改善了肠道形态结构,这可能是饮用30 ℃水有助于提高断奶仔猪对粗蛋白质、粗脂肪和能量的表观消化率的原因之一。同时有研究表明,动物胃肠道中存在温度受体[21-22],因此对温度的改变较为敏感。有研究表明冷刺激可诱导近端胃产生反射性的收缩,而热刺激却能使之舒张[23]。给断奶仔猪饮用30 ℃水有缓解冷应激的效果,使胃更加舒张,减缓胃排空,使养分能够在胃肠道中有充足的时间被消化吸收利用,从而显著改善了断奶仔猪对粗蛋白质、粗脂肪、粗灰分表观消化率。此外,饮用30 ℃水给断奶仔猪提供了更多的能量,仔猪不必消耗过多的能量来维持体温,有助于提高仔猪对能量的消化利用率,可以将能量更多地用于生长发育,从而提高生长性能。DWF对断奶仔猪养分表观消化率无显著影响。
4 结论冬季低温环境下,饮用30 ℃的水有助于缓解断奶仔猪应激,改善肠道形态和养分消化率,从而提高生长性能;将DWF降低至300 mL/min不会对断奶仔猪生长性能造成影响,还可以在一定程度上减少水的浪费。
| [1] |
BARBER R S, BRAUDE R, MITCHELL K G. Water for the baconer[J]. Pig Farming, 1958, 6(1): 25. |
| [2] |
王美芝, 赵婉莹, 吴中红, 等. 不同饮水器保育猪用水总量及浪费水量对比试验[J]. 农业工程学报, 2017, 33(4): 242-247. |
| [3] |
谭磊.冬季饮水温度和环境富集对断奶仔猪生产性能、营养素利用、福利及行为的影响[D].硕士学位论文.重庆: 西南大学, 2009.
|
| [4] |
JEON J H, YEON S C, CHOI Y H, et al. Effects of chilled drinking water on the performance of lactating sows and their litters during high ambient temperatures under farm conditions[J]. Livestock Science, 2006, 105(1/2/3): 86-93. |
| [5] |
LIU J, SAVENIJE H H G. Food consumption patterns and their effect on water requirement in China[J]. Hydrology and Earth System Sciences, 2008, 12(3): 887-898. DOI:10.5194/hess-12-887-2008 |
| [6] |
LI Y Z, CHÉNARD L, LEMAY S P, et al. Water intake and wastage at nipple drinkers by growing-finishing pigs[J]. Journal of Animal Science, 2005, 83(6): 1413-1422. DOI:10.2527/2005.8361413x |
| [7] |
VAJRABUKKA C, THWAITES C J, FARRELL D J.Overcoming the effects of high temperature on pig growth[C]//RAAN Conference Proceedings.[s.l.]: [s.n.], 1981: 99-114.
|
| [8] |
BARBER J, BROOKS P H, CARPENTER J L.The effects of water delivery rate on the voluntary food intake, water use and performance of early-weaned pigs from 3 to 6 weeks of age[M]//FORBES J M, VARLEY M A, LAWRENCE T L J.The Voluntary Food Intake of Pigs.Scotland: British Society of Animal Production, 1989.
|
| [9] |
LEIBBRANDT V D, JOHNSTON L J, SHURSON G C, et al. Effect of nipple drinker water flow rate and season on performance of lactating swine[J]. Journal of Animal Science, 2001, 79(11): 2770-2775. DOI:10.2527/2001.79112770x |
| [10] |
SUN X, MCELROY A, WEBB K E, J r, et al. Broiler performance and intestinal alterations when fed drug-free diets[J]. Poultry Science, 2005, 84(8): 1294-1302. DOI:10.1093/ps/84.8.1294 |
| [11] |
张丽英. 饲料分析及饲料质量检测技术[M]. 4版.北京: 中国农业大学出版社, 2016.
|
| [12] |
YEAGER M P, GUYRE C A, SITES B D, et al. The stress hormone cortisol enhances interferon-υ-mediated proinflammatory responses of human immune cells[J]. Anesthesia & Analgesia, 2018, 127(2): 556-563. |
| [13] |
LEE P P, LIN Y H, CHEN M C, et al. Dietary administration of sodium alginate ameliorated stress and promoted immune resistance of grouper Epinephelus coioides under cold stress[J]. Fish & Shellfish Immunology, 2017, 65: 127-135. |
| [14] |
REN J Y, LIU C P, ZHAO D, et al. The role of heat shock protein 70 in oxidant stress and inflammatory injury in quail spleen induced by cold stress[J]. Environmental Science and Pollution Research, 2018, 25(21): 21011-21023. DOI:10.1007/s11356-018-2142-8 |
| [15] |
LIAN S, GUO J R, WANG L P, et al. Impact of prenatal cold stress on placental physiology, inflammatory response, and apoptosis in rats[J]. Oncotarget, 2017, 8(70): 115304-115314. |
| [16] |
National Research Council. Nutrient requirements of swine[M]. 10th ed.Washington D.C.: National Academy Press, 1998: 145.
|
| [17] |
NIENABER J A, HAHN G L. Effects of water flow restriction and environmental factors on performance of nursery-age pigs[J]. Journal of Animal Science, 1984, 59(6): 1423-1429. DOI:10.2527/jas1984.5961423x |
| [18] |
FRASER D, PATIENCE J F, PHILLIPS P A, et al.Water for pig-lets and lactating sows: quantity, quality and quandaries[M]//GARNSWORTHY P C, WISEMAN J.Recent Advances in Animal Nutrition.London: Butterworths, 1990: 137-160.
|
| [19] |
CASPARY W F. Physiology and pathophysiology of intestinal absorption[J]. The American Journal of Clinical Nutrition, 1992, 55(Suppl.1): 299S-308S. |
| [20] |
EL AIDY S, VAN DEN BOGERT B, KLEEREBEZEM M. The small intestine microbiota, nutritional modulation and relevance for health[J]. Current Opinion in Biotechnology, 2015, 32: 14-20. DOI:10.1016/j.copbio.2014.09.005 |
| [21] |
ROZSA Z, MATTILA J, JACOBSON E D. Substance P mediates a gastrointestinal thermoreflex in rats[J]. Gastroenterology, 1988, 95(2): 265-276. DOI:10.1016/0016-5085(88)90480-5 |
| [22] |
EL OUAZZANI T, MEI N. Electrophysiologic properties and role of the vagal thermoreceptors of lower esophagus and stomach of cat[J]. Gastroenterology, 1982, 83(5): 995-1001. |
| [23] |
VILLANOVA N, AZPIROZ F, MALAGELADA J R. Perception and gut reflexes induced by stimulation of gastrointestinal thermoreceptors in humans[J]. Journal of Physiology, 1997, 502(1): 215-222. |




