2. 德克萨斯州农工大学动物科学院, 大学城 77843;
3. 郑州新威营养技术有限公司, 郑州 450100
2. Department of Animal Science, Texas A & M University, College Station 77843, USA;
3. Zhengzhou Newwill Nutrition Technology Co., Ltd., Zhengzhou 450100, China
肠道不仅是机体消化和吸收养分的主要场所,也是机体最大的免疫器官[1]。养猪生产中,常通过早期断奶技术提高母猪繁殖效率。但受营养、环境和心理等因素的影响,仔猪在断奶后小肠绒毛高度明显下降或出现脱落,隐窝深度明显增加,营养物质吸收和吸收率下降,这影响仔猪的生长发育和健康,即所谓“断奶应激综合征”。因此,如何降低断奶应激对仔猪生产带来的不利影响一直是养猪生产中备受关注的热点问题。
谷氨酰胺是猪乳、羊水和组织中含量最为丰富的氨基酸,泌乳第28天时的猪乳中游离谷氨酰胺浓度可达3.4 mmol/L[2-3]。谷氨酰胺是肠道重要的能量底物,同时也是参与蛋白质合成和肠道损伤修复的重要氨基酸。Wu等[4]研究表明,在泌乳母猪饲粮中添加1%谷氨酰胺可提高母猪血液和乳中的谷氨酰胺水平,促进哺乳仔猪的生长。饲粮中67%的谷氨酰胺在小肠中被利用,以维持上皮细胞的增殖、更新和正常的肠屏障功能[4-5]。Wang等[6]研究发现,在断奶仔猪饲粮中添加1%谷氨酰胺可改善断奶仔猪小肠绒毛结构,提高肠上皮细胞间紧密连接蛋白的表达,减小肠上皮细胞的通透性。研究还发现,谷氨酰胺能够调节机体氧化还原稳态,减少猪肠上皮细胞的损伤和凋亡[7]。小麦水解蛋白(hydrolyzed wheat gluten, HWG)是小麦蛋白的水解产物,富含多种氨基酸和小肽,粗蛋白质含量可达80%,其中谷氨酰胺约占氨基酸总量的1/3[8]。已有研究发现,富含谷氨酰胺的小麦蛋白水解物能够改善葡聚糖硫酸钠引起的小鼠肠道炎症,增强肠上皮组织的抗氧化能力,缓解肠黏膜的损伤[9]。妊娠后期母猪饲粮中添加2%HWG能提高母猪血液氨基酸水平,调节胎盘组织中氨基酸和葡萄糖转运载体的表达,提高仔猪初生窝重和初生活仔窝重[10]。原伟伟等[11]研究表明,饲粮中添加3.3%HWG可显著提高断奶仔猪平均日增重,降低腹泻率,改善肠绒毛形态,缓解断奶应激造成的肠黏膜损伤。基于此,本试验旨在探讨在母猪妊娠后期和泌乳期饲粮中添加1%和2%HWG对母猪初乳中氨基酸和生长因子含量以及仔猪生长性能、肠绒毛结构、紧密连接蛋白和炎性细胞因子表达的影响,为其在母猪饲粮配制中的应用提供试验依据。
1 材料与方法 1.1 试验动物、分组与饲养管理本试验在河南银发牧业有限公司(新郑)完成。试验选用3~4胎次、预产期相近的妊娠第90天的约克夏母猪33头,随机分为3组,每组11个重复,每个重复1头猪,单独饲喂。参考NRC(2012)标准配制妊娠后期和泌乳期母猪基础饲粮,试验组母猪于妊娠第90天至泌乳第21天在基础饲粮中分别添加1%和2%HWG,所有饲粮均以丙氨酸和玉米淀粉进行等能等氮,并平衡赖氨酸、蛋氨酸、色氨酸和苏氨酸4种必需氨基酸水平。试验所用的HWG由郑州新威营养技术有限公司提供,饲粮组成及营养水平见表 1。母猪妊娠第90天至分娩前每日饲喂2次(06:00和14:00,3 kg/d),妊娠第107天将母猪转入彻底消毒的产房单体分娩栏内饲养。母猪分娩后第1~3天,每天饲喂基础饲粮或试验饲粮2 kg,从分娩第4天开始每天增加1 kg的饲喂量直到母猪达到最大采食量,自由采食,饲养管理按猪场日常管理程序进行。
|
|
表 1 饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of diets (DM basis) |
仔猪21日龄断奶后转至保育舍,于25日龄早上禁食2 h后,每组分别选取6头仔猪,前腔静脉采血后进行屠宰采样,分离并采集10 cm左右的十二指肠、空肠和回肠组织样品,其中2 cm肠道组织经4%多聚甲醛固定;其余样品液氮保存备用。母猪开始分娩4 h内,收集其前3对乳头的乳样8 mL左右,-20 ℃保存。
1.3 仔猪生长性能的测定以每头母猪为单位,记录仔猪初生窝重、14和21日龄的仔猪窝重,并计算仔猪平均体重和平均日增重。
1.4 初乳中生长因子分析将初乳样品置于冰上解冻,取2 mL全乳于离心管,置于4 ℃离心机中,3 000×g离心10 min,取中间层乳清。采用酶联免疫吸附法检测乳清中胰岛素、胰岛素样生长因子-Ⅰ和表皮生长因子含量,试剂盒均购于南京建成生物工程研究所。
1.5 血清生化指标的测定仔猪前腔静脉采血5 mL,室温静置1 h后,3 000×g离心10 min,取上清液于-20 ℃保存,用于生化指标检测,所有测定试剂盒均购于南京建成生物工程研究所。
1.6 肠道炎性细胞因子mRNA水平的测定肠道组织样品采用TRIpure试剂盒(艾德莱生物科技有限公司,北京)提取mRNA,通过核酸蛋白测定仪(IMPLEN,德国)测定各样品RNA浓度,反转录为cDNA(天根生化科技有限公司,北京),按照荧光定量PCR试剂盒说明书(天根生化科技有限公司,北京)进行扩增(7500 Real-Time PCR,Applied Biosystems,美国),目的基因和内参基因的引物序列见表 2。PCR反应体系为10 μL:cDNA模板1 μL,上、下游引物各0.3 μL(10 μmol/L),2×SuperReal Premix 5 μL,Rox染料0.2 μL,ddH2O补齐至10 μL。扩增反应程序如下:1)95 ℃预变性15 min;2)PCR反应,95 ℃变性10 s,60 ℃退火/延伸32 s,循环40次。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,采用2-ΔΔCt法进行目的基因mRNA相对表达量的计算[12]。
|
|
表 2 基因引物序列 Table 2 Gene primer sequences |
10%过硫酸铵:0.1 g过硫酸铵,ddH2O定容1 mL。10%十二烷基硫酸钠:50 g十二烷基硫酸钠,ddH2O定容500 mL,0.22 μm滤膜过滤,常温储存。30%丙烯酰胺溶液:30 g丙烯酰胺,ddH2O定容100 mL,0.45 μm滤膜过滤,4 ℃储存。按照常规方法配制5%浓缩胶和12%分离胶。电泳缓冲液:三羟甲基氨基甲烷(Tris-Base)3.03 g,甘氨酸14.4 g,十二烷基硫酸钠1 g,定容至1 L。转膜缓冲液(湿转):Tris-Base 3.03 g,甘氨酸14.4 g,甲醇200 mL,定容至1 L。洗涤缓冲液:三羟甲基氨基甲烷-盐酸(Tris-HCl,1.0 mol/L,pH 7.4)20 mL,氯化钠8.01 g,10%吐温10 mL,ddH2O 970 mL。5%封闭液:2.5 g脱脂奶粉,加入50 mL洗膜缓冲液。
1.7.2 Western Blot试验研磨空肠组织样品,取100 mg左右加入1 mL裂解溶液(含蛋白酶和磷酸酶抑制剂)破碎细胞,4 ℃、13 800×g离心15 min取上清,用二喹啉甲酸法测定蛋白质浓度。SDS-PAGE凝胶(12%分离胶和5%浓缩胶)电泳分离蛋白,上样量为40 μg,电泳条件为:65 V,40 min;115 V,1 h 20 min;湿转法进行转膜,转膜条件:200 mA,50 min;5%脱脂奶粉室温封闭1 h,加入1 : 2 000稀释的一抗,4 ℃过夜孵育,洗膜3次,每次5 min;二抗(1 : 2 000稀释)室温孵育1 h,洗膜3次,每次5 min;增强型化学发光试剂反应,在ImageQuant LAS 4000 mini系统进行曝光显影。
1.8 数据统计分析试验数据采用SAS 6.0.0.3软件中one-way ANOVA进行方差分析,GraphPad Prism 6软件作图。结果用平均值±标准误表示,P < 0.05表示差异显著。
2 结果 2.1 母猪妊娠后期和泌乳期饲粮中添加HWG对仔猪生长性能的影响由表 3可知,与对照组相比,母猪妊娠后期和泌乳期饲粮中添加1%HWG显著提高了仔猪出生平均体重、21日龄断奶平均体重和15~21日龄的平均日增重(P < 0.05);母猪妊娠后期和泌乳期饲粮中添加2%HWG显著提高了14和21日龄仔猪的平均体重以及15~21日龄的平均日增重(P < 0.05),1~14日龄仔猪平均日增重有所提高但无显著差异(P>0.05)。
|
|
表 3 母猪妊娠后期和泌乳期饲粮中添加HWG对仔猪生长性能的影响 Table 3 Effects of dietary HWG to sows during late gestation and lactation on growth performance of piglets (n=11) |
由表 4可知,母猪妊娠后期和泌乳期饲粮中添加1%HWG显著提高了初乳中胰岛素生长因子-Ⅰ含量(P < 0.05),对胰岛素和表皮生长因子含量无显著影响(P>0.05);添加2%HWG显著提高了初乳中胰岛素、胰岛素生长因子-Ⅰ和表皮生长因子含量(P < 0.05)。
|
|
表 4 母猪妊娠后期和泌乳期饲粮中添加HWG对初乳中生长因子含量的影响 Table 4 Effects of dietary HWG to sows during late gestation and lactation on growth factor contents in colostrum (n=6) |
由表 5可知,母猪妊娠后期和泌乳期饲粮中添加1%HWG显著提高了初乳中天冬氨酸、谷氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、苏氨酸、色氨酸和酪氨酸含量(P < 0.05);添加2%HWG显著提高了初乳中甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、丝氨酸和苏氨酸含量(P < 0.05)。
|
|
表 5 母猪妊娠后期和泌乳期饲粮中添加HWG对初乳中氨基酸含量的影响 Table 5 Effects of dietary HWG to sows during late gestation and lactation on amino acid contents in colostrum (n=6) |
由表 6可知,母猪妊娠后期和泌乳期饲粮中添加2%HWG显著提高了断奶3 d仔猪血清中白蛋白含量(P < 0.05);添加1%和2%HWG显著降低了断奶3 d仔猪血清中氨含量(P < 0.05),对断奶3 d仔猪血清中总蛋白、尿素氮、葡萄糖含量和碱性磷酸酶活性无显著影响(P>0.05)。
|
|
表 6 母猪妊娠后期和泌乳期饲粮中添加HWG对断奶仔猪血清生化指标的影响 Table 6 Effects of dietary HWG to sows during late gestation and lactation on serum biochemical indices of weaned piglets (n=6) |
母猪妊娠后期和泌乳期饲粮中添加HWG对断奶仔猪小肠绒毛形态的影响如图 1所示。由表 7可知,母猪妊娠后期和泌乳期饲粮中添加1%HWG显著提高了断奶仔猪回肠的绒毛高度以及十二指肠、空肠和回肠的绒毛高度与隐窝深度的比值(P < 0.05);添加2%HWG显著提高了断奶仔猪十二指肠、空肠和回肠的绒毛高度与隐窝深度的比值(P < 0.05),并显著降低了回肠的隐窝深度(P < 0.05)。
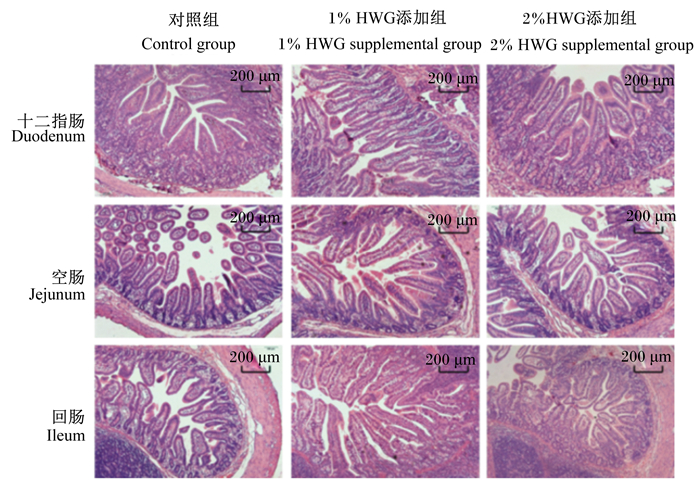
|
图 1 母猪妊娠后期和泌乳期饲粮中添加HWG对断奶仔猪小肠绒毛形态的影响 Fig. 1 Effects of dietary HWG to sows during late gestation and lactation on small intestinal villus morphology of weaned piglets (100×) |
由图 2-A可知,母猪妊娠后期和泌乳期饲粮中添加1%和2%HWG均显著降低了断奶仔猪空肠炎性细胞因子白细胞介素(IL)-8、IL-6、IL-1β和肿瘤坏死因子-α(TNF-α)的mRNA相对表达量(P < 0.05);由图 2-B可知,母猪妊娠后期和泌乳期饲粮中添加1%和2%HWG显著降低了断奶仔猪回肠炎性细胞因子IL-8和TNF-α的mRNA相对表达量(P < 0.05),其中添加2%HWG还显著降低了断奶仔猪回肠IL-6的mRNA相对表达量(P < 0.05)。
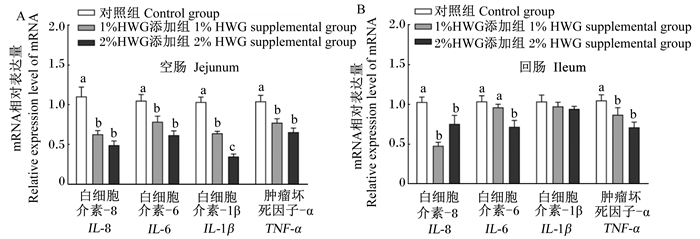
|
同一指标数据柱形标注不同字母表示差异显著(P < 0.05)。图 3同。 For the same index, column diagrams with different letter superscripts mean significant difference (P < 0.05). The same as Fig. 3. 图 2 母猪妊娠后期和泌乳期饲粮中添加HWG对断奶仔猪肠道炎性细胞因子mRNA相对表达量的影响 Fig. 2 Effects of dietary HWG to sows during late gestation and lactation on mRNA relative expression levels of inflammatory cytokines in intestine of weaned piglets (n=6) |
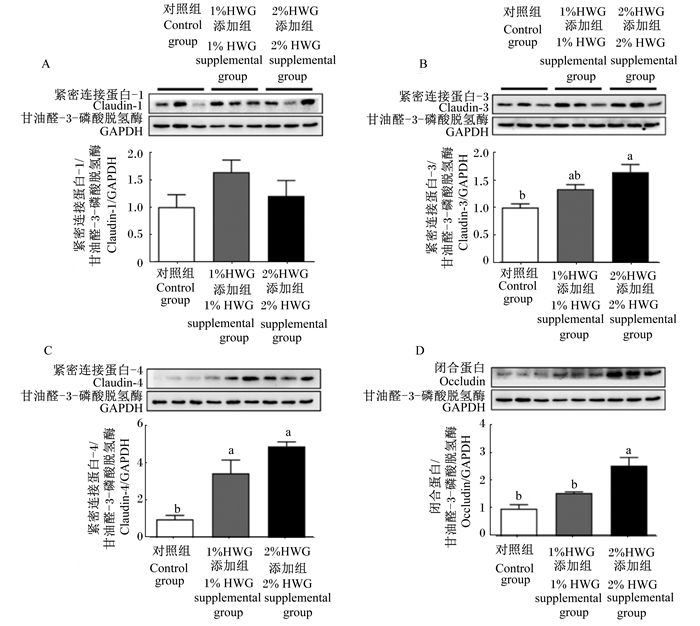
|
图 3 母猪妊娠后期和泌乳期饲粮中添加HWG对断奶仔猪空肠紧密连接蛋白表达的影响 Fig. 3 Effects of dietary HWG to sows during late gestation and lactation on tight junction protein expression in jejunum of weaned piglets |
|
|
表 7 母猪妊娠后期和泌乳期饲粮中添加HWG对仔猪小肠绒毛形态的影响 Table 7 Effects of dietary HWG to sows during late gestation and lactation on small intestinal villus morphology of weaned piglets (n=6) |
由图 3可知,母猪妊娠后期和泌乳期饲粮中添加1%HWG显著提高了断奶仔猪空肠紧密连接蛋白-4(claudin-4)的表达(P < 0.05),对紧密连接蛋白-1(claudin-1)、紧密连接蛋白-3(claudin-3)和闭合蛋白(occludin)的表达无显著影响(P>0.05);添加2%HWG显著提高了空肠claudin-3、claudin-4和occludin的表达(P < 0.05)。
3 讨论同哺乳仔猪相比,断奶仔猪的营养物质来源、形态和组成等均发生了明显变化。饲粮、外界环境和心理的变化以及仔猪肠道本身发育不成熟的生理特点等因素共同作用下,断奶仔猪的肠道形态、结构和功能出现异常,影响营养物质的吸收和利用率以及仔猪的生长发育[13]。妊娠和泌乳期母猪的营养水平可以影响泌乳中的营养成分和生长因子水平,进而影响仔猪的生长发育[14]。新生仔猪肠道和免疫系统发育及功能尚不成熟,易受病原菌侵袭,从而导致肠黏膜结构和屏障功能异常。猪乳中丰富的谷氨酰胺能够参与蛋白质的合成,为肠上皮细胞提供能量,并通过多种信号途径影响肠屏障功能和生长发育[4-5]。此外,初乳中的生长因子(如胰岛素、胰岛素生长因子-Ⅰ和表皮生长因子)在乳腺发育、新生仔猪肠道发育以及抵抗病原菌感染等诸多方面都发挥着重要作用[15-16]。HWG作为重要的植物蛋白质源,富含谷氨酰胺和小肽。母猪妊娠后期和泌乳期饲粮中添加HWG对母猪乳组成及仔猪生长、肠屏障功能的影响目前还未见报道。
本试验研究发现,在母猪妊娠后期和泌乳期饲粮中添加2%HWG显著提高了哺乳期仔猪的平均日增重和断奶体重,以及初乳中甘氨酸、组氨酸、异亮氨酸、亮氨酸、赖氨酸、丝氨酸和苏氨酸含量。赖氨酸、苏氨酸、亮氨酸和异亮氨酸均是机体重要的必需氨基酸,其中赖氨酸和苏氨酸分别是仔猪的第一和第三限制性氨基酸,亮氨酸约占机体氨基酸的6.8%。笔者团队前期研究结果表明,饲粮中补充亮氨酸能够促进仔猪肠绒毛发育、蛋白质合成和氨基酸转运载体的表达,提高仔猪的生长性能[17]。饲粮中补充甘氨酸,可促进新生仔猪的肠绒毛发育、肠道氨基酸转运和提高仔猪的平均日增重和平均体重[18]。HWG提高了初乳中多种氨基酸的含量,增加了仔猪的氨基酸摄入量,从而改善了肠道的生长发育。此外,HWG显著提高了初乳中胰岛素、胰岛素生长因子-Ⅰ和表皮生长因子的含量。胰岛素和胰岛素生长因子-Ⅰ以通过哺乳动物雷帕霉素靶蛋白通路参与调控氨基酸转运载体表达和蛋白质的合成,促进仔猪肠绒毛的发育,进而提高仔猪肠道生长发育与成熟[15, 19]。表皮生长因子可促进肠壁细胞DNA、RNA和蛋白质的合成,调节肠道消化酶的分泌[20]。本研究发现,HWG显著提高了初乳中生长因子水平,这可能是其改善仔猪生长性能的原因之一。由于本试验并未测定泌乳能力相关的其他指标,如泌乳量、乳品质和乳糖含量等,因此尚不能全面评价其对母猪泌乳性能的影响。
受断奶应激的影响,仔猪的小肠绒毛萎缩、脱落,隐窝的深度明显增加,绒毛高度和隐窝深度比值下降[21]。本试验中,母猪饲粮中补充1%和2%HWG可以显著提高仔猪断奶后的绒毛高度,降低隐窝深度,提高绒毛高度与隐窝深度的比值。这表明母体补充HWG可以促进仔猪的肠道发育,改善断奶后仔猪的肠道健康。饲粮中的蛋白质在消化道各种酶的作用下生成游离氨基酸,在上皮细胞中氨基酸转运载体的介导下,进入肠上皮细胞。已有研究发现,谷氨酰胺、亮氨酸、赖氨酸等能够提高肠上皮细胞中氨基酸转运载体的表达,促进氨基酸的转运和吸收[17, 22-23]。HWG可能通过提高氨基酸转运载体的表达而提高血浆中氨基酸水平。这可能是HWG显著提高了仔猪血清中谷氨酰胺、组氨酸、亮氨酸和赖氨酸含量的重要原因。谷氨酰胺是肠上皮细胞的主要能量来源,也能参与蛋白质及还原型谷胱甘肽的合成等[4]。赖氨酸、亮氨酸等是猪生长发育的重要的必需氨基酸,HWG显著提高了仔猪血清中组氨酸、亮氨酸和赖氨酸含量,同时也显著降低了血清氨含量,提示其提高了氨基酸的利用效率,促进了蛋白质在动物体内的沉积。
肠上皮细胞间的紧密连接蛋白在维持肠屏障功能方面发挥着重要作用。断奶仔猪空肠上皮细胞间紧密连接蛋白表达降低,通透性明显增加[24]。肠腔中的细菌或细菌毒素通过上皮细胞间隙进入内环境,引起炎性细胞因子IL-1β和IL-6分泌增加。炎性细胞因子进一步降低紧密连接蛋白的表达[25],加剧了屏障功能的损伤,引起仔猪的腹泻,严重影响仔猪生长[26]。本研究表明,饲粮添加HWG显著降低了断奶仔猪十二指肠、空肠和回肠中IL-1β、IL-8、IL-6和TNF-α等炎性细胞因子的mRNA相对表达量,显著上调了空肠紧密连接蛋白claudin-3、claudin-4和occludin的表达,这与已有的研究结果[6]基本一致。有研究表明,断奶应激可通过激活核因子-κB(NF-κB)促进炎性细胞因子的表达[27],谷氨酰胺可通过抑制该信号通路减少断奶仔猪肠道组织中IL-1、IL-8等炎性细胞因子的表达[28]。HWG抑制肠上皮细胞炎性因子表达是否与NF-κB转录因子的表达和活性有关,有待进一步研究。
4 结论在母猪妊娠后期和泌乳期饲粮中添加1%和2%HWG,显著提高了仔猪的平均日增重、平均体重和21日龄断奶重,显著改善了断奶仔猪肠绒毛形态、空肠紧密连接蛋白的表达以及仔猪的肠道健康。HWG的促生长作用与其提高了初乳中生长因子和氨基酸水平有关。
| [1] |
MACPHERSON A J, DE AGVERO M G, GANAL-VONARBURG S C. How nutrition and the maternal microbiota shape the neonatal immune system[J]. Nature Reviews Immunology, 2017, 17(8): 508-517. DOI:10.1038/nri.2017.58 |
| [2] |
BATTAGLIA F C. Glutamine and glutamate exchange between the fetal liver and the placenta[J]. The Journal of Nutrition, 2000, 130(4 Suppl): 974S-977S. |
| [3] |
WU G Y, KNABE D A. Free and protein-bound amino acids in sow's colostrum and milk[J]. The Journal of Nutrition, 1994, 124(3): 415-424. DOI:10.1093/jn/124.3.415 |
| [4] |
WU G, BAZER F W, JOHNSON G A, et al. Triennial growth symposium:important roles for L-glutamine in swine nutrition and production[J]. Journal of Animal Science, 2011, 89(7): 2017-2030. DOI:10.2527/jas.2010-3614 |
| [5] |
WANG B, WU G Y, ZHOU Z G, et al. Glutamine and intestinal barrier function[J]. Amino Acids, 2015, 47(10): 2143-2154. DOI:10.1007/s00726-014-1773-4 |
| [6] |
WANG H, ZHANG C, WU G Y, et al. Glutamine enhances tight junction protein expression and modulates corticotropin-releasing factor signaling in the jejunum of weanling piglets[J]. The Journal of Nutrition, 2015, 145(1): 25-31. |
| [7] |
LIU N, MA X S, LUO X, et al. L-glutamine attenuates apoptosis in porcine enterocytes by regulating glutathione-related redox homeostasis[J]. The Journal of Nutrition, 2018, 148(4): 526-534. DOI:10.1093/jn/nxx062 |
| [8] |
WANG X Q, FENG Y, SHU G, et al. Effect of dietary supplementation with hydrolyzed wheat gluten on growth performance, cell immunity and serum biochemical indices of weaned piglets (Sus scrofa)[J]. Agricultural Sciences in China, 2011, 10(6): 938-945. DOI:10.1016/S1671-2927(11)60079-5 |
| [9] |
严斌.小麦谷氨酰胺肽的高浓制备及其肠道修复功能研究[D].硕士学位论文.北京: 中国农业科学院, 2017: 27-34.
|
| [10] |
寇娇, 梁海威, 刘宁, 等. 妊娠后期饲粮中添加小麦水解蛋白对母猪繁殖性能、血清生化指标和氨基酸含量及胎盘组织营养物质转运相关基因表达的影响[J]. 动物营养学报, 2018, 30(11): 4369-4378. DOI:10.3969/j.issn.1006-267x.2018.11.013 |
| [11] |
原伟伟, 王井亮, 代兵, 等. 小麦水解蛋白对早期断奶仔猪生产性能及肠道健康的影响[J]. 畜牧与兽医, 2017, 49(7): 23-27. |
| [12] |
LIVAK K J, SCHMITTGEN T D. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCt method[J]. Methods, 2001, 25(4): 402-408. DOI:10.1006/meth.2001.1262 |
| [13] |
GU X H, LI D F, SHE R P. Effect of weaning on small intestinal structure and function in the piglet[J]. Archiv für Tierernaehrung, 2002, 56(4): 275-286. DOI:10.1080/00039420214345 |
| [14] |
TOKACH M D, PETTIGREW J E, CROOKER B A, et al. Quantitative influence of lysine and energy intake on yield of milk components in the primiparous sow[J]. Journal of Animal Science, 1992, 70(6): 1864-1872. DOI:10.2527/1992.7061864x |
| [15] |
TAN L B, WEI T, YUAN A W, et al. Dietary supplementation of astragalus polysaccharides enhanced immune components and growth factors EGF and IGF-1 in sow colostrum[J]. Journal of Immunology Research, 2017, 2017: 9253208. DOI:10.1155/2017/9253208 |
| [16] |
HOULE V M, SCHROEDER E A, ODLE J, et al. Small intestinal disaccharidase activity and ileal villus height are increased in piglets consuming formula containing recombinant human insulin-like growth factor-Ⅰ[J]. Pediatric Research, 1997, 42(1): 78-86. DOI:10.1203/00006450-199707000-00013 |
| [17] |
SUN Y L, WU Z L, LI W, et al. Dietary L-leucine supplementation enhances intestinal development in suckling piglets[J]. Amino Acids, 2015, 47(8): 1517-1525. DOI:10.1007/s00726-015-1985-2 |
| [18] |
WANG W W, DAI Z L, WU Z L, et al. Glycine is a nutritionally essential amino acid for maximal growth of milk-fed young pigs[J]. Amino Acids, 2014, 46(8): 2037-2045. DOI:10.1007/s00726-014-1758-3 |
| [19] |
ROOS S, LAGERLÖF O, WENNERGREN M, et al. Regulation of amino acid transporters by glucose and growth factors in cultured primary human trophoblast cells is mediated by mTOR signaling[J]. American Journal of Physiology:Cell Physiology, 2009, 297(3): C723-C731. DOI:10.1152/ajpcell.00191.2009 |
| [20] |
XU R J. Development of the newborn GI tract and its relation to colostrum/milk intake:a review[J]. Reproduction, Fertility and Development, 1996, 8(1): 35-48. DOI:10.1071/RD9960035 |
| [21] |
KONG X F, TAN B, YIN Y L, et al. L-arginine stimulates the mTOR signaling pathway and protein synthesis in porcine trophectoderm cells[J]. The Journal of Nutritional Biochemistry, 2012, 23(9): 1178-1183. DOI:10.1016/j.jnutbio.2011.06.012 |
| [22] |
JIAO N, WU Z L, JI Y, et al. L-glutamate enhances barrier and antioxidative functions in intestinal porcine epithelial cells[J]. The Journal of Nutrition, 2015, 145(10): 2258-2264. DOI:10.3945/jn.115.217661 |
| [23] |
PONCET N, TAYLOR P M. The role of amino acid transporters in nutrition[J]. Current Opinion in Clinical Nutrition and Metabolic Care, 2013, 16(1): 57-65. DOI:10.1097/MCO.0b013e32835a885c |
| [24] |
栾兆双, 姚丽丽, 傅振宁, 等. 断奶应激对仔猪肠形态、肠黏膜屏障和p38丝裂原活化蛋白激酶信号通路的影响[J]. 动物营养学报, 2012, 24(11): 2237-2242. DOI:10.3969/j.issn.1006-267x.2012.11.023 |
| [25] |
EWASCHUK J B, MURDOCH G K, JOHNSON I R, et al. Glutamine supplementation improves intestinal barrier function in a weaned piglet model of Escherichia coli infection[J]. British Journal of Nutrition, 2011, 106(6): 870-877. DOI:10.1017/S0007114511001152 |
| [26] |
SMITH F, CLARK J E, OVERMAN B L, et al. Early weaning stress impairs development of mucosal barrier function in the porcine intestine[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2010, 298(3): G352-G363. DOI:10.1152/ajpgi.00081.2009 |
| [27] |
YI H B, JIANG D H, ZHANG L, et al. Developmental expression of STATs, nuclear factor-κB and inflammatory genes in the jejunum of piglets during weaning[J]. International Immunopharmacology, 2016, 36: 199-204. DOI:10.1016/j.intimp.2016.04.032 |
| [28] |
ZHONG X, LI W, HUANG X X, et al. Effects of glutamine supplementation on the immune status in weaning piglets with intrauterine growth retardation[J]. Archives of Animal Nutrition, 2012, 66(5): 347-356. DOI:10.1080/1745039X.2012.683325 |




