中华蜜蜂(Apis cerana cerana)为东方蜜蜂的指名亚种,是原产于我国的优良蜂种,具有抗病抗逆、适应性强和善于采集零星蜜源等意大利蜜蜂(Apis mellifera ligustica)无法比拟的优势,在生态环境保护以及为农作物传花授粉等方面都发挥了重要的作用[1]。蜜蜂个体为变温动物,其生命活动与外界环境温度密切相关。温带地区由于季节的变化,蜂群在生长发育过程中都要经受冬季低温的制约。明确中华蜜蜂越冬的分子机制对保护中华蜜蜂种质资源具有重要的理论和实际意义。低温胁迫是超出正常变动范围的温度因子,常常在一定程度上构成了生物有机体的选择压力和进化动力[2]。在低温环境中,昆虫体内许多生物过程开始减缓,甚至会限制其生长发育和生存状况[3]。早期研究显示细胞膜系统是低温冷伤害的首要部位,低温胁迫下的昆虫会在体内积累许多有毒代谢废物(如自由基、乳酸等)[4]。常志光等[5]分别测定了越冬期不同蜂种的过冷却点(SCP)并分析了其与血淋巴超氧化物歧化酶(SOD)活性的关系,结果发现抗寒性能更优的卡尼鄂拉蜂(Apis mellifera carnica)血淋巴SOD活性显著高于意大利蜜蜂。赵静等[6]研究发现,异色瓢虫体内过氧化物酶(POD)与过氧化氢酶(CAT)活性伴随着温度的降低及暴露时间的增加而显著升高,可以防御新陈代谢产生的活性氧及其过氧化物对细胞造成的伤害。总抗氧化能力(T-AOC)是反映生物体抗氧化能力的重要指标[7],当小金蝠蛾幼虫受到低温胁迫时体内,T-AOC呈现上升趋势[8]。除了膜组分的变化,低温胁迫还会上调一些基因的表达,包括热激蛋白(HSP)和抗冻蛋白(AFP)基因[9]。Huang等[10]分离了美洲版潜蝇(Liriomyza sativa)的3种小分子热激蛋白基因(ls-hsp19.5、ls-hsp20.8、ls-hsp21.7),并研究其与潜蝇生长发育的作用关系,结果表明它们均为抗寒必需成员,且在不同强度低温胁迫条件下其表达的种类和含量不同,而类致死必需蛋白[L(2)efl]的基因序列和小分子热激蛋白(sHSP)基因有很高的同源性,其翻译出来的氨基酸序列和已知的其他小分子热激蛋白高度同源[11]。在短时低温诱导下,异色瓢虫海藻糖-6-磷酸合成酶(TPS)基因的表达量上调,而TPS基因可抵御低温刺激并保持体内血糖平衡[12]。此外,Amdam等[13]比较了欧洲蜜蜂和非洲蜜蜂种群体内的卵黄蛋白原(Vg)含量,发现至欧洲蜜蜂体内Vg含量要显著高于非洲蜜蜂,明确了Vg可帮助欧洲蜜蜂适应低温环境。众所周知,中华蜜蜂是一个耐寒性强的蜂种,但有关其冬季寒冷环境下体内耐寒物质及相关基因在分子层面的调控方式的研究还较少。鉴于此,本试验拟明确3种抗氧化物质(T-AOC、SOD和POD)在越冬期中华蜜蜂体内扮演的角色,分析中华蜜蜂耐寒基因[L(2)efl、Vg、TPS、CAT和SOD]的表达变化,以期阐明其在耐寒中的功能,为今后蛋白质互作、基因变异探索以及提高冬季蜂群存活率研究提供参考。
1 材料与方法 1.1 试验动物在山东农业大学动物科技学院选取山东本地12月上旬的中华蜜蜂作为研究对象,并在越冬前期人工饲喂越冬饲粮,稳定群势。
1.2 试验方法 1.2.1 中华蜜蜂低温胁迫处理选取试验蜂群中的越冬工蜂900只,随机分为6组,1个对照组和5个试验组,每组3个重复,每个重复50只。5个试验组越冬工蜂于恒温恒湿培养箱低温条件(16 ℃)下分别暴露15、30、45、60和90 min,对照组不在低温条件下暴露。暴露结束后各组取20只蜜蜂样品,立即置于液氮中保存。
1.2.2 抗氧化指标测定将对照组和试验组蜜蜂样品按质量体积比1 : 9加预冷的磷酸盐缓冲液(PBS)于离心管中进行组织匀浆后,用PBS分别配制成10.0%和1.5%的匀浆液,4 ℃条件下5 000 r/min离心10 min后取上清备用。10.0%的匀浆液用于测定蜂体的T-AOC以及SOD和POD活性,1.5%的匀浆液用于测定相应蜂体的蛋白质浓度。
采用双抗体一步夹心法酶联免疫吸附试验(ELISA)法测定蜂体的T-AOC。往预先包被昆虫总抗氧化酶捕获抗体的包被微孔中依次加入样品、标准品、辣根过氧化物酶(HRP)标记的检测抗体,经过温育并彻底洗涤,用底物四甲基联苯胺(TMB)显色,TMB在POD的催化下转化成蓝色,并在酸的作用下转化成最终的黄色。颜色的深浅和样品的T-AOC呈正相关。用EL80S超级酶标仪分别测定标准品和样品的吸光度(OD)值,计算样品的T-AOC。SOD和POD活性的测定原理同上。蜂体的T-AOC以及SOD和POD活性均用蜂体蛋白质浓度进行校准。
1.2.3 耐寒基因表达的测定 1.2.3.1 总RNA提取每组选取3只蜜蜂,液氮研磨后按照总RNA提取试剂盒(R6934-01)所述方法提取样品总RNA,然后用反转录试剂盒(DRR037A,TaKaRa)将总RNA立即反转录成cDNA,反转录操作步骤如下:20 μL体系混匀后,25 ℃反应10 min,55 ℃反应30 min,85 ℃灭活5 min,4 ℃终止反应,共1循环,随后将cDNA样品浓度调节为相同水平后,-20 ℃保存待用。
1.2.3.2 实时荧光定量PCR(qRT-PCR)参照FastStart Universal SYBR Green Master (Roche)操作指南配制20 μL反应体系,使用7500 Real-Time PCR仪(美国ABI公司)检测耐寒基因[L(2)efl、Vg、TPS、CAT和SOD]的相对表达量。以中华蜜蜂β-肌动蛋白(β-actin)为内参基因,目的基因引物设计参考序列来自于NCBI数据库,委托上海生工生物科技有限公司完成,基因引物序列如表 1所示。
|
|
表 1 基因引物序列 Table 1 Primer sequences of genes |
试验数据采用SAS 9.2软件进行单因素方差分析(one-way ANOVA),并采用LSD法进行多重比较分析,结果表示为平均值±标准差。P<0.05表示差异显著。
2 结果与分析 2.1 低温胁迫对越冬期中华蜜蜂体内抗氧化指标的影响 2.1.1 低温胁迫对越冬期中华蜜蜂体内T-AOC的影响蜂体T-AOC的变化情况如图 1所示。越冬期中华蜜蜂在低温条件下暴露60 min之内T-AOC略有波动,在暴露90 min时体内T-AOC升高。方差分析显示,中华蜜蜂低温暴露90 min组T-AOC显著高于对照组(P<0.05),说明90 min的低温胁迫导致其体内抗氧化物质和抗氧化酶活性增加,使得T-AOC升高。
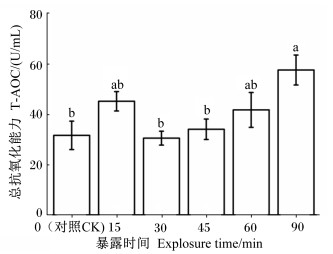
|
数据柱标注不同字母表示差异显著(P<0.05)。下图同。 Value columns with different letters indicated significantly different (P<0.05)。The same as below. 图 1 低温胁迫对越冬期中华蜜蜂体内T-AOC的影响 Fig. 1 Effects of low temperature stress on T-AOC of Apis cerana cerana during over-wintering period |
图 2显示,越冬期中华蜜蜂在低温条件下暴露不同时间后体内SOD活性波动明显,其中低温暴露90 min组的SOD活性相对于对照组增加了近1倍,从(12.12±1.73) U/mL升高到(21.39±1.77) U/mL。方差分析显示,中华蜜蜂低温暴露60和90 min组SOD活性显著高于对照组(P<0.05),说明60和90 min的低温胁迫使得中华蜜蜂体内SOD活性升高。
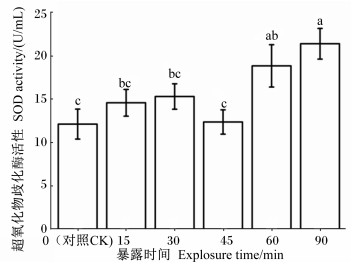
|
图 2 低温胁迫对越冬期中华蜜蜂体内SOD活性的影响 Fig. 2 Effects of low temperature stress on SOD activity of Apis cerana cerana during over-wintering period |
低温胁迫下中华蜜蜂体内POD活性与T-AOC和SOD活性表现出相似的变化趋势,在在低温条件下暴露90 min时POD活性最高(图 3)。方差分析显示,中华蜜蜂低温暴露90 min组POD活性显著高于对照组(P<0.05),其POD活性达到(27.24±2.41) U/mL。
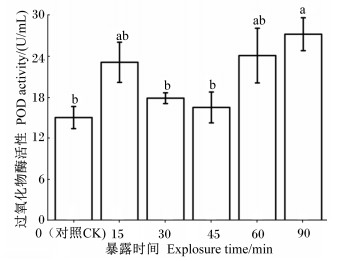
|
图 3 低温胁迫对越冬期中华蜜蜂体内POD活性的影响 Fig. 3 Effects of low temperature stress on POD activity of Apis cerana cerana during over-wintering period |
将对照组测定的目的基因相对表达量设定为1,低温胁迫下中华蜜蜂体内Vg、L(2)efl和TPS基因的相对表达量如图 4所示。从图中可以看出,在低温胁迫过程当中L(2)efl和TPS基因的相对表达量变化幅度较大,随着暴露时间的延长,L(2)efl基因的相对表达量一直在上升(除了在60 min时略微下降),TPS基因的相对表达量则呈现先上升后下降的趋势,暴露15 min时已处于高表达状态,在暴露30 min时达到峰值;Vg基因的相对表达量相较于L(2)efl和TPS基因变化幅度较小。与对照组相比,各试验组L(2)efl基因的相对表达量显著升高(P<0.05),低温暴露15和30 min组TPS基因的相对表达量显著升高(P<0.05),低温暴露30和45 min组Vg基因的相对表达量显著降低(P<0.05),而低温暴露60 min组Vg基因的相对表达量则显著升高(P<0.05)。
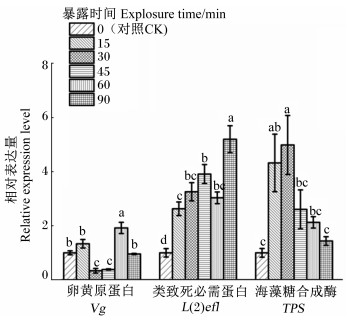
|
图 4 低温胁迫下越冬期中华蜜蜂体内Vg、L(2)efl和TPS基因的相对表达量 Fig. 4 Relative expression levels of Vg, L(2)efl and TPS genes of Apis cerana cerana during over-wintering period under low temperature stress |
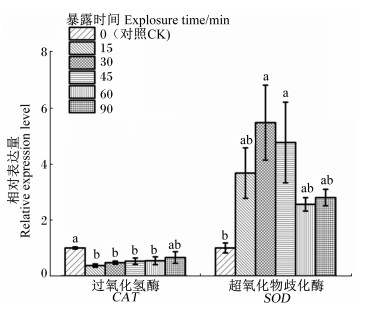
将对照组测定的目的基因相对表达量设定为1,低温胁迫下中华蜜蜂体内CAT和SOD基因的相对表达量如图 5所示。从图中可以看出,CAT基因的相对表达量在对照组较高,而在试验组中一直处于低表达状态,且低温暴露15、30、45和60 min组显著低于对照组(P<0.05),这表明CAT基因对低温环境不敏感或是本试验所设置的环境温度及暴露时间不足以诱导其表达;SOD基因的相对表达量则与CAT基因相对表达量的变化趋势不同,与对照组相比,试验组SOD基因经低温胁迫处理后其相对表达量大幅升高,在暴露于低温下30 min时SOD基因的相对表达量达到峰值,此时SOD基因的相对表达量是对照组的5.47倍,差异达到显著水平(P<0.05),当暴露时间继续延长时,SOD基因的相对表达量开始逐渐降低。
|
图 5 低温胁迫下越冬期中华蜜蜂体内CAT和 SOD基因的相对表达量 Fig. 5 Relative expression levels of CAT and SOD genes of Apis cerana cerana during over-wintering period under low temperature stress |
昆虫在生存过程中必然面对低温胁迫,其自身的应对机制不同也导致了耐寒性能的差异。蜜蜂作为社会性昆虫,在应对低温胁迫时通过结团取暖的方式维持蜂团温度相对较高。在越冬期,当-10 ℃≤外界环境气温≤-2 ℃时,蜂箱内温度基本维持在17~19 ℃;当环境温度回升至0 ℃附近时,箱内温度急剧升高后稳定维持在34~35 ℃[14]。本试验进行时,所选蜜蜂蜂团中心温度在28~34 ℃。因此以16 ℃为低温条件,是基于中华蜜蜂越冬生物学特性做出的合理选择。
3.1 低温胁迫下越冬期中华蜜蜂体内T-AOC及SOD和POD活性变化短时低温胁迫是指昆虫在较短时间内承受突然低温带来的刺激,机体产生一系列的应激反应,其与季节性低温环境伤害完全不同[15]。这些伤害包括新陈代谢紊乱、离子调节失衡及膜结构改变失去渗透性等[16-17]。在这个过程中,昆虫体内会积累大量的乳酸、含氮废物等有毒代谢物质并产生自由基,因此昆虫在长期适应环境的进化过程中形成了相应的酶系统[18]。SOD是生物体内最重要的一种酶[19],广泛存在于各种需氧生物体内,是生物体内的一种重要氧自由基清除剂,并在一定程度上影响到生物体的抗逆能力,属于生物体内防御系统的酶类[20]。本研究结果显示,中华蜜蜂体内SOD活性在低温胁迫下随暴露时间的延长而有所上升,表明低温胁迫诱导了中华蜜蜂体内SOD活性的升高,以便分解超氧自由基,保护机体免受活性氧的伤害,同样的情况在桔小实蝇的相关研究[21]中也有发现。POD能清除昆虫体内的过氧化氢(H2O2),是昆虫体内重要的保护酶,对昆虫的新陈代谢具有重要作用[22]。本研究发现,中华蜜蜂体内POD活性在低温条件下暴露60和90 min后均显著高于对照组,西藏飞蝗受低温胁迫后也出现POD活性增加的现象[23]。对于生物体而言,这些抗氧化酶之间存在共调节机制来控制细胞内活性氧的含量,在功能上相互协调限制,一种酶的活性发生改变就可能会诱导相关酶活性的改变[24]。例如,随着体内活性氧含量的增加,SOD活性也逐渐增加,从而催化超氧自由基的歧化反应,生成H2O2和氧气(O2),此时POD又可以清除生成的H2O2,进而保护机体不受损伤[25-26]。T-AOC是反映生物体内抗氧化能力的重要指标,低温胁迫后中华蜜蜂体内T-AOC及SOD和POD活性均不同程度地随着暴露时间的延长而升高,这可能是为了避免细胞受损而在生理上作出的适应性改变。上述结果表明,在越冬期,中华蜜蜂体内的T-AOC、SOD和POD协同作用,共同防御新陈代谢产生的活性氧及其过氧化物对细胞造成的伤害,形成抵御低温的耐寒应答机制。
3.2 低温胁迫下越冬期中华蜜蜂体内Vg、TPS基因表达的变化Vg涉及到蜜蜂营养分配、气候适应和免疫机制等诸多方面,因此蜜蜂是目前Vg多效性昆虫最为典型的代表。Vg已经被证明是高浓度锌离子的携带者,如果缺乏锌离子,将会导致氧化损伤和衰老,包括免疫细胞及血细胞固缩。已有研究认为Vg可能是作为免疫系统成分,增强了蜂王和越冬蜂的抗氧化能力,从而提高抗寒能力[27]。Amdam等[13]比较了欧洲蜜蜂和非洲蜜蜂种群体内的Vg含量,发现至少在5~30日龄内,欧洲蜜蜂体内Vg含量都要显著大于非洲蜜蜂,明确了Vg可帮助欧洲蜜蜂适应低温环境;除此之外,张卫星等[28]的研究结果也表明在4 ℃低温环境下中华蜜蜂Vg基因的相对表达量相比对照组显著上调。然而,本试验中中华蜜蜂体内Vg基因在低温胁迫下的表达变化与前人报道不同,这可能是由于试验中设计的温度及暴露时间还未能够诱导中华蜜蜂体内Vg基因的表达。L(2)efl的基因序列和小分子热激蛋白家族基因有很高的同源性,其翻译出来的氨基酸序列和已知的其他小分子热激蛋白高度同源[11]。小分子热激蛋白家族成员具有广泛的生物学功能,如分子伴侣、抗氧化、抗低温以及免疫等功能。L(2)efl是大多昆虫小分子热激蛋白家族中的一员,许多研究报道此类蛋白可以防止蛋白质在各种各样的应激条件(如极端温度和氧化)下不可逆的聚集,从而保护机体免受伤害[29]。近几年对昆虫小分子热激蛋白的研究相对较多,比如Zhang等[30]探究了中华蜜蜂AccHsp22.6基因在不同试验条件下的表达特性,结果表明,AccHsp22.6基因的转录水平在高温和低温等大多数非生物因素下均被诱导上调。从图 4可以看出,L(2)efl与小分子热激蛋白在抵御外界不利环境胁迫时具有同样的抗逆功能。在面对低温胁迫期间,昆虫除了涉及到酶系统的改变之外,前人大量研究表明其还能诱导抗冻类物质(如糖原、海藻糖、山梨醇等)的积累[31]。海藻糖在昆虫体内分布广泛,在昆虫血淋巴糖成分中扮演至关重要的角色[32]。海藻糖是昆虫血淋巴中主要的抗冻保护剂之一,能够通过保护生物膜的完整性和维持生物活性来保护细胞免受冻伤,此外,海藻糖能够特异性地将1分子海藻糖水解为2分子葡萄糖,在面对低温胁迫时为机体时供能[33]。海藻糖合成途径中被研究最多的是TPS/6-磷酸海藻糖磷酸酯酶(TPP)途径,在海藻糖合成过程中TPS起到关键作用[34]。海藻糖合成主要过程是由TPS催化尿苷二磷酸葡萄糖(UDP-G)和6-磷酸葡萄糖合成6-磷酸海藻糖,然后在TPP催化下形成海藻糖,其中UDP-G由尿苷二磷酸葡萄糖焦磷酸化酶(UGP)催化而成[35]。本试验中, 中华蜜蜂体内TPS基因的表达与异色瓢虫在降温处理时TPS基因表达出现先上升后下降的趋势一致[36]。在低温胁迫前期,TPS基因的表达量上调,使中华蜜蜂体内合成了足够的海藻糖,可以满足其在一定时间内的生理需要,随着时间的推进,其表达量逐渐回到正常水平,由此表明TPS基因能够通过控制中华蜜蜂体内海藻糖的含量来应对低温胁迫的伤害。
3.3 低温胁迫下越冬期中华蜜蜂体内SOD和CAT基因表达的变化SOD是一种能够防御活性氧及其他过氧化物伤害细胞膜系统的保护酶,对维持昆虫等细胞正常的生命活动[37]。本研究中,在低温条件下暴露30 min时,中华蜜蜂体内SOD基因的相对表达量与对照组相比显著升高,说明其在低温胁迫后体内积累了一定的活性氧及其他过氧化物,从而导致SOD基因的表达显著上调。CAT和POD均能清除昆虫体内的H2O2,CAT是在H2O2浓度较高时发挥作用[38],而POD在低H2O2浓度的情况下即可发挥高效的作用[39],二者共同作用将H2O2维持在较低的水平。本试验中,低温胁迫下中华蜜蜂体内CAT基因的相对表达量呈现低表达状态,可能是因为POD在此期间分解了大量的H2O2,导致CAT基因的表达下调。这也充分说明中华蜜蜂体内抗氧化酶系统存在一定的平衡机制,在其面对外界不良环境时协同发挥作用。
4 结论低温胁迫下越冬期中华蜜蜂抗氧化系统的防御能力趋强,耐寒基因L(2)efl、TPS和SOD表达上调,CAT表达下调,提示中华蜜蜂对低温胁迫存在耐寒响应的生理机制。
| [1] |
孟飞, 胥保华, 郭兴启. 中华蜜蜂重要生物学特性相关功能基因研究进展[J]. 应用昆虫学报, 2012, 49(5): 1338-1344. |
| [2] |
康乐. 环境胁迫下的昆虫-植物相互关系[J]. 生态学杂志, 1995, 14(5): 51-57, 50. |
| [3] |
SINCLAIR B J, VERNON P, KLOK C J, et al. Insects at low temperatures:an ecological perspective[J]. Trends in Ecology & Evolution, 2003, 18(5): 257-262. |
| [4] |
ROJAS R R, LEOPOLD R A. Chilling injury in the housefly:evidence for the role of oxidative stress between pupariation and emergence[J]. Cryobiology, 1996, 33(4): 447-458. DOI:10.1006/cryo.1996.0045 |
| [5] |
常志光, 牛庆生, 闫德斌, 等. 不同蜜蜂品种越冬后期血淋巴总SOD活力与抗寒力的相关性研究[J]. 中国蜂业, 2015, 66(3): 16-18. DOI:10.3969/j.issn.0412-4367.2015.03.003 |
| [6] |
赵静, 李姝, 陈珍珍, 王甦, 等. 低温胁迫对异色瓢虫成虫存活及体内几种酶活力的影响[J]. 植物保护学报, 2014, 41(5): 513-518. |
| [7] |
GHISELLI A, SERAFINI M, NATELLA F, et al. Total antioxidant capacity as a tool to assess redox status:critical view and experimental data[J]. Free Radical Biology and Medicine, 2000, 29(11): 1106-1114. DOI:10.1016/S0891-5849(00)00394-4 |
| [8] |
张青, 涂永勤, 刘怀, 等. 温度胁迫对小金蝠蛾幼虫抗氧化酶活性的影响[J]. 环境昆虫学报, 2016, 38(1): 47-53. |
| [9] |
HOFFMANN A A, SØRENSEN J G, LOESCHCKE V. Adaptation of Drosophila to temperature extremes:bringing together quantitative and molecular approaches[J]. Journal of Thermal Biology, 2003, 28(3): 175-216. DOI:10.1016/S0306-4565(02)00057-8 |
| [10] |
HUANG L H, WANG C Z, KANG L. Cloning and expression of five heat shock protein genes in relation to cold hardening and development in the leafminer, Liriomyza sativa[J]. Journal of Insect Physiology, 2009, 55(3): 279-285. DOI:10.1016/j.jinsphys.2008.12.004 |
| [11] |
KURZIK-DUMKE U, LOHMANN E. Sequence of the new Drosophila melanogaster small heat-shock-related gene, lethal (2) essential for life[L(2)efl], at locus 59F4, 5[J]. Gene, 1995, 154(2): 171-175. |
| [12] |
秦资.异色瓢虫TPS与Treh1基因低温诱导表达分析[D].硕士学位论文.杭州: 杭州师范大学, 2012.
|
| [13] |
AMDAM G V, NORBERG K, OMHOLT S W, et al. Higher vitellogenin concentrations in honey bee workers may be an adaptation to life in temperate climates[J]. Insectes Sociaux, 2005, 52(4): 316-319. DOI:10.1007/s00040-005-0812-2 |
| [14] |
赵晓峰, 刘新生, 李化龙, 等. 冬季外界环境温度变化对中、意蜜蜂箱内温度影响的试验分析[J]. 陕西农业科学, 2008, 54(4): 35-38. DOI:10.3969/j.issn.0488-5368.2008.04.013 |
| [15] |
LEE R E, J r, CHEN C P, DENLINGER D L. A rapid cold-hardening process in insects[J]. Science, 1987, 238(4832): 1415-1417. DOI:10.1126/science.238.4832.1415 |
| [16] |
ZACHARIASSEN K E, KRISTIANSEN E, PEDERSEN S A. Inorganic ions in cold-hardiness[J]. Cryobiology, 2004, 48(2): 126-133. DOI:10.1016/j.cryobiol.2004.01.004 |
| [17] |
OVERGAARD J, SØRENSEN J G, PETERSEN S O, et al. Changes in membrane lipid composition following rapid cold hardening in Drosophila melanogaster[J]. Journal of Insect Physiology, 2005, 51(11): 1173-1182. DOI:10.1016/j.jinsphys.2005.06.007 |
| [18] |
李周直, 沈惠娟, 蒋巧很, 等. 几种昆虫体内保护酶系统活力的研究[J]. 昆虫学报, 1994, 37(4): 399-403. DOI:10.3321/j.issn:0454-6296.1994.04.002 |
| [19] |
刘井兰, 于建飞, 吴进才, 等. 昆虫活性氧代谢[J]. 应用昆虫学报, 2006, 43(6): 752-756. DOI:10.3969/j.issn.0452-8255.2006.06.002 |
| [20] |
于平. 超氧化物歧化酶研究进展[J]. 生物学通报, 2006, 41(1): 4-6. DOI:10.3969/j.issn.0006-3193.2006.01.002 |
| [21] |
JIA F X, DOU W, HU F, et al. Effects of thermal stress on lipid peroxidation and antioxidant enzyme activities of oriental fruit fly, Bactrocera dorsalis (Diptera:tephritidae)[J]. Florida Entomologist, 2011, 94(4): 956-964. DOI:10.1653/024.094.0432 |
| [22] |
郑玉涛.高温胁迫对西花蓟马抗氧化酶活性的影响及CAT基因的克隆与表达[D].硕士学位论文.扬州: 扬州大学, 2015.
|
| [23] |
李庆, 吴蕾, 杨刚, 等. 温度和紫外辐射胁迫对西藏飞蝗抗氧化系统的影响[J]. 生态学报, 2012, 32(10): 3189-3197. |
| [24] |
SHIGEOKA S, ISHIKAWA T, TAMOI M, et al. Regulation and function of ascorbate peroxidase isoenzymes[J]. Journal of Experimental Botany, 2002, 53(372): 1305-1319. DOI:10.1093/jexbot/53.372.1305 |
| [25] |
KHACHIK F, CARVALHO L, BERNSTEIN P S, et al. Chemistry, distribution, and metabolism of tomato carotenoids and their impact on human health[J]. Experimental Biology and Medicine, 2002, 227(10): 845-851. DOI:10.1177/153537020222701002 |
| [26] |
YILDIRIM Ö, BÜYÜKBINGÖL Z. Effects of supplementation with a combination of cobalt and ascorbic acid on antioxidant enzymes and lipid peroxidation levels in streptozocin-diabetic rat liver[J]. Biological Trace Element Research, 2002, 90(1/2/3): 143-154. |
| [27] |
张卫星, 胥保华. 蜜蜂卵黄原蛋白的研究进展[J]. 蜜蜂杂志, 2014, 34(5): 5-7. DOI:10.3969/j.issn.1003-9139.2014.05.003 |
| [28] |
ZHANG W X, LIU Z G, ZHU M, et al. Molecular cloning, expression and oxidative stress response of the vitellogenin G gene (AccVg) from Apis cerana cerana[J]. Apidologie, 2017, 48(5): 599-611. DOI:10.1007/s13592-017-0503-9 |
| [29] |
REINEKE A. Identification and expression of a small heat shock protein in two lines of the endoparasitic wasp Venturia canescens[J]. Comparative Biochemistry and Physiology Part A:Molecular & Integrative Physiology, 2005, 141(1): 60-69. |
| [30] |
ZHANG Y Y, LIU Y L, GUO X L, et al. SHsp22.6, an intronless small heat shock protein gene, is involved in stress defence and development in Apis cerana cerana[J]. Insect Biochemistry and Molecular Biology, 2014, 53: 1-12. DOI:10.1016/j.ibmb.2014.06.007 |
| [31] |
ŠLACHTA M, BERKOVÁ P, VAMBERA J, et al. Physiology of cold-acclimation in non-diapausing adults of Pyrrhocoris apterus (Heteroptera)[J]. European Journal of Entomology, 2013, 99(2): 181-187. |
| [32] |
于彩虹, 卢丹, 林荣华, 等. 海藻糖——昆虫的血糖[J]. 应用昆虫学报, 2008, 45(5): 832-837. DOI:10.3969/j.issn.0452-8255.2008.05.035 |
| [33] |
秦加敏, 罗术东, 和绍禹, 等. 昆虫海藻糖与海藻糖酶的特性及功能研究[J]. 环境昆虫学报, 2015, 37(1): 163-169. |
| [34] |
史彩华, 胡静荣, 李传仁, 等. 环境胁迫下昆虫的耐寒适应机制研究进展[J]. 植物保护, 2016, 42(6): 21-28. |
| [35] |
KLOWDEN M J. Physiological systems in insects[M]. 3rd ed. Amsterdam: Academic Press, 2013.
|
| [36] |
秦资.异色瓢虫TPS与Treh1基因低温诱导表达分析[D].硕士学位论文.杭州: 杭州师范大学, 2012.
|
| [37] |
王建华, 刘鸿先, 徐同. 超氧物歧化酶(SOD)在植物逆境和衰老生理中的作用[J]. 植物生理学通讯, 1989(1): 1-7. |
| [38] |
AHMAD S, DUVAL D L, WEINHOLD L C, et al. Cabbage looper antioxidant enzymes:tissue specificity[J]. Insect Biochemistry, 1991, 21(5): 563-572. DOI:10.1016/0020-1790(91)90111-Q |
| [39] |
吴启仙, 夏嫱. 重金属对昆虫抗氧化酶影响研究进展[J]. 环境昆虫学报, 2014, 36(2): 247-251. |




