2. 江苏省畜牧兽医总站, 南京 210017;
3. 扬州大学教育部农业与农产品安全国际合作联合实验室, 扬州 225009;
4. 江苏省宜兴市动物疫病预防控制中心, 宜兴 214206;
5. 廊坊职业技术学院, 廊坊 065001
2. Station of Animal Husbandry and Veterinary Medicine in Jiangsu Province, Nanjing 210017, China;
3. Joint International Research Laboratory of Agriculture and Agri-Product Safety of Ministry of Education of China, Yangzhou University, Yangzhou 225009, China;
4. Animal Disease Prevention and Control Center of Jiangsu Province, Yixing 214206, China;
5. Langfang Polytechnic Institute, Langfang 065001, China
短链脂肪酸(SCFA)是通过瘤胃内的微生物发酵饲粮中碳水化合物产生的有机脂肪酸,主要包括乙酸、丙酸和丁酸,约占总挥发性脂肪酸95%[1]。同时,瘤胃上皮能够吸收50%~80%的SCFA并为自身提供能量需求,吸收速度顺序为丁酸>丙酸>乙酸[2]。除了为反刍动物提供能量之外,SCFA能够调节瘦素的产生、中性粒细胞的招募以及抗菌肽的产生[3-5]。此外,SCFA也能够调控瘤胃上皮细胞的增殖发育、动物中枢神经系统和炎症反应[6-8]。最近的研究显示,肠道微生物能够积极地调节免疫反应从而预防肠道的炎症疾病发生[9-10]。这是由于肠道微生物发酵碳水化合物所产生的次生代谢产物SCFA所引起的。患有溃肠性结肠炎和其他慢性结肠炎疾病的病人往往伴随着肠道SCFA的减少[11]。
之前的研究证明,体内敲除G-蛋白偶联受体41(GPR41)的小鼠产生严重的炎症反应并减少免疫应答反应。与正常小鼠相比,通过乙醇诱导丢失GPR41基因功能的小鼠,结肠部分产生炎症反应且免疫应答反应显著降低[12]。在人的肾上皮细胞中,SCFA介导p38促分裂原活化蛋白激酶(MAPK)和c-Jun氨基端激酶(JNK)的磷酸化的减少,从而下调肿瘤坏死因子-α(TNF-α)的表达,显示抗炎症的作用,这主要依赖GPR41和G-蛋白偶联受体43(GPR43)信号通路[13]。Kim等[12]证明SCFA通过激活GPR41和GPR43来响应免疫反应,并激活p38和磷酸化细胞外信号调节激酶1/2(p-ERK1/2)MAPK信号分子。体内试验证明,丢失GPR43基因功能的小鼠显示趋化免疫细胞保护肠道的能力显著减弱,这个结果提示,GPR43对于免疫细胞的趋化以及对小鼠小肠免疫保护起到关键作用[4]。然而,GPR41调节中性粒细胞和免疫细胞趋化的研究仍然鲜见报道。之前的研究中,GPR41和GPR43已经被证明是SCFA的受体[14-15],这提示SCFA调控炎症反应可能通过GPR41和GPR43的介导。此外,GPR41和GPR43已经在奶牛不同的组织中被鉴定[16]。值得注意的是,本实验室建立的永生化奶牛瘤胃上皮细胞系能够表达GPR41,但不表达GPR43。我们推测SCFA调控奶牛瘤胃上皮细胞的炎症反应可能通过GPR41的介导。因此,本试验的目的是为了研究SCFA对奶牛瘤胃上皮细胞的炎性细胞因子、趋化因子和GPR41表达的影响。
1 材料与方法 1.1 试验材料DMEM/F12培养基、非必需氨基酸(NEAA)、磷酸盐缓冲液(PBS)和胰蛋白酶(Gibco,美国);乙酸、丙酸、丁酸、青霉素、链霉素、L-谷氨酰胺溶液、乙二胺四乙酸(EDTA)(Sigma,美国);Gemini胎牛血清、荧光定量96孔板和8连管(Bio-rad,美国);PrimeScriptTM RT Master Mix和SYBR Premix Ex TaqTM Ⅱ(TaKaRa,中国);总RNA提取试剂盒(Tiangen,中国)。来源于公犊奶牛瘤胃上皮细胞由扬州大学动物培养物保藏应用研究所(IACCA)提供[16]。
1.2 试验方法 1.2.1 SCFA对GPR41、炎性细胞因子和趋化因子表达的影响奶牛瘤胃上皮细胞培养于含有10%胎牛血清的DMEM/F12培养基中,放置于37 ℃、5% CO2培养箱中培养。试验分为4组,各组分别添加5、10、20和40 mmol/L SCFA培养奶牛瘤胃上皮细胞24 h。培养24 h之后,细胞被收集提取总RNA。每组试验样品3个重复。所有组乙酸、丙酸和丁酸的摩尔百分比分别为60%、25%和15%。5 mmol/L SCFA由3.00 mmol/L乙酸、1.25 mmol/L丙酸和0.75 mmol/L丁酸组成;10 mmol/L SCFA由6.00 mmol/L乙酸、2.50 mmol/L丙酸和1.50 mmol/L丁酸组成;20 mmol/L SCFA由12 mmol/L乙酸、5 mmol/L丙酸和3 mmol/L丁酸组成;40 mmol/L SCFA由24 mmol/L乙酸、10 mmol/L丙酸和6 mmol/L丁酸组成。
1.2.2 总RNA提取添加SCFA刺激奶牛瘤胃上皮细胞24 h之后,按照总RNA提取试剂盒提取总RNA。加1 mL的Trizol裂解液来裂解细胞,室温放置5 min,将细胞裂解液转移到1.5 mL的无酶离心管中;加入200 μL氯仿,盖好管盖,在漩涡振荡器上剧烈振荡15 s,室温放置3 min;4 ℃、13 400×g离心10 min,样品将会分层,最上层为无色的水相,细胞总RNA主要存在于水相中,把水相转移到新的1.5 mL的无酶离心管中,缓慢加入水相0.5倍体积无水乙醇,轻轻吹打混匀,将溶液转移至吸附柱中,4 ℃、13 400×g离心30 s;向吸附柱中加入500 μL去蛋白液RD,4 ℃、13 400×g离心30 s,弃废液,将吸附柱放入收集管中;再向吸附柱中加入700 μL的漂洗液RW,室温静置2 min,4 ℃、13 400×g离心30 s,弃废液;重复上述操作步骤;将含有总RNA的吸附柱放入收集管中,4 ℃、13 400×g离心2 min;打开吸附柱盖子于超净工作台上12 min后,去除残余有机液体;将吸附柱转入新的1.5 mL离心管中,加30 μL无RNA酶水,室温放置3 min,4 ℃、13 400×g离心2 min。取1 μL新鲜的样品,用One Drop仪器在260 nm条件下测定总RNA的浓度。
1.2.3 反转录成cDNA按照TaKaRa反转录试剂盒说明书将总RNA反转录为cDNA,试验于冰上操作,反转录体系10 μL:total RNA 500 ng、5×PrimeScript RT Master Mix 2 μL和无RNA酶水,总体积10 μL。反应条件:37 ℃ 15 min和85 ℃ 5 s,于4 ℃保存。
1.2.4 实时荧光定量PCR通过LightCycler ® 96实时荧光定量PCR仪进行mRNA水平定量。PCR反应体系20 μL:SYBR ® Premix Ex TaqTM Ⅱ Kit 10 μL、上游和下游引物(10 μmol/L)各0.8 μL、cDNA模板100 ng和灭菌蒸馏水,总体积20 μL。反应条件:95 ℃预变性30 s;95 ℃ 5 s,60 ℃ 30 s,40个循环,每个样品3个重复且使用磷酸甘油醛脱氢酶(GAPDH)作为内参基因。引物在表 1中列出。
|
|
表 1 实时荧光定量PCR引物 Table 1 Primers for qRT-PCR |
试验数据运用SPSS 16.0统计软件中的one-way ANOVA模块进行单因素方差分析,显著性检验应用LSD法。P>0.05表示差异不显著,P < 0.05表示差异显著。
2 结果与分析 2.1 SCFA对奶牛瘤胃上皮细胞GPR41表达的影响由图 1可知,随着SCFA浓度逐渐增加,GPR41表达量也逐渐上调。与添加5 mmol/L SCFA相比,添加10 mmol/L SCFA加强了GPR41表达量,差异不显著(P>0.05),但添加20和40 mmol/L SCFA显著加强了GPR41表达量(P < 0.05)。
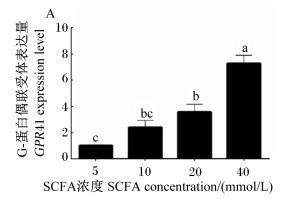
|
数据柱标注不同小写字母表示差异显著(P<0.05)。下图同。 Data columns with different small letters mean significant difference (P<0.05). The same as below. 图 1 SCFA对奶牛瘤胃上皮细胞GPR41表达的影响 Fig. 1 Effects of SCFA on expression of GPR41 in BRECs |
由图 2-A可知,随着SCFA浓度逐渐增加,IL-1β表达量也逐渐上调。与添加5 mmol/L SCFA相比,添加10 mmol/L SCFA加强了IL-1β表达量,但差异不显著(P>0.05);添加20和40 mmol/L SCFA显著加强了IL-1β表达量(P < 0.05)。由图 2-B可知,随着SCFA浓度由5 mmol/L增加至20 mmol/L SCFA,TNF-α表达量显著上调(P < 0.05)。
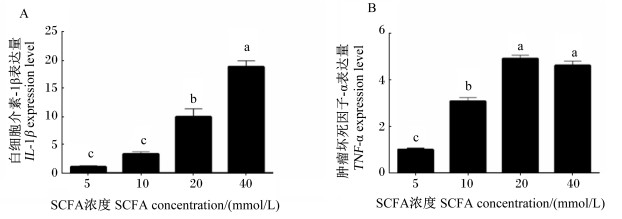
|
图 2 SCFA对奶牛瘤胃上皮细胞的炎性细胞因子表达的影响 Fig. 2 Effects of SCFA on expression of inflammatory cytokines in BRECs |
由图 3-A可知,添加5、10和20 mmol/L SCFA孵育奶牛瘤胃上皮细胞后,CCL20表达量没有显著变化(P>0.05),然而,添加40 mmol/L SCFA时,CCL20表达量显著增加(P < 0.05)。图 3-B可知,随着SCFA浓度逐渐增加,CXCL2表达量也逐渐上调。与添加5 mmol/L SCFA相比,添加10 mmol/L SCFA加强了CXCL2表达量,但差异不显著(P>0.05);添加20和40 mmol/L SCFA显著加强了CXCL2表达量(P < 0.05)。由图 3-C可知,随着SCFA浓度逐渐增加,CXCL3表达量显著上调(P < 0.05)。由图 3-D可知,随着SCFA浓度由5 mmol/L增加至20 mmol/L SCFA,CXCL8表达量显著上调(P < 0.05)。
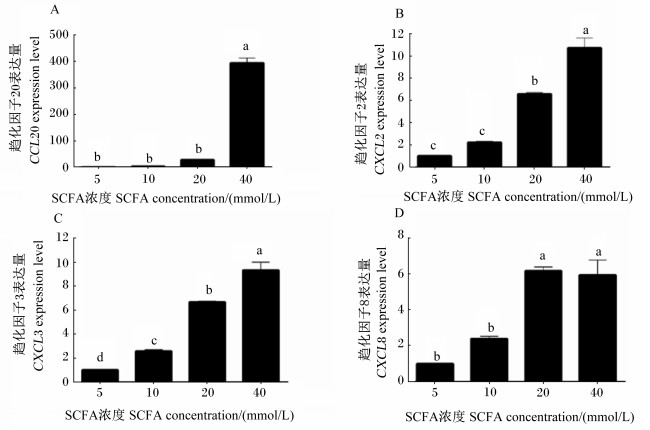
|
图 3 SCFA对奶牛瘤胃上皮细胞趋化因子表达的影响 Fig. 3 Effects of SCFA on expression of chemokines in BRECs |
SCFA在促进反刍动物瘤胃上皮的发育、增加血液中胰岛素、瘦素的含量和调节动物体内炎症反应中起到至关重要的作用[3-4, 12]。然而,SCFA调控反刍动物瘤胃上皮炎症反应潜在的机制还未被报道。SCFA能够激活GPR41和GPR43表达[14-15],这提示SCFA介导反刍动物瘤胃上皮炎症反应可能通过GPR41和GPR43调控。Wang等[16]证明GPR41和GPR43能够在奶牛瘤胃上皮组织中表达,然而,GPR43为低表达量。此外,分离的奶牛瘤胃上皮细胞中能够表达GPR41,但并不表达GPR43[17]。本试验结果证明了目前的假设,SCFA上调GPR41表达,从而进一步促进炎性细胞因子IL-1β、TNF-α和趋化因子的表达量。
目前的研究中,GPR41和GPR43对炎症反应的调控作用主要研究对象为人和小鼠[7, 12],对于反刍动物的研究知之甚少。SCFA诱导GPR43的表达,从而促进小鼠骨髓中性粒细胞的趋化[18]。体内注射乙醇能诱导小鼠结肠炎症反应,然而,丢失GPR41和GPR43基因条件下,小鼠IL-1β和白细胞介素-12(IL-12)表达量显著降低[11]。这些研究显示,GPR41和GPR43的激活能够加强促炎症因子高表达。本试验研究证明,随着SCFA浓度逐渐上升,GPR41表达量也逐渐上调,此外,IL-1β和TNF-α表达量也上调。在体内敲除小鼠GPR43基因之后,小鼠结肠淋巴结内T淋巴细胞显著增加以及结肠组织IL-1β、白细胞介素-6(IL-6)和白细胞介素-17(IL-17A)表达量也显著增加[7]。与野生型小鼠相比,双敲除的GPR41和GPR43基因的小鼠结肠对淋巴细胞趋化能力减弱,这是由于丢失的GPR41和GPR43并未响应SCFA信号刺激,从而下调CCL2、CCL5、CXCL2、CXCL10和CXCL13的表达量。随着SCFA浓度逐渐上升,GPR41表达量逐渐上调,同时,CCL20、CXCL2、CXCL3和CXCL8表达量也逐渐上调。瘤胃微生物发酵饲粮碳水化合物快速产生大量的有机酸,使瘤胃液pH降低,从而破坏革兰氏阴性菌并释放游离脂多糖(LPS),引起瘤胃上皮组织的炎症反应和小肠的炎症,最终导致反刍动物腹泻症状。饲喂高精料会产生大量的SCFA,同时也激活瘤胃上皮GPR41,增加CCL型和CXCL型趋化因子的表达量可趋化免疫细胞至瘤胃上皮层,从而介导瘤胃上皮保护性免疫反应。本试验结果表明,SCFA可能通过GPR41的激活来介导瘤胃上皮保护性免疫反应。
4 结论SCFA诱导GPR41表达,从而介导上调IL-1β和TNF-α的表达以及趋化因子CCL20、CXCL2、CXCL3和CXCL8的表达,因此,SCFA可通过GPR41的激活来介导瘤胃上皮保护性免疫反应。
| [1] |
BERGMAN E N. Energy contributions of volatile fatty acids from the gastrointestinal tract in various species[J]. Physiological Reviews, 1990, 70(2): 567-590. DOI:10.1152/physrev.1990.70.2.567 |
| [2] |
SICILIANO-JONES J, MURPHY M R. Production of volatile fatty acids in the rumen and cecum-colon of steers as affected by forage:concentrate and forage physical form[J]. Journal of Dairy Science, 1989, 72(2): 485-492. DOI:10.3168/jds.S0022-0302(89)79130-X |
| [3] |
XIONG Y, MIYAMOTO N, SHIBATA K, et al. Short-chain fatty acids stimulate leptin production in adipocytes through the G protein-coupled receptor GPR41[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(4): 1045-1050. DOI:10.1073/pnas.2637002100 |
| [4] |
SINA C, GAVRILOVA O, FÖRSTER M, et al. G protein-coupled receptor 43 is essential for neutrophil recruitment during intestinal inflammation[J]. Journal of Immunology, 2009, 183(11): 7514-7522. DOI:10.4049/jimmunol.0900063 |
| [5] |
KLES K A, CHANG E B. Short-chain fatty acids impact on intestinal adaptation, inflammation, carcinoma, and failure[J]. Gastroenterology, 2006, 130(2 Suppl 1): S100-S105. |
| [6] |
KIMURA I, INOUE D, MAEDA T, et al. G Short-chain fatty acids and ketones directly regulate sympathetic nervous system via G protein-coupled receptor 41(GPR41)[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(19): 8030-8035. DOI:10.1073/pnas.1016088108 |
| [7] |
MASLOWSKI K M, VIEIRA A T, NG A, et al. Regulation of inflammatory responses by gut microbiota and chemoattractant receptor GPR43[J]. Nature, 2009, 461(7268): 1282-1286. DOI:10.1038/nature08530 |
| [8] |
HAGUE A, ELDER D J E, HICKS D J, et al. Apoptosis in colorectal tumour cells:induction by the short chain fatty acids butyrate, propionate and acetate and by the bile salt deoxycholate[J]. International Journal of Cancer, 1995, 60(3): 400-406. DOI:10.1002/ijc.v60:3 |
| [9] |
WEN L, LEY R E, VOLCHKOV P Y, et al. Innate immunity and intestinal microbiota in the development of Type 1 diabetes[J]. Nature, 2008, 455(7216): 1109-1113. DOI:10.1038/nature07336 |
| [10] |
MAZMANIAN S K, ROUND J L, KASPER D L. A microbial symbiosis factor prevents intestinal inflammatory disease[J]. Nature, 2008, 453(7195): 620-625. DOI:10.1038/nature07008 |
| [11] |
TREEM W R, AHSAN N, SHOUP M, et al. Fecal short-chain fatty acids in children with inflammatory bowel disease[J]. Journal of Pediatric Gastroenterology and Nutrition, 1994, 18(2): 159-164. |
| [12] |
KIM M H, KANG S G, PARK J H, et al. Short-chain fatty acids activate GPR41 and GPR43 on intestinal epithelial cells to promote inflammatory responses in mice[J]. Gastroenterology, 2013, 145(2): 396-406. DOI:10.1053/j.gastro.2013.04.056 |
| [13] |
KOBAYASHI M, MIKAMI D, KIMURA H, et al. Short-chain fatty acids, GPR41 and GPR43 ligands, inhibit TNF-α-induced MCP-1 expression by modulating p38 and JNK signaling pathways in human renal cortical epithelial cells[J]. Biochemical and Biophysical Research Communications, 2017, 486(2): 499-505. DOI:10.1016/j.bbrc.2017.03.071 |
| [14] |
LE POUL E, LOISON C, STRUYF S, et al. Functional characterization of human receptors for short chain fatty acids and their role in polymorphonuclear cell activation[J]. Journal of Biological Chemistry, 2003, 278(28): 25481-25489. DOI:10.1074/jbc.M301403200 |
| [15] |
BROWN A J, GOLDSWORTHY S M, BARNES A A, et al. The orphan G protein-coupled receptors GPR41 and GPR43 are activated by propionate and other short chain carboxylic acids[J]. Journal of Biological Chemistry, 2003, 278(13): 11312-11319. DOI:10.1074/jbc.M211609200 |
| [16] |
WANG A, GU Z, HEID B, et al. Identification and characterization of the bovine G protein-coupled receptor GPR41 and GPR43 genes[J]. Journal of Dairy Science, 2009, 92(6): 2696-2705. DOI:10.3168/jds.2009-2037 |
| [17] |
詹康.SCFAs通过GPR41调控奶牛瘤胃上皮细胞炎症反应的研究[D].博士学位论文.扬州: 扬州大学, 2018.
|
| [18] |
VINOLO M A R, FERGUSON G J, KULKARNI S, et al. SCFAs induce mouse neutrophil chemotaxis through the GPR43 receptor[J]. PLoS One, 2011, 6(6): e21205. DOI:10.1371/journal.pone.0021205 |




