果胶寡糖(pectic oligosaccharide, POS)是一种功能性寡糖,它主要由以半乳糖醛酸为基质的果胶二糖和果胶三糖组成。近些年,相关的研究表明,在饲粮中添加山楂POS能调节小鼠的脂肪代谢和抗氧化能力[1-2];一些体外研究也发现,甜菜来源的POS可以改善人和猪肠道食糜中的微生物组成[3]。本团队前期的研究表明,饲粮添加苹果POS能改善断奶大鼠生长性能、抗氧化能力、肠道微生物组成和空肠黏膜结构[4];并改善了断奶仔猪的生长性能和免疫力[5],且其在饲粮中的添加剂量以200 mg/kg为宜。
轮状病毒(rotavirus, RV)是一种双链RNA病毒,其是通过引起严重胃肠炎而导致幼龄动物和婴幼儿腹泻的主要病原之一;流行病学表明,仔猪对RV极为易感,初生仔猪感染其的死亡率可达100%,且RV易感部位主要集中在消化道前段(即十二指肠和空肠)[6-8]。但是,也有研究报道,RV将侵袭回肠,并损伤回肠的屏障功能[9]。本团队前期的研究已表明,饲粮添加POS可以缓解RV攻毒对仔猪空肠屏障功能的影响[10]。但是,目前对于饲粮添加POS是否也能够改善RV攻毒对仔猪回肠的影响尚未见报道。因此,本试验的目的在于考察饲粮中添加POS对RV感染仔猪回肠屏障功能的影响,以期进一步完善POS预防RV感染对机体影响的可能原因,并为POS在动物生产上的应用和推广提供试验支撑。
1 材料与方法 1.1 试验材料POS产品:主要是果胶二糖和果胶三糖,另有半乳糖醛酸单糖,载体为玉米淀粉(POS的有效含量为30%,由中国农业科学院饲料研究所提供)。
RV:OSU(G5P9)毒株(ATCC#VR-893),购自国家兽医微生物菌种保藏管理中心。
1.2 试验动物与设计试验选取28头平均体重约为7.54 kg健康的断奶仔猪(“杜×长×大”),采用2×2因子试验设计,即POS处理(添加或不添加POS饲粮)和RV攻毒(灌服RV或无菌培养液)。全部仔猪采用代谢笼饲养。试验第1天仔猪空腹称重后,根据体重相近原则,将所有仔猪随机分为2个组,每个组14个重复,每个重复1头猪,分别饲喂添加0或200 mg/kg POS的饲粮。试验第15天,所有仔猪灌服100 mmol/L碳酸氢钠(NaHCO3)溶液5 mL,20 min后,每个饲粮处理中随机选取7头仔猪口服RV(1.4×107 TCID50/mL)4 mL,剩余仔猪口服无菌培养液4 mL。试验期18 d。
1.3 试验饲粮及营养水平试验采用玉米-豆粕型基础饲粮,参照NRC(2012)7~11 kg阶段仔猪营养需要配制。通过在基础饲粮中添加或不添加200 mg/kg POS构成试验饲粮,添加的POS等量替代基础饲粮中的玉米淀粉。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验在四川农业大学动物营养研究所教学科研基地代谢室进行。所有仔猪预饲喂2 d,使其适应粉状饲粮和饲养环境。猪舍温度控制在27~30 ℃,相对湿度不高于80%,每天饲喂4次(08:00、12:00、16:00和20:00),以每次采食后料槽有少量余料为度。所有仔猪自由饮水,试验期间消毒、清扫按常规程序进行,并保持猪舍通风、清洁。
1.5 RV培养本试验中RV培养、强化和病毒滴度测定按文献Mao等[11]提供的方法,选用恒河猴肾细胞系(MA104)进行。
1.6 测定指标及方法 1.6.1 腹泻率攻毒后,每天进行粪便评分(0,正常;1,黏性粪便;2,半液体状粪便;3,液体状粪便);当粪便评分≥2时,记为腹泻,并计算每个组仔猪每天的腹泻率。
1.6.2 样品采集试验第19天,通过心脏注射戊巴比妥钠(50 mg/kg BW)和颈静脉放血的方法屠宰所有仔猪,迅速取出回肠,并用冰生理盐水冲洗。取3 cm的回肠固定于4%多聚甲醛溶液中,并通过载玻片刮取回肠黏膜,收集回肠食糜。回肠黏膜和食糜经过液氮速冻后,存于-80 ℃。
1.6.3 回肠黏膜形态的检测仔猪回肠黏膜形态(绒毛高度、隐窝深度和绒毛高度/隐窝深度)的测定参考Mao等[12]的方法进行。
1.6.4 回肠黏膜RV非结构蛋白4(non-structural protein 4, NSP4)和抗氧化能力的检测称取约1 g回肠黏膜组织,按重量体积比1 : 9的比例加入预冷的生理盐水,置于冰上匀浆后,匀浆液于冷冻离心机中以5 000×g离心10 min,取上清液用于指标检测。
仔猪回肠黏膜中RV NSP4的阳性检出率采用上海诺渊有限公司生产的酶联免疫吸附试验(ELISA)试剂盒测定,操作按照试剂盒说明书进行。
仔猪回肠黏膜中丙二醛(malondialdehyde, MDA)含量和总抗氧化能力(total antioxidant capacity, T-AOC)采用南京建成生物工程研究所的试剂盒检测,操作按照试剂盒说明书进行。
1.6.5 回肠黏膜中紧密连接蛋白和黏液蛋白基因表达回肠黏膜中闭锁小带蛋白-1(ZO-1)、闭合蛋白(occludin)、黏蛋白(mucin)1和mucin2的表达量,采用实时荧光定量PCR技术测定,具体方法参考Mao等[13]。
1.6.6 回肠食糜中菌群数量回肠食糜中菌群(总菌、乳酸杆菌和大肠杆菌)的数量采用实时荧光定量PCR技术测定,具体方法参考Mao等[13]。
1.7 数据处理与分析试验数据采用Excel 2007进行初步整理,除了腹泻率和RV NSP4阳性率的数据外,其他数据采用SAS 8.0软件中的两因子方差分析,模型主效应包括RV攻毒和饲粮添加POS以及二者之间的互作,差异显著后进行Duncan氏多重比较,各指标以每个重复为单位统计,数据以“平均值±标准误”表示。以P < 0.05为差异显著判定标准,以0.05≤P < 0.10为有差异趋势的判定标准。
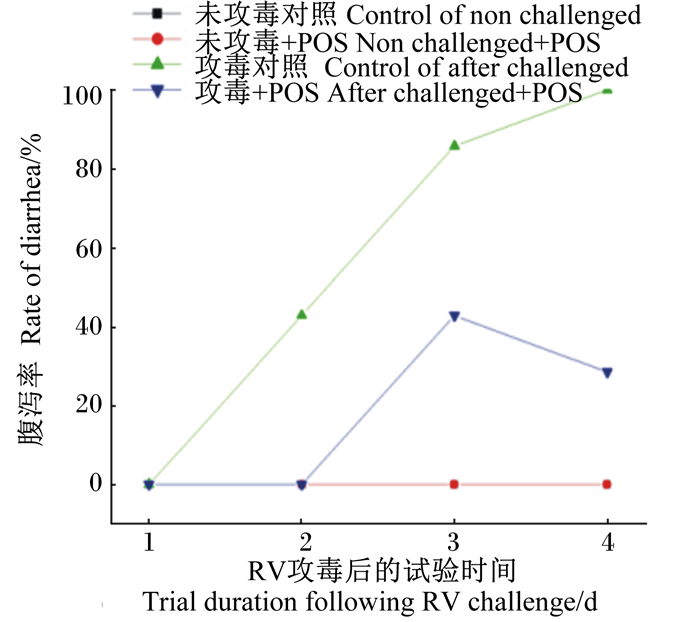
2 结果 2.1 饲粮添加POS对RV攻毒断奶仔猪腹泻率和回肠黏膜RV NSP4阳性率的影响从图 1和表 2中可以看出,RV攻毒提高了仔猪的腹泻率和回肠黏膜中RV NSP4的阳性率;而饲粮中添加POS可以延缓仔猪腹泻的发生,缩短腹泻时间,并降低回肠黏膜中RV NSP4的阳性率。
|
图 1 饲粮添加POS对RV攻毒断奶仔猪腹泻率的影响 Fig. 1 Effect of dietary POS on diarrhea rate of weaned piglets challenged by RV |
|
|
表 2 饲粮添加POS对RV攻毒断奶仔猪回肠黏膜RV NSP4阳性率的影响 Table 2 Effects of dietary POS on RV NSP4 positive rate in ileal mucosa of weaned piglets challenged by RV |
从表 3可以看出,RV攻毒显著降低了断奶仔猪回肠黏膜的绒毛高度和绒毛高度/隐窝深度值(P < 0.05);饲粮添加POS显著提高了断奶仔猪回肠黏膜的绒毛高度/隐窝深度值(P < 0.05),并有提高绒毛高度的趋势(P=0.07),且在一定程度上缓解了RV攻毒对断奶仔猪回肠黏膜的绒毛高度和绒毛高度/隐窝深度的影响。
|
|
表 3 饲粮添加POS对RV攻毒断奶仔猪回肠黏膜形态的影响 Table 3 Effects of dietary POS on ileal mucosa morphology of weaned piglets challenged by RV |
从表 4可以看出,RV攻毒显著提高了断奶仔猪回肠黏膜中MDA含量(P < 0.05),显著降低了回肠黏膜中T-AOC(P < 0.05);饲粮添加POS显著提高了回肠黏膜中T-AOC(P < 0.05),显著降低了回肠黏膜中MDA含量(P < 0.05),且显著缓解了RV攻毒对仔猪回肠黏膜抗氧化能力的影响(P < 0.05)。
|
|
表 4 饲粮添加POS对RV攻毒断奶仔猪回肠黏膜抗氧化能力的影响 Table 4 Effects of dietary POS on antioxidant capacity in ileal mucosa of weaned piglets challenged by RV |
从表 5可以看出,RV攻毒显著降低了断奶仔猪回肠黏膜中ZO-1、occludin、mucin1和mucin2的表达量(P < 0.05);饲粮中添加POS显著提高了回肠黏膜中occludin、mucin1和mucin2的表达量(P < 0.05),且显著缓解了RV攻毒对仔猪回肠黏膜中occludin、mucin1和mucin2表达的影响(P < 0.05)。
|
|
表 5 饲粮添加POS对RV攻毒断奶仔猪回肠黏膜紧密连接蛋白和黏液蛋白基因表达的影响 Table 5 Effects of dietary POS on gene expressions of tight junction protein and mucin in ileal mucosa of weaned piglets challenged by RV |
从表 6可以看出,RV攻毒显著降低了断奶仔猪回肠食糜中乳酸杆菌和总菌的数量(P < 0.05),显著提高了回肠食糜中大肠杆菌的数量(P < 0.05);饲粮中添加POS显著提高了回肠食糜中乳酸杆菌和总菌的数量(P < 0.05),显著降低了回肠食糜中大肠杆菌的数量(P < 0.05),且显著缓解了RV攻毒对仔猪回肠食糜中乳酸杆菌、大肠杆菌和总菌的影响(P < 0.05)。
|
|
表 6 饲粮添加POS对RV攻毒断奶仔猪回肠食糜中菌群数量的影响 Table 6 Effects of dietary POS on microflora amounts in ileal digesta of weaned piglets challenged by RV |
作为一种影响健康的病原,RV主要是诱导幼龄动物和婴幼儿严重胃肠炎和腹泻[6-8]。本研究中,RV攻毒诱导了断奶仔猪腹泻,损伤了回肠的屏障功能,这与前人的研究结果[14-16]一致。本研究还发现,RV攻毒提高了断奶仔猪回肠黏膜中RV的NSP4阳性率。综上结果表明,本试验成功构建了RV感染模型。
作为RV产生的一种非结构蛋白,NSP4在RV诱导腹泻过程中发挥着重要的作用,这也使得NSP4已作为一种RV感染的标识[17]。在本研究中,尽管RV攻毒提高了断奶仔猪回肠黏膜中RV NSP4的阳性率,但饲粮中添加POS则降低了回肠黏膜中RV NSP4的阳性率。这表明,饲粮添加POS能在一定程度上抑制RV对回肠的侵袭。肠道屏障功能在抵御病原侵袭过程中发挥着重要作用,那么,POS抑制RV侵袭回肠可能源于其改善了仔猪肠道屏障功能。
非特异性屏障机制是肠道屏障功能的组成成分,其包含了黏膜上皮完整性、上皮细胞间的紧密连接和黏膜胶质层[18]。一般来说,黏膜上皮完整性可通过形态结构测定黏膜表面积进行评价[19];细胞间紧密连接蛋白表达量可说明细胞间紧密连接的状态[20];肠道黏膜上皮细胞和杯状细胞产生的黏液蛋白是黏膜胶质层的主要成分[21]。本研究中,饲粮添加POS可缓解RV攻毒对肠道黏膜形态及黏膜上皮紧密连接蛋白和黏液蛋白表达的影响,这些说明POS抑制RV侵袭回肠的过程依赖于其对非特异性屏障机制的改善作用。
机体的氧化还原状态与细胞活性和动物健康密切相关[22-23]。而本团队前期的研究表明,RV感染引起的肠道非特异性屏障机制损伤也主要源于其破坏了肠道上皮细胞的氧化还原状态[10]。本研究发现,RV感染可在一定程度上破坏仔猪回肠黏膜的氧化还原状态,而饲粮添加POS缓解了RV感染引起的回肠黏膜氧化还原状态失衡。因此,POS对RV攻毒仔猪回肠非特异性屏障机制的改善作用与其提高了抗氧化水平有关。
与本团队之前在大鼠和断奶仔猪关于POS调节盲肠食糜的研究结果[5, 10]一致,本研究发现,饲粮添加POS可显著提高仔猪回肠食糜中乳酸杆菌和总菌数量,降低了大肠杆菌数量,且改善RV攻毒对回肠食糜中菌群的影响。作为肠道屏障功能的重要组成部分,肠道微生物的组成在维持肠道健康过程中也发挥了重要作用[24]。因此,POS缓解RV侵袭回肠也与其可改善肠道微生物组成有关。
基于本研究中POS可改善回肠屏障功能,防止RV侵入回肠,与本团队前期在POS对RV感染仔猪空肠屏障功能影响的研究结果[10]对比,可以发现POS在回肠中的优化作用并未达到其在空肠中的效果。分析其原因,可能在于虽然RV感染对回肠屏障功能也会产生影响,但没有其对空肠屏障功能的影响大(即RV的侵袭主要还是发生在肠道前段)。
4 结论饲粮添加POS可以预防RV诱导腹泻的发生,这一过程除了POS主要对前肠段屏障功能的优化作用,部分也涉及到了POS改善RV对回肠氧化还原状态、非特异性屏障机制和微生物菌群的损伤。
| [1] |
LI T P, LI S H, DU L J, et al. Effects of haw pectic oligosaccharide on lipid metabolism and oxidative stress in experimental hyperlipidemia mice induced by high-fat diet[J]. Food Chemistry, 2010, 121(4): 1010-1013. DOI:10.1016/j.foodchem.2010.01.039 |
| [2] |
LI T P, ZHU R G, DONG Y P, et al. Effects of pectin pentaoligosaccharide from hawthorn (Crataegus pinnatifida Bunge. var. Major) on the activity and mRNA levels of enzymes involved in fatty acid oxidation in the liver of mice fed a high-fat diet[J]. Journal of Agricultural and Food Chemistry, 2013, 61(31): 7599-7605. DOI:10.1021/jf400283w |
| [3] |
LEIJDEKKERS A G M, AGUIRRE M, VENEMA K, et al. In vitro fermentability of sugar beet pulp derived oligosaccharides using human and pig fecal inocula[J]. Journal of Agricultural and Food Chemistry, 2014, 62(5): 1079-1087. DOI:10.1021/jf4049676 |
| [4] |
毛湘冰, 冯小花, 陈代文, 等. 饲粮添加苹果果胶寡糖对断奶大鼠生长性能、抗氧化能力和肠道健康的影响[J]. 动物营养学报, 2016, 28(9): 2872-2877. DOI:10.3969/j.issn.1006-267x.2016.09.026 |
| [5] |
CHEN H, HU H Y, CHEN D W, et al. Dietary pectic oligosaccharide administration improves growth performance and immunity in weaned pigs infected by rotavirus[J]. Journal of Agricultural and Food Chemistry, 2017, 65(14): 2923-2929. DOI:10.1021/acs.jafc.7b00039 |
| [6] |
任文华, 崔志洪. 猪轮状病毒概述[J]. 畜牧兽医杂志, 2005, 24(5): 21-25. |
| [7] |
DONELLI G, SUPERTI F. The rotavirus genus[J]. Comparative Immunology, Microbiology and Infectious Diseases, 1994, 17(3/4): 305-320. |
| [8] |
BARNETT B. Viral gastroenteritis[J]. Medical Clinics of North America, 1983, 67(5): 1031-1058. DOI:10.1016/S0025-7125(16)31165-8 |
| [9] |
WU S P, YUAN L J, ZHANG Y G, et al. Probiotic Lactobacillus rhamnosus GG mono-association suppresses human rotavirus-induced autophagy in the gnotobiotic piglet intestine[J]. Gut Pathogens, 2013, 5(1): 22. DOI:10.1186/1757-4749-5-22 |
| [10] |
MAO X B, XIAO X J, CHEN D W, et al. Dietary apple pectic oligosaccharide improves gut barrier function of rotavirus-challenged weaned pigs by increasing antioxidant capacity of enterocytes[J]. Oncotarget, 2017, 8(54): 92420-92430. |
| [11] |
MAO X B, GU C S, REN M, et al. L-isoleucine administration alleviates rotavirus infection and immune response in the weaned piglet model[J]. Frontiers in Immunology, 2018, 9: 1654. DOI:10.3389/fimmu.2018.01654 |
| [12] |
MAO X B, LIU M H, TANG J, et al. Dietary leucine supplementation improves the mucin production in the jejunal mucosa of the weaned pigs challenged by porcine rotavirus[J]. PLoS One, 2015, 10(9): e0137380. DOI:10.1371/journal.pone.0137380 |
| [13] |
MAO X B, GU C S, HU H Y, et al. Dietary Lactobacillus rhamnosus GG supplementation improves the mucosal barrier function in the intestine of weaned piglets challenged by porcine rotavirus[J]. PLoS One, 2016, 11(1): e0146312. DOI:10.1371/journal.pone.0146312 |
| [14] |
JUNTUNEN M, KIRJAVAINEN P V, OUWEHAND A C, et al. Adherence of probiotic bacteria to human intestinal mucus in healthy infants and during rotavirus infection[J]. Clinical and Diagnostic Laboratory Immunology, 2001, 8(2): 293-296. |
| [15] |
TIAN G, LIANG X F, CHEN D W, et al. Vitamin D3 supplementation alleviates rotavirus infection in pigs and IPEC-J2 cells via regulating the autophagy signaling pathway[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2016, 163: 157-163. DOI:10.1016/j.jsbmb.2016.05.004 |
| [16] |
BOSHUIZEN J A, REIMERINK J H J, KORTELAND-VAN MALE A M, et al. Changes in small intestinal homeostasis, morphology, and gene expression during rotavirus infection of infant mice[J]. Journal of Virology, 2003, 77(24): 13005-13016. DOI:10.1128/JVI.77.24.13005-13016.2003 |
| [17] |
HORIE Y, NAKAGOMI O, KOSHIMURA Y, et al. Diarrhea induction by rotavirus NSP4 in the homologous mouse model system[J]. Virology, 1999, 262(2): 398-407. |
| [18] |
MAO X B, ZENG X F, QIAO S Y, et al. Specific roles of threonine in intestinal mucosal integrity and barrier function[J]. Frontiers in Bioscience, 2011, 3: 1192-1200. |
| [19] |
POTTEN C S, KELLET M, ROBERTS S A, et al. Measurement of in vivo proliferation in human colorectal mucosa using bromodeoxyuridine[J]. Gut, 1992, 33(1): 71-78. |
| [20] |
LAUKOETTER M G, BRUEWER M, NUSRAT A. Regulation of the intestinal epithelial barrier by the apical junctional complex[J]. Current Opinion in Gastroenterology, 2006, 22(2): 85-89. DOI:10.1097/01.mog.0000203864.48255.4f |
| [21] |
DEPLANCKE B, GASKINS H R. Microbial modulation of innate defense:goblet cells and the intestinal mucus layer[J]. The American Journal of Clinical Nutrition, 2001, 73(6): 1131S-1141S. DOI:10.1093/ajcn/73.6.1131S |
| [22] |
KUREK-GÓRECKA A, RZEPECKA-STOJKO A, GÓRECKI M, et al. Structure and antioxidant activity of polyphenols derived from propolis[J]. Molecules, 2014, 19(1): 78-101. |
| [23] |
WANG J, JI H F, WANG S X, et al. Lactobacillus plantarum ZLP001:in vitro assessment of antioxidant capacity and effect on growth performance and antioxidant status in weaning piglets[J]. Asian-Australasian Journal of Animal Sciences, 2012, 25(8): 1153-1158. DOI:10.5713/ajas.2012.12079 |
| [24] |
ELLIS R J, BRUCE K D, JENKINS C, et al. Comparison of the distal gut microbiota from people and animals in Africa[J]. PLoS One, 2013, 8(1): e54783. DOI:10.1371/journal.pone.0054783 |



