我国是产粮大国,在粮食高产的同时,大量的农作物秸秆既为我国可再生资源应用方面提供了优势,也带来了不可忽视的环境污染等问题。据统计,世界秸秆的年产量为20亿~30亿t,中国各类农作物秸秆年产量为6亿~8亿t,占全世界秸秆总产量的20%~30%。其中玉米秸秆作为中国第一大农作物秸秆,年产量可达到2亿t以上[1]。玉米秸秆中含有丰富的纤维素、半纤维素以及木质素[2],因此玉米秸秆可以作为动物的粗饲料加以利用。但由于其营养成分不平衡,粗蛋白质含量过低,且适口性较差,不能满足反刍动物对营养物质的需求。玉米秸秆中的木质素与纤维素、半纤维素间形成的坚固酯键结构[3],使营养物质不能被反刍动物充分利用,导致了玉米秸秆消化率低下[4],并且秸秆的木质化程度越高,其消化率越低。为了改善玉米秸秆的饲用价值,许多研究工作者将目光转向微生物发酵技术,例如运用芽孢杆菌属、木霉属[5]以及白腐真菌[6-7]等可降解木质纤维素的菌种来生产高品质的发酵粗饲料。拟康宁木霉(Trichoderma koningiopsis)是一种木霉属真菌,据报道用其发酵秸秆以及油茶籽渣等农业副产物,纤维素降解率可达到20%以上[8-9]。拟康宁木霉的纤维素分解能力突出,但因其自身产酶特性,无法有效地降解木质素,这在一定程度上限制了其分解纤维素的能力。黄孢原毛平革菌(Phanerochaete chrysosporium)是白腐真菌的一种,其分泌的锰过氧化物酶、漆酶、木质素过氧化物酶等胞外酶可有效降解秸秆中的木质素[10-12],使原本被木质素包裹的纤维素、半纤维素释放出来。拟康宁木霉与黄孢原毛平革菌因其具有较强的纤维素和木质素降解能力,均被广泛应用于秸秆饲料的研究与开发当中,但是运用该2种菌进行混合发酵的研究还很少见。为此,本研究使用拟康宁木霉和黄孢原毛平革菌对玉米秸秆进行混合发酵,探讨其最优发酵条件,以期为降低玉米秸秆中木质素与纤维素的含量从而提高玉米秸秆的饲用价值提供理论依据。
1 材料与方法 1.1 试验材料 1.1.1 菌种所需菌种为黄孢原毛平革菌CICC 40299和拟康宁木霉B17。黄孢原毛平革菌购自中国工业微生物菌种保藏管理中心,拟康宁木霉由黑龙江八一农垦大学动物营养实验室提供。
1.1.2 玉米秸秆玉米秸秆收购自大庆市周边农户,在自然风干后,用粉碎机粉碎过60目筛备用。
1.1.3 培养基黄孢原毛平革菌液体种子培养基:马铃薯提取液1 L,葡萄糖20 g,KH2PO4 3 g,MgSO4·7H2O 1.5 g,维生素B1微量。121 ℃灭菌15 min。
拟康宁木霉液体种子培养基:马铃薯提取液1 L,葡萄糖10 g,蔗糖10 g,MgSO4·7H2O 2 g,KH2PO4 1 g,蛋白胨1.5 g,酵母浸出物1.5 g,维生素B1微量。121 ℃灭菌15 min。
Mandels营养液:(NH4)2SO4 3 g,KH2PO4 3 g,MgSO4·7H2O 2 g,NaNO3 0.3 g,FeCl3 0.5 g,加入1 000 mL水。
固态发酵培养基:玉米秸秆粉8 g,麦麸2 g,按要求加入Mandels营养液,并将水分调节至50%~60%,装于250 mL锥形瓶中。121 ℃灭菌15 min。
1.2 菌种培养菌种活化:将保存的拟康宁木霉和黄孢原毛平革菌接种到马铃薯葡萄糖琼脂(PDA)培养基上,在28 ℃条件下培养5 d,并转接活化2次,放于4 ℃保存备用。
液体菌种培养:将PDA培养基上的2菌种分别接种到与菌种相对应的液体种子培养基中,黄孢原毛平革菌于28 ℃、150 r/min条件下振荡培养7 d,拟康宁木霉于25 ℃、150 r/min条件下振荡培养7 d。采用血球计数板计数,将2菌种的孢子浓度控制在1×108个/mL。
1.3 固态发酵培养将培养好的液体菌种按要求接种到固态发酵培养基中,混匀后于28 ℃下发酵。
1.4 拟康宁木霉与黄孢原毛平革菌单菌发酵玉米秸秆将2单菌分别接种到固态发酵培养基中,接种量20%,营养液添加量80%,发酵天数8 d,发酵结束后测定木质素和纤维素的降解率。
1.5 拟康宁木霉与黄孢原毛平革菌混合发酵玉米秸秆 1.5.1 单因素接种拟康宁木霉与黄孢原毛平革菌以菌种比例(拟康宁木霉:黄孢原毛平革菌)、接种量、营养液添加量和发酵天数作为单因素,考察其对玉米秸秆木质素和纤维素降解率的影响,每组试验设3个重复。
分别在固态发酵培养基中接入菌种比例为1:1、1:2、1:3、1:4和1:5的菌液,接种量为20%,营养液添加量为80%,发酵天数8 d。
分别在固态发酵培养基中按玉米秸秆粉与麦麸质量接入10%、15%、20%、25%、30%的菌液,菌种比例为1:3,营养液添加量为80%,发酵天数8 d。
分别在固态发酵培养基中按玉米秸秆粉与麦麸质量加入60%、70%、80%、90%和100%的营养液,菌种比例为1:3,接种量为20%,发酵天数8 d。
在固态发酵培养基中加入菌种比例为1:3的菌液,接种量为20%,营养液添加量为80%,分别发酵4、6、8、10、12 d。
1.5.2 拟康宁木霉与黄孢原毛平革菌混合发酵最优条件在单因素试验的基础上,采用Design Expert 8.0.6软件,根据Box-Benhnken试验设计原理,选取菌种比例、接种量、营养液添加量和发酵天数4个因素,以纤维素和木质素降解率为响应值,每个因素取3个水平,进行响应面分析和试验,并建立木质素和纤维素降解率与各因素之间的数学模型,通过计算来优化最佳的发酵条件,从而确定拟康宁木霉与黄孢原毛平革菌混合发酵降解木质素和纤维素的最佳条件。
1.6 木质素与纤维素降解率的测定纤维素、木质素含量的测定参考范氏洗涤纤维分析法[13]。
1.7 数据处理试验数据使用Excel 2007软件整理,然后采用SPSS 16.0软件的one-way ANOVA、Duncan氏多重比较法进行分析,以P < 0.05为差异显著,P < 0.01为差异极显著。
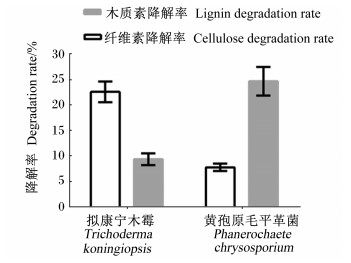
2 结果与分析 2.1 拟康宁木霉与黄孢原毛平革菌单菌发酵玉米秸秆由图 1可知,拟康宁木霉对纤维素和木质素降解率分别为22.64%和9.23%,黄孢原毛平革菌对纤维素和木质素降解率分别为7.81%和24.83%。两者均能在一定程度上降解木质素与纤维素,但侧重点不同。
|
图 1 拟康宁木霉与黄孢原毛平革菌单菌发酵玉米秸秆 Fig. 1 Fermentation of corn stalk by Trichoderma koningiopsis and Phanerochaete chrysosporium |
由表 1可知,随着菌种比例的改变拟康宁木霉的相对含量逐渐减少,黄孢原毛平革菌的相对含量逐渐增加,纤维素降解率在菌种比例1:3时达到29.19%,木质素降解率在菌种比例1:4时达到23.56%,两者都呈先升高而后略微降低的趋势。主要原因是黄孢原毛平革菌对分解木质素起主要作用,在黄孢原毛平革菌相对含量增加的同时,更多的木质素将被其降解,当菌种比例超过1:3后,木质素降解率差异不显著(P>0.05)。同时黄孢原毛平革菌具备协同降解纤维素的能力,这是随着菌种比例的改变使拟康宁木霉相对含量减少,但纤维素降解率仍有上升趋势的主要原因。当菌种比例超过1:3时,拟康宁木霉相对含量过低,导致纤维素降解率开始下降。
|
|
表 1 菌种比例对纤维素和木质素降解率的影响 Table 1 Effects of fungus ratio on degradation rate of cellulose and lignin |
由表 2可知,随着接种量的增加,纤维素和木质素降解率也随之升高,当接种量为25%时,两者的降解率均达到最大值,分别为31.10%和25.59%,显著高于其他接种量组的降解率(P < 0.05)。固态发酵过程中适宜的接种量可以缩短菌种菌丝生长的延迟期,使拟康宁木霉和黄孢原毛平革菌可以尽快地合成用于分解纤维素和木质素的漆酶、锰过氧化物酶、木质素过氧化物酶以及纤维素酶等。但是接种量过高会使固态发酵培养基中的营养物质的消耗过快,影响菌种后期的各种正常生命活动。同时菌种产生的代谢产物也会在短期内增多,使合成各种分解酶的速率降低。因此当接种量为25%时较为适宜。
|
|
表 2 接种量对纤维素和木质素降解率的影响 Table 2 Effects of inoculation amount on degradation rate of cellulose and lignin |
由表 3可知,当营养液添加量为70%时,木质素降解率最高为22.88%,显著高于营养液添加量为60%时的木质素降解率(P < 0.05),之后随营养液添加量增多而略微降低。纤维素降解率在营养液添加量为60%时显著低于其他组别(P < 0.05),且其他4组间差异不显著(P>0.05)。为了能够批量发酵节约成本,营养液添加量为70%最佳。
|
|
表 3 营养液添加量对纤维素和木质素降解率的影响 Table 3 Effects of additive amount of nutrient solution on degradation rate of cellulose and lignin |
由表 4可知,拟康宁木霉和黄孢原毛平革菌在前4 d主要生长菌丝,而后纤维素和木质素降解率随发酵时间的增加快速升高,发酵8 d后,两者的降解速度渐缓,当发酵进行到12 d时,纤维素和木质素降解率分别达到29.03%和26.11%。随着发酵天数的增加,固态发酵培养基中剩余的营养物质逐渐减少,菌种的生长和代谢速度减慢,用于降解的相关酶分泌减少,因此纤维素和木质素降解速率会逐渐降低。综合考虑,发酵天数为10 d最佳。
|
|
表 4 发酵天数对纤维素和木质素降解率的影响 Table 4 Effects of fermentation day on degradation rate of cellulose and lignin |
结合单因素试验结果,采用Design Expert 8.0.6软件进一步优化各因素的参数。响应面试验设计因素水平及编码见表 5,Box-Behnken响应面试验设计及结果见表 6。
|
|
表 5 响应面试验设计因素水平及编码 Table 5 Response surface design factor levels and coding |
|
|
表 6 Box-Behnken响应面试验设计及结果 Table 6 Box-Behnken response surface design and results |
根据表 6试验结果,采用Design Expert 8.0.6软件对结果进行分析。由表 7可知,B、C、D、AB、AC、CD、A2、B2、C2、D2对纤维素降解率有极显著影响(P < 0.01),A对纤维素降解率有显著影响(P < 0.05),说明这些是固态发酵过程中的重要因素。失拟项不显著(P>0.05),说明试验数据中无异常点,模型合适。由表 8可知,B、D、AD、BC、A2、B2、C2、D2对木质素降解率有极显著影响(P < 0.01),A、C、AC、CD对木质素降解率有显著影响(P < 0.05),说明这些是固态发酵过程中的重要因素。失拟项不显著(P>0.05),说明试验数据中无异常点,模型合适。
|
|
表 7 纤维素降解率响应面结果方差分析 Table 7 Variance analysis of cellulose degradation rate response surface results |
|
|
表 8 木质素降解率响应面结果方差分析 Table 8 Variance analysis of lignin degradation rate response surface results |
根据纤维素降解率响应面系数的回归分析,得到模型的拟合方程为:Y=36.64+0.99A-2.02B+1.59C+1.42D-3.69AB+2.23AC-0.099AD+0.82BC-1.07BD+3.35CD-5.08A2-4.38B2-3.71C2-5.84D2。从表 7可知,回归模型极显著(P < 0.01),失拟项不显著(P=0.352 4),表明回归方程拟合度良好。回归方程的复相关系数为0.969 1,表明96.91%的纤维素降解率变化可由此模型解释,与实际情况拟合良好。校正相关系数为0.938 1,纤维素降解率变异系数为4.18%,信噪比为16.38,说明模型可信度较高。
根据木质素降解率响应面系数的回归分析,得到模型的拟合方程为:Y=28.59+0.91A+2.70B+0.83C+2.77D+0.65AB-1.57AC+1.89AD+1.97BC+0.54BD+1.23CD-2.77A2- 4.40B2-5.05C2-3.92D2。从表 8可知,回归模型极显著(P < 0.01),失拟项不显著(P=0.948 5),表明回归方程拟合度良好。回归方程的复相关系数为0.969 9,表明96.99%的木质素降解率变化可由此模型解释,与实际情况拟合良好。校正相关系数为0.939 8,木质素降解率变异系数为4.98%,信噪比为16.915,说明模型可信度较高。
2个方程为纤维素和木质素的降解提供了一个合适的模型,因此可用上述2模型代替真实试验点对拟康宁木霉与黄孢原毛平革菌降解纤维素和木质素进行预测与分析。
2.3.2 纤维素降解率响应面结果分析根据回归方程所做的响应面图可直观地反映各因素及两两因素的交互作用对响应值的影响。交互图中的曲面坡度越大,等高线越接近椭圆形,则代表该因素对响应值的影响越大。固定其中2因素,分析另外2因素间的交互作用。
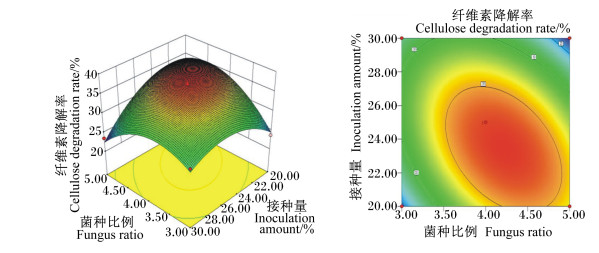
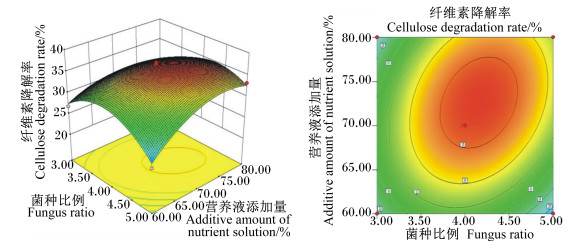
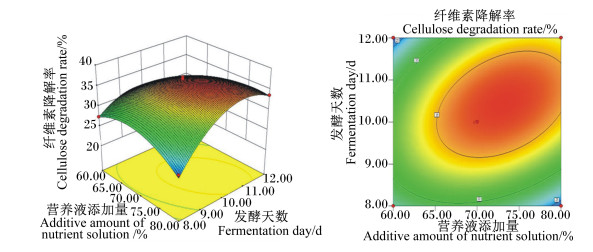
菌种比例和接种量的交互作用见图 2。随着菌种比例的改变和接种量的增加,纤维素降解率均呈先上升后下降的趋势,交互图曲面坡度较高,说明这2个因素对纤维素降解率的影响显著。菌种比例和营养液添加量的交互作用见图 3,随着菌种比例的改变和营养液添加量的增加,纤维素降解率均呈先上升后下降的趋势,但营养液添加量对纤维素降解率变化趋势的影响不大。营养液添加量和发酵天数的交互作用见图 4。随着发酵天数的增加,纤维素降解率迅速增高,当发酵进行到10 d时,纤维素降解率的增长速度变缓,两者的交互图曲面坡度较高,说明两者对纤维素降解率的影响极显著。以上各交互作用图的等高线均呈椭圆形,证明其交互作用显著,与方差分析结果一致。
|
图 2 菌种比例和接种量对纤维素降解率影响的响应面图和等高线图 Fig. 2 Response surface and contour graph of effects of fungus ratio and inoculation amount on degradation rate of cellulose |
|
图 3 菌种比例和营养液添加量对纤维素降解率影响的响应面图和等高线图 Fig. 3 Response surface and contour graph of effects of fungus ratio and additive amount of nutrient solution on degradation rate of cellulose |
|
图 4 营养液添加量和发酵天数对纤维素降解率影响的响应面图和等高线图 Fig. 4 Response surface and contour graph of effects of additive amount of nutrient solution and fermentation day on degradation rate of cellulose |
菌种比例和营养液添加量的交互作用见图 5,随着菌种比例的改变和营养液添加量的增加,木质素降解率均呈先上升后下降趋势,说明二者对木质素降解率有显著影响。营养液添加量和接种量的交互作用见图 6,木质素降解率随着营养液添加量和接种量的增加均呈先上升后下降的趋势,曲面图坡度陡峭,证明两者对木质素降解率有较大影响。营养液添加量和发酵天数的交互作用见图 7,木质素降解率随发酵天数增加而迅速增高,随营养液添加量增加而先上升后下降。以上各交互作用图的等高线均呈椭圆形,证明其交互作用显著,与方差分析结果一致。
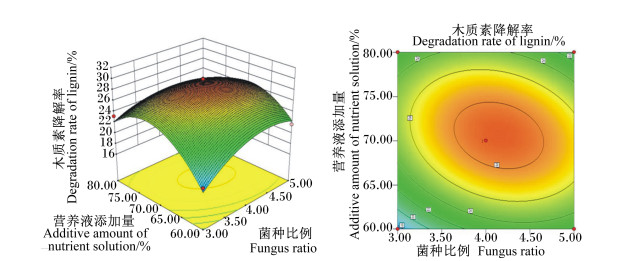
|
图 5 菌种比例和营养液添加量对木质素降解率影响的响应面图和等高线图 Fig. 5 Response surface and contour graph of effects of fungus ratio and additive amount of nutrient solution on degradation rate of lignin |
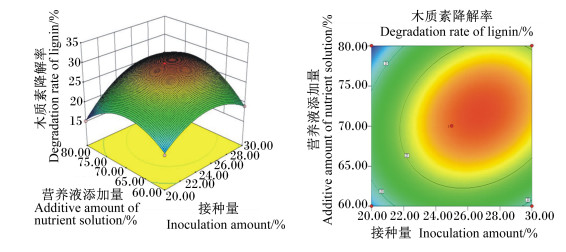
|
图 6 营养液添加量和接种量对木质素降解率影响的响应面图和等高线图 Fig. 6 Response surface and contour graph of effects of additive amount of nutrient solution and inoculation amount on degradation rate of lignin |
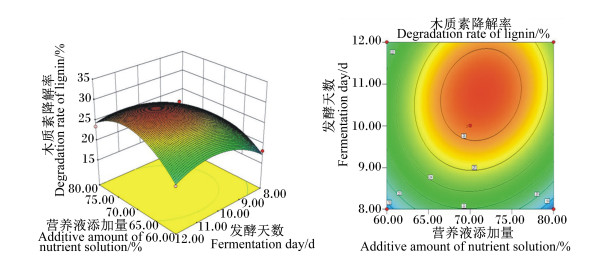
|
图 7 营养液添加量和发酵天数对木质素降解率影响的响应面图和等高线图 Fig. 7 Response surface and contour graph of effects of additive amount of nutrient solution and fermentation day on degradation rate of lignin |
运用Design Expert 8.0.6软件优化所得到的同时降解纤维素和木质素的最优条件为:菌种比例1.00:4.16,接种量25.2%,营养液添加量72.25%,发酵天数10.56 d。在此条件下,纤维素降解率和木质素降解率的预测值为36.94%和29.30%。为了验证模型的有效性,对模型优化的最优条件进行验证。考虑到试验的可行性与便捷性,选择条件为:菌种比例1.0:4.1,接种量25.2%,营养液添加量72.2%,发酵天数11 d。进行固态发酵试验,验证试验设3个重复,平均值为纤维素降解率36.80%、木质素降解率为28.87%。可见该模型能较好地预测纤维素和木质素的降解情况。
3 讨论混合真菌发酵玉米秸秆的优势在于不同的菌种可以发挥自身的产酶特性,通过酶系互补,起到相辅相成,相互促进的作用[14-15]。陈耀宁等[16]通过在纤维素筛选培养基中加黄孢原毛平革菌的固态发酵浸提液,筛选出与黄孢原毛平革菌相容的菌株,这些菌株在与其混合发酵时对纤维素酶能产生较好的协同效果,混合发酵后纤维素和木质素的降解效果均有提高。王志等[17]用拟康氏木霉和白腐菌混合发酵秸秆,发现秸秆的纤维素降解率和木质素降解率分别为40.38%和31.52%,比单独使用拟康氏木霉或白腐菌处理秸秆的效果显著提高。本试验优化了拟康宁木霉和黄孢原毛平革菌混合发酵玉米秸秆生产优质粗饲料的条件,优化后复合菌共同发酵玉米秸秆的纤维素降解率均高于2菌单独发酵玉米秸秆的纤维素降解率,但复合菌共同发酵后的木质素降解率与黄孢原毛平革菌单独发酵的木质素降解率差异不大,证明这2种菌之间存在着协同作用,与陈耀宁等[16]的研究结果相符。混合真菌发酵更具优势,主要与菌种产生的酶系有关[18]。Baldrian[19]用变色栓菌和平菇混合培养时,通过添加土壤中的真菌等其他微生物,使体系中的漆酶活性得到显著提高,说明混合培养可以通过加强和完善胞外木质纤维素降解酶及其他活性因子的种类来实现纤维素和木质素降解率的提高。
混合菌种发酵玉米秸秆时选择的菌种不同对木质纤维素的降解效果有较大影响。张立霞[20]使用黄孢原毛平革菌、黑曲霉、青霉、木霉等菌株混合发酵玉米秸秆,发酵结束后纤维素和木质素降解率分别为29.6%和29.1%。赵玲[21]利用产酶互补原则将黄孢原毛平革菌、云芝等菌株进行混合培养降解玉米秸秆,处理11 d后纤维素、木质素降解率分别为17.74%和28.74%。焦有宙等[22]用含有密黏褶菌、环状芽孢杆菌、铜绿假单胞菌、栗褐链霉菌、黄孢原毛平革菌、杂色云芝、绿色木霉、黑曲霉等菌株的复合菌处理玉米秸秆,纤维素和木质素降解率分别为36.38%和40.11%。由此可以看出,在相互没有拮抗作用的混合菌发酵秸秆的过程中,随着参与降解的菌种的增加,降解酶系趋于完善,木质纤维素降解率也随之升高。本试验用拟康宁木霉与黄孢原毛平革菌混合发酵玉米秸秆,其中以纤维素的降解效果最明显。
4 结论拟康宁木霉与黄孢原毛平革菌混合发酵玉米秸秆的效果显著优于单菌发酵玉米秸秆,混合真菌降解玉米秸秆纤维素和木质素的最优发酵条件为:菌种比例1.0:4.1,接种量25.2%,营养液添加量72.2%,发酵天数11 d,纤维素和木质素降解率最高分别为36.80%和28.87%。
| [1] |
左旭, 王红彦, 王亚静, 等. 中国玉米秸秆资源量估算及其自然适宜性评价[J]. 中国农业资源与区划, 2015, 36(6): 5-10, 29. |
| [2] |
刘丽英, 陈洪章. 玉米秸秆组分近红外漫反射光谱(NIRS)测定方法的建立[J]. 光谱学与光谱分析, 2007, 27(2): 275-278. |
| [3] |
STEPANOVA E V, KOROLEVA O V, VASILCHENKO L G, et al. Fungal decomposition of oat straw during liquid and solid-state fermentation[J]. Applied Biochemistry and Microbiology, 2003, 39(1): 65-74. |
| [4] |
刁其玉, 国春艳. 提高粗饲料利用率的途径[J]. 粮食与饲料工业, 2005(10): 34-36. DOI:10.3969/j.issn.1003-6202.2005.10.016 |
| [5] |
SÁNCHEZ C. Lignocellulosic residues:biodegradation and bioconversion by fungi[J]. Biotechnology Advances, 2009, 27(2): 185-194. DOI:10.1016/j.biotechadv.2008.11.001 |
| [6] |
BERIKASHVILI V, JOKHARIDZE T, KACHLISHVILI E, et al. The comparison of white-rot basidiomycetes lignocellulolytic potential in wheat straw solid-state fermentation[J]. Ecological Engineering and Environment Protection, 2014(1): 69-74. |
| [7] |
SHARMA R K, ARORA D S. Fungal degradation of lignocellulosic residues:an aspect of improved nutritive quality[J]. Critical Reviews in Microbiology, 2015, 41(1): 52-60. DOI:10.3109/1040841X.2013.791247 |
| [8] |
伍文宪, 刘勇, 张蕾, 等.拟康宁木霉的分离鉴定及其在纤维素降解中的应用研究[C]//中国植物保护学会2015年学术年会论文集.长春: 中国植物保护学会, 2015.
|
| [9] |
武月雷.真菌预处理改善油茶籽渣饲用价值研究[D].硕士学位论文.杭州: 浙江大学, 2017: 29-31. http://d.g.wanfangdata.com.cn/Thesis_Y3280460.aspx
|
| [10] |
吴丹, 王之盛, 薛白, 等. 不同加工方法对白酒糟营养价值和体外瘤胃发酵的影响[J]. 动物营养学报, 2011, 23(8): 1422-1429. DOI:10.3969/j.issn.1006-267x.2011.08.023 |
| [11] |
VARSHNEY A K, MOHAN M K, VIDYARTHI A S, et al. Effect of nitrogen sources and C:N ratio on production of manganese peroxidase using Phanerochaete chrysosporium NCIM 1197[J]. Journal of Pure and Applied Microbiology, 2014, 8(1): 481-487. |
| [12] |
卢松.微生物处理玉米秸秆的腐解特征研究[D].硕士学位论文.重庆: 西南大学, 2010: 17-27. http://cdmd.cnki.com.cn/Article/CDMD-10635-2010095932.htm
|
| [13] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [14] |
GUTIERREZ-CORREA M, PORTAL L, MORENO P, et al. Mixed culture solid substrate fermentation of Trichoderma reesei with Aspergillus niger on sugar cane bagasse[J]. Bioresource Technology, 1999, 68(2): 173-178. DOI:10.1016/S0960-8524(98)00139-4 |
| [15] |
文娅, 赵国柱, 周传斌, 等. 生态工程领域微生物菌剂研究进展[J]. 生态学报, 2011, 31(20): 6287-6294. |
| [16] |
陈耀宁, 曾光明, 喻曼, 等. 与黄孢原毛平革菌协同降解稻草的混合菌筛选[J]. 中国环境科学, 2007, 27(2): 189-193. DOI:10.3321/j.issn:1000-6923.2007.02.010 |
| [17] |
王志, 陈雄, 王实玉, 等. 拟康氏木霉和白腐菌混菌发酵处理稻草秸秆的研究[J]. 可再生能源, 2009, 27(2): 36-39. DOI:10.3969/j.issn.1671-5292.2009.02.009 |
| [18] |
GUTIERREZ-CORREA M, TENGERDY R P. Production of cellulase on sugar cane bagasse by fungal mixed culture solid substrate fermentation[J]. Biotechnology Letters, 1997, 19(7): 665-667. DOI:10.1023/A:1018342916095 |
| [19] |
BALDRIAN P. Increase of laccase activity during interspecific interactions of white-rot fungi[J]. FEMS Microbiology Ecology, 2004, 50(3): 245-253. |
| [20] |
张立霞.纤维降解菌组合的筛选、优化及对玉米秸秆的降解效果[D].硕士学位论文.北京: 中国农业科学院, 2014: 7-15. http://cdmd.cnki.com.cn/Article/CDMD-82101-1014326365.htm
|
| [21] |
赵玲.生物预处理玉米秸秆厌氧干发酵特性及沼渣基质利用的研究[D].博士学位论文.沈阳: 沈阳农业大学, 2011: 50-58. http://cdmd.cnki.com.cn/Article/CDMD-10157-1012302281.htm
|
| [22] |
焦有宙, 高赞, 李刚, 等. 不同土著菌及其复合菌对玉米秸秆降解的影响[J]. 农业工程学报, 2015, 31(23): 201-207. DOI:10.11975/j.issn.1002-6819.2015.23.027 |




