2. 郑州人民医院 泌尿外科, 郑州 450003;
3. 河南农业大学生命科学学院, 郑州 450002;
4. 河南农业大学 牧医工程学院, 郑州 450002
2. Department of Urology, People's Hospital of Zhengzhou, Zhengzhou 450003, China;
3. School of Life Science, Henan Agricultural University, Zhengzhou 450002, China;
4. College of Animal Science and Veterinary Medicine, Henan Agricultural University, Zhengzhou 450002, China
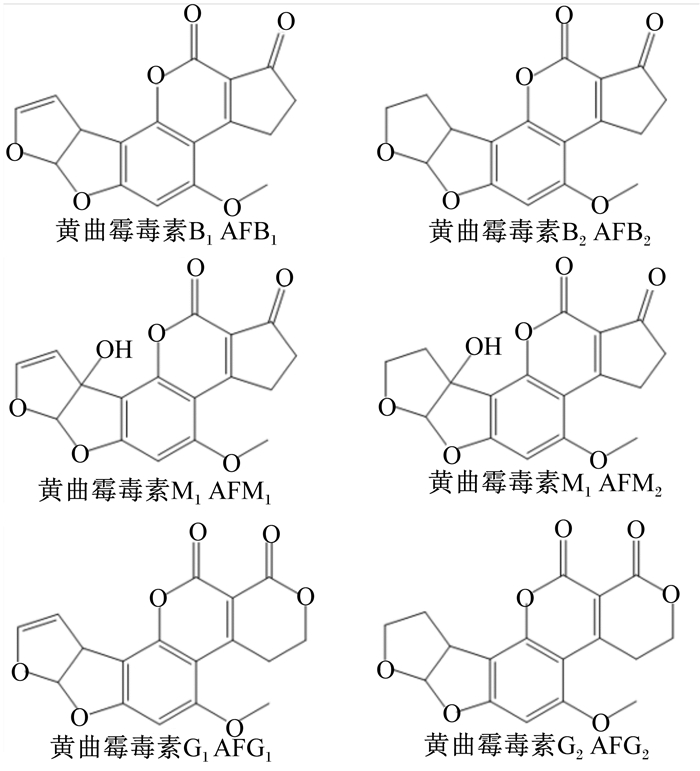
黄曲霉毒素(AF)是由黄曲霉和寄生曲霉等真菌产生的代谢物,共有20余种衍生物,如AFB1、AFB2、AFM1、AFM2、AFG1、AFG2(分子式见图 1),广泛存在于粮食与饲料中。其中AFB1的毒性最强[1-3],对人畜均有严重的伤害,可导致动物免疫机能失常[4],并具有致畸、致癌性[5]。国际癌症研究机构(IARC)将AFB1列为Ⅰ类致癌物[6]。各国对食品中AFB1的含量有着严格的规定。韩国规定食品中AFB1的最高含量不超过10 mg/kg,欧盟规定食品中AFB1最大残留量为5 mg/kg[7]。我国对于不同种类食品中AFB1的含量也有着不同的检测标准。因此,AFB1的快速准确检测对于我国食品安全以及农业、畜牧业生产至关重要。
|
图 1 AFB1、AFB2、AFM1、AFM2、AFG1、AFG2的分子式 Fig. 1 Molecular formulas of AFB1, AFB2, AFM1, AFM2, AFG1 and AFG2 |
目前,对于AFB1的检测主要有色谱法(如高效液相色谱法、亲和柱液相色谱法)[8-10]、免疫学检测法[如酶联免疫吸附测定(ELISA)法][11-12]、时间分辨免疫荧光分析技术[13-14]和免疫层析法[15-17]。色谱法检测灵敏,但检测设备昂贵,操作技术要求较高,不适用于普通生产中AFB1的快速检测。免疫学检测法具有灵敏度高、检测迅速、适用范围广等优势,适用于普通生产中AFB1的快速检测。免疫学检测法的前提是制备特异性抗体(单克隆抗体或多克隆抗体),在2005—2017年间,Kolosova等[18]、王磊等[19]、谢珲等[20]、Kong等[21]报道了所制备的AFB1单克隆抗体半数抑制浓度(IC50)在0.62~6.03 ng/mL,数值较大,抗体的特异性能越弱;2017年,宋青龙等[22]报道了胶体金快速检测技术在检测AFB1中的应用,检测范围为2~50 μg/kg,最低检测限较高。受所制备的AFB1单克隆抗体灵敏度及特异性的限制,以上报道的检测方法的灵敏度均不能很好地满足AFB1的检测要求,也不能用于AFB1类似物AFB2、AFG1、AFG2、AFM1、AFM2的检测。鉴于此,本试验拟通过优化AFB1的改造方法及偶联方法制备完全抗原,适当调整免疫小鼠的时间间隔,通过细胞融合并进行多次亚克隆等技术筛选出优秀的单克隆细胞株,制备出更高亲和力和灵敏度的AFB1单克隆抗体,并基于制备的AFB1单克隆抗体建立间接竞争ELISA方法,以期能够高效、快速、准确地对粮食和饲料中AFB1进行检测。
1 材料与方法 1.1 试验材料 1.1.1 主要试剂AFB1标准品、AFB2标准品、AFG1标准品、AFG2标准品、AFM1标准品、伏马菌素B1(FB1)标准品、T-2毒素(T-2)标准品、赭曲霉毒素(OTA)标准品、牛血清白蛋白(BSA)、鸡卵白蛋白(OVA)、弗氏完全佐剂(FCA)、弗氏不完全佐剂(FIA)、辣根过氧化酶标记羊抗鼠二抗(GaM IgG-HRP)、RPMI 1640培养基、HAT培养基、HT培养基、聚乙二醇1500(PEG-1500)、抗体亚型测定试剂盒均为Sigma公司产品。
1.1.2 主要溶液包被液为浓度为0.05 mol/L、pH=9.6的碳酸盐缓冲液(CBS);洗液为含0.05%吐温-20的磷酸盐缓冲液(PBST,0.01 mol/L、pH=7.4);封闭液为含有5%猪血清的PBST;显色液为3,3′,5,5′-四甲基联苯胺(TMB)显色液;终止液为2 mol/L硫酸溶液。配制以上溶液所用试剂均为分析纯,未经处理使用。
1.1.3 主要仪器Bio-Rad-550型酶标仪,美国Bio-Rad公司;CO2培养箱,美国Thermo公司;生物倒置显微镜,Leica公司;U-3000紫外扫描仪,日本岛津公司;3K-18高速冷冻离心机,德国Sigma公司;DK-8D电热恒温水槽,上海一恒科技有限公司;RE-5299旋转蒸发仪,予华仪器公司。
1.1.4 试验动物与细胞BALB/c小鼠购自郑州大学医学院实验动物中心,由河南省农业科学院动物免疫学重点实验室饲养;SP2/0骨髓瘤细胞购自中国农业大学动物医学院。
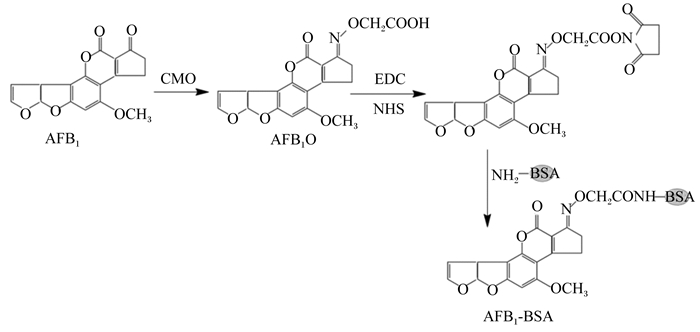
1.2 试验方法 1.2.1 小鼠的免疫及多抗血清测定首先,制备AFB1完全抗原。根据文献[23-24]报道的方法,采用肟化法对AFB1进行修饰。将4 mg AFB1溶于2 mL甲醇与吡啶混合溶液(甲醇:吡啶=1 : 1)中,随后加入5 mg羧甲基羟胺半盐酸盐(CMO)和5 mg乙酸钠,70 ℃下搅拌2 h,制得AFB1肟化物(AFB1O)。将2.20 mg AFB1O充分溶于0.5 mL N,N-二甲基甲酰胺(DMF),加入1.35 mg碳二亚胺(EDC)和0.81 mg N-羟基琥珀酰亚胺(NHS)避光反应30 min,充分活化。将6.50 mg BSA充分溶于1.5 mL CBS中,把活化后的AFB1O逐滴加入BSA溶液中,避光反应2 h。反应产物以PBS为透析液,在4 ℃下搅拌透析3 d,每天更换透析液4~5次。随后,将透析后的产物以5 000 r/min离心10 min,收集上清液,得到AFB1完全抗原AFB1-BSA,低温冻存,备用。AFB1完全抗原AFB1-BSA合成路线见图 2。AFB1完全抗原AFB1-OVA的合成方法同上。
|
AFB1:黄曲霉毒素B1 aflatoxin B1;CMO:羧甲基羟胺半盐酸盐carboxymethoxylamine hemihydrochloride;AFB1O:黄曲霉毒素B1肟化物aflatoxin B1 oxime;EDC:碳二亚胺carbodiimide;NHS:N-羟基琥珀酰亚胺N-hydroxysuccinimide;BSA:牛血清白蛋白bovine serum albumin。 图 2 AFB1完全抗原AFB1-BSA合成路线 Fig. 2 Synthetic route of AFB1 complete antigen AFB1-BSA |
然后,免疫小鼠。取8周龄雌性BALB/c小鼠4只,以AFB1-BSA为免疫原进行背部皮下多点注射,剂量为20 μg/只,每只200 μL,每次免疫间隔3周,共4次。初次免疫时将用无菌PBS稀释的AFB1-BSA与等量的弗氏完全佐剂混合乳化,此后3次免疫均改用等量弗氏不完全佐剂。
其次,四免后1周,小鼠断尾采血,用CBS将包被原AFB1-OVA (1.5 mg/mL)1 : 400稀释,包被ELISA板。分别将1~4号小鼠血清从1 : 800开始倍比稀释测定多抗血清的效价。根据效价测定结果,采用间接竞争ELISA方法测定小鼠多抗血清的灵敏度,方法同1.2.4.4,将1~4号鼠血清1 : 10 000稀释,AFB1标准品从1 000 ng/mL开始倍比稀释。筛选出多抗血清效价与灵敏度较高的小鼠进行细胞融合。
最后,细胞融合的前3 d对小鼠进行强化免疫,剂量为50 μg/只,每只200 μL(不加佐剂)。
1.2.2 单克隆抗体的制备首先,进行细胞融合。融合之前复苏SP2/0骨髓瘤细胞,扩大培养,并于融合前1天制备饲养细胞。小鼠强化免疫3 d后,摘除眼球,收集阳性血清,脱颈致死后,浸泡于75%的酒精中灭菌。随后,无菌条件下摘除脾脏,分离脾细胞。收集生长良好的SP2/0骨髓瘤细胞,与脾细胞在50% PEG-1500的作用下进行融合。将融合后的细胞转入含有HAT培养基的平皿中,混匀后分散于铺有饲养细胞的96孔板,200 μL/孔。置于37 ℃、5%二氧化碳培养箱中,4~5 d后半量换液,7 d后取细胞上清进行阳性筛选。
然后,筛选单克隆杂交瘤细胞株。收集细胞上清,分别采用间接ELISA和间接竞争ELISA方法,挑选出效价高、灵敏度好的细胞,转入24孔板,用HAT和HT混合培养基(HAT培养基: HT培养基=1 : 1)进行扩大培养。随后经过数次有限稀释克隆,筛选出能持续稳定分泌抗体的杂交瘤细胞株,扩大培养并冻存。
最后,采用体内诱生腹水法[25]制备AFB1单克隆抗体。提前10 d向8周龄BALB/c小鼠腹腔内接种500 μL液体石蜡,随后将筛选出来的阳性杂交瘤细胞注射到小鼠腹腔,注射剂量为5×105个/只(每只500 μL),观察腹水产生情况。8 d后待腹部明显肿大即可采集腹水,离心后收集上清,即可得到单克隆抗体,以便进行纯化。
1.2.3 单克隆抗体的纯化采用辛酸-硫酸铵法[26]纯化收集到的腹水,之后采用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)对纯化结果进行鉴定,并计算抗体的分子质量。
1.2.4 单克隆抗体的鉴定 1.2.4.1 单克隆抗体亚型的鉴定使用抗体亚型测定试剂盒对单克隆抗体亚型进行鉴定。
1.2.4.2 单克隆抗体效价的测定采用间接ELISA方法测定单克隆抗体效价。用CBS将包被原AFB1-OVA 1 : 4 000稀释,包被96孔板,100 μL/孔,37 ℃孵育4 h,PBST洗涤4~6次。随后用含5%猪血清的PBST封闭2 h,300 μL/孔。洗涤后甩干,以磷酸盐缓冲液(PBS)铺底,100 μL/孔。将单克隆抗体浓度稀释为1 : 500,100 μL/孔,倍比稀释,设置阴性对照(NC)和空白对照(BC)孔,37 ℃下孵育25 min。洗涤后加入1 : 1 000含5%猪血清的PBST稀释的GaM-IgG-HRP,100 μL/孔,孵育30 min。然后加入100 μL/孔TMB显色液显色10 min,用2 mol/L硫酸溶液(100 μL/孔)终止反应,酶标仪读出OD450 nm值。消除背景后,若待测孔OD450 nm值与阴性孔OD450 nm值的比值大于2.1(P/N≥2.1),则该孔判断为阳性,稀释倍数最高的阳性孔的稀释倍数即为效价。
1.2.4.3 单克隆抗体亲和力的测定参考文献[27-28]的方法测定单克隆抗体的亲和常数(Ka)。采用间接ELISA方法,分别以1 : 4 000和1 : 8 000稀释的AFB1-OVA包被ELISA板,将单克隆抗体从1 : 2 000开始倍比稀释,测定各孔OD450 nm值。方法同1.2.4.2所述。根据测得的OD450 nm值,以单克隆抗体的浓度为横坐标,OD450 nm值为纵坐标作图。曲线的平台段表示抗原被全部结合,以此时的OD450 nm值作为100%,找出OD450 nm值为50%时单克隆抗体的浓度,代入公式进行计算,求出Ka(L/mol)
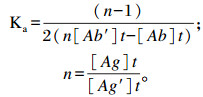
|
式中:[Ag]t、[Ag′]t分别为不同的包被原浓度(mol/L);[Ab]t、[Ab′]t分别为相对应的单抗浓度(mol/L)。
1.2.4.4 单克隆抗体灵敏度的测定采用间接竞争ELISA方法测定单克隆抗体的灵敏度。通过方阵法确定最佳包被浓度和抗体的稀释倍数。以1 : 4 000稀释的包被原包被ELISA板,将OD450 nm值为1.0左右时的浓度确定为最佳抗体浓度。加入竞争物AFB1,从5 ng/mL开始倍比稀释,50 μL/孔,设置阴性对照和空白对照。随后加入1 : 1.5×104稀释的抗体,50 μL/孔,37 ℃下孵育25 min。PBST洗涤后加入GaM-IgG-HRP(1 : 1 000稀释),孵育30 min。然后加入显色液显色10 min,2 mol/L硫酸溶液终止后读出OD450 nm值。以IC50来衡量单克隆抗体的灵敏度。抑制率为含有AFB1标准品的孔的OD450 nm值(B)与阴性孔OD450 nm值(B0)的比值(B/B0)。以抑制率为纵坐标,以AFB1浓度的对数值为横坐标,可以得到关于二者的回归直线和回归直线方程,从而计算出IC50,即可表征单克隆抗体的灵敏度。回归直线方程斜率越大、IC50越低,单克隆抗体的灵敏度越高。同时,还可以计算出最低检测限(LOD,抑制程度为10%时对应的靶标物浓度)以及检测范围(抑制程度为10%~80%时对应的靶标物浓度范围)[29]。
1.2.4.5 单克隆抗体特异性的测定以AFB2、AFG1、AFG2、AFM1及其他霉菌毒素(FB1、T-2、OTA)为竞争物,AFB1为对照,通过间接竞争ELISA方法测定各竞争物的IC50(方法同1.2.4.4)。将AFB1的IC50与各竞争物的IC50的比值的百分数称为交叉反应率(CR,%),以CR表征单克隆抗体的特异性。
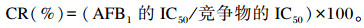
|
用1.2.4.4中建立的抑制曲线,测定浓度为1.00 ng/mL的AFB1标准溶液20次,计算测定值、回收率和变异系数(CV)。

|
由河南省粮油饲料产品质量监督检验中心提供2个霉变玉米样品,经粉碎处理,采用相同的前处理方法,分别采用HPLC-MS法和本试验建立的免疫学检测方法进行AFB1含量测定,每个样品每种方法测定6次。检测结果以平均值±标准差表示,采用SPSS 13.0软件进行单因素独立t检验,P < 0.05表示差异显著。
2 结果与分析 2.1 小鼠的多抗血清测定采用间接ELISA方法测定1~4号小鼠多抗血清的效价,可达51 200(表 1)。采用间接竞争ELISA方法检测1~4号小鼠多抗血清的灵敏度,结果见表 2。综合各小鼠多抗血清的效价和灵敏度,选择2号小鼠进行细胞融合。
|
|
表 1 间接ELISA方法测定多抗血清效价 Table 1 Titer of antiserum detected by indirect ELISA method |
|
|
表 2 间接竞争ELISA方法测定多抗血清抑制效价 Table 2 Inhibitive titer of antiserum detected by indirect competitive ELISA method |
细胞融合后,经过数次有限稀释克隆,得到2株单克隆细胞株:9H1F5、9H1F6。经过多次传代,冻存以及复苏,2株细胞均可以稳定产生抗体。最后选择9H1F5细胞株诱生腹水,得到AFB1单克隆抗体。
2.3 AFB1单克隆抗体纯化结果纯化后的AFB1单克隆抗体通过SDS-PAGE检测,可以看见2条明显的条带(图 3),一条为25 ku的轻链,另一条为50 ku的重链,经分析可知AFB1单克隆抗体的分子质量约为150 ku。
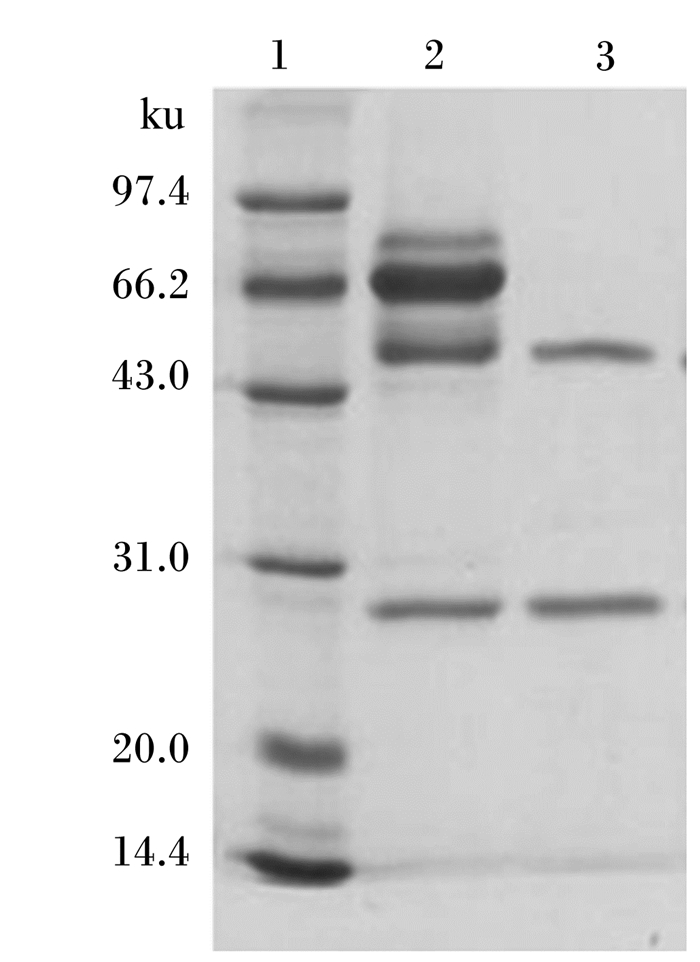
|
1:Marker;2:纯化前的AFB1单克隆抗体unpurified AFB1 monoclonal antibody;3:纯化后的AFB1单克隆抗体purified AFB1 monoclonal antibody。 图 3 AFB1单克隆抗体纯化后的SDS-PAGE图谱 Fig. 3 SDS-PAGE map of purified AFB1 monoclonal antibody |
使用抗体亚型测定试剂盒进行鉴定,9H1F5细胞株分泌的AFB1单克隆抗体的亚型为免疫球蛋白G2(IgG2)。
2.4.2 AFB1单克隆抗体效价测定结果采用间接ELISA方法测得9H1F5细胞株产生的AFB1单克隆抗体的效价最高可达5.12×105(表 3)。
|
|
表 3 间接ELISA方法测定AFB1抗单克隆抗体效价 Table 3 Titer of AFB1 monoclonal antibody detected by indirect ELISA method |
根据1.2.4.3所述,绘出关于不同浓度的AFB1单克隆抗体的亲和力曲线(图 4),在曲线上找出50% OD450 nm值所对应的AFB1单克隆抗体的浓度,代入公式中计算出Ka=6.72×107 L/mol。
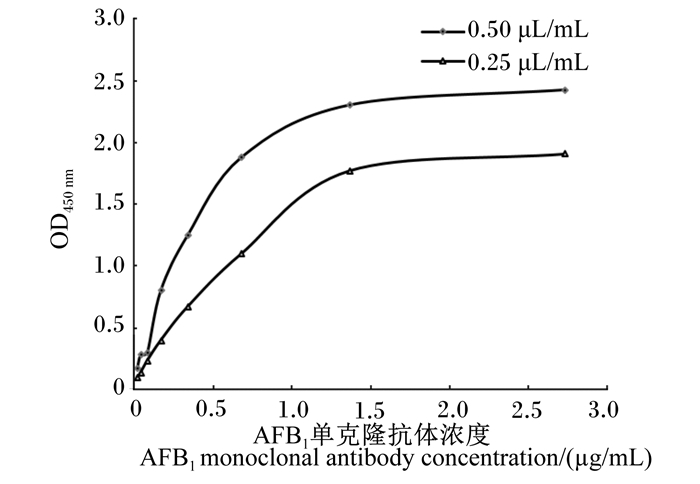
|
图 4 AFB1单克隆抗体亲和力曲线 Fig. 4 Affinity curve of AFB1 monoclonal antibody |
根据间接竞争ELISA方法测定结果绘制关于AFB1浓度的对数值(x)与抑制率(y)的回归直线和回归直线方程y=-0.326 8x+0.292 5(R2=0.991 9)(图 5)。根据回归直线方程求出AFB1的IC50为0.232 ng/mL。回归直线的线性范围为0.014~1.920 ng/mL,最低检测限为0.014 ng/mL。
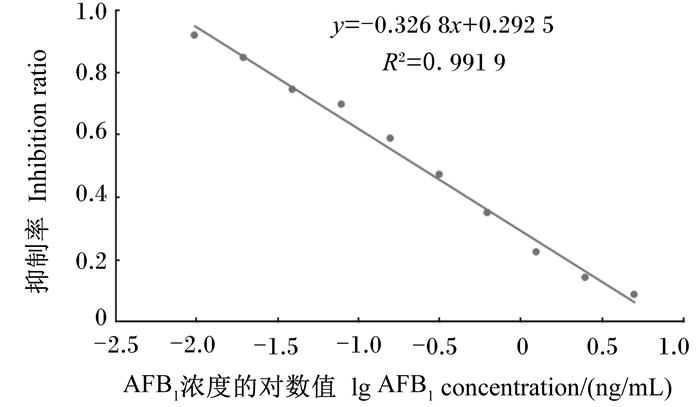
|
图 5 AFB1单克隆抗体竞争曲线 Fig. 5 Competitive curve of AFB1 monoclonal antibody |
根据1.2.4.5提到的方法,测得AFB1单克隆抗体对于AFB2、AFG1、AFG2、AFM1的IC50分别为0.577、0.699、0.726、5.270 ng/mL,交叉反应率分别为40.21%、33.19%、31.96%、4.40%,但与其他霉菌毒素无交叉反应(表 4)。
|
|
表 4 AFB1单克隆抗体与其他衍生物的交叉反应 Table 4 Cross reactionof AFB1 monoclonal antibody with other derivatives |
为了评估本试验建立的检测AFB1间接竞争ELISA方法的精密性,对AFB1标准溶液进行重复测定,测定结果见表 5。由表中数据可知,测定浓度为1.00 ng/mL的AFB1标准溶液20次,测定值在0.82~1.14 ng/mL,平均值为0.97 ng/mL;回收率在82.0%~114.0%,平均值为97.35%;经计算,变异系数为10.4%。上述结果说明本试验建立的间接竞争ELISA方法具有较高的精密性。
|
|
表 5 间接竞争ELISA方法精密性测定结果 Table 5 Precision of measuring results for indirect competitive ELISA method |
采用本试验建立的免疫学检测方法与HPLC-MS法分别对2个霉变玉米样品中AFB1含量进行测定,测定结果见表 5。将2种方法的检测结果进行单因素独立t检验后发现采用2种方法测定时2个霉变玉米样品的AFB1含量均差异不显著(P>0.05),说明本试验建立的免疫学检测方法对AFB1含量的测定结果具有较高可靠性。
3 讨论AFB1是相对分子质量为312.27的小分子毒素,作为半抗原只具有免疫反应性,而不具有免疫原性,需要和载体蛋白偶联成为完全抗原,才能刺激机体产生特异性抗体。由于AFB1缺少与蛋白质连接所必需的基团,因此在偶联之前需对半抗原进行改造。本试验采用肟化法在AFB1上引入羧基(―COOH)[23],将AFB1改造为AFB1O,然后采用EDC法[24],经过条件优化最终按AFB1O : EDC : BSA(或OVA)=60 : 72 : 1将AFB1O与BSA(或OVA)偶联,在降低载体蛋白间的自联的同时,使载体蛋白尽可能多的与AFB1O偶联。此方法得到的人工抗原AFB1-BSA和AFB1-OVA为建立灵敏度高、特异性强的免疫学检测方法奠定了基础。
|
|
表 6 本试验建立的间接竞争ELISA方法与HPLC-MS法对2个霉变玉米样品中AFB1含量测定结果对比 Table 6 Comparation of AFB1 content measuring results in two moldy corn samples between HPLC-MS method and indirect competitive ELISA method established in this experiment |
本试验采用低剂量(20 μg/只)人工抗原AFB1-BSA免疫小鼠,且免疫间隔为3周,四免后用AFB1-OVA作为包被原,这样就避免了载体蛋白之间的交叉反应。采用ELISA方法检测鼠源多抗的效价高达51 200,灵敏度在250 ng/mL左右。虽然,鼠源多抗的灵敏度并不高,但我们希望通过细胞融合筛选出高灵敏度、高特异性的单克隆细胞株。通过将融合后的杂交瘤细胞多次传代培养以及亚克隆后,筛选出了2株能够持续产生高效抗体的单克隆细胞株9H1F5、9H1F6。其中,9H1F5产生的单克隆抗体具有较高的灵敏度以及亲和力,Ka为6.72×107 L/mol。采用间接竞争ELISA方法得到关于AFB1浓度(x)与抑制率(y)的回归直线方程y=-0.326 8x+0.292 5(R2=0.991 9),且AFB1的IC50可达到0.232 ng/mL,检测范围为0.014~1.920 ng/mL,检测限为0.014 ng/mL,低于国家规定的食品中AFB1的检测限[20],可满足检测需求。
与已报道的有关AFB1的免疫学检测方法[18-21]相比,本试验所制备的AFB1单克隆抗体在灵敏度、检测限、检测范围均存在优势,因此由该抗体建立的间接竞争ELISA方法更加灵敏高效,可以应用于AFB1的快速检测。此外,本试验获得AFB1单克隆抗体对AFB1类似物AFB2、AFG1、AFG2、AFM1有较强的交叉反应,其IC50分别为0.577、0.699、0.726、5.270 ng/mL,表明该单克隆抗体对AF有较高的特异性,该检测方法可同时应用于AFB2、AFG1、AFG2、AFM1的检测。
基于本试验所制备的AFB1单克隆抗体建立的AFB1间接竞争ELISA检测方法,20次重复试验的回收率在82.0%~114.0%,平均值为97.35%;变异系数为10.40%;此外,该检测方法与HPLC-MS法的检测结果对比差异不显著。这说明该检测方法具有较高的精密性和可靠性,为快速检测AFB1的胶体金免疫层析试纸条的建立奠定了基础。
4 结论本试验采用肟化法将AFB1偶联为AFB1O,优化反应物比例制备AFB1的免疫原与包被原,通过检测鼠源多抗及细胞融合技术筛选出的AFB1单克隆细胞株,制备的AFB1单克隆抗体具有灵敏度高(IC50=0.232 ng/mL)以及亲和力(Ka=6.72×107 L/mol)与特异性均较强的特性,基于该抗体建立的间接竞争ELISA方法能够快速准确地定量检测AFB1。另外,基于该抗体与AFB1类似物之间有较高的交叉反应率,该检测方法可同时应用于AFB2、AFG1、AFG2、AFM1的检测。
| [1] |
BENNETT J W, KLICH M. Mycotoxins[J]. Clinical Microbiology Reviews, 2003, 16(3): 497-516. DOI:10.1128/CMR.16.3.497-516.2003 |
| [2] |
MACHIDA M, ASAI K, SANO M, et al. Genome sequencing and analysis of Aspergillus oryzae[J]. Nature, 2005, 438(7071): 1157-1161. DOI:10.1038/nature04300 |
| [3] |
WU F, GROOPMAN J D, PESTKA J J. Public health impacts of foodborne mycotoxins[J]. Annual Review of Food Science and Technology, 2014, 5: 351-372. DOI:10.1146/annurev-food-030713-092431 |
| [4] |
陈兴祥, 黄克和. 黄曲霉毒素对畜禽免疫机能的影响[J]. 中国兽医杂志, 2002, 38(10): 33-35. DOI:10.3969/j.issn.0529-6005.2002.10.018 |
| [5] |
OSTRY V, MALIR F, TOMAN J, et al. Mycotoxins as human carcinogens-the IARC monographs classification[J]. Mycotoxin Research, 2017, 33(1): 65-73. DOI:10.1007/s12550-016-0265-7 |
| [6] |
IARC.International Agency for Research on Cancer, WHO IARC Monographs on the evaluation of carcinogenic risks to humans Some traditional herbal medicines, some mycotoxins naphthalene and styrene aflatoxins[C].Lyon: IARC, 2002.
|
| [7] |
CHOI S, JUN H, BANG J, et al. Behaviour of Aspergillus flavus and Fusarium graminearum on rice as affected by degree of milling, temperature, and relative humidity during storage[J]. Food Microbiology, 2015, 46: 307-313. DOI:10.1016/j.fm.2014.08.019 |
| [8] |
HU X F, HU R, ZHANG Z W, et al. Development of a multiple immunoaffinity column for simultaneous determination of multiple mycotoxins in feeds using UPLC-MS/MS[J]. Analytical and Bioanalytical Chemistry, 2016, 408(22): 6027-6036. DOI:10.1007/s00216-016-9626-5 |
| [9] |
GARCÍA-MORALEJA A, FONT G, MAÑES J, et al. Development of a new method for the simultaneous determination of 21 mycotoxins in coffee beverages by liquid chromatography tandem mass spectrometry[J]. Food Research International, 2015, 72: 247-255. DOI:10.1016/j.foodres.2015.02.030 |
| [10] |
ZHENG W L, TENG J, CHENG L, et al. Hetero-enzyme-based two-round signal amplification strategy for trace detection of aflatoxin B1 using an electrochemical aptasensor[J]. Biosensors and Bioelectronics, 2016, 80: 574-581. DOI:10.1016/j.bios.2016.01.091 |
| [11] |
GARCÍA-FONSECA S, BALLESTEROS-GÍMEZ A, RUBIO S. Restricted access supramolecular solvents for sample treatment in enzyme-linked immuno-sorbent assay of mycotoxins in food[J]. Analytica Chimica Acta, 2016, 935: 129-135. DOI:10.1016/j.aca.2016.06.042 |
| [12] |
LEE N A, WANG S, ALLAN R D, et al. A rapid aflatoxin B1 ELISA:development and validation with reduced matrix effects for peanuts, corn, pistachio, and soybeans[J]. Journal of Agricultural and Food Chemistry, 2004, 52(10): 2746-2755. DOI:10.1021/jf0354038 |
| [13] |
HU X, YAO J, WANG F, et al. Eu3+-labeled IgG-based time-resolved fluoroimmunoassay for highly sensitive detection of aflatoxin B1 in feed[J]. Journal of the Science of Food and Agriculture, 2018, 98(2): 674-680. DOI:10.1002/jsfa.2018.98.issue-2 |
| [14] |
WANG D, ZHANG Z W, LI P W, et al. Europium nanospheres-based time-resolved fluorescence for rapid and ultrasensitive determination of total aflatoxin in feed[J]. Journal of Agricultural and Food Chemistry, 2015, 63(47): 10313-10318. DOI:10.1021/acs.jafc.5b03746 |
| [15] |
HANG D H, LI P W, ZHANG Q, et al. Ultrasensitive nanogold probe-based immunochromatographic assay for simultaneous detection of total aflatoxins in peanuts[J]. Biosensors and Bioelectronics, 2010, 26(6): 2877-2882. |
| [16] |
LI P W, ZHANG Z W, ZHANG Q, et al. Current development of microfluidic immunosensing approaches for mycotoxin detection via capillary electromigration and lateral flow technology[J]. Electrophoresis, 2012, 33(15): 2253-2265. DOI:10.1002/elps.201200050 |
| [17] |
CHEN Y Q, CHEN Q, HAN M M, et al. Development and optimization of a multiplex lateral flow immunoassay for the simultaneous determination of three mycotoxins in corn, rice and peanut[J]. Food Chemistry, 2016, 213: 478-484. DOI:10.1016/j.foodchem.2016.06.116 |
| [18] |
KOLOSOVA A Y, SHIM W B, YANG Z Y, et al. Direct competitive ELISA based on a monoclonal antibody for detection of aflatoxin B1.Stabilization of ELISA kit components and application to grain samples[J]. Analytical and Bioanalytical Chemistry, 2006, 384(1): 286-294. |
| [19] |
王磊, 胡骁飞, 滕蔓, 等. 抗黄曲霉毒素B1单抗制备及免疫学定量方法建立[J]. 中国公共卫生, 2012, 28(1): 58-60. |
| [20] |
谢珲, 章先, 王歆, 等. 黄曲霉毒素B1单克隆抗体的制备及间接竞争ELISA检测技术研究[J]. 微生物学通报, 2015, 42(10): 2033-2040. |
| [21] |
KONG D Z, XIE Z J, LIU L Q, et al. Development of ic-ELISA and lateral-flow immunochromatographic assay strip for the detection of vancomycin in raw milk and animal feed[J]. Food and Agricultural Immunology, 2017, 28(3): 414-426. DOI:10.1080/09540105.2017.1293014 |
| [22] |
宋青龙, 李成洪, 傅巍, 等. 黄曲霉毒素B1胶体金快速定量检测试剂盒的研发[J]. 动物营养学报, 2017, 29(10): 3703-3709. DOI:10.3969/j.issn.1006-267X.2017.10.033 |
| [23] |
KEMP H A, MORGAN M R A. Studies on the detrimental effects of bivalent binding in a microtitration plate ELISA and possible remedies[J]. Journal of Immunological Methods, 1986, 94(1/2): 65-72. |
| [24] |
王磊, 胡骁飞, 职爱民, 等. 黄曲霉毒素B1人工抗原及鼠源多克隆抗血清的制备[J]. 食品科技, 2011, 36(3): 277-281. |
| [25] |
LANE R D, CRISSMAN R S, GINN S. High efficiency fusion procedure for producing monoclonal antibodies against weak immunogens[J]. Methods in Enzymology, 1986, 121: 183-192. DOI:10.1016/0076-6879(86)21017-4 |
| [26] |
刘晓波, 蔡美英, 王霞, 等. 一种简单实用纯化腹水McAb方法——辛酸/硫酸铵法[J]. 华西医科大学学报, 1999, 30(4): 455-456. |
| [27] |
BEATTY J D, BEATTY B G, VLAHOS W G. Measurement of monoclonal antibody affinity by non-competitive enzyme immunoassay[J]. Journal of Immunological Methods, 1987, 100(1/2): 173-179. |
| [28] |
万文徽. 单克隆抗体亲和常数的测定[J]. 单克隆抗体通讯, 1993, 9(2): 72-75. DOI:10.3321/j.issn:1007-8738.1993.02.027 |
| [29] |
YAO J J, WANG F Y, HAN J L, et al. Novel fluoroimmunoassays for detecting ochratoxin A using CdTe quantum dots[J]. Journal of Biophotonics, 2017, 10: 657-663. DOI:10.1002/jbio.201600005 |




