2. 青藏高原生态系统管理国际中心, 兰州大学草地农业科技学院, 兰州 730020;
3. 中国科学院 西北生态环境资源研究院, 兰州 730000
2. International Centre for Tibetan Plateau Ecosystem Management, College of Pastoral Agricultural Science and Technology, Lanzhou University, Lanzhou 730020, China;
3. Northwest Institute of Eco-Environment and Resource, Chinese Academy of Sciences, Lanzhou 730000, China
藏羊又被称为西藏羊或藏系绵羊,主产于西藏、青海等高海拔地区,是我国青藏高原上独有的原始绵羊品种[1]。藏羊作为该地区主要的优势畜种,在维系当地牧民生产、生活以及维持青藏高原草地生态系统平衡中发挥着重要作用[2-3]。由于青藏高原特殊的自然环境和气候条件,该地区牧草具有生长期短而枯草期长(10月至翌年5月)的特点。在冷季,青藏高原天然草地上的牧草生物量及营养水平均会急剧下降,这使得放牧藏羊营养物质摄入严重不足,从而导致藏羊出现生长发育受阻、体重严重下降甚至死亡的现象。因此,在传统的自然放牧方式下,藏羊生产一直重复着“夏活、秋肥、冬瘦、春死”的恶性循环[4]。
研究表明,通过补饲燕麦干草、营养舔砖及精料等方式来增加藏羊对营养物质的摄入量,能够有效减少藏羊冷季失重率,甚至可以达到增重的效果[5-8]。因此,冷季补饲是解决藏羊饲粮营养摄入不足和提高其生长性能的有效途径之一[9-11]。据报道,藏羊的氮维持需要量是0.50 g/(kg BW0.75·d)[12],仅为相同体重下NRC(1985)绵羊的66%[13];当饲粮粗蛋白质含量为6.9%和10.4%时,藏羊氮沉积率显著高于甘肃高山细毛羊[14]。由此可见,藏羊具有氮的维持需要量低和氮素高效利用的特点。据此推断,藏羊冷季掉膘可能主要是能量摄入严重不足所导致。同时,王威等[15]在牦牛补饲试验中也发现,在冷季对牦牛补饲能量饲料的效果显著优于补饲蛋白质饲料。然而目前为止,关于低氮条件下藏羊瘤胃发酵特征及饲粮降解率对能量补饲的响应特征还鲜见报道。因此,本研究利用体外模拟瘤胃发酵的方法,探究低氮条件下饲粮能量水平对藏羊体外发酵营养物质降解率、发酵参数以及产气量的影响,以期为藏羊的冷季科学补饲提供基础数据及理论依据。
1 材料与方法 1.1 试验设计与发酵底物本试验采用单因素试验设计。试验选取6只年龄为1.5周岁、体重为(45.10±2.42) kg和体况相近的健康去势藏羊作为瘤胃液供体,分别以4种粗蛋白质含量均为6.26%(与青藏高原冷季牧草粗蛋白质平均含量相近[16]),消化能(DE)分别为7.37(低能, LE)、8.45(中低能,MLE)、9.54(中高能,MHE)和10.62 MJ/kg(高能,HE)(分别依次相当于体重为45 kg绵羊能量推荐量的0.80、0.92、1.04和1.15倍[17])的饲粮为发酵底物,利用体外法模拟瘤胃发酵,分别在发酵开始后的4、8、12、24、48和72 h进行样品收集,每个时间点设置3个重复。试验饲粮的配制主要参照中国《肉羊饲养标准》(2004)[17]和《中国饲料成分与营养价值表》(2015)[18],其组成及营养水平见表 1。饲粮经65 ℃烘干24 h,粉碎过1 mm孔径的筛备用。
|
|
表 1 试验饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
试验于2016年10月在甘肃省天祝藏族自治县安远镇乌鞘岭(东经103°57.1′,北纬37°12.4′,海拔3 154 m)进行。瘤胃液供体藏羊每天07:00—18:00在天然草场上自由放牧,不进行任何补饲。在试验当天早晨出牧前,利用口腔式瘤胃管分别抽取试验藏羊瘤胃液200 mL/只,等体积混合,4层纱布过滤后持续通入二氧化碳(CO2),保证整个过程严格厌氧,并控制温度为39 ℃。
人工瘤胃营养液参照Menke等[19]的方法配制,由常量元素溶液、微量元素溶液、缓冲液、还原剂溶液和刃天青溶液5部分组成。使用前向配制好的人工瘤胃营养液底部不断通入CO2,并在39 ℃预热,直至溶液颜色由粉色变至无色。
将人工瘤胃营养液与瘤胃液按2 : 1的比例混合,制成混合人工瘤胃发酵液,39 ℃恒温水浴,用磁力搅拌器不断搅拌,同时不断通入CO2,保证整个过程严格厌氧。
1.3 体外发酵试验准确称取0.3 g发酵底物,转移至37.4 μm(400目)的自制尼龙袋(长:3.5 cm,宽:2.5 cm)中,并加入适量玻璃珠(防止发酵过程中尼龙袋漂浮于发酵管液面)。在试验前,给发酵管内胆均匀涂抹适量凡士林(保证其气密性良好),并将装有发酵底物的尼龙袋放入发酵管内, 再将发酵管放入恒温水浴锅,提前预热至39 ℃。试验开始时,用移液器向发酵管内加入50 mL混合人工瘤胃发酵液,进行39 ℃恒温培养,并记录发酵管活塞初始刻度。
1.4 样品采集在各时间点发酵结束时,取出发酵管。用注射器采集发酵气体,注入真空气体采集管中,用于甲烷(CH4)产量测定;分别采集5 mL发酵液于10 mL离心管中,于-20 ℃冰箱中保存,用于氨态氮(NH3-N)和挥发性脂肪酸(VFA)浓度测定。
1.5 指标测定 1.5.1 发酵底物常规养分测定发酵底物常规养分的测定主要参照张丽英[20]的方法。利用ANKOM-2000I型纤维分析仪测定中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量。
1.5.2 产气量的测定发酵产气量的测定参照Menke等[21]的方法,培养至0.5、1、2、4、8、12、24、48和72 h时,取出对应的发酵管,迅速读取数据,减去该时间点空白发酵管的数值,即为底物发酵产气量。当产气量接近发酵管最大量程时,进行放气处理并记录放气后刻度,然后再进行产气量累积计算。
1.5.3 营养物质降解率测定当各时间点发酵结束后,取出发酵管,并将尼龙袋放入冰水中以终止发酵。将尼龙袋用蒸馏水反复冲洗,直至水变清,放入烘箱中105 ℃烘干8 h,用于测定干物质(DM)含量,并计算干物质降解率(DMD)。尼龙袋中发酵后的饲粮残渣用于中性洗涤纤维(NDF)和酸性洗涤纤维(ADF)含量的测定,同时计算中性洗涤纤维降解率(NDFD)和酸性洗涤纤维降解率(ADFD)。DMD、NDFD和ADFD计算公式如下:
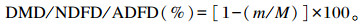
|
式中:m为发酵后底物DM或NDF或ADF质量(g);M为发酵前底物DM或NDF或ADF质量(g)。
1.5.4 pH测定各时间点发酵结束后利用pH计(PB-10,赛多利斯)立即测定发酵液pH。
1.5.5 NH3-N浓度测定发酵液NH3-N浓度参照Hristov等[22]的方法,使用Multiskan FC型酶标仪(Thermo,上海)测定。
1.5.6 VFA浓度测定参照Erwin等[23]的方法对发酵液进行前处理,并利用气相色谱仪(SP-3420,北京北分瑞利分析仪器有限责任公司)测定发酵液中VFA的浓度。测定条件:火焰离子检测器(FID),色谱柱为AT-FFAP毛细管柱(30 m×0.32 mm×0.25 μm);色谱柱升温程序,初始90 ℃,保留1 min,以10 ℃/min升温至120 ℃,保留3 min,以15 ℃/min升温至180 ℃,保留2 min;进样器温度250 ℃;检测器温度为250 ℃;载气为高纯氮气(N2)(99.99%),其中N2、氢气(H2)、空气流速分别为45、40、450 mL/min;进样量为0.6 μL, 2-乙基丁酸用作内标物。计算公式为:

|
式中:C样品为样品的VFA浓度(mmol/L);C发酵液为发酵液的VFA浓度(mmol/L);C空白为空白的VFA浓度(mmol/L)。
1.5.7 CH4产量的测定利用气相色谱仪(SP-3420,北京北分瑞利分析仪器有限责任公司)测定发酵气体中的CH4产量并计算其总产量。
1.6 数据统计分析试验数据经Excel 2016初步整理后,利用SPSS 22.0软件中一般线性模型(GLM)程序进行方差分析,采用Duncan氏法进行多重比较,结果用平均值和平均值标准误表示。P < 0.05为差异显著, P < 0.01为差异极显著。
2 结果与分析 2.1 干物质和纤维降解率由表 2可知,随发酵时间的延长,各能量组DMD、NDFD和ADFD均增加。在发酵48和72 h时,HE组DMD均显著高于MHE、MLE和LE组(P < 0.05);除8 h外,MHE组DMD均显著高于MLE组(P < 0.05);在发酵4、8、12和48 h时,MLE组DMD均显著高于LE组(P < 0.05)。在发酵4、8、12、24和72 h时,HE组NDFD均显著高于MHE、MLE和LE组(P < 0.05);在发酵4、12、24和48 h时,MHE组NDFD均显著高于MLE和LE组(P < 0.05);在发酵各时间点,MLE组NDFD均显著高于LE组(P < 0.05)。在发酵各时间点,HE组ADFD均显著高于MHE、MLE和LE组(P < 0.05);在发酵各时间点,MHE组NDFD均显著高于MLE和LE组(P < 0.05);在发酵4、8、12和72 h时,MLE组NDFD显著高于LE组(P < 0.05)。
|
|
表 2 低氮条件下饲粮能量水平对藏羊体外发酵DM、NDF和ADF降解率的影响 Table 2 Effects of dietary energy level under low nitrogen condition on in vitro fermentation DMD, NDFD and ADFD of Tibetan sheep |
由表 3可知,随发酵时间的延长,各能量组发酵总产气量和甲烷产量均增加。在发酵4、12和24 h时,HE组总产气量均显著高于MHE、MLE和LE组(P < 0.05)。在发酵4、8、12、24和48 h时,HE组甲烷产量均显著低于MHE、MLE和LE组(P < 0.05);除发酵48和72 h外,MHE组甲烷产量均显著低于MLE和LE组(P < 0.05);在发酵各时间点,MLE组甲烷产量均显著低于LE组(P < 0.05)。
|
|
表 3 低氮条件下饲粮能量水平对藏羊体外发酵总产气量和甲烷产量的影响 Table 3 Effects of dietary energy level under low nitrogen condition on in vitro fermentation total gas production and methane production of Tibetan sheep |
由表 4可知,随发酵时间的延长,各能量组发酵液NH3-N浓度均增加。在发酵各时间点,HE组NH3-N浓度均显著高于MHE、MLE和LE组(P < 0.05);除发酵48 h外,MHE组NH3-N浓度均显著高于MLE组和LE组(P < 0.05),且MLE组均显著高于LE组(P < 0.05);在发酵48 h时,MHE与MLE组间和MLE与LE组间NH3-N浓度均无显著差异(P>0.05)。
|
|
表 4 低氮条件下饲粮能量水平对藏羊体外发酵液NH3-N浓度的影响 Table 4 Effects of dietary energy level under low nitrogen condition on in vitro fermentation fluid NH3-N concentration of Tibetan sheep |
由表 5可知,随发酵时间的延长,各能量组发酵液pH均降低。在发酵各时间点,pH均随能量水平的升高而降低,其中在发酵8、12、24、48和72 h时,HE组均显著低于MHE、MLE和LE组(P < 0.05);在发酵12和48 h时,MHE组pH显著低于MLE组(P < 0.05);发酵12 h时,MLE组pH显著低于LE组(P < 0.05)。
|
|
表 5 低氮条件下饲粮能量水平对藏羊体外发酵液pH和VFA浓度的影响 Table 5 Effects of dietary energy level under low nitrogen condition on in vitro fermentation fluid pH and VFA concentration of Tibetan sheep |
随发酵时间的延长,各能量组总挥发性脂肪酸浓度、丙酸比例和丁酸比例上升,乙酸比例和乙酸/丙酸下降。在发酵各时间点,HE组总挥发性脂肪酸浓度均显著高于MHE、MLE和LE组(P < 0.05)。在发酵各时间点,HE组乙酸比例均显著低于MHE、MLE和LE组(P < 0.05)。在发酵各时间点,HE组丙酸比例均显著高于MHE、MLE和LE组(P < 0.05)。发酵至12、24和48 h时,LE组丁酸比例均显著低于MLE、MHE和HE组(P < 0.05),而在发酵72 h时,LE组与MLE、MHE组无显著差异(P>0.05),但显著低于HE组(P < 0.05)。在发酵12、48和72 h时,LE组乙酸/丙酸均显著高于MLE、MHE和HE组(P < 0.05),而在发酵24 h时,LE组与MLE组无显著差异(P>0.05),但显著高于MHE和HE组(P < 0.05)。
3 讨论体外模拟瘤胃发酵法是在人工模拟条件下研究瘤胃发酵过程的重要方法,同时也是评定饲粮营养价值的重要方式。饲粮DMD可以反映反刍动物对饲粮的利用程度。NDFD和ADFD则是体现反刍动物瘤胃发酵过程中粗饲料利用效率的重要指标。本试验中,随着饲粮能量水平的提高,DMD、NDFD和ADFD均显著升高。这主要是因为,随饲粮能量水平的升高,饲粮中的淀粉等可溶性非结构性碳水化合物含量升高,饲粮DM被瘤胃微生物及其消化酶降解利用的程度也升高。此外,饲粮能量水平的提高,可以为瘤胃中纤维降解菌的自身繁殖以及对纤维的降解活动提供更多的能量,从而促进了微生物对NDF、ADF的降解作用。
瘤胃微生物在对饲粮的发酵利用过程中会产生CO2、CH4和H2等气体,CH4主要是由糖类等碳水化合物在瘤胃中的无氧酵解产生的;而CO2和H2则主要来自于丙酮酸转变为乙酸的脱羧过程[24]。此外,发酵总产气量也可反映瘤胃微生物对饲粮的降解利用程度[25],总产气量越高,表明饲粮发酵越充分,对饲粮的利用率越高。本试验中,各时间点发酵总产气量均随饲粮能量水平的提高而增加,这主要是由于随着饲粮能量水平提高,饲粮中瘤胃可降解物质含量增加且微生物活性增强[26]。这与本试验中随着饲粮能量水平的提高,DMD、NDFD和ADFD也显著升高的结果相一致。
瘤胃微生物发酵所产生的CH4主要是由瘤胃中的碳水化合物经细菌、原虫等微生物厌氧发酵所产生的,反刍动物瘤胃发酵产生的CH4不但会造成2%~12%的饲粮能量损失,还会加剧温室效应[27]。本试验中,随着饲粮能量水平和精粗比的提高,CH4产量降低,这与Chandramoni等[27]和梁静等[28]的研究结果相同。反刍动物瘤胃发酵生成乙酸的过程中会产生大量H2,而丙酸的生成过程会消耗氢,古菌类微生物也可利用氢合成CH4[24]。本试验中,随饲粮能量水平的提高,更多的氢被微生物利用合成丙酸,从而使得瘤胃CH4生成的前体物氢减少,CH4产量也随之减少。这也与本试验中随饲粮能量水平的提高,发酵液乙酸/丙酸降低的结果相一致。
VFA是碳水化合物在瘤胃中降解的终产物,主要由乙酸、丙酸和丁酸组成。它主要是由丙酮酸经过一系列代谢过程而产生,而丙酮酸又是由瘤胃中的碳水化合物经细菌和原虫等微生物发酵所产生[29]。反刍动物总能需要量的70%~80%来自VFA[30]。与张海波等[31]对肉牛补饲精料的研究结果一致,本试验中发酵液总挥发性脂肪酸浓度随着饲粮能量水平的提高而增加,这主要是由饲粮中瘤胃可发酵碳水化合物的变化而引起。通常,非结构性碳水化合物(NSC)经瘤胃发酵产生的VFA中丙酸的比例较高,而纤维等结构性碳水化合物在瘤胃发酵过程中则以产乙酸为主。对反刍动物而言,动物体活动所需要的能量来源主要是肝脏糖异生作用所产生的葡萄糖,而丙酸是糖异生作用的重要前体物质,这说明发酵产生的VFA中丙酸所占比例越大,乙酸/丙酸越小,其能量利用效率越高[24]。本试验中乙酸/丙酸随饲粮能量水平的提高而降低,这说明在本试验条件下,随着饲粮能量水平的提高,瘤胃发酵类型由乙酸型发酵逐渐向丙酸型发酵转变。通常在体内试验中,VFA会经动物瘤胃壁吸收而进入血液,其在瘤胃内的浓度是VFA在瘤胃内发酵生成与被瘤胃壁吸收的平衡值。然而,在体外试验中,VFA因为缺失外流过程而会在发酵液中逐渐积累,因此pH下降可能更显著。pH是评价瘤胃内环境的重要指标之一,受发酵底物类型、唾液分泌以及有机酸积累等许多因素的影响[32],而相对稳定的瘤胃内环境则是瘤胃微生物发挥正常功能的重要条件之一。本试验研究结果表明,随着饲粮能量水平的提高,发酵液pH均显著下降,且随着发酵时间的延长,发酵液pH也逐渐降低。究其原因可能是饲粮能量水平越高,发酵过程中产生的VFA越多,且VFA在发酵液中不断积累,从而使得发酵液pH降低。此外,发酵液中VFA浓度与pH呈负相关,本研究中发酵液pH随饲粮能量水平升高而降低的结果也间接反映了VFA浓度的上升。但在整个发酵过程中发酵液pH始终保持在5.5~7.5的正常范围内[33]。因此,本试验中不同能量水平饲粮发酵环境基本没有对微生物生长产生不良影响。
饲粮中的粗蛋白质被发酵液中的原虫和部分蛋白降解菌消耗而产生NH3-N[34],它是瘤胃微生物用于合成菌体蛋白最重要的氮源之一[35]。瘤胃液中NH3-N浓度在一定程度上可以反映出瘤胃微生物分解蛋白质等含氮物质产生NH3-N及对其摄取利用的情况,是瘤胃内环境的重要指标。本研究中,随着饲粮能量水平提高,发酵液NH3-N浓度增加,这可能是由于体外发酵过程中,饲粮能量水平的提高为瘤胃微生物分解含氮物质产生NH3-N的活动提供了充足的能量。
4 结论低氮条件下,提高饲粮能量水平可促进DM、NDF和ADF的降解,增加总挥发性脂肪酸浓度,并降低CH4排放。因此,在青藏高原冷季,通过补饲易获得且经济的能量饲料,可提高藏羊对营养物质利用效率,改善其生长性能,从而维护草畜生态平衡。
| [1] |
赵有璋. 羊生产学[M]. 2版. 北京: 中国农业出版社, 2002.
|
| [2] |
XIN G S, LONG R J, GUO X S, et al. Blood mineral status of grazing Tibetan sheep in the Northeast of the Qinghai-Tibetan Plateau[J]. Livestock Science, 2011, 136(2/3): 102-107. |
| [3] |
李孝仪, 杨舒黎, 马黎, 等. 西藏绵羊低氧适应的血液生理学特性研究[J]. 黑龙江畜牧兽医, 2016(1): 12-15. |
| [4] |
LONG R J, DING L M, SHANG Z H, et al. The yak grazing system on the Qinghai-Tibetan plateau and its status[J]. The Rangeland Journal, 2008, 30(2): 241-246. DOI:10.1071/RJ08012 |
| [5] |
莫文生, 杜雪燕, 孙璐, 等. 不同能氮比精料对藏羊生长性能和血清指标的影响[J]. 黑龙江畜牧兽医, 2017(13): 122-125. |
| [6] |
祁生元, 雷良煜. 放牧藏羊冷季营养调控试验报告[J]. 青海畜牧兽医杂志, 2012, 42(4): 24-25. DOI:10.3969/j.issn.1003-7950.2012.04.017 |
| [7] |
张立, 央金, 洛桑催成, 等. 高原型藏绵羊春季补饲试验[J]. 西南农业学报, 2017, 30(4): 975-977. |
| [8] |
丁考仁青, 石红梅, 张玉林, 等. 甘南藏羊高寒牧区冷季补饲育肥试验[J]. 畜牧兽医杂志, 2011, 30(6): 28-29. |
| [9] |
马桂琳, 祁红霞, 刘秀, 等. 甘南藏绵羊冷季补饲试验研究[J]. 畜牧兽医杂志, 2011, 30(6): 35-37. DOI:10.3969/j.issn.1004-6704.2011.06.014 |
| [10] |
赵忠, 王安禄, 王宝全, 等. 藏系绵羊冷季补饲时限与措施优化研究[J]. 中国草食动物, 2005, 25(2): 21-23. DOI:10.3969/j.issn.2095-3887.2005.02.006 |
| [11] |
徐田伟, 胡林勇, 赵娜, 等. 补饲燕麦青干草对牦牛和藏系绵羊冷季生长性能的影响[J]. 西南农业学报, 2017, 30(1): 205-208. |
| [12] |
ZHOU J W, GUO X S, DEGEN A A, et al. Urea kinetics and nitrogen balance and requirements for maintenance in Tibetan sheep when fed oat hay[J]. Small Ruminant Research, 2015, 129: 60-68. DOI:10.1016/j.smallrumres.2015.05.009 |
| [13] |
National Research Council. Nutrient requirements of sheep[M]. Washington D.C.: National Academies, 1985.
|
| [14] |
ZHOU J W, MI J D, TITGEMEYER E C, et al. A comparison of nitrogen utilization and urea metabolism between Tibetan and fine-wool sheep[J]. Journal of Animal Science, 2015, 93(6): 3006-3017. DOI:10.2527/jas.2014-8865 |
| [15] |
王威, 张建勋, 康坤, 等. 冷季补饲精料对牦牛繁殖性能和生长性能的影响[J]. 中国畜牧杂志, 2013, 49(7): 78-80. DOI:10.3969/j.issn.0258-7033.2013.07.021 |
| [16] |
谢敖云, 柴沙驼, 王万邦, 等. 高山草甸草地牧草产量及其营养变化规律[J]. 青海畜牧兽医杂志, 1996, 26(2): 8-10. |
| [17] |
中华人民共和国农业部.NY/T 816-2004肉羊饲养标准[S].北京: 中国农业出版社, 2004.
|
| [18] |
熊本海, 罗清尧, 赵峰, 等. 中国饲料成分及营养价值表(2015年第26版)制订说明[J]. 中国饲料, 2015(21): 23-23. |
| [19] |
MENKE K H, STEINGASS H. Estimation of the energetic feed value obtained from chemical analysis and in vitro gas production using rumen fluid[J]. Animal Research and Development, 1988, 28: 7-55. |
| [20] |
张丽英. 饲料分析及饲料质量检测技术[M]. 2版. 北京: 中国农业大学出版社, 2003.
|
| [21] |
MENKE K H, RAAB L, SALEWSKI A, et al. The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J]. The Journal of Agricultural Science, 1979, 93(1): 217-222. DOI:10.1017/S0021859600086305 |
| [22] |
HRISTOV A N, IVAN M, RODE L M, et al. Fermentation characteristics and ruminal ciliate protozoal populations in cattle fed medium-or high-concentrate barley-based diets[J]. Journal of Animal Science, 2001, 79(2): 515-524. DOI:10.2527/2001.792515x |
| [23] |
ERWIN E S, MARCO G J, EMERY E M. Volatile fatty acid analyses of blood and rumen fluid by gas chromatography[J]. Journal of Dairy Science, 1961, 44(9): 1768-1771. DOI:10.3168/jds.S0022-0302(61)89956-6 |
| [24] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004.
|
| [25] |
CHALUPA W. Manipulating rumen fermentation[J]. Journal of Animal Science, 1977, 45(3): 585-599. DOI:10.2527/jas1977.453585x |
| [26] |
李婉, 张爱忠, 姜宁, 等. 不同精料水平对绒山羊体外发酵的影响[J]. 黑龙江畜牧兽医, 2008(1): 40-42. DOI:10.3969/j.issn.1004-7034.2008.01.018 |
| [27] |
CHANDRAMONI, JADHAO S B, TIWARI C M, et al. Energy metabolism with particular reference to methane production in Muzaffarnagari sheep fed rations varying in roughage to concentrate ratio[J]. Animal Feed Science and Technology, 2000, 83(3/4): 287-300. |
| [28] |
梁静, 张文举, 王博. 不同精粗比底物下添加复合营养调控剂对绵羊瘤胃微生物体外发酵的影响[J]. 家畜生态学报, 2016, 37(11): 25-30. DOI:10.3969/j.issn.1673-1182.2016.11.005 |
| [29] |
郭冬生, 彭小兰. 反刍动物挥发性脂肪酸消化代谢规律刍议[J]. 畜牧与饲料科学, 2005(1): 1-3. DOI:10.3969/j.issn.1672-5190.2005.01.001 |
| [30] |
王中华. 反刍动物挥发性脂肪酸中间代谢[J]. 草食家畜, 1995(2): 23-31, 34. |
| [31] |
张海波, 王之盛. 精料补充料能量水平对肉牛瘤胃发酵特性及微生物菌群的影响[J]. 中国畜牧杂志, 2017, 53(9): 97-101. |
| [32] |
高天爽, 孙海霞, 谢小来, 等. 日粮中高粱替代玉米对绵羊瘤胃发酵的影响[J]. 黑龙江畜牧兽医, 2014(5): 7-10. |
| [33] |
BEUVINK J M W, SPOELSTRA S F. Interactions between substrate, fermentation end-products, buffering systems and gas production upon fermentation of different carbohydrates by mixed rumen microorganisms in vitro[J]. Applied Microbiology and Biotechnology, 1992, 37(4): 505-509. |
| [34] |
姜鑫, 刘帅, 徐宏建, 等. 玉米蛋白水解物对奶牛瘤胃体外发酵及纤维素酶活的影响[J]. 中国饲料, 2018(3): 60-65. |
| [35] |
BACH A, CALSAMIGLIA S, STERN M D. Nitrogen metabolism in the rumen[J]. Journal of Dairy Science, 2005, 88(Suppl.1): E9-E21. |




