鸡蛋清是一种以蛋白质(11%)为分散相、水(88%)为分散质的淡黄色透明胶体溶液,是氨基酸组成最接近人体的优质、廉价动物源性蛋白质。而蛋白高度和哈氏单位[1]是衡量蛋清品质、鸡蛋货架期的关键指标,蛋清蛋白、氨基酸组成及碳水化合物含量显著影响其起泡性、乳化性和稳定性。蛋清品质下降一直是蛋鸡生产者和消费者最为关注的问题之一。影响蛋清品质的因素主要包括:饲粮营养素来源及水平、蛋鸡周龄和品种、疾病(传染性支气管炎)、应激(冷、热)以及储存条件和时间等。随着我国蛋鸡养殖生产向着集约化、规模化不断发展,加之由于饲粮豆粕资源短缺,非常规蛋白质原料的使用越来越多,以及蛋鸡产蛋后期的机体氧化还原体系失衡,导致生殖系统功能降低,这些因素使鲜蛋品质下降(蛋清稀化)问题日益突出。因此,笔者在简述鸡蛋蛋清组成及其影响因素的基础上,围绕饲粮蛋白质和抗氧化物质对鸡蛋清品质的影响及其机制等方面,回顾了国内外尤其是本团队近年来在鸡蛋蛋清品质调控方面所做的研究工作,以期为鸡蛋蛋清品质的营养调控提供借鉴。
1 鸡蛋蛋清的组成及其高丰度蛋白的功能特性蛋清约占鸡蛋重的60%,除溶菌酶外的蛋清蛋白都属于糖蛋白,卵清蛋白(54%)、卵转铁蛋白(13%)、卵类黏蛋白(11%)、卵黏蛋白(3.5%)和溶菌酶(3.5%)等高丰度蛋白(图 1)占总蛋白的86%[2-3];此外,还包括抗生物素蛋白(0.05%)、半胱氨酸蛋白酶抑制剂(0.05%)、卵黄蛋白(0.8%)、卵糖蛋白(1.0%)和卵抑制剂(1.5%)等微量蛋白[3-4]。
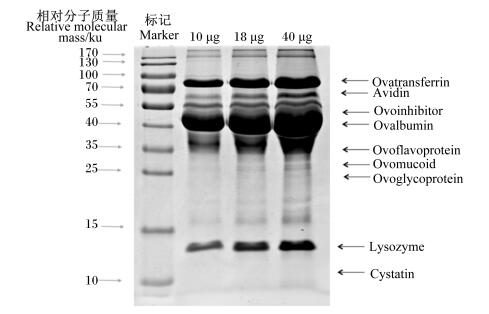
|
Ovotransferrin:卵转铁蛋白;Avidin:抗生物素蛋白;Ovoinhibitor:卵抑制剂;Ovalbumin:卵清蛋白;Ovoflavoprotein:卵黄蛋白;Ovomucoid:卵类黏蛋白;Ovoglycoprotein:卵糖蛋白;Lysozyme:溶菌酶;Cystatin:半胱氨酸蛋白酶抑制剂。 图 1 鸡蛋蛋清的蛋白质组成 Fig. 1 Protein composition of egg ovalbumin of laying hens[3] |
其中,卵清蛋白、卵转铁蛋白、卵类黏蛋白、溶菌酶和卵黏蛋白等蛋清中高丰度蛋白已经可从鸡蛋清中分离,且具有抗氧化、螯合金属、抑菌、抗病毒和抗肿瘤等生物学功能[5]。其一,卵清蛋白(45 ku)是典型的球蛋白,具抗氧化活性,约占蛋清蛋白的54%,亦是蛋清中唯一内部含自由巯基的蛋白质,由A1(含2个磷酸盐基团)、A2(含1个磷酸盐基团)及A3(不含磷酸盐基团)以85 : 12 : 3的比例[4]组成,含3.5%糖基和386个氨基酸残基,其氨基酸链的N端是乙酰甘氨酸,C端是脯氨酸[6],其在储藏和孵化过程中会转化为一种热稳定形式(S-卵清蛋白)。其二,卵转铁蛋白(76 ku)由686个氨基酸残基组成的单体糖蛋白[4],有结合和传递铁的能力。其三,卵类黏蛋白(28 ku)的糖基化程度较高,是胰蛋白酶抑制剂,亦是食物过敏原物质,还可做抑菌剂。其四,溶菌酶(14 400 u)因其抑菌性而得名,是含129个氨基酸残基的单一多肽链,也是唯一的非糖蛋白,等电点10.7,可与带负电的蛋白(如卵黏蛋白)结合,且两者络合物影响蛋清的凝胶性[4]。含33%碳水化合物的卵黏蛋白在蛋清蛋白中含量排在第5位,对蛋清凝胶性起关键作用,其含量影响鸡蛋蛋白高度和哈氏单位;卵黏蛋白有α(匀质,α1和α2)和β(不匀质)2种亚基,α-亚基(含11%~15%碳水化合物,150~220 ku)富含天冬氨酸和谷氨酸;β-亚基(含50%~57%碳水化合物,400~523 ku)富含丝氨酸和苏氨酸。根据溶解度(亚基比例)的不同,可把卵黏蛋白分为2类:可溶性卵黏蛋白(8 300 ku,87%α-亚基+13%β-亚基)存在于浓蛋清和稀蛋清中;不溶性卵黏蛋白(23×103 ku,67%α-亚基+33%β-亚基)仅存在于浓蛋清中[7]。新近研究证实,卵黏蛋白还具抑菌、抗病毒和抗肿瘤等生物活性[5]。
2 鸡蛋蛋清稀化的影响机制储存壳蛋和新产蛋均会出现蛋清稀化,但蛋清稀化的机制尚不完全清楚。新产鸡蛋的哈氏单位通常在75~82,甚至可达90左右,但从产出那一刻开始,浓蛋白便会随储存时间的延长逐渐转化为低黏度状态,哈氏单位逐渐降低,直至完全水化,称蛋白稀化。蛋白质构象改变对储存过程中蛋清稀化起着至关重要的作用,当前关于其稀化机制有3种观点:其一,最被认可的观点是卵黏蛋白β-亚基的降解;其二,有学者认为蛋清pH升高降低卵黏蛋白与溶菌酶相互作用,改变了其络合物形式;其三,储存期内S-卵清蛋白含量升高,且与哈氏单位负相关,所以卵清蛋白转化成S-卵清蛋白也可能是蛋清稀化的部分原因[8]。产蛋鸡的输卵管膨大部约占输卵管长度的50%,是蛋清合成、分泌的靶器官[9],其健康状况与鲜蛋蛋清品质密切相关。其皱褶黏膜层由具纤毛和无纤毛的单层柱状上皮细胞排列而成,固有层分布着丰富的管状腺。膨大部皱褶高度和表面上皮细胞高度是影响蛋清品质的重要因素[10]。研究显示,传染性支气管炎病毒严重损害产蛋鸡的生殖系统,引起膨大部颗粒上皮细胞和管状腺上皮细胞出现病理变化,降低膨大部的蛋清蛋白合成,形成水样蛋清鸡蛋[11];H9N2亚型禽流感病毒亦可降低产蛋鸡的输卵管膨大部的卵清蛋白合成量,导致鲜蛋蛋清稀化[12]。研究表明,皮质酮可下调产蛋鸡膨大部组织的卵清蛋白、卵清蛋白-Y、卵转铁蛋白、卵抑制剂等蛋白和mRNA表达量,进而影响鲜蛋的蛋清品质[13]。
因此,储存壳蛋和鲜鸡蛋蛋清稀化的机制可能并不完全相同,比如S-卵清蛋白含量与储存蛋的哈氏单位间呈高度负相关,或可作为衡量储存壳蛋新鲜度的一个指标,但S-卵清蛋白含量与产蛋鸡周龄、营养情况和蛋重无关。储存壳蛋蛋清的稀化机制主要考虑鸡蛋蛋清蛋白质含量、相互作用及蛋白质构象;而鲜蛋蛋清的稀化机制要从产蛋鸡本身入手,围绕机体蛋白代谢,聚焦蛋清分泌靶器官,进行系统研究以揭示其机制。
3 饲粮蛋白质因素对蛋清品质的影响 3.1 饲粮蛋白质水平对蛋清品质的影响在一定范围内,饲粮粗蛋白质水平降低不会影响鸡蛋蛋清品质。在总含硫氨基酸(TSAA)与赖氨酸(Lys)比例恒定的条件下,20~72周龄内海兰W-36产蛋鸡饲粮粗蛋白质水平降低1.5百分点对鸡蛋蛋白高度无显著影响[14]。然而,付胜勇[15]在添加6种晶体氨基酸的基础上,使试验饲粮具有相同的标准回肠可消化氨基酸(SID AA)模式,将540只20周龄海兰灰蛋鸡分为5个组,每组6个重复,饲粮粗蛋白质水平从18.0%按0.5%差值降到16.0%,试验期12周,结果发现16.5%粗蛋白质组的鸡蛋蛋白高度与对照组无显著差异,而16.0%粗蛋白质组的蛋白高度显著低于对照组,且鸡蛋蛋白高度与标准回肠可消化亮氨酸摄入量显著相关。这与Novak等[16]的研究结果一致,该试验给44周龄海兰W-98蛋鸡饲喂玉米-豆粕型饲粮,通过调整玉米和豆粕比例并添加晶体Lys、色氨酸和苏氨酸,保证饲粮粗蛋白质水平(16.0%、14.5%和13.0%)和TSAA/Lys(0.92、0.82和0.72),试验期20周,发现14.5%粗蛋白质组和16.0%粗蛋白质组的鸡蛋蛋清比例等品质无显著差异,而13.0%粗蛋白质组的鸡蛋蛋清比例、蛋清蛋白和干物质含量显著低于16.0%粗蛋白质组,作者认为其原因可能是饲粮中过低的粗蛋白质水平引起蛋鸡体内蛋白质合成受到抑制或限制。在不影响鸡蛋清品质的前提下,降低饲粮粗蛋白质水平,既可缓解豆粕资源短缺问题,节约饲粮成本、同时可降低氮排放减少环境污染。但当前关于饲粮粗蛋白质水平对蛋清品质的影响仅局限在蛋白高度、哈氏单位等表观指标,而产蛋鸡不同品种及阶段对蛋白质的需求可能不同,因此后续研究需考虑蛋鸡品种及生理阶段的影响,以期在蛋鸡实际生产中更加合理、高效地应用低蛋白质饲粮。
3.2 饲粮蛋白质原料对蛋清品质的影响及机理饲粮蛋白质质量是影响蛋清品质(蛋白高度和哈氏单位)的最重要营养因素。不同的饲粮蛋白质原料可能通过其氨基酸模式、抗营养因子等影响动物体内的蛋白质代谢,进而影响蛋清品质。豆粕的氨基酸组成比较平衡,系产蛋鸡饲粮的首选蛋白质原料[17];但国内豆粕生产严重依赖进口大豆,价格高、波动大;棉籽粕、菜籽粕、花生粕等油料饼粕,以及淀粉加工副产物等蛋白质原料价格低廉,是替代豆粕的潜在原料。当前,关于饲粮蛋白质原料与蛋清品质的研究主要局限于棉籽粕,Yuan等[18]将360只40周龄海兰褐产蛋鸡按产蛋率相近的原则分为5个组,每组4个重复,在玉米-豆粕型饲粮基础上分别添加6%普通棉籽粕以及6%、8%和10%的膨化棉籽粕,试验期8周,发现10%膨化棉籽粕(游离棉酚:40 mg/kg)饲粮显著降低8周末的鸡蛋蛋白高度和哈氏单位。基于理想氨基酸模式的概念,何涛[3]在饲粮中添加7种晶体氨基酸,使其保持相同的SID AA模式和等氮等能水平,将432只40周龄健康海兰褐产蛋鸡据产蛋率接近的原则分为6个组:对照组为玉米-豆粕型饲粮;4个试验组分别按25%、50%、75%和100%的棉籽粕蛋白替代豆粕蛋白;第6组添加与100%棉籽粕蛋白组相同含量的游离棉酚(28.35 mg/kg),试验期12周,结果表明:全棉籽粕蛋白饲粮显著降低12周末的鸡蛋蛋白高度、哈氏单位和蛋清蛋白含量,且饲粮中28.35 mg/kg游离棉酚并非致蛋清品质降低的主要原因。研究证实,饲粮氨基酸只有被小肠吸收后才能发挥作用,小肠氨基酸转运体对于饲粮蛋白质的利用至关重要[19-20],且Lys和精氨酸间存在拮抗[21],棉籽粕蛋白饲粮中标准回肠可消化精氨酸/标准回肠可消化Lys远远高于豆粕饲粮(149 vs. 113),在饲粮粗蛋白质水平恒定的前提下无法消除过量精氨酸。而试验饲粮中并未添加晶体亮氨酸,致棉籽粕蛋白饲粮标准回肠可消化亮氨酸/标准回肠可消化Lys远低于豆粕蛋白饲粮(119 vs. 156),而亮氨酸缺乏不利于机体蛋白合成[15, 22]。因此,蛋清品质差异可能与棉籽粕蛋白与豆粕蛋白的化学组成、氨基酸模式、蛋白和小肽消化以及代谢不同有关[16]。进一步研究表明,全棉籽粕蛋白饲粮可引起产蛋鸡血液孕酮水平降低,抑制了输卵管膨大部的上皮细胞和管状腺细胞生长,导致膨大部指数降低,其黏膜柱状上皮细胞不完整,管腔内蛋白分泌物较少,蛋白合成、分泌功能降低,最终引起蛋清蛋白的差异化表达,降低蛋清品质[23-24]。
双低菜籽粕是一种低芥酸、低硫苷、氨基酸组成平衡的非常规蛋白质原料,是极具开发潜力的饲料蛋白质资源。王晓翠[25]以32周龄京红1号产蛋鸡为试验动物,试验饲粮中添加7种晶体氨基酸,使其具相同SID AA模式,并保证等氮等能水平,以玉米-豆粕型饲粮为对照,29.20%双低菜籽粕替代豆粕连续饲喂12周,结果表明玉米-豆粕组和玉米-双低菜籽粕组的鸡蛋蛋白高度和哈氏单位无显著差异。可见,双低菜籽粕可以作为豆粕的替代物。除此之外,今后还应研究普通菜籽粕、花生粕、棕榈籽粕、昆虫蛋白等非常规蛋白质原料对蛋清品质的影响及其机制,以便在蛋鸡饲粮中更好利用其他蛋白质原料。
4 饲粮抗氧化物质对蛋清品质的影响蛋鸡在集约化饲养过程中,经较长高峰产蛋期后,进入产蛋后期的蛋鸡机体可能出现活性氧(reactive oxygen species,ROS)过度产生、抗氧化系统功能减弱等导致自由基过剩,损伤DNA和蛋白质,导致体内氧化还原系统失衡、生殖系统功能降低,使体内的蛋白质合成和转运能力降低[26],在鲜蛋蛋清品质上表现为蛋白高度、哈氏单位、浓蛋白比例下降[27],大大缩短鸡蛋货架期。机体氧化还原是一种动态平衡,自由基产生过多或抗氧化防御机能削弱,就会产生氧化应激,诱发疾病、衰老等[28]。饲粮抗氧化剂可延缓饲粮营养物质氧化,提高其稳定性并延长储存期;同时消除、抑制或减缓体内自由基生成,调节机体氧化还原平衡,减少氧化应激的产生。目前,除了合成抗氧化剂以外,人们越来越重视植物源性抗氧化物质[29]的潜在应用价值。
4.1 茶多酚(tea polyphenols,TP)对蛋清品质的影响及可能机制许多研究证实,TP可通过提高抗氧化能力改善鸡蛋蛋白高度和哈氏单位等蛋清品质。Yuan等[30]采用1+3×3因子设计,将300只67周龄罗曼蛋鸡分10个组,以玉米-豆粕型饲粮为对照组,试验组在对照组饲粮基础上添加钒(5、10和15 mg/kg)和TP(0、600和1 000 mg/kg),试验期5周,结果显示,10 mg/kg以上钒可造成蛋鸡肝脏氧化应激,降低鸡蛋蛋白高度和哈氏单位;TP可缓解钒引起的氧化应激和鸡蛋蛋白高度和哈氏单位的降低。由此,我们推断TP改善鸡蛋蛋清品质可能有以下几个方面的原因:其一,多酚可与蛋白质、多糖形成复合物,提高β-卵黏蛋白含量和蛋清凝胶强度[31],其二,TP作为典型的黄酮类天然抗氧化物,可直接清除体内ROS,同时提高体内超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)和过氧化氢酶(CAT)等抗氧化酶活性,抑制炎症反应,刺激核转录因子——核因子E2相关因子2(Nrf2),提高抗氧化能力,保护细胞免受损伤[32-33],有效调控机体氧化应激和细胞凋亡[34],改善膨大部组织功能,提高蛋白质合成和分泌功能[35]。其三,蛋清稀化与输卵管膨大部腺上皮细胞和管腔组织形态相关[11-12]。有研究证实,200 mg/kg TP显著提高产蛋后期的蛋鸡输卵管膨大部的皱褶高度和表面上皮细胞高度[35],但纤毛在整个蛋清形成过程中起何种作用还需进一步研究。
TP可降低蛋白质氧化损伤。本实验室前期研究显示,在玉米-豆粕型饲粮基础上添加200 mg/kg TP连续饲喂65周龄海兰褐蛋鸡10周,与基础饲粮相比,200 mg/kg TP显著降低10周末的蛋清蛋白羰基含量和表面疏水力、提高蛋白巯基含量[35]。与此类似,发现500 mg/kg绿茶提取物显著降低老龄大鼠心脏和肝脏的蛋白质羰基含量[36]。蛋白质是ROS攻击的主要靶标之一,导致氨基酸残基发生氧化修饰,改变其结构和功能[37]。氧化损伤致蛋白质羰基含量和表面疏水力增加,巯基含量降低,这3个指标是衡量蛋白氧化损伤的关键指标[38-40]。适宜剂量TP通过平衡氧化/抗氧化系统提高机体抗氧化防御系统性能,降低蛋白氧化损伤[41-42]。而且,TP可通过介导金属结合蛋白、细胞增殖、免疫功能相关蛋白表达和p53信号通路调控细胞凋亡和自噬,改善氧化应激引起的蛋清品质降低[43]。
4.2 其他抗氧化物质对鸡蛋清品质的影响近年来,本研究室针对抗氧化物质对蛋清品质的影响做了一系列探索,证实低聚异麦芽糖(isomalto-oligosaccharide,IMO)、L-肉碱、吡咯喹啉醌(pyrroloquinoline quinone,PQQ)、锌、葡萄原花青素(grape procyanidins,GPC)等抗氧化物质通过提高机体抗氧化能力改善蛋清品质。IMO是一种可提高机体抗氧化能力的新型功能性低聚糖,武书庚等[44]采用单因子完全随机区组设计,选用600只29周龄健康海兰褐蛋鸡,分5个组,每组6个重复,在玉米-豆粕-棉籽粕-花生粕型饲粮基础上,分别添加1、2、4和8 g/kg IMO,基础饲粮为对照组,试验期8周,结果显示2 g/kg IMO显著提高37周龄海兰褐蛋鸡的鸡蛋蛋白高度。L-肉碱作为一种水溶性维生素,同样具抗氧化功效,我们选用576只53周龄海兰褐蛋鸡进行L-肉碱对蛋清品质的影响研究,以玉米-豆粕型饲粮为对照,试验组在对照组基础上分别添加25、50、100、200和400 mg/kg L-肉碱,试验期6周,结果表明25 mg/kg L-肉碱显著提高59周龄海兰褐蛋鸡的鸡蛋蛋白高度和哈氏单位[45]。PQQ作为一种具有抗氧化功能的类维生素物质,也可以提高蛋鸡的抗氧化能力。赵芹[46]选用288只29周龄海兰褐蛋鸡为试验鸡,Ⅰ组为对照,饲喂玉米-豆粕型基础饲粮,Ⅱ组为病理模型,饲喂高能低蛋白质饲粮,Ⅲ组和Ⅳ组分别在Ⅱ组基础上添加0.08和0.16 mg/kg PQQ,预试期1周,正试期8周,发现0.08 mg/kg PQQ可显著改善高能低蛋白质饲粮引起的鸡蛋蛋白高度和哈氏单位的降低。微量元素锌作为铜锌超氧化物歧化酶(Cu/Zn-SOD)的重要组成部分,参与SOD合成及活性维持[47];同时参与体内300多种酶(如氨基酰转移酶)的形成,可促进体内蛋白质周转代谢,提高鸡蛋蛋白质含量。张亚男[48]选用504只54周龄海兰灰蛋鸡据产蛋率相近原则分成7组,每组6个重复,正试期6周,玉米-豆粕型基础饲粮(29.07 mg/kg锌)饲喂所有试验鸡4周以排除锌的影响,而后分别饲喂基础饲粮和基础饲粮基础上分别添加硫酸锌(35、70和140 mg/kg锌)和蛋氨酸锌(35、70和140 mg/kg锌)的试验饲粮,试验期6周,结果显示:70 mg/kg硫酸锌显著提高61周龄蛋鸡的鸡蛋蛋白高度和哈氏单位。关于GPC的研究,我们将288只64周龄罗曼蛋鸡分为4个组,每组6个重复,在玉米-豆粕型饲粮基础上添加50、100 mg/kg GPC及200 mg/kg特丁基对苯二酚,试验期8周,结果表明:50 mg/kg GPC显著提高8周末的鸡蛋哈氏单位[49]。此外,褚静娟等[50]以180只39周龄海兰灰产蛋鸡为试验动物,在玉米-豆粕型饲粮基础上添加5.0、7.5和10.0 g/kg复合抗氧化剂(维生素C、维生素E、TP、异黄酮和硫辛酸等复合物),试验期8周,结果显示:10 g/kg复合抗氧化剂显著提高8周末的鸡蛋哈氏单位和机体抗氧化能力。虽然以上研究对蛋清品质的影响仅局限在蛋白高度和哈氏单位等表观指标上,但为蛋清品质的调控提供了方向,今后尚需对不同种类抗氧化剂的配伍组合及其机制进行深入研究。
5 小结鸡蛋是质优、价廉的动物蛋白质,蛋清品质一直是消费者和生产者关注的重要问题之一,饲粮蛋白质和蛋鸡周龄是2个主要影响因素,提高新鲜鸡蛋蛋清品质有助于提高鸡蛋营养价值,延长货架期,最终提高蛋禽业的经济效益。因此,从营养角度调控鸡蛋蛋清品质具有重要的科学意义和实际应用价值。而精准调控蛋清品质的关键是明确关键基因和代谢通路,棉籽粕蛋白和TP有可能通过影响产蛋鸡输卵管膨大部的组织形态和功能,调控蛋白质合成和分泌,影响蛋清品质,但其作用机制尚需进一步探讨。此外,蛋清蛋白中除溶菌酶外都是糖蛋白,亦可从蛋白质糖基化修饰角度入手,探讨调控蛋清品质的机制;再者,来源于植物和食用菌的具抗氧化、抗衰老、提高免疫力功效的多糖,在调控蛋清品质效果方面是否优于植物多酚类物质也有必要深入研究;而且,当前代谢组、转录组、蛋白组等组学技术,为揭示蛋清品质调控机制提供了有力保障。
| [1] |
HAUGH R R. The haugh unit for measuring egg quality[J]. U.S. Egg Poultry Magazine, 1937, 43: 552-555, 572-573. |
| [2] |
DATTA D, BHATTACHARJEE S, NATH A, et al. Separation of ovalbumin from chicken egg white using two-stage ultrafiltration technique[J]. Separation and Purification Technology, 2009, 66(2): 353-361. DOI:10.1016/j.seppur.2008.12.016 |
| [3] |
何涛.脱酚棉籽蛋白对鸡蛋品质的影响及其机理[D].博士学位论文.北京: 中国农业科学院, 2016. http://cdmd.cnki.com.cn/Article/CDMD-82101-1016174616.htm
|
| [4] |
ABEYRATHNE E D N S, LEE H Y, AHN D U. Egg white proteins and their potential use in food processing or as nutraceutical and pharmaceutical agents-a review[J]. Poultry Science, 2013, 92(12): 3292-3299. DOI:10.3382/ps.2013-03391 |
| [5] |
ABEYRATHNE E D N S, HUANG X, AHN D U. Antioxidant, angiotensin-converting enzyme inhibitory activity and other functional properties of egg white proteins and their derived peptides a review[J]. Poultry Science, 2018, 97(4): 1462-1468. DOI:10.3382/ps/pex399 |
| [6] |
NISBET A D, SAUNDRY R H, MOIR A J G, et al. The complete amino-acid sequence of hen ovalbumin[J]. The FEBS Journal, 1981, 115(2): 335-345. |
| [7] |
OMANA D A, WANG J P, WU J P. Co-extraction of egg white proteins using ion-exchange chromatography from ovomucin-removed egg whites[J]. Journal of Chromatography B, 2010, 878(21): 1771-1776. DOI:10.1016/j.jchromb.2010.04.037 |
| [8] |
王晓翠, 武书庚, 岳洪源, 等. 卵黏蛋白:结构组成、理化性质、在浓蛋白液化中的作用及营养调控[J]. 动物营养学报, 2015, 27(2): 327-333. DOI:10.3969/j.issn.1006-267x.2015.02.001 |
| [9] |
WYBURN G M, JOHNSTON H S, DRAPER M H, et al. The fine structure of the infundibulum and magnum of the oviduct of Gallus domesticus[J]. Experimental Physiology, 1970, 55(3): 213-232. DOI:10.1113/expphysiol.1970.sp002071 |
| [10] |
KIMARO W H, MADEKUROZWA M C, GROENEWALD H B. Histomorphometrical and ultrastructural study of the effects of carbendazim on the magnum of the Japanese quail (Coturnix coturnix japonica)[J]. Onderstepoort Journal of Veterinary Research, 2013, 80(1): 579. |
| [11] |
CHOUSALKAR K K, ROBERTS J R. Ultrastructural study of infectious bronchitis virus infection in infundibulum and magnum of commercial laying hens[J]. Veterinary Microbiology, 2007, 122(3/4): 223-236. |
| [12] |
李涛.产蛋鸡感染H9N2亚型禽流感病毒后输卵管中卵清蛋白基因表达的变化[D].硕士学位论文.杨凌: 西北农林科技大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10712-1014420298.htm
|
| [13] |
KIM J, CHOI Y H. Differential abundance of egg white proteins in laying hens treated with corticosterone[J]. Journal of Agricultural and Food Chemistry, 2014, 62(51): 12346-12359. DOI:10.1021/jf504469t |
| [14] |
KHAJALI F, KHOSHOUIE E A, DEHKORDI S K, et al. Production performance and egg quality of Hy-Line W36 laying hens fed reduced-protein diets at a constant total sulfur amino acid:lysine ratio[J]. The Journal of Applied Poultry Research, 2008, 17(3): 390-397. DOI:10.3382/japr.2008-00002 |
| [15] |
付胜勇.标准回肠可消化氨基酸模式下日粮能量与蛋白质水平对产蛋鸡的影响[D].硕士学位论文.北京: 中国农业科学院, 2012. http://cdmd.cnki.com.cn/Article/CDMD-82101-1012415516.htm
|
| [16] |
NOVAK C, YAKOUT H M, SCHEIDELER S E. The effect of dietary protein level and total sulfur amino acid:lysine ratio on egg production parameters and egg yield in Hy-Line W-98 hens[J]. Poultry Science, 2006, 85(12): 2195-2206. DOI:10.1093/ps/85.12.2195 |
| [17] |
MARTENS S D, TIEMANN T T, BINDELLE J, et al. Alternative plant protein sources for pigs and chickens in the tropics-nutritional value and constraints:a review[J]. Journal of Agriculture and Rural Development in the Tropics and Subtropics, 2012, 113(2): 101-123. |
| [18] |
YUAN C, SONG H H, ZHANG X Y, et al. Effect of expanded cottonseed meal on laying performance, egg quality, concentrations of free gossypol in tissue, serum and egg of laying hens[J]. Animal Science Journal, 2014, 85(5): 549-554. DOI:10.1111/asj.2014.85.issue-5 |
| [19] |
HE L Q, YANG H S, HOU Y Q, et al. Effects of dietary L-lysine intake on the intestinal mucosa and expression of CAT genes in weaned piglets[J]. Amino Acids, 2013, 45(2): 383-391. DOI:10.1007/s00726-013-1514-0 |
| [20] |
GILBERT E R, LI H F, EMMERSON D A, et al. Dietary protein quality and feed restriction influence abundance of nutrient transporter mRNA in the small intestine of broiler chicks[J]. The Journal of Nutrition, 2008, 138(2): 262-271. DOI:10.1093/jn/138.2.262 |
| [21] |
BRAKE J. Optimum dietary arginine:lysine ratio for broiler chickens is altered during heat stress in association with changes in intestinal uptake and dietary sodium chloride[J]. British Poultry Science, 1998, 39(5): 639-647. DOI:10.1080/00071669888511 |
| [22] |
YIN Y L, YAO K, LIU Z J, et al. Supplementing L-leucine to a low-protein diet increases tissue protein synthesis in weanling pigs[J]. Amino Acids, 2010, 39(5): 1477-1486. DOI:10.1007/s00726-010-0612-5 |
| [23] |
WANG X C, ZHANG H J, WANG H, et al. Effect of different protein ingredients on performance, egg quality, organ health, and jejunum morphology of laying hens[J]. Poultry Science, 2017, 96(5): 1316-1324. |
| [24] |
HE T, ZHANG H J, WANG J, et al. Proteomic comparison by iTRAQ combined with mass spectrometry of egg white proteins in laying hens (Gallus gallus) fed with soybean meal and cottonseed meal[J]. PLoS One, 2017, 12(8): e0182886. DOI:10.1371/journal.pone.0182886 |
| [25] |
王晓翠.理想蛋白模式下饲粮蛋白源对蛋品质的影响及其机理研究[D].博士学位论文.哈尔滨: 东北农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10224-1016017757.htm
|
| [26] |
STADTMAN E R. Protein oxidation in aging and age-related diseases[J]. Annals of the New York Academy of Science, 2001, 928(1): 22-38. |
| [27] |
SILVERSIDES F G, SCOTT T A. Effect of storage and layer age on quality of eggs from two lines of hens[J]. Poultry Science, 2001, 80(8): 1240-1245. DOI:10.1093/ps/80.8.1240 |
| [28] |
YU J, CHEN Y, ZHAI L, et al. Antioxidative effect of ginseng stem-leaf saponins on oxidative stress induced by cyclophosphamide in chickens[J]. Poultry Science, 2015, 94(5): 927-933. DOI:10.3382/ps/pev055 |
| [29] |
萨茹丽, 杨斌, 敖长金. 天然植物提取物在动物氧化应激中的研究概况[J]. 动物营养学报, 2018, 30(6): 2021-2026. DOI:10.3969/j.issn.1006-267x.2018.06.001 |
| [30] |
YUAN Z H, ZHANG K Y, DING X M, et al. Effect of tea polyphenols on production performance, egg quality, and hepatic antioxidant status of laying hens in vanadium-containing diets[J]. Poultry Science, 2016, 95(7): 1709-1717. DOI:10.3382/ps/pew097 |
| [31] |
HATANAKA Y, YAMAUCHI A, KOBAYASHI O, et al. Electron microscopic analysis of the effects of tea extract on strength improvement of egg white gels[J]. Food Science and Technology Research, 2009, 15(1): 5-10. |
| [32] |
FREI B, HIGDON J V. Antioxidant activity of tea polyphenols in vivo:evidence from animal studies[J]. The Journal of Nutrition, 2003, 133(10): 3275S-3284S. DOI:10.1093/jn/133.10.3275S |
| [33] |
KANSANEN E, KUOSMANEN S M, LEINONEN H, et al. The Keap-Nrf2 pathway:mechanisms of activation and dysregulation in cancer[J]. Redox Biology, 2013, 1(1): 45-49. DOI:10.1016/j.redox.2012.10.001 |
| [34] |
HIGDON J V, FREI B. Tea catechins and polyphenols:health effects, metabolism, and antioxidant functions[J]. Critical Reviews in Food Science and Nutrition, 2003, 43(1): 89-143. DOI:10.1080/10408690390826464 |
| [35] |
WANG X C, WANG X H, WANG J, et al. Dietary tea polyphenol supplementation improved egg production performance, albumen quality, and magnum morphology of Hy-Line Brown hens during the late laying period[J]. Journal of Animal Science, 2018, 96(1): 225-235. DOI:10.1093/jas/skx007 |
| [36] |
WANG Y C. Supplementation of green tea attenuates protein carbonyls formation in aged mice[J]. Life Science Journal, 2013, 10(3): 1034-1037. |
| [37] |
CECARINI V, GEE J, FIORETTI E, et al. Protein oxidation and cellular homeostasis:emphasis on metabolism[J]. Biochimica et Biophysica Acta (BBA):Molecular Cell Research, 2007, 1773(2): 93-104. DOI:10.1016/j.bbamcr.2006.08.039 |
| [38] |
SARHADI KHOLARI F, DEHPOUR A R, NOURBAKHSH M, et al. Erythrocytes membrane alterations reflecting liver damage in CCl4-induced cirrhotic rats:the ameliorative effect of naltrexone[J]. Acta Medica Iranica, 2016, 54(10): 631-639. |
| [39] |
TROMBETTA D, GANGEMI S, SAIJA A, et al. Increased protein carbonyl groups in the serum of patients affected by thalassemia major[J]. Annals of Hematology, 2006, 85(8): 520-522. DOI:10.1007/s00277-006-0115-3 |
| [40] |
YUKSEL Z, AVCI E, UYMAZ B, et al. General composition and protein surface hydrophobicity of goat, sheep and cow milk in the region of Mount Ida[J]. Small Ruminant Research, 2012, 106(2/3): 137-144. |
| [41] |
KIM H S, QUON M J, KIM J A. New insights into the mechanisms of polyphenols beyond antioxidant properties; lessons from the green tea polyphenol, epigallocatechin 3-gallate[J]. Redox Biology, 2014, 2: 187-195. DOI:10.1016/j.redox.2013.12.022 |
| [42] |
VAYALIL P K, ELMETS C A, KATIYAR S K. Treatment of green tea polyphenols in hydrophilic cream prevents UVB-induced oxidation of lipids and proteins, depletion of antioxidant enzymes and phosphorylation of MAPK proteins in SKH-1 hairless mouse skin[J]. Carcinogenesis, 2003, 24(5): 927-936. DOI:10.1093/carcin/bgg025 |
| [43] |
WANG J P, BAI X, DING X M, et al. Quantitative proteomic analysis reveals the role of tea polyphenol EGCG in egg whites in response to vanadium stress[J]. Nutrition, 2017, 39/40: 20-29. DOI:10.1016/j.nut.2017.02.007 |
| [44] |
武书庚, 高春起, 张海军, 等. 低聚异麦芽糖对产蛋鸡生产性能、盲肠微生物和免疫机能的影响[J]. 动物营养学报, 2011, 23(9): 1560-1568. DOI:10.3969/j.issn.1006-267x.2011.09.015 |
| [45] |
徐少辉.L-肉碱对产蛋鸡生产性能及抗氧化机能的影响[D].硕士学位论文.北京: 中国农业科学院, 2011. http://cdmd.cnki.com.cn/Article/CDMD-82101-1011158770.htm
|
| [46] |
赵芹.吡咯喹啉醌钠(PQQ.Na_2)对蛋鸡脂肪肝的调控作用[D].硕士学位论文.北京: 中国农业科学院, 2014.
|
| [47] |
OTEIZA P I, CLEGG M S, ZAGO M P, et al. Zinc deficiency induces oxidative stress and AP-1 activation in 3T3 cells[J]. Free Radical Biology and Medicine, 2000, 28(7): 1091-1099. DOI:10.1016/S0891-5849(00)00200-8 |
| [48] |
张亚男.饲粮锌对产蛋后期蛋鸡蛋壳品质及抗氧化机能的影响[D].硕士学位论文.北京: 中国农业科学院, 2013. http://cdmd.cnki.com.cn/Article/CDMD-82101-1013357335.htm
|
| [49] |
张玉, 武书庚, 王晶, 等. 葡萄原花青素对产蛋后期蛋鸡生产性能和抗氧化能力的影响[J]. 动物营养学报, 2016, 28(4): 1129-1136. DOI:10.3969/j.issn.1006-267x.2016.04.022 |
| [50] |
褚静娟, 谷娟, 顾永远, 等. 复合抗氧化剂对蛋鸡抗氧化、生产性能和鸡蛋抗氧化力的影响[J]. 上海交通大学学报(农业科学版), 2016, 34(4): 1-5, 20. DOI:10.3969/J.ISSN.1671-9964.2016.04.01 |




