大豆抗原蛋白能够导致动物肠道形态损伤、免疫功能紊乱、生长抑制和腹泻,甚至死亡[1-2],肠道是机体与外界环境接触最为密切的部位,不仅是消化、吸收营养物质的重要场所,也是机体的重要免疫屏障[3]。根据以蛋白质沉降系数为基础的超速离心分类法,大豆蛋白分为2S、7S、11S和15S。其中11S为大豆球蛋白,是胚胎时期在种子中合成的储藏蛋白质,占种子总球蛋白的40%,是大豆种子中含量最高的一种球蛋白[4-5]。为了使大豆及其制品能更充分、安全、有效的利用,降低或消除其致敏性,国内外研究人员对大豆抗原蛋白的免疫原性和致敏原性进行很多研究,深入探索大豆抗原蛋白对动物机体的致敏机理。Luo等[6]发现有限水解和高压匀化能改善11S的理化特性;Usui等[7]用半乳糖和壳聚糖与大豆蛋白进行糖基化反应,发现可降低大豆蛋白的过敏反应。张瑜等[8]前期体内试验发现,提前免疫大豆抗原蛋白对仔猪有一定的免疫保护作用。
丝裂原活化蛋白激酶(MAPK)信号通路参与调节肠道的炎症、凋亡等病理过程,是介导细胞反应的重要信号系统[9-11]。p38 MAPK可影响多种细胞因子的产生,细胞凋亡的众多途径最终都汇聚到半胱氨酸天冬氨酸蛋白酶-3(caspase-3)的激活[12],Bcl-2相关X蛋白(Bax)和B淋巴细胞瘤-2(Bcl-2)是Bcl-2家族的关键成员,Bcl-2家族主要包括促凋亡因子Bax、Bak、Bcl-2/Bcl-xL相关凋亡蛋白(Bad)等和抑制凋亡因子Bcl-2等[13]。
本研究旨在通过体外培养猪小肠上皮细胞(IPEC-J2)在分子水平上研究不同浓度11S及p38和JNK抑制剂对猪小肠上皮细胞存活率以及相关炎性因子、蛋白和mRNA相对表达量的影响,为大豆抗原蛋白引起细胞损伤的机制提供科学依据。
1 材料与方法 1.1 主要试验材料11S由中国农业大学食品工程学院提供,安徽农业大学动物科技学院进一步提纯(纯度为90.8%)。猪小肠上皮细胞购自武汉农科院细胞库。BCA蛋白浓度测定试剂盒购自Biosharp公司;β-肌动蛋白(β-actin)抗体购自北京锐抗生物科技有限公司;羊抗兔和羊抗鼠二抗购自Biosharp公司;磷酸化c-Jun氨基端激酶(p-JNK)抗体购自沈阳万类生物科技有限公司;磷酸化p38(p-p38)抗体购自博士德生物工程有限公司;Bcl-2抗体购自Proteintech公司;JNK抑制剂(SP600125)和p38抑制剂(SB202190)购自MEC公司;白细胞介素-6(IL-6)、一氧化氮(NO)、5-羟色胺(5-HT)、白细胞介素-10(IL-10)酶联免疫吸附测定(ELISA)试剂盒购自江苏酶标生物有限公司。
1.2 试验分组将对数生长期的猪小肠上皮细胞以1×105个/mL的密度接种于6孔细胞培养板。置于37 ℃、5% CO2培养箱中培养至细胞贴壁,试验分为A、B、C、D、E、F 6组,其中A组为对照组,其他各组分别在培养液中添加1、5、10、5、5 mg/mL的11S,并且在E、F组分别添加1 μmol/L的JNK和p38抑制剂,每个组设置6个重复孔。
1.3 试验方法 1.3.1 CCK-8法检测细胞存活率猪小肠上皮细胞经过不同浓度11S以及相应抑制剂处理培养24 h后,每孔再加入10 μL CCK-8,放入细胞培养箱中继续培养,直至出现明显的颜色反应。在酶标仪450 nm波长下读取吸光度(OD)值,计算细胞存活率。
1.3.2 ELISA法检测细胞NO、IL-6、5-HT和IL-10的含量猪小肠上皮细胞经过不同浓度11S以及相应抑制剂处理培养24 h后,收集细胞,1 000 r/min离心5 min,用磷酸盐缓冲液(PBS)洗涤3次,然后加入500 μL含0.1% Triton X-100的0.1 mol/L Tris-HCl缓冲溶液(pH=7.4),放入冰水中进行超声裂解。将细胞裂解液以l 000 r/min离心10 min,收取上清液,按照ELISA试剂盒说明书进行测定,计算NO、IL-6、5-HT和IL-10的含量。
1.3.3 Western blot检测细胞p-JNK、p-p38和Bcl-2的蛋白表达量收集猪小肠上皮细胞,加入混有蛋白酶抑制剂以及蛋白磷酸酶抑制剂的RIPA裂解液,漩涡振荡器混合均匀,置于冰上20 min使细胞充分裂解。之后14 000 r/min离心10 min,收集上清液。按照BCA蛋白浓度测定试剂盒说明书进行操作,并根据标准曲线算出蛋白浓度。将提取的蛋白质样品煮沸5 min,经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移到聚偏二氟乙烯(PVDF)膜。室温下用牛血清白蛋白(BSA)封闭膜4 h,加入一抗后4 ℃孵育过夜。将膜洗涤3次,并用二抗在室温下水平振荡孵育45 min,洗膜后在凝胶成像系统(Bio-Rad)中成像。
1.3.4 实时荧光定量PCR(qRT-PCR)检测细胞Bad、Bax、Bcl-2和caspase-3 mRNA相对表达量利用Trizol法提取RNA,用紫外分光光度计在260 nm测定OD值,进行RNA纯度检测。qRT-PCR反应体系为20 μL:cDNA 2 μL,上游引物1 μL,下游引物1 μL,PCR Master Mix(2×) 10 μL,dd H2O 6 μL。目的基因及内参基因β-actin引物序列见表 1,引物由生工生物工程股份有限公司根据GenBank设计合成。
|
|
表 1 基因引物参数 Table 1 Primer parameters of genes |
数据以“平均值±标准差”表示,采用SPSS 17.0软件中的ANOVA进行方差分析,LSD法进行显著性检验。P < 0.05为差异显著,P < 0.01为差异极显著。运用GraphPad Prism 7.0进行柱状图的绘制,Western blot结果采用Quantity One进行灰度值分析。
2 结果与分析 2.1 11S对猪小肠上皮细胞存活率的影响由图 1可知,猪小肠上皮细胞的存活率随着11S浓度的增加而降低,与A组相比,B组无显著差异(P>0.05),C、D组细胞存活率极显著降低(P < 0.01),D组存活率过低,C组适中,因此选用C组11S浓度为基础添加抑制剂。与C组相比,E组细胞存活率显著增加(P < 0.05),F组极显著增加(P < 0.01)。
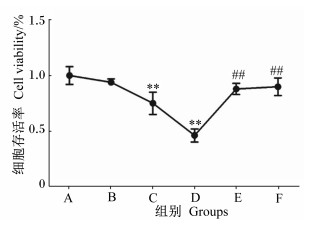
|
*表示与A组相比差异显著(P < 0.05);* *表示与A组相比差异极显著(P < 0.01)。#表示与C组相比差异显著(P < 0.05),##表示与C组相比差异极显著(P < 0.01)。下图和下表同。 * shows significant difference compared with group A (P < 0.05); * * shows extremely significant difference compared with group A (P < 0.01); # shows significant difference compared with group C (P < 0.05); ## shows extremely significant difference compared with group C (P < 0.01). The same as below. 图 1 11S对猪小肠上皮细胞存活率的影响 Fig. 1 Effects of 11S on activity of IPEC-J2 |
由表 2可知,与A组相比,B组NO含量无显著差异(P>0.05),C、D组极显著增加(P < 0.01);与C组相比,E、F组显著降低(P < 0.05)。与A组相比,B组5-HT含量无显著差异(P>0.05),C、D组极显著增加(P < 0.01);与C组相比,E组5-HT含量显著降低(P < 0.05),F组极显著降低(P < 0.05)。与A组相比,B组IL-6含量无显著差异(P>0.05),C、D组极显著增加(P < 0.01);与C组相比,E、F组IL-6含量显著降低(P < 0.05)。与A组相比,B组IL-10含量无显著差异(P>0.05),C、D组极显著增加(P < 0.01);与C组相比,E、F组IL-10含量显著降低(P < 0.05)。
|
|
表 2 11S对仔猪肠上皮细胞NO、5-HT、IL-6和IL-10含量的影响 Table 2 Effects of 11S on NO, 5-HT, IL-6 and IL-10 contents in IPEC-J2 |
由图 2-A可见,与A组相比,B组p-JNK蛋白表达量差异不显著(P>0.05),C、D组显著增加(P < 0.05);与C组相比,E组p-JNK蛋白表达量极显著降低(P < 0.01),F组显著降低(P < 0.05)。由图 2-B可见,与A组相比,B、C和D组p-p38蛋白表达量极显著增加(P < 0.01);与C组相比,E、F组p-p38蛋白表达量极显著降低(P < 0.01)。由图 2-C可见,与A组相比,B组Bcl-2蛋白表达量差异不显著(P>0.05),C、D组极显著降低(P < 0.01);与C组相比,E组Bcl-2蛋白表达量显著增加(P < 0.05),F组极显著增加(P < 0.01)。
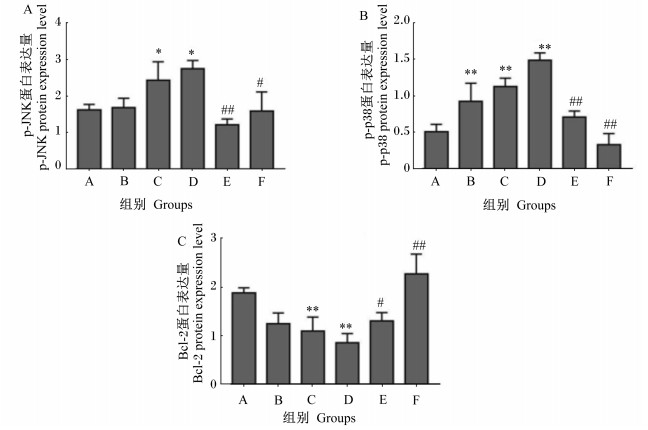
|
图 2 11S对仔猪肠上皮细胞p-JNK、p-p38和Bcl-2蛋白表达量的影响 Fig. 2 Effects of 11S on expression levels of p-JNK, p-p38 and Bcl-2 proteins in IPEC-J2 |
由表 3可知,与A组相比,B、C和D组Bcl-2/Bax极显著降低(P < 0.01);与C组相比,E、F组Bcl-2/Bax极显著增加(P < 0.01)。与A组相比,B组Bax/Bcl-xL无显著差异(P>0.05),C、D组极显著增加(P < 0.01);与C组相比,E、F组Bax/Bcl-xL极显著降低(P < 0.01)。与A组相比,B组Bad mRNA相对表达量无显著差异(P>0.05),C组显著增加(P < 0.05),D组极显著增加(P < 0.01);与C组相比,E组Bad mRNA相对表达量差异不显著(P>0.05),F组极显著增加(P < 0.01)。与A组相比,B组caspase-3 mRNA相对表达量无显著差异(P>0.05),C、D组极显著增加(P < 0.01);与C组相比,E、F组caspase-3 mRNA相对表达量极显著降低(P < 0.01)。
|
|
表 3 11S对仔猪肠上皮细胞Bcl-2/Bax、Bax/Bcl-xL及Bad、caspase-3 mRNA相对表达量的影响 Table 3 Effects of 11S on relative expression levels of Bcl-2/Bax, Bax/Bcl-xL, Bad and caspase-3 mRNA in IPEC-J2 |
韩蕊等[14]将不同浓度的11S(0~5.0 mg/mL)与肠上皮细胞共同培养24 h后,检测发现,11S使仔猪小肠上皮细胞通透性增加并使闭合蛋白(occludin)mRNA表达量下降,证明11S影响细胞增殖且对肠上皮细胞造成直接损伤,并破坏肠上皮细胞的完整性。Sun等[15]发现11S可通过诱导超敏反应结合于动物肠道组织中,从而影响动物肠道健康。11S诱导的超敏反应主要是一个Th2型的免疫应答,由免疫球蛋白E(IgE)抗体介导,导致仔猪腹泻和生长性能降低。过敏性反应的严重程度取决于11S的剂量。本试验CCK-8结果显示,细胞存活率随11S浓度增高而降低,证明11S抑制上皮细胞增殖,造成猪小肠上皮细胞活性降低。添加5 mg/mL 11S和1 μmol/L JNK或p38抑制剂的细胞存活率高于仅添加5 mg/mL 11S的细胞。与A组相比,添加JNK或p38抑制剂组细胞存活率差异不显著。
本试验结果发现细胞IL-10含量随着11S浓度增高而降低,刘欣[16]通过灌胃小鼠11S和7S,发现小鼠小肠组织中IL-10 mRNA的表达量降低,IL-10参与的免疫抑制反应是由p38途径介导的,p38通路增加细胞内NO的产生[17],目前认为,NO诱导细胞凋亡的机制主要在于激活凋亡的死亡受体途径和线粒体凋亡途径[18],NO还能够影响炎症反应的进程,进而影响IL-6、组胺、5-HT、肿瘤坏死因子-α(TNF-α)等炎症因子的表达等[19],这与本试验采用ELISA法检测发现细胞NO、5-HT、IL-6含量随11S浓度增高而增加的结果一致,并且添加1 μmol/L JNK或p38抑制剂后细胞NO、5-HT、IL-6含量显著降低,说明11S通过p38 MAPK/JNK通路促进NO、5-HT、IL-6产生。陈海华等[20]通过添加抑制剂抑制p38 MAPK和JNK信号通道蛋白表达。Smith等[21]发现,大肠埃希氏杆菌毒素(Stx1)能够激活肠上皮细胞株HCT8内的JNK/应激活化蛋白激酶(SAPK)通路,p38抑制剂可以阻断p38和JNK的激活,阻止细胞死亡。
MAPK是细胞内丝氨酸-苏氨酸蛋白激酶超家族成员之一,是多种信号转导途径的中心节点[22]。正常情况下,MAPK通路由3个信号级联通路组成:JNK、p38和细胞外信号调节激酶(ERK)[23]。本试验Western blot结果显示,p-p38、p-JNK蛋白表达量随11S浓度增高而增高,Bcl-2蛋白表达量降低,且添加5 mg/mL 11S和1 μmol/L JNK或p38抑制剂的细胞p-p38和p-JNK蛋白表达量显著低于仅添加5 mg/mL 11S的细胞,Bcl-2蛋白表达量显著高于仅添加5 mg/mL 11S的细胞。这说明11S激活p38 MAPK/JNK信号通路。
Markou等[24]通过成人心机细胞模型验证JNK和p38信号通路通过调节Bcl-2家族诱导线粒体介导的细胞凋亡,结果发现抑制p38 MAPK导致Bcl-2磷酸化水平降低。Bcl-2和Bax表达的高低与凋亡调控直接相关,Bcl-2/Bax决定细胞在受刺激后是启动抑制凋亡机制还是促凋亡机制[25]。本试验结果表明,Bcl-2/Bax随11S浓度增加而降低,说明11S刺激猪肠上皮细胞启动促凋亡机制。本试验中,随11S浓度升高,Bax/Bcl-xL增加,caspase-3 mRNA相对表达量增加,已知Bax/Bcl-xL增加使Bax可以通过内在的细胞凋亡途径发出凋亡信号,触发线粒体孔隙向细胞质释放促凋亡因子Bax,导致caspase-3激活[25]。这表明11S激活细胞凋亡的线粒体和死亡受体凋亡途径,与仅添加5 mg/mL 11S的细胞相比,添加5 mg/mL 11S和1 μmol/L p38或JNK抑制剂的细胞caspase-3、Bad mRNA相对表达量显著降低,Bcl-2/Bax增加,Bax/Bcl-xL降低。这说明11S通过p38 MAPK/JNK信号通路导致猪小肠细胞损伤,p38和JNK抑制剂可以抑制11S诱导的猪小肠上皮细胞凋亡。
4 结论① 11S促进猪小肠上皮细胞分泌NO、5-HT、IL-6、IL-10,降低Bcl-2蛋白表达,提高Bad和caspase-3 mRNA相对表达量,提高Bax/Bcl-xL,降低Bax/Bcl-xL。
② 11S通过p38 MAPK/JNK信号通路引起猪肠上皮细胞损伤,p38或JNK抑制剂可以抑制11S诱导的猪小肠上皮细胞损伤。
| [1] |
KRISHNAN H B, KIM W S, JANG S, et al. All three subunits of soybean β-conglycinin are potential food allergens[J]. Journal of Agricultural and Food Chemistry, 2009, 57(3): 938-943. DOI:10.1021/jf802451g |
| [2] |
王福慧, 李颖丽, 杨晓东, 等. 发酵豆粕对犊牛生长性能的影响[J]. 中国奶牛, 2013(2): 31-33. DOI:10.3969/j.issn.1004-4264.2013.02.007 |
| [3] |
邢秀苹, 杨欢欢, 韦庆勇, 等. 豆粕和膨化大豆粉对鲤鱼生长及其肌肉营养成分的影响[J]. 西北农林科技大学学报(自然科学版), 2015, 43(12): 13-17, 28. |
| [4] |
HOLZHAUSER T, WACKERMANN O, BALLMER-WEBER B K, et al.Soybean (Glycine max) allergy in Europe:Gly m 5 (β-conglycinin) and Gly m 6 (glycinin) are potential diagnostic markers for severe allergic reactions to soy[J].Journal of Allergy and Clinical Immunology, 2009, 123(2):452-458.e4.
|
| [5] |
游金明, 王自蕊, 瞿明仁, 等. 大豆抗原蛋白的生物学特性及其对仔猪的过敏反应[J]. 饲料工业, 2007, 28(21): 53-56. DOI:10.3969/j.issn.1001-991X.2007.21.020 |
| [6] |
LUO D H, ZHAO Q Z, ZHAO M M, et al. Effects of limited proteolysis and high-pressure homogenisation on structural and functional characteristics of glycinin[J]. Food Chemistry, 2010, 122(1): 25-30. DOI:10.1016/j.foodchem.2010.02.011 |
| [7] |
USUI M, TAMURA H, NAKAMURA K, et al. Enhanced bactericidal action and masking of allergen structure of soy protein by attachment of chitosan through Maillard-type protein-polysaccharide conjugation[J]. Die Nahrung, 2004, 48(1): 69-72. DOI:10.1002/(ISSN)1521-3803 |
| [8] |
张瑜, 王元红, 汤雪冰, 等. 大豆抗原蛋白对仔猪的免疫作用[J]. 浙江农业学报, 2018, 30(4): 560-567. DOI:10.3969/j.issn.1004-1524.2018.04.06 |
| [9] |
王红云, 李同洲, 赵杰. 膨化全脂大豆在断奶仔猪上的应用研究进展[J]. 饲料博览, 2002(6): 12-13. DOI:10.3969/j.issn.1001-0084.2002.06.005 |
| [10] |
刘辉, 姚咏明. 细胞内炎症信号通路交汇作用研究进展[J]. 感染.炎症.修复, 2003, 4(4): 241-245. |
| [11] |
REUSTLE A, TORZEWSKI M. Role of p38 MAPK in atherosclerosis and aortic valve sclerosis[J]. International Journal of Molecular Sciences, 2018, 19(12): 3761. DOI:10.3390/ijms19123761 |
| [12] |
乔维洲. 免疫性病变与肠道菌群相关性研究进展[J]. 国际检验医学杂志, 2013, 34(23): 3199-3201. |
| [13] |
YEE Y H, CHONG S J F, PERVAIZ S. The anti-oxidant and pro-oxidant dichotomy of Bcl-2[J]. Biological Chemistry, 2016, 397(7): 585-593. |
| [14] |
韩蕊, 赵元, 潘丽, 等. 大豆球蛋白对仔猪小肠上皮细胞Occludin mRNA表达的影响[J]. 畜牧兽医学报, 2013, 44(8): 1258-1262. |
| [15] |
SUN P, LI D F, LI Z J, et al. Effects of glycinin on IgE-mediated increase of mast cell numbers and histamine release in the small intestine[J]. Journal of Nutritional Biochemistry, 2008, 19(9): 627-633. DOI:10.1016/j.jnutbio.2007.08.007 |
| [16] |
刘欣.大豆球蛋白glycinin和β-conglycinin引发Bal b/c小鼠过敏反应及其机理的研究[D].博士学位论文.杭州: 浙江大学, 2008. http://cdmd.cnki.com.cn/Article/CDMD-10335-2010144055.htm
|
| [17] |
张频捷, 朱立新, 耿小平. p38 MAPK信号传导通路及其抑制剂的研究现状[J]. 安徽医药, 2010, 14(5): 596-598. DOI:10.3969/j.issn.1009-6469.2010.05.050 |
| [18] |
ALMEIDA A, BOLAÑOS J P. A transient inhibition of mitochondrial ATP synthesis by nitric oxide synthase activation triggered apoptosis in primary cortical neurons[J]. Journal of Neurochemistry, 2010, 77(2): 676-690. |
| [19] |
范精华, 刘康, 刘保林. NO在炎症及免疫应答中的调节作用[J]. 中外医疗, 2009, 28(25): 163, 166. |
| [20] |
陈海华, 陈海华, 周贤龙, 等. p38 MAPK和JNK信号通道在TGF-β1诱导的肺泡上皮细胞上皮-间质转化中的意义[J]. 国际呼吸杂志, 2014, 34(20): 1544-1550. DOI:10.3760/cma.j.issn.1673-436X.2014.20.006 |
| [21] |
SMITH W E, KANE A V, CAMPBELL S T, et al. Shiga toxin 1 triggers a ribotoxic stress response leading to p38 and JNK activation and induction of apoptosis in intestinal epithelial cells[J]. Infection and Immunity, 2003, 71(3): 1497-1504. DOI:10.1128/IAI.71.3.1497-1504.2003 |
| [22] |
JEONG J W, LEE H H, CHOI E O, et al. Schisandrae fructus inhibits IL-1β-induced matrix metalloproteinases and inflammatory mediators production in SW1353 human chondrocytes by suppressing NF-κB and MAPK activation[J]. Drug Development Research, 2015, 76(8): 474-483. DOI:10.1002/ddr.21283 |
| [23] |
KESHET Y, SEGER R. The MAP kinase signaling cascades:a system of hundreds of components regulates a diverse array of physiological functions[J]. Methods in Molecular Biology, 2010, 661: 3-38. DOI:10.1007/978-1-60761-795-2 |
| [24] |
MARKOU T, DOWLING A A, KELLY T, et al. Regulation of Bcl-2 phosphorylation in response to oxidative stress in cardiac myocytes[J]. Free Radical Research, 2009, 43(9): 809-816. DOI:10.1080/10715760903071649 |
| [25] |
ADAMS J M, CORY S. Bcl-2-regulated apoptosis:mechanism and therapeutic potential[J]. Current Opinion in Immunology, 2007, 19(5): 488-496. DOI:10.1016/j.coi.2007.05.004 |




