2. 动物病毒病防控与药残分析河南省重点学科开放实验室, 新乡 453003;
3. 畜禽智能化清洁生产河南省工程实验室, 新乡 453003;
4. 新乡学院, 新乡 453003
2. Animal Viral Disease Control and Residual Analysis Henan Higher Education Key Discipline Open Laboratory, Xinxiang 453003, China;
3. Intelligent Cleaner Production of Livestock and Poultry of Henan Provincial Engineering Laboratory, Xinxiang 453003, China;
4. Xinxiang University, Xinxiang 453003, China
抗生素在饲粮中的广泛使用,造成细菌耐药性、食品安全、公共卫生和环境污染等问题,农业部农办医[2018]13号明确指出2020年药物饲料添加剂全部退出,饲粮中禁止添加抗生素。因此,研发安全、无残留、能有效替代抗生素的新型饲料添加剂已成为发展趋势[1-3]。由于益生菌发酵饲粮通过1种或多种益生菌的发酵,饲粮中富含更多的活性益生菌菌体、有益代谢产物,同时可消除饲粮中的抗营养因子,能够促生长和维持动物健康,而益生菌是替代抗生素潜力最大的一种添加剂[4-5]。在动物机体中,小肠是营养物质消化吸收的主要场所,小肠黏膜状态与营养物质的吸收密切相关,肠道杯状细胞是一种分泌细胞,其分泌的黏蛋白(MUC)和三叶肽因子等形成肠道黏液层,对维持肠道黏膜稳态起着重要的作用[6-7]。本试验通过观察不同日龄猪的肠道黏膜形态,测量小肠黏膜的绒毛高度、隐窝深度和绒毛高度/隐窝深度(V/C)及肠绒毛上皮间杯状细胞的数量[8],来探讨无抗发酵饲粮对猪肠道黏膜的影响,为其代替市场上含有抗生素的饲粮提供理论依据。
1 材料与方法 1.1 试验动物及设计选取120头体重相近的“长×大”初生健康乳猪,随机分为试验组和对照组,每组6个重复,每个重复10头猪,试验分为3个阶段即哺乳阶段(0~28日龄)、断奶阶段(29~44日龄)、保育阶段(45~75日龄),试验周期共75 d。各组试验仔猪以窝为单位,7~28日龄饲喂哺乳仔猪饲粮,29日龄转群至保育舍,饲喂断奶仔猪饲粮至试验结束。对照组和试验组同舍饲养,各重复室内均匀分布,条件尽可能一致,自由采食,自主饮水。
1.2 试验饲粮无抗发酵饲粮的生产方式为:将玉米与豆粕按各50%的比例进行称量、粉碎和混合,作为发酵底物;发酵菌种由鼠李糖乳杆菌、植物乳杆菌、枯草芽孢杆菌、地衣芽孢杆菌、酵母菌组成,料水比为1.00 : 0.45;35 ℃厌氧发酵60 h,委托新乡市酵守康饲料有限公司生产。
试验组饲粮加入以10%发酵饲粮来替代部分不含抗生素基础饲粮,对照组饲喂含抗生素的基础饲粮(50 mg/kg金霉素和100 mg/kg吉他霉素),并调整试验组各阶段的饲粮营养水平与对照组相同。玉米-豆粕型混合饲粮发酵前后营养水平见表 1。哺乳仔猪和断奶仔猪基础饲粮组成及营养水平分别见表 2、表 3[9]。
|
|
表 1 玉米-豆粕型混合饲粮发酵前后营养水平(干物质基础) Table 1 Nutrient levels of mixed corn and soybean diets before and after fermentation (DM basis) |
|
|
表 2 哺乳仔猪基础饲粮组成及营养水平(风干基础) Table 2 Composition and nutrient levels of the basal diet for lactation piglets (air-dry basis) |
|
|
表 3 断奶仔猪基础饲粮组成及营养水平(风干基础) Table 3 Composition and nutrient levels of the basal diet for weaning piglets (air-dry basis) |
在仔猪出生后的第5、15、25、44和75天分别于2组的每个重复中随机抽取1头猪称重后宰杀,取十二指肠、空肠和回肠各段约2 cm,于4%多聚甲醛液中固定。
1.4 组织切片制作样品在4%多聚甲醛溶液中固定48 h后,将组织修整成7 mm小块;自来水冲洗固定12 h;常规梯度酒精脱水、透明、石蜡包埋后切片,进行苏木精-伊红(HE)染色和高碘酸雪夫氏(PAS)染色。
1.5 肠黏膜检测指标在各阶段的十二指肠、空肠和回肠每个样本中选取5张切片,低倍镜下每张切片选出5个不同视野观察肠黏膜形态,测量绒毛高度、隐窝深度、V/C和杯状细胞数量。观察过程中应注意所选取的肠绒毛长度应该基本一致,应用Nikon50i显微镜照相处理软件进行拍照。
1.6 统计分析试验数据用平均值±标准差表示,采用SPSS 19.0软件进行t检验分析,以P<0.05表示差异显著,以P<0.01表示差异极显著。
2 结果与分析 2.1 无抗发酵饲粮对猪小肠黏膜形态的影响试验组和对照组小肠黏膜形态变化上有一定的差异。由图 1可见,2组十二指肠不同的变化表现为:试验组肠绒毛较长,呈明显的叶状结构,绒毛的游离端明显膨大。绒毛体至腺体部散在少量杯状细胞,肠腺中的杯状细胞增多。肠绒毛的固有层中有较多散在的淋巴细胞。而对照组肠绒毛较短,呈指状,绒毛的游离缘有较多的杯状细胞分散在柱状细胞之间。2组猪空肠不同的变化表现为:试验组肠绒毛较粗,固有层发达,其中弥散大量淋巴细胞,肠腺部的固有层也有大量淋巴细胞,形成淋巴组织样结构。对照组肠绒毛较细,固有层不发达,肠腺部固有层内淋巴细胞较少,呈散在状,没有形成淋巴组织样结构。2组回肠不同的变化表现为:试验组回肠绒毛较稀疏,绒毛的固有层较发达,其中分布大量淋巴细胞。肠腺基部的固有层中有大量淋巴细胞集聚,并突破黏膜肌层,在固有层和黏膜下层形成集合淋巴小结样构造。对照组回肠绒毛细长,数量较多,排列较密。在黏膜下层中见有淋巴小结形成,呈现孤立淋巴小结样构造。
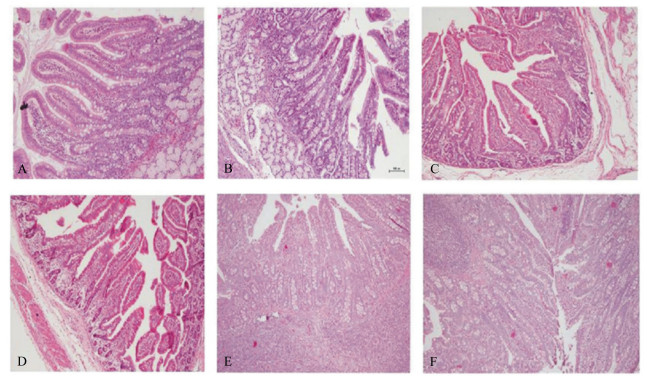
|
A:试验组25日龄十二指肠;B:对照组25日龄十二指肠;C:试验组15日龄空肠;D:对照组15日龄空肠;E:试验组44日龄回肠;F:对照组44日龄回肠。 A: duodenum at 25 days of age in test group; B: duodenum at 25 days of age in control group; C: jejunum at 15 days of age in test group; D: jejunum at 15 days of age in control group; E: ileum at 44 days of age in test group; F: ileum at 44 days of age in control group. 图 1 小肠黏膜形态的观察 Fig. 1 Morphological observation of the small intestinal (100×) |
如表 4所示,自25日龄开始,试验组十二指肠绒毛高度整体都略高于对照组,但没有达到差异显著的水平(P>0.05)。在44日龄时,试验组空肠绒毛高度比对照组提高7.19%(P < 0.05),其他日龄组间差异不显著(P>0.05)。在44和75日龄时,试验组回肠绒毛高度显著高于对照组(P < 0.05),其他日龄组间差异不显著(P>0.05)。
|
|
表 4 无抗发酵饲粮对猪小肠绒毛高度的影响 Table 4 Effects of fermentation diet without antibiotic on villus height in small intestine of piglets |
如表 5所示,对照组十二指肠、空肠、回肠隐窝深度均较高于试验组,但差异不显著(P>0.05)。在75日龄时,试验组十二指肠和回肠隐窝深度比对照组分别降低6.40%和5.98%,但差异不显著(P>0.05)。
|
|
表 5 无抗发酵饲粮对猪小肠隐窝深度的影响 Table 5 Effects of fermentation diet without antibiotic on crypt depth in small intestine of piglets |
如表 6所示,试验组十二指肠、空肠和回肠V/C(除15日龄十二指肠外)均高于对照组,但差异不显著(P>0.05)。其中在44日龄时,试验组回肠V/C比对照组提高17.18%,差异极显著(P < 0.01)。
|
|
表 6 无抗发酵饲粮对猪小肠V/C的影响 Table 6 Effects of fermentation diet without antibiotic on V/C in small intestine of piglets |
小肠黏膜上皮的杯状细胞分散在柱状细胞之间,但也有连续排列的杯状细胞,一般靠近肠腺部位较为集中,胞核位于基底部,呈高脚杯状,被PAS染色法染成深红色(图 2)。在25日龄时,试验组和对照组十二指肠绒毛体的中、下两侧部至肠腺部见有较多的杯状细胞,绒毛顶端的杯状细胞较少,杯状细胞分泌的黏液被染成深红色覆盖在肠上皮表面,以对照组较明显(图 2-A、图 2-B)。在75日龄时,试验组空肠肠绒毛变短,但较粗,排列较密集。杯状细胞多分散于肠绒毛体两侧的吸收细胞间,绒毛顶端少有杯状细胞(图 2-C)。对照组空肠绒毛较粗大,呈叶状。在绒毛两侧的吸收细胞之间杯状细胞数量增多,有的呈连续排列,肠腺部杯状细胞较为集中(图 2-D)。在75日龄时,回肠绒毛变短,较粗,绒毛的固有层中有大量淋巴细胞,绒毛顶端有肠上皮脱落现象(图 2-E、图 2-F)。试验组肠绒毛呈锥状,绒毛的两侧到肠腺部见有大量杯状细胞,肠腺腺腔的上皮细胞也被PAS染成深红色(图 2-E)。对照组回肠绒毛呈短柱状,较稀疏,绒毛的中、下部和肠腺部有较多的杯状细胞,至绒毛顶端脱落(图 2-F)。
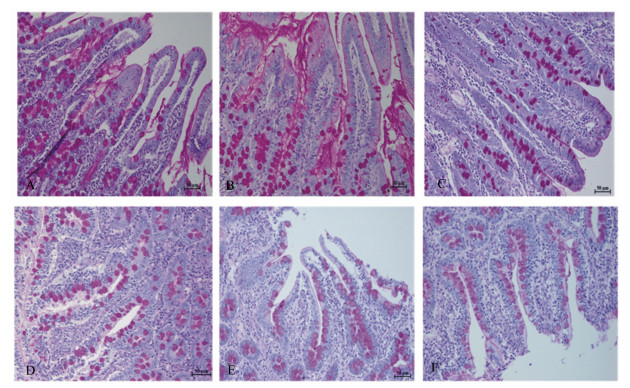
|
A:试验组25日龄十二指肠;B:对照组25日龄十二指肠;C:试验组75日龄空肠;D:对照组75日龄空肠;E:试验组75日龄回肠;F:对照组75日龄回肠。 A: duodenum at 25 days of age in test group; B: duodenum at 25 days of age in control group; C: jejunum at 75 days of age in test group; D: jejunum at 75 days of age in control group; E: ileum at 75 days of age in test group; F: ileum at 75 days of age in control group. 图 2 小肠上皮间杯状细胞形态的观察 Fig. 2 Morphological observation of goblet cells in intestinal mucosa epithelium (200×) |
如表 7所示,在44日龄时,对照组十二指肠、空肠和回肠黏膜上皮间杯状细胞数量极显著高于试验组(P < 0.01)。在75日龄时,对照组十二指肠黏膜上皮间杯状细胞数量极显著高于试验组(P < 0.01)。其他日龄组间差异不显著(P>0.05)。
|
|
表 7 无抗发酵饲粮对猪小肠黏膜上皮间杯状细胞数量的影响 Table 7 Effects of fermentation diet without antibiotic on goblet cells counts in intestinal mucosa epithelium of piglets |
小肠是猪对营养物质消化和吸收的主要场所,其功能的发挥与其生理结构是密切相关的,肠道屏障功能可以维持微生态的平衡,所以肠道黏膜与动物的健康至关重要[10],特别是小肠绒毛高度、隐窝深度、V/C及有效的吸收面积都是衡量其消化和吸收功能高低的重要指标[11],肠道形态学结构的改变是造成消化吸收功能和免疫功能差异的主要原因之一[12-13]。肠绒毛和微绒毛的存在极大地增加了小肠与食物的接触表面积,肠绒毛变短时,肠上皮细胞数量随之减少,其营养物质吸收能力降低[14]。绒毛根部下陷至固有层形成的管形缩陷为小肠腺即隐窝,当肠道绒毛脱落,隐窝多能干细胞会分化成新的肠上皮细胞向绒毛顶端移行,形成新的绒毛。隐窝深度反映细胞的生成率,隐窝变浅表明细胞成熟率上升,分泌功能增强[15-16]。V/C下降表明小肠的消化吸收功能下降,比值升高表明消化吸收率增强。庞敏等[17]研究表明,断奶应激对仔猪的肠道黏膜形态有很大的影响,而饲喂益生菌发酵饲粮可以显著提高断奶仔猪的肠道上皮绒毛高度,且显著提高V/C。断奶应激会造成仔猪的绒毛萎缩,隐窝细胞分裂过快,造成隐窝深度增加及V/C下降,严重影响小肠对营养物质的消化吸收。益生菌发酵饲粮可以提高饲粮中有机酸含量,降低pH,进而使断奶仔猪胃液pH与消化道酸度发育水平趋于稳定,减少仔猪腹泻和增强仔猪对营养物质的消化吸收能力[2, 18]。益生菌发酵为减少断奶仔猪应激提供了一种营养策略[18]。邓军[16]研究表明,同时饲喂枯草芽孢杆菌和猪源乳酸杆菌可以提高十二指肠和空肠的绒毛高度和降低空肠和回肠的隐窝深度,V/C升高。Feng等[19]研究发现,饲喂发酵豆粕配合饲料可以显著提高断奶仔猪小肠绒毛高度,提高V/C。
本试验结果显示,在44日龄时,试验组空肠和回肠绒毛高度显著高于对照组;在75日龄时,试验组回肠绒毛高度显著高于对照组;在44日龄时,试验组回肠V/C显著高于对照组。根据本试验结果得出:试验组绒毛高度、隐窝深度和V/C略优于对照组。其原因可能是饲粮经过益生菌发酵后,其营养成分更有益于动物机体的吸收,几种益生菌复合发酵后随着饲粮一同进入消化道,黏附于肠道黏膜上皮细胞,并在动物胃肠道中迅速萌发和增殖,调节胃肠道微生物生态平衡,且发酵产物中的有机酸、氨基酸和小肽等代谢产物能刺激肠绒毛的生长发育和肠上皮细胞的更新[1],增加绒毛高度,提高V/C,进而促进小肠对饲粮中营养物质的消化吸收。此外,益生菌还能调节肠道黏液的分泌,上调肠道上皮细胞紧密连接蛋白和细胞骨架蛋白的表达[20-22],增强肠上皮细胞间的紧密连接,维持肠道黏膜屏障的完整性。
小肠杯状细胞起初分化于小肠腺,之后向绒毛顶端或肠上皮不断迁移分化,最后脱落至肠腔死亡,为杯状细胞的一个分泌周期[23]。杯状细胞是一种典型的黏液细胞,其成分主要是黏蛋白,黏蛋白颗粒分泌到胞外与水、无机盐等合成黏液附着在肠黏膜表面形成肠道黏液层,有润滑保护作用[24],并参与多种肠道疾病的发生发展。但肠绒毛杯状细胞数量增多,分泌过量的黏液覆盖在肠黏膜表面,会使消化酶的分泌减少,肠黏膜的吸收面积减少,再加之大量黏液被覆在肠上皮细胞的表面,在肠上皮细胞与肠内容物之间形成了一道屏障,减少了肠上皮细胞与营养物质接触的机会[25],故在很大程度上降低了肠道的吸收面积,导致营养物质的吸收障碍,严重时可引起腹泻。张献彩[26]发现发生糖尿病小鼠的小肠绒毛易被破坏, 糖尿病组中杯状细胞的分泌物比同月份正常对照组显著增加。本试验结果显示,在44日龄时,对照组十二指肠、空肠和回肠杯状细胞数量极显著高于试验组;在75日龄时,对照组十二指肠杯状细胞数量极显著高于试验组。分析原因可能是饲喂抗生素饲粮的对照组猪在断奶后,由于受到断奶应激的影响,肠道黏膜受损,破坏小肠绒毛, 引起炎症反应, 使缓激肽和组织胺释放增多,这些刺激可直接引起杯状细胞分泌增多[24],而无抗发酵饲粮中的益生菌能与黏蛋白一起作为肠道黏膜屏障,阻碍致病菌进入体内,并能调节杯状细胞的产生和肠液中黏蛋白的含量,使肠道中杯状细胞的数量趋于稳定,维持肠道结构的完整。此外,发酵产物中的一些小分子有益代谢产物能自由通过黏液层,更有利于机体的吸收。
4 结论综上所述,饲喂无抗发酵饲粮在哺乳、断奶和保育阶段对猪机体无不良影响,并可在一定程度上改善肠道黏膜形态,提示无抗发酵饲粮可以替代含抗生素的饲粮应用于猪生产中。
| [1] |
张俊, 朱建津, 刘江英, 等. 益生菌发酵产物对肉鸡肠道形态和肠道屏障功能的影响[J]. 浙江农业学报, 2016, 28(10): 1657-1662. DOI:10.3969/j.issn.1004-1524.2016.10.05 |
| [2] |
崔艳红, 韩庆功, 崔艺佳, 等. 益生菌复合发酵料对断奶仔猪消化环境、血清生化指标和代谢激素水平的影响[J]. 西北农业学报, 2018, 27(1): 16-23. |
| [3] |
袁文华, 赵文文, 袁慧坤, 等. 无抗发酵饲料在动物生产上的应用研究进展[J]. 黑龙江畜牧兽医, 2018(9): 59-62. |
| [4] |
张秀林, 魏小兵, 欧长波, 等. 益生菌发酵饲料对仔猪生长和免疫功能影响的研究进展[J]. 中国畜牧兽医, 2017, 44(2): 476-481. |
| [5] |
康丽慧, 黄亚明, 刘兴友, 等. 无抗生素发酵饲料对仔猪生长性能和粪便微生物的影响[J]. 黑龙江畜牧兽医, 2017(3): 177-179. |
| [6] |
GIPSON I K. Goblet cells of the conjunctiva:a review of recent findings[J]. Progress in Retinal and Eye Research, 2016, 54: 49-63. DOI:10.1016/j.preteyeres.2016.04.005 |
| [7] |
MCCAULEY H A, GUASCH G. Three cheers for the goblet cell:maintaining homeostasis in mucosal epithelia[J]. Trends in Molecular Medicine, 2015, 21(8): 492-503. DOI:10.1016/j.molmed.2015.06.003 |
| [8] |
贺琴, 王自蕊, 游金明, 等. 酵母壁多糖对断奶仔猪生长性能和小肠黏膜形态结构的影响[J]. 动物营养学报, 2016, 28(11): 3536-3541. DOI:10.3969/j.issn.1006-267x.2016.11.021 |
| [9] |
康丽慧.饲喂无抗生素发酵饲料猪消化指标及增重的测定[D].硕士学位论文.新乡: 河南科技学院, 2016: 13-16.
|
| [10] |
LIAO S F, NYACHOTI M. Using probiotics to improve swine gut health and nutrient utilization[J]. Animal Nutrition, 2017, 3(4): 331-343. DOI:10.1016/j.aninu.2017.06.007 |
| [11] |
廖珂.不同处理豆粕及嗜酸乳杆菌对断奶仔猪生长性能、肠黏膜屏障功能的影响[D].硕士学位论文.南昌: 江西农业大学, 2016: 5-8. http://cdmd.cnki.com.cn/Article/CDMD-10410-1016280677.htm
|
| [12] |
李涛, 曾东, 倪学勤, 等. 乳酸杆菌发酵饲料对猪生长性能和肉质及血清抗氧化性能的影响[J]. 湖南农业大学学报(自然科学版), 2014, 40(2): 192-195. |
| [13] |
WANG Y, LU W Q, LI D F, et al. Energy and ileal digestible amino acid concentrations for growing pigs and performance of weanling pigs fed fermented or conventional soybean meal[J]. Asian-Australasian Journal of Animal Sciences, 2014, 27(5): 706-716. DOI:10.5713/ajas.2013.13612 |
| [14] |
王继凤.丁酸钠对断奶仔猪肠黏膜结构及黏膜免疫相关细胞影响的研究[D].硕士学位论文.北京: 中国农业大学, 2005: 8-9. http://cdmd.cnki.com.cn/Article/CDMD-10019-2005084675.htm
|
| [15] |
WOYENGO T A, KIARIE E, NYACHOTI C M. Metabolizable energy and standardized ileal digestible amino acid contents of expeller-extracted canola meal fed to broiler chicks[J]. Poultry Science, 2010, 89(6): 1182-1189. DOI:10.3382/ps.2009-00595 |
| [16] |
邓军.枯草芽孢杆菌和猪源乳酸杆菌混合饲喂对新生仔猪先天免疫系统的影响[D].硕士学位论文.南京: 南京农业大学, 2012: 4-8. http://cdmd.cnki.com.cn/Article/CDMD-10307-1013283036.htm
|
| [17] |
庞敏, 卢庆萍, 夏冰, 等. 酪酸梭菌对断奶仔猪生长性能、肠道组织形态及肠道通透性的影响[J]. 动物营养学报, 2016, 28(7): 2113-2121. DOI:10.3969/j.issn.1006-267x.2016.07.016 |
| [18] |
BARBA-VIDAL E, MARTÍN-ORUE S M, CASTILLEJOS L. Review:are we using probiotics correctly in post-weaning piglets?[J]. Animal, 2018, 1-10. DOI:10.1017/S1751731118000873 |
| [19] |
FENG J, LIU X, XU Z R, et al. Effect of fermented soybean meal on intestinal morphology and digestive enzyme activities in weaned piglets[J]. Digestive Diseases and Sciences, 2007, 52(8): 1845-1850. DOI:10.1007/s10620-006-9705-0 |
| [20] |
PATEL R M, MYERS L S, KURUNDKAR A R, et al. Probiotic bacteria induce maturation of intestinal claudin 3 expression and barrier function[J]. The American Journal of Pathology, 2012, 180(2): 626-635. DOI:10.1016/j.ajpath.2011.10.025 |
| [21] |
RESTA-LENERT S, BARRETT K E. Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive Escherichia coli (EIEC)[J]. Gut, 2003, 52(7): 988-997. DOI:10.1136/gut.52.7.988 |
| [22] |
ANDERSON R C, COOKSON A L, MCNABB W C, et al. Lactobacillus plantarum MB452 enhances the function of the intestinal barrier by increasing the expression levels of genes involved in tight junction formation[J]. BioMed Central Microbiology, 2010, 10: 316. |
| [23] |
董文逍, 曹海龙, 王邦茂. 杯状细胞在肠道疾病发病中作用的研究进展[J]. 国际消化病杂志, 2015, 35(4): 244-246, 269. DOI:10.3969/j.issn.1673-534X.2015.04.005 |
| [24] |
隋欣.益生菌对雏鸡肠道杯状细胞数量及黏蛋白2含量的影响[D].硕士学位论文.哈尔滨: 东北农业大学, 2014: 4-5. http://cdmd.cnki.com.cn/Article/CDMD-10224-1014341362.htm
|
| [25] |
朱广蕊.鸭源性传染性支气管炎病毒ZZ2004株人工感染肉仔鸡肠道的病理学研究[D].硕士学位论文.新乡: 河南科技学院, 2012: 27.
|
| [26] |
张献彩. 糖尿病小鼠小肠绒毛杯状细胞分泌黏原颗粒的变化[J]. 山西医科大学学报, 2014, 45(12): 1127-1128. |




