2. 中国农业科学院北京畜牧兽医研究所, 北京 100193
2. Institute of Animal Science, Chinese Academy of Agricultural Sciences, Beijing 100193, China
随着抗生素逐渐退出畜牧业,天然植物添加剂成为了众多学者的研究方向。竹叶提取物的主要活性成分是竹叶黄酮,竹叶黄酮是以C6—C3—C6为基本碳架的系列化合物,由于其获取资源丰富、天然无公害,且有良好的抗氧化、抗炎、抗菌、保护心血管等生理作用,正成为动物营养研究的新热点。动物体内外试验均证明,黄酮类物质具有提高动物免疫机能及促进动物繁殖、生长等功能[1]。研究显示,植物类黄酮化合物对原虫具有一定的抑制作用[2],能降低白色瘤胃球菌和黄化瘤胃球菌的数量,增加产琥珀酸丝状杆菌的数量[3]。黄酮类物质能够调节瘤胃中的细菌菌群,影响瘤胃的发酵。竹叶提取物能够合理有效地提高奶牛的产奶性能,并能适当提高原料奶品质,改善奶牛泌乳后期的生理机能[4]。竹叶提取物可以显著影响肉鸡盲肠菌群结构,从而促进肉鸡肠道营养物质的消化吸收,提高饲料转化率[5]。还有研究显示,竹叶提取物可以明显减少仔猪的腹泻率[6]。然而,目前竹叶提取物在奶牛瘤胃发酵方面的研究较少。因此,本试验旨在通过瘤胃体外发酵试验,探究竹叶提取物对奶牛瘤胃发酵参数及产气量的影响,为竹叶提取物作为饲料添加剂应用于动物生产提供理论依据。
1 材料与方法 1.1 试验材料竹叶提取物购自陕西森弗天然制品有限公司,实验室检测利用硝酸铝-亚硝酸钠比色法[7],以芦丁为标准品绘制标准曲线,测得其中竹叶黄酮纯度为40%。竹叶提取物中还含有粗灰分(20%)、粗蛋白质(13%)、水溶性多糖(15.5%)等。
发酵底物:由玉米青贮、进口苜蓿、压片玉米等组成,将饲料原料65 ℃烘干48 h,充分研磨过1 mm筛,按照底物配比,称取各原料,混匀待用。发酵底物中干物质含量采用烘箱干燥法测定,粗蛋白质含量参照GB/T 6433—2006进行测定,酸性洗涤纤维和中性洗涤纤维含量参照GB/T 6434—2006进行测定,钙含量参照GB/T 6436—2018进行测定,磷含量参照GB/T 6437—2018进行测定。发酵底物组成及营养水平见表 1。
|
|
表 1 发酵底物组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the fermentation substrate (DM basis) |
人工唾液盐:各组分参照Menke等[9]方法进行配制,组成成分见表 2。并按顺序依次加入1 000 L蒸馏水、0.25 mL微量元素溶液、500 mL碳酸盐缓冲液、500 mL磷酸盐缓冲液、2.5 mL刃天青指示剂、100 mL还原液。充分混匀后通入CO2直至溶液由粉红色变为无色透明,调整pH至6.80为止,使用前39 ℃预热。
|
|
表 2 人工唾液盐组成成分 Table 2 Composition components of artificial saliva |
瘤胃液采集:在北京某牛场选取5头体况良好、体重相近的荷斯坦奶牛作为瘤胃液供体,于晨饲前2 h通过口腔进行瘤胃液采集,每头采集0.5 L瘤胃液,装入保温瓶中,均匀混匀,迅速返回实验室,4层纱布进行过滤。
体外发酵液配制:将人工唾液盐与瘤胃液以2 : 1的比例进行充分混合,持续通入CO2,整个过程在39 ℃水浴锅中进行。
1.2 试验设计将发酵底物准确称取500 mg置于150 mL发酵瓶中,各组竹叶提取物添加量分别为0(对照)、0.75、1.50、3.00、4.50、6.00 mg/g,每组6个重复,每个重复3个批次。迅速向发酵瓶中加入75 mL体外发酵液,通入CO2立即盖上瓶塞通过传感器与气体收集袋连接,采用AGRS-Ⅲ型64通路微生物发酵微量产气全自动记录装置进行39 ℃恒温培养,并记录24 h产气量。
1.3 发酵液样本采集及测定发酵24 h后将发酵瓶置于冰水浴中,停止发酵,用便携式pH计立即测定pH。将发酵液过4层纱布,分装于离心管中用挥发性脂肪酸和氨态氮(NH3-N)浓度的测定。
1.3.1 NH3-N浓度测定发酵液置于2 mL离心管中,12 000×g离心20 min,取上清液40 μL加入苯酚显色试剂2.5 mL,摇匀后加入次氯酸盐试剂2.0 mL,摇匀,置于37 ℃水浴30 min,于550 nm波长处测定吸光值,计算NH3-N浓度。
1.3.2 挥发性脂肪酸浓度测定以2-乙基丁酸为内标采用气相色谱法测定,取2 mL瘤胃发酵液在5 000×g离心10 min,取上清液1 mL置于2 mL离心管中,加入0.2 mL 25%偏磷酸溶液,混匀置于4 ℃冰箱过夜。第2天取出后10 000×g离心10 min,取上清液置于测样瓶中,采用安捷伦7890B型号气相色谱仪测定发酵液中总挥发性脂肪酸(TVFA)和各种挥发性脂肪酸含量。测定条件:检测室温度220 ℃,柱温180 ℃,气化室200 ℃,高纯氮气作为载气,压力90 kPa,总流量为37.2 mL/min,空气流量400 mL/min,氢气流量40 mL/min,吹扫流量3 mL/min,分流比50 : 1,线速度为23.4 cm/s。
1.3.3 甲烷产量的测定将产生气体收集于气袋中,用气相色谱仪测定甲烷含量。检测器:TC检测器;色谱柱:DB-FFAP(15.00 m×0.32 mm×0.25 μm);进样口温度:120 ℃;检测器温度;250 ℃;柱温:60 ℃;载气:氮气(99.999%);恒压:21.8 kPa;柱流量:2 mL/min;进样量:1 mL。
1.3.4 干物质消失率的测定干物质消失率采用尼龙袋法测定,将尼龙袋中发酵液滤渣在65 ℃下烘干4 h后称重,按如下公式[10]计算待测饲料的干物质消失率:
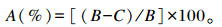
|
式中:A为待测饲料的干物质消失率(%);B为待测饲料降解前营养物质的含量(g);C为待测饲料降解后营养物质的含量(g)。
1.4 数据统计分析试验数据经Excel 2007进行初步整理后,采用SPSS 20.0进行单因素方差分析,以Duncan氏法进行多重比较,并以P<0.05为差异显著性判断标准。统计分析模型为:
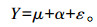
|
式中:Y表示因变量值;μ表示总体平均值;α表示不同浓度竹叶提取物处理效果;ε表示随机误差。
2 结果 2.1 竹叶提取物对发酵液pH、NH3-N浓度及干物质消失率的影响由表 3可知,体外培养24 h后,各组的发酵液pH均无显著差异(P>0.05)。试验组的发酵液中NH3-N浓度均显著低于对照组(P<0.05),其中3.00和4.50 mg/g竹叶提取物组的发酵液中NH3-N浓度显著低于其他各组(P<0.05);随着竹叶提取物添加量的增加,NH3-N浓度有线性降低趋势(P<0.05)。试验组的发酵液中干物质消失率均显著高于对照组(P<0.05);随着竹叶提取物添加量的增加,干物质消失率有线性升高趋势(P<0.05)。
|
|
表 3 竹叶提取物对发酵液pH、NH3-N浓度及干物质消失率的影响 Table 3 Effects of bamboo leaf extract on pH, NH3-N concentration and dry matter disappearance rate of fermentation fluid |
由表 4可知,4.50、6.00 mg/g竹叶提取物组的发酵液中总挥发性脂肪酸浓度显著高于其他各组(P<0.05)。3.00、4.50、6.00 mg/g竹叶提取物组的发酵液中乙酸浓度显著高于其他各组(P<0.05);随着竹叶提取物添加量的增加,乙酸浓度呈线性增加趋势(P<0.05)。4.50、6.00 mg/g竹叶提取物组的发酵液中丙酸浓度显著高于对照组(P<0.05);随着竹叶提取物添加量的增加,丙酸浓度呈线性增加趋势(P<0.05)。3.00、4.50、6.00 mg/g竹叶提取物组的发酵液中丁酸浓度显著低于其他各组(P<0.05);随着竹叶提取物添加量增加,丁酸浓度呈线性下降趋势(P<0.05)。6.00 mg/g竹叶提取物组的发酵液中异戊酸浓度显著低于对照组(P<0.05)。各组发酵液中异丁酸、戊酸浓度以及乙酸/丙酸均无显著差异(P>0.05)。
|
|
表 4 竹叶提取物对发酵液中挥发性脂肪酸浓度的影响 Table 4 Effects of bamboo leaf extract on volatile fatty acid concentrations of fermentation fluid |
由表 5可知,试验组的体外发酵甲烷体积和甲烷含量均显著低于对照组(P<0.05)。体外发酵总产气量虽随着竹叶提取物添加量的增加而呈线性下降趋势(P<0.05),但各组间无显著差异(P>0.05)。
|
|
表 5 竹叶提取物对体外发酵产气量和甲烷含量的影响 Table 5 Effects of bamboo leaf extract on gas production and methane content in vitro fermentation |
本试验中,试验组pH与对照组相比无显著差异,且均在适宜范围内,不会引起瘤胃酸中毒。NH3-N浓度取决于饲粮中蛋白质的降解和微生物对氨的利用率,反映了瘤胃内蛋白质降解与合成之间所达到的平衡状况。瘤胃内大部分的微生物均可以利用代谢产物合成微生物蛋白质,但是原虫只能通过吞噬细菌来合成蛋白质,微生物蛋白质的浓度在反映微生物利用NH3-N能力的同时也间接反映了发酵体系中微生物种群的数量[11]。有研究发现,富含黄酮化合物的印度苦楝树种子提取物和意大利蓟叶子提取物能够降低瘤胃原虫的数量[2]。Oskoueian等[12]研究报道,柚皮苷和槲皮素能够抑制原虫数量。本试验中,试验组的发酵液中NH3-N浓度均显著低于对照组,干物质消失率均显著高于对照,这说明竹叶提取物减少了参与细菌蛋白质周转的原生动物,促进了微生物的活性。Ozdal等[13]研究发现,黄酮-蛋白质复合物的形成也可能会降低瘤胃微生物的氮利用率。植物类黄酮化合物的结构相似,主要成分都为黄酮。其他学者的动物体内试验证明,奶牛饲喂染料木黄酮4 h后,显著降低了瘤胃NH3-N浓度,沙葱黄酮类化合物能够降低绵羊瘤胃NH3-N浓度[14]。本试验结果与上述研究结果一致,但竹叶提取物具体如何作用于瘤胃微生物菌群还需要进一步研究。
3.2 竹叶提取物对发酵液挥发性脂肪酸浓度的影响瘤胃内挥发性脂肪酸是反刍动物能量利用的中间代谢产物,是瘤胃微生物主要的碳源,其浓度是反映瘤胃消化代谢的重要指标。反刍动物瘤胃发酵产生的挥发性脂肪酸大约占机体代谢碳流量的2/3,是反刍动物赖以生存和保持正常生长、泌乳繁殖的主要能量来源,可提供反刍动物总能量需要的70%~80%[15]。瘤胃中丁酸产生菌大量增殖依赖于乳酸菌的营养保障[16]。瘤胃内丙酸生成,可以竞争性消耗氢气,从而有效地抑制甲烷形成[17],丙酸还是葡萄糖合成的主要前体物质,乙酸和葡萄糖对于奶牛脂肪的合成具有相互依赖性,乙酸是反刍动物脂肪合成的主要前体物质,是乳腺合成乳脂中脂肪酸的重要原料,乙酸转化为乳脂的效率为67%~71%[18]。与对照组相比,3.00、4.50、6.00 mg/g竹叶提取物组的发酵液中丁酸浓度显著降低,可能是竹叶提取物本身的抑菌性抑制了乳酸菌的生长;4.50、6.00 mg/g竹叶提取物组的发酵液中丙酸、乙酸浓度显著升高,但是乙酸/丙酸差异不显著,且比值均在2.5以上,说明没有影响奶牛瘤胃发酵类型的条件下能够竞争性消耗氢气,降低甲烷生成,乙酸浓度升高还有利于乳脂率的提高。挥发性脂肪酸能够提供奶牛能量需求的70%~80%,因此添加竹叶提取物有利于为动物生产提供更多能量。许多研究表明,植物类黄酮化合物能够增加乙酸和丙酸浓度,降低丁酸浓度[19],增加挥发性脂肪酸浓度[20],与本试验结果一致。
3.3 竹叶提取物对体外发酵产气量和甲烷含量的影响甲烷是一种导致温室效应的气体,它是由动物肠道厌氧菌发酵产生的。反刍动物产生甲烷需要消耗2%~5%的总能[21]。瘤胃中甲烷产生大部分是甲烷菌的直接作用,原虫代谢过程中也会产生大量甲烷,原虫为甲烷菌提供生长物质,二者存在共生关系。研究表明,植物类黄酮化合物能够降低产甲烷菌数量[22],抑制体外培养瘤胃产甲烷短杆菌数量[23],降低瘤胃原虫数量[2, 13]。瘤胃中丙酸浓度与甲烷产生呈高度的负相关[24]。本试验中,与对照组相比,试验组体外发酵甲烷含量显著降低,同时甲烷体积也显著降低,与郭旭东[24]研究结果一致。推断竹叶提取物可能通过其本身的抑菌性抑制了产甲烷菌和瘤胃原虫的生长,改变了细菌和古菌群落的结构,进而影响甲烷的生成。
4 结论① 不同添加量的竹叶提取物可以显著降低发酵液中NH3-N浓度,对pH无影响,且提高了发酵液中乙酸、丙酸和总挥发性脂肪酸含量,降低了丁酸含量,并且乙酸、丙酸和丁酸含量与竹叶提取物添加量存在线性关系。
② 不同添加量的竹叶提取物显著降低了体外发酵甲烷含量。综合考虑,添加4.50 mg/g竹叶提取物效果最佳。
| [1] |
毛红霞, 许梓荣, 占秀安. 黄酮类化合物在动物营养中的研究及应用[J]. 饲料研究, 2000(11): 15-16. DOI:10.3969/j.issn.1002-2813.2000.11.006 |
| [2] |
PATRA A K, KAMRA D N, AGARWAL N. Effect of plant extracts on in vitro methanogenesis, enzyme activities and fermentation of feed in rumen liquor of buffalo[J]. Animal Feed Science and Technology, 2006, 128(3/4): 276-291. |
| [3] |
KIM E T, GUAN L L, LEE S J, et al. Effects of flavonoid-rich plant extracts on in vitro ruminal methanogenesis, microbial populations and fermentation characteristics[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(4): 530-537. DOI:10.5713/ajas.14.0692 |
| [4] |
贾若愚.竹提取物对泌乳后期奶牛生产性能和血液生化指标的影响[D].硕士学位论文.合肥: 安徽农业大学, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10364-1013163591.htm
|
| [5] |
舒刚.竹叶黄酮对肉鸡的生物效应及作用机理研究[D].博士学位论文.雅安: 四川农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10626-1016050665.htm
|
| [6] |
张金枝, 邵庆均, 吴晓琴, 等. 竹叶黄酮对断奶仔猪生产性能的影响[J]. 中国畜牧杂志, 2003, 39(1): 25-26. DOI:10.3969/j.issn.0258-7033.2003.01.013 |
| [7] |
贾可敬.竹叶黄酮提取、纯化及抗氧化活性研究[D].硕士学位论文.长沙: 中南林业科技大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10538-1014203730.htm
|
| [8] |
冯仰廉, 周建民, 张晓明, 等.我国奶牛饲料产奶净能值测算方法的研究[C]//第三届全国反刍动物营养学术研讨会论文集.北京: 中国畜牧兽医学会, 2011: 113-118.
|
| [9] |
MENKE K H, RAAB L, SALEWSKI A, et al. The estimation of the digestibility and metabolizable energy content of ruminant feedingstuffs from the gas production when they are incubated with rumen liquor in vitro[J]. The Journal of Agricultural Science, 1979, 93(1): 217-222. DOI:10.1017/S0021859600086305 |
| [10] |
CHURCH D C. Livestock feeds and feeding[M]. Englewood Cliffs: Prentice-Hall, 1986: 113.
|
| [11] |
韦学玉, 阎宏. 反刍动物瘤胃功能调控技术的研究进展[J]. 养殖与饲料, 2006(7): 34-37. DOI:10.3969/j.issn.1671-427X.2006.07.009 |
| [12] |
OSKOUEIAN E, ABDULLAH N, OSKOUEIAN A. Effects of flavonoids on rumen fermentation activity, methane production, and microbial population[J]. BioMed Research International, 2013, 2013: 349129. |
| [13] |
OZDAL T, CAPANOGLU E, ALTAY F. A review on protein-phenolic interactions and associated changes[J]. Food Research International, 2013, 51(2): 954-970. DOI:10.1016/j.foodres.2013.02.009 |
| [14] |
包玲玲, 敖长金, 萨茹丽, 等. 沙葱黄酮类化合物对绵羊瘤胃内环境(体外)的影响[J]. 饲料工业, 2015, 36(14): 6-10. |
| [15] |
MCELWEE K J, NⅡYAMA S, FREYSCHMIDT-PAUL P, et al. Dietary soy oil content and soy-derived phytoestrogen genistein increase resistance to alopecia areata onset in C3H/HeJ mice[J]. Experimental Dermatology, 2003, 12(1): 30-36. |
| [16] |
杜瑞平.绵羊瘤胃乙酸和丁酸的产生、吸收和利用规律及可代谢生脂物质(MLS)的测定[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10129-2006101214.htm
|
| [17] |
WHITELAW F G, EADIE J M, BRUCE L A, et al. Methane formation in faunated and ciliate-free cattle and its relationship with rumen volatile fatty acid proportions[J]. British Journal of Nutrition, 1984, 52(2): 261-275. DOI:10.1079/BJN19840094 |
| [18] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004: 335-336.
|
| [19] |
BROUDISCOU L P, PAPON Y, BROUDISCOU A F. Effects of dry plant extracts on fermentation and methanogenesis in continuous culture of rumen microbes[J]. Animal Feed Science and Technology, 2000, 87(3/4): 236-277. |
| [20] |
刘艳丰, 王晶, 王文奇, 等. 沙棘叶黄酮对绵羊瘤胃代谢和血清指标的影响[J]. 中国畜牧杂志, 2016, 52(7): 66-70. DOI:10.3969/j.issn.0258-7033.2016.07.014 |
| [21] |
ZHAO X W, WANG J Q, YANG Y X, et al. Effects of different fat mixtures on milk fatty acid composition and oxidative stability of milk fat[J]. Animal Feed Science and Technology, 2013, 185(1/2): 35-42. |
| [22] |
陈丹丹.四种植物提取物对肉羊甲烷排放、物质代谢及瘤胃微生物区系的影响[D].硕士学位论文.乌鲁木齐: 新疆农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10758-1015548182.htm
|
| [23] |
PATRA A K, SAXENA J. A new perspective on the use of plant secondary metabolites to inhibit methanogenesis in the rumen[J]. Phytochemistry, 2010, 71(11/12): 1198-1222. |
| [24] |
郭旭东.芦丁对奶牛泌乳性能、瘤胃消化代谢和对大鼠乳腺发育的影响[D].博士学位论文.北京: 中国农业科学院, 2011. http://cdmd.cnki.com.cn/Article/CDMD-82101-1011159202.htm
|




