2. 河北省牛羊胚胎工程技术研究中心, 保定 071000
2. Research Center of Cattle and Sheep Embryo Engineering Technique of Hebei, Baoding 071000, China
啤酒酵母营养丰富,且含有酵母多糖,酵母多糖能改善机体的免疫功能和抗氧化性能。相关研究表明,酵母多糖可以增强肉鸡[1]和肉牛[2]的免疫功能,激活免疫细胞,促进免疫因子的释放,启动免疫相关级联反应。谢明欣等[3]在蒙古绵羊的饲粮中添加酵母多糖发现对其抗氧化能力有提升作用。Rakowska等[4]报道,酵母多糖具有抗菌特性,并且能够通过激活巨噬细胞和细胞因子如白细胞介素(IL)-1、IL-6和IL-8等的分泌来增强机体免疫力。Underhill[5]报道,酵母多糖能刺激肿瘤坏死因子-α(TNF-α)的释放,并具有抗氧化特性。我国啤酒酵母产量较大,每年在15万t左右,但多数未得到充分、有效的应用,特别是在獭兔生产中的应用研究较少。因此,本试验通过在饲粮中添加不同水平的啤酒酵母,研究其对生长獭兔免疫和抗氧化性能的影响,为其在兔生产中的准确应用提供参考。
1 材料与方法 1.1 试验材料和基础饲粮啤酒酵母由河北康源润生生物有限公司提供,过200目筛, 生产批号为(2016)02911, 红褐色粉末状,蛋白质含量为45%,多糖含量大于25%。
基础饲粮参照谷子林[6]推荐的獭兔营养需要进行配制,其组成及营养水平见表 1,试验饲粮均制成直径为4 mm、长10 mm的颗粒饲料。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
选取30日龄健康状况良好、体重相近的白色獭兔120只(公母各1/2),按性别和体重随机分为4组,每组30个重复,每个重复1只。对照组饲喂基础饲粮,试验Ⅰ、Ⅱ、Ⅲ组分别饲喂在基础饲粮中以5、10、15 kg/t的啤酒酵母等量替代豆粕的试验饲粮。
试验前对使用的兔舍和笼具进行清理和消毒,试验兔采用单笼饲养,常规饲养管理,自然通风和光照,自由饮水和采食。正试期每天于08:00和18:00饲喂2次,预试期7 d,正试期60 d。
1.3 测定指标和方法 1.3.1 死亡率统计试验期间试验兔的死亡情况,计算获得死亡率,公式如下:

|
分别在试验期的第20天、第40天、第60天进行屠宰试验。每次每组选取公母各1/2、体重相近的6只试验兔进行屠宰。宰前称量宰前活重,宰后分别称量胴体重以及脾脏和胸腺器官重。
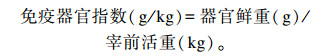
|
分别于试验期的第20天、第40天、第60天,屠宰试验兔,每组6只,公母各1/2,分别取脾脏和胸腺,放入Bouin氏液中固定,石蜡切片,苏木精-伊红(HE)染色,显微镜下观察,使用Image J软件分析细胞密度。
1.3.4 血清生化指标分别在试验期的第20天、第40天、第60天进行心脏采血,每组6只,公母各1/2,每只采集5 mL,将血液注入离心管内倾斜静置,待血凝后3 000 r/min离心10 min,分离血清,于-80 ℃条件下冷冻保存待测。采用酶联免疫吸附试验(ELISA)试剂盒法测定血清样品中的免疫球蛋白M(IgM)、免疫球蛋白A(IgA)、免疫球蛋白G(IgG)、丙二醛(MDA)含量和谷胱甘肽过氧化物酶(GSH-Px)、超氧化物歧化酶(SOD)活性及总抗氧化能力(T-AOC)。
1.4 数据统计分析采用SPSS 17.0和Excel 2007软件对数据进行处理和分析,用one-way ANOVA程序检验各组数据间差异是否显著,用LSD法进行多重比较,P < 0.05表示差异显著,P < 0.01表示差异极显著。
2 结果 2.1 啤酒酵母对生长獭兔死亡率的影响由表 2可知,各试验组獭兔死亡率均低于对照组,但无显著差异(P>0.05)。
|
|
表 2 啤酒酵母对生长獭兔死亡率的影响 Table 2 Effects of beer yeast on mortality rate of growing Rex rabbits |
由表 3可知,第20天、第40天和第60天时,各试验组脾脏指数均高于对照组,但均无显著差异(P>0.05)。第20天时,各试验组胸腺指数均显著高于对照组(P<0.05),以试验Ⅲ组最高,比对照组高48.9%;第40天时,试验Ⅱ组胸腺指数显著高于对照组(P<0.05),比对照组高16.23%;第60天时,各组间胸腺指数无显著差异(P>0.05)。
|
|
表 3 啤酒酵母对生长獭兔免疫器官指数的影响 Table 3 Effects of beer yeast on immune organ indexes of growing Rex rabbits |
由表 4可知,除试验Ⅰ组第20天时的脾脏细胞密度低于对照组外,其余各试验组第20天、第40天和第60天时的脾脏和胸腺细胞密度均高于对照组,但均无显著差异(P>0.05)。
|
|
表 4 啤酒酵母对生长獭兔免疫器官细胞密度的影响 Table 4 Effects of beer yeast on immune organ cell density of growing Rex rabbits |
由表 5可知,除试验Ⅲ组第20天时血清IgA含量低于对照组外,各试验组第20天、第40天和第60天时血清IgA含量均高于对照组,但均无显著差异(P>0.05)。各试验组第20天、第40天和第60天时血清IgG含量均高于对照组, 其中第20天和第60天时,试验Ⅱ组血清IgG含量显著高于对照组(P<0.05),分别比对照组提高了25.37%和30.74%。各试验组第20天、第40天和第60天时血清IgM含量均高于对照组, 其中第20天,试验Ⅲ组血清IgM含量显著高于对照组(P < 0.05),比对照组提高了21.80%。
|
|
表 5 啤酒酵母对生长獭兔血清抗体指标的影响 Table 5 Effects of beer yeast on serum antibody indexes of growing Rex rabbit |
由表 6可知,除试验Ⅲ组第60天时血清GSH-Px活性低于对照组外,其余各试验组第20天、第40天和第60天时血清GSH-Px活性均高于对照组, 其中第20天时,试验Ⅱ组血清GSH-Px活性显著高于对照组(P<0.05),比对照组提高了54.52%。各组间第20天、第40天和第60天时血清MDA含量均无显著差异(P>0.05)。各试验组第20天、第40天和第60天时血清SOD活性均高于对照组,但均无显著差异(P>0.05)。第60天时,试验Ⅱ组清T-AOC显著高于对照组(P<0.05),比对照组高了10.80%。
|
|
表 6 啤酒酵母对生长獭兔血清抗氧化指标的影响 Table 6 Effects of beer yeast on serum antioxidant indexes of growing Rex rabbit |
本试验中,试验组獭兔死亡率均低于对照组,这与郝生宏等[7]在肉鸡的试验中得到的结果相近。其原因可能是生长獭兔抗病能力相对较弱,且易受到外界环境应激的影响,产生应激反应,导致机体的免疫功能及肠道内环境受到影响,易发生肠道内环境紊乱,菌群失调,导致消化不良、腹泻甚至死亡的发生。而啤酒酵母细胞壁中富含葡聚糖和甘露聚糖,其中β-葡聚糖是首个被发现的具有免疫活性的葡聚糖,其可以通过与免疫细胞受体结合,启动免疫应答反应,提高机体的免疫功能[8]。此外,酵母多糖还能改善肠道内环境,促进有益菌增殖,抑制有害菌定植,减少内环境紊乱及菌群失调的发生,从而降低獭兔的死亡率[9-10]。
3.2 啤酒酵母对生长獭兔免疫器官指数和细胞密度的影响胸腺是中枢免疫器官,主要参与细胞免疫;脾是獭兔最大的外周免疫(淋巴)器官,是獭兔体液免疫和细胞免疫的中心;两者的发育情况可在一定程度上反映机体免疫功能的强弱。本试验中,各试验组的胸腺指数和脾脏指数均比对照组高,且各试验组的胸腺细胞密度和脾脏细胞密度也均比对照组高,说明添加啤酒酵母对獭兔的免疫功能有一定的改善作用。其原因可能是啤酒酵母中含有酵母多糖以及啤酒酵母在加工、存储过程中,蛋白质降解会产生功能性小肽,对胸腺和脾脏的发育均有一定的促进作用,但具体的作用机制有待进一步的研究[11]。这与Halas等[12]在猪上、宋新磊等[13]在肉鸡上添加酵母多糖,以及贺英等[14]和吴耀忠等[15]在鸡上添加啤酒酵母得到的结果相近。3次屠宰结果显示,啤酒酵母对獭兔胸腺和脾脏发育均有促进作用,但促进作用逐渐减弱,这可能与獭兔免疫器官的发育规律有关,如李清宏[16]报道的美系獭兔脾脏的快速生长期为40~70日龄。
3.3 啤酒酵母对生长獭兔血清抗体指标的影响免疫球蛋白是一类在抗原物质刺激下机体所产生的具有抗体活性的球蛋白,其在机体防御系统中发挥着重要的作用,是反映机体体液免疫功能的一项重要指标。本试验中,3次血清抗体指标检测结果显示,各试验组獭兔在第20天时已表现出免疫球蛋白含量较对照组有升高或显著升高的趋势,并且在试验第40天和第60天时仍有升高的趋势,说明添加啤酒酵母后,对生长獭兔的免疫机能有一定的改善作用。其原因可能是酵母多糖占酵母细胞干质量的20%,主要由葡聚糖和甘露聚糖组成,其中甘露寡糖可以与真核生物、细菌、病毒等外源性抗原结合,作为助剂,减缓抗原的吸收,增加抗原的效价,提高机体的体液免疫水平[17]。β-葡聚糖能与C型凝集素受体(Dectin-1)结合,激活天然和适应性免疫应答[18]。葡聚糖还可以与机体的免疫细胞发生特异性的结合,刺激免疫细胞增殖,促进免疫球蛋白分泌,增强机体免疫力[19]。这与李永娟[20]在黄颡鱼、贺琴等[21]在仔猪上添加酵母多糖得到的研究结果相近。
3.4 啤酒酵母对生长獭兔血清抗氧化指标的影响当机体不能及时清除体内大量产生的自由基,氧化和还原系统失衡时,机体发生氧化应激反应,导致细胞膜功能状态异常、蛋白质和核酸损伤、机体免疫力下降等一些列氧化损伤。啤酒酵母中含有多种生物活性物质,能通过降低血清MDA含量,提高血清GSH-Px、SOD等抗氧化酶的活性,来提高机体抑制自由基产生或清除自由基的能力,来发挥抗氧化作用[22]。本试验中,血清抗氧化指标分析结果显示,各试验组獭兔在试验第20天时已表现出SOD、GSH-Px活性和T-AOC等与机体抗氧化性能有直接关系的指标较对照组有升高或显著升高的趋势,并且在试验第40天和第60天时仍有这种升高趋势,且对血清MDA含量有降低的作用,说明啤酒酵母对生长獭兔的抗氧化能力有积极作用。这与黄婧溪等[23]在黄羽肉鸡的饲粮中添加0.1%的酵母多糖、张学峰等[24]在绵羊十二指肠中灌注酵母培养物得到的结果相近。其原因可能是β-葡聚糖对过氧亚硝酸盐或过氧化氢诱导的脂质过氧化有较强的抵抗能力[25]。同时,多糖分子能够结合磷酸根与金属离子螯合,抑制自由基的产生。
4 结论啤酒酵母可以通过促进胸腺和脾脏的发育以及提高血清免疫球蛋白含量来提高生长獭兔的免疫力,还可以通过提高血清T-AOC和GSH-Px活性来改善生长獭兔的抗氧化能力。
| [1] |
MUTHUSAMY N, HALDAR S, GHOSH T K, et al. Effects of hydrolysed Saccharomyces cerevisiae yeast and yeast cell wall components on live performance, intestinal histo-morphology and humoral immune response of broilers[J]. British Poultry Science, 2011, 52(6): 694-703. DOI:10.1080/00071668.2011.633072 |
| [2] |
MERRILL M L, BOHNERT D W, HARMON D L, et al. The ability of a yeast-derived cell wall preparation to minimize the toxic effects of high-ergot alkaloid tall fescue straw in beef cattle[J]. Journal of Animal Science, 2007, 85(10): 2596-2605. DOI:10.2527/jas.2007-0075 |
| [3] |
谢明欣, 王海荣, 杨金丽, 等. 酵母甘露寡糖对蒙古绵羊生长性能、血清免疫和炎症及抗氧化指标的影响[J]. 动物营养学报, 2018, 30(1): 219-226. DOI:10.3969/j.issn.1006-267x.2018.01.027 |
| [4] |
RAKOWSKA R, SADOWSKA A, DYBKOWSKA E, et al. Spent yeast as natural source of functional food additives[J]. Roczniki Panstwowego Zakladu Higieny, 2017, 68(2): 115-121. |
| [5] |
UNDERHILL D M. Macrophage recognition of zymosan particles[J]. Journal of Endotoxin Research, 2003, 9(3): 176-180. DOI:10.1177/09680519030090030601 |
| [6] |
谷子林. 家兔饲料的配制与配方[M]. 北京: 中国农业出版社, 2002.
|
| [7] |
郝生宏, 佟建明, 萨仁娜, 等. 四株耐制粒益生菌对0~3周龄肉仔鸡死亡率、腹泻率及盲肠菌群的影响[J]. 中国饲料, 2008(3): 30-32. DOI:10.3969/j.issn.1004-3314.2008.03.008 |
| [8] |
BROWN G D. Dectin-1:a signalling non-TLR pattern-recognition receptor[J]. Nature Reviews Immunology, 2006, 6(1): 33-43. DOI:10.1038/nri1745 |
| [9] |
SPRING P, WENK C, CONNOLLY A, et al. A review of 733 published trials on Bio-Mos, a mannan oligosaccharide, and Actigen, a second generation mannose rich fraction, on farm and companion animals[J]. Journal Applied Animal Nutrition, 2015, 3: e7. DOI:10.1017/jan.2015.5 |
| [10] |
RAMIREZ-HERNANDEZ A, RUPNOW J, HUTKINS R W. Adherence reduction of Campylobacter jejuni and Campylobacter coli strains to HEp-2 cells by mannan oligosaccharides and a high-molecular-weight component of cranberry extract[J]. Journal of Food Protection, 2015, 78(8): 1496-1505. DOI:10.4315/0362-028X.JFP-15-087 |
| [11] |
张连忠. 酵母固态发酵过程中营养物质变化的研究[J]. 饲料工业, 2011, 32(2): 44-46. DOI:10.3969/j.issn.1001-991X.2011.02.010 |
| [12] |
HALAS V, NOCHTA I. Mannan oligosaccharides in nursery pig nutrition and their potential mode of action[J]. Animals, 2012, 2(2): 261-274. DOI:10.3390/ani2020261 |
| [13] |
宋新磊, 朱连勤, 林刚, 等. 甘露寡糖和有机硒联合应用对肉鸡生产性能与免疫性能的影响[J]. 中国家禽, 2018(8): 24-27. |
| [14] |
贺英, 曹旺斌, 王晓娟, 等. 啤酒酵母对雏鸡生产性能和免疫器官的影响[J]. 中国饲料, 2002(20): 12, 31. |
| [15] |
吴耀忠, 陈溥言, 韩惠雯, 等. 啤酒酵母和枸杞对肉鸡免疫功能的影响[J]. 上海畜牧兽医通讯, 2008(5): 34-35. DOI:10.3969/j.issn.1000-7725.2008.05.016 |
| [16] |
李清宏.美系獭兔生长发育规律的研究[D].博士学位论文.晋中: 山西农业大学, 2013: 61. http://cdmd.cnki.com.cn/Article/CDMD-10113-1014416381.htm
|
| [17] |
SHARON N. Lectin-carbohydrate complexes of plants and animals:an atomic view[J]. Trends in Biochemical Sciences, 1993, 18(6): 221-226. DOI:10.1016/0968-0004(93)90193-Q |
| [18] |
STIER H, EBBESKOTTE V, GRUENWALD J. Immune-modulatory effects of dietary Yeast Beta-1, 3/1, 6-D-glucan[J]. Nutrition Journal, 2014, 13: 38. DOI:10.1186/1475-2891-13-38 |
| [19] |
HOFER M, POSPÍŠIL M. Glucan as stimulator of hematopoiesis in normal and gamma-irradiated mice.A survey of the authors' results[J]. International Journal of Immunopharmacology, 1997, 19(9/10): 607-609. |
| [20] |
李永娟.β-葡聚糖对黄颡鱼生长性能和免疫功能的影响[D].硕士学位论文.武汉: 华中农业大学, 2016: 23-25. http://cdmd.cnki.com.cn/Article/CDMD-10504-1016155419.htm
|
| [21] |
贺琴, 王自蕊, 游金明, 等. 酵母壁多糖对断奶仔猪外周血免疫和肠道免疫的影响[J]. 动物营养学报, 2017, 29(7): 2502-2511. DOI:10.3969/j.issn.1006-267x.2017.07.035 |
| [22] |
崔艺燕, 马现永. 酵母多糖的生物学功能及其对仔猪肠道健康的影响[J]. 动物营养学报, 2018, 30(3): 857-864. DOI:10.3969/j.issn.1006-267x.2018.03.007 |
| [23] |
黄婧溪, 夏超笃, 罗龙军, 等. 酵母细胞壁多糖对黄羽肉鸡生长性能、免疫及抗氧化能力的影响[J]. 饲料工业, 2018(1): 27-31. |
| [24] |
张学峰, 王兰惠, 周雪飞, 等. 十二指肠灌注酵母培养物对绵羊血液生化指标、免疫及抗氧化功能的影响[J]. 中国兽医学报, 2016, 36(6): 1044-1048. |
| [25] |
SALUK-JUSZCZAK J, KROLEWSKA K, WACHOWICZ B. β-glucan from Saccharomyces cerevisiae as a blood platelet antioxidant[J]. Platelets, 2010, 21(6): 451-459. DOI:10.3109/09537101003780032 |




