鱼粉具有蛋白质含量高、氨基酸平衡且易于消化吸收等众多优点,一直是优质的动物蛋白质源。我国是饲料生产大国,蛋白质原料供应远远不足,每年需要进口大量的鱼粉和大豆。但是随着各国对海洋生态环境的重视以及渔获量的逐年降低,鱼粉的价格逐年上升,导致配合饲料价格也居高不下。因此,寻找鱼粉的优质替代物成为产业关注的热点。
发展酵母单细胞蛋白质饲料,既可以充分利用废弃的糟渣资源,改善现有蛋白质原料的营养品质,又可以替代鱼粉满足生产需求,被认为是解决饲料蛋白质源紧缺的重要途径之一。早在20世纪90年代,啤酒酵母粉(brewer’s yeast meal, BYM)就被认为是未来替代鱼粉的良好蛋白质源和生物活化物[1-2],而我国每年产生的废啤酒酵母达45 000 t以上[3],其主要成分是酿酒的酵母菌体及培养基残渣等副产品,粗蛋白质含量高,粗纤维含量低,并且含有较为丰富的必需氨基酸和B族维生素[4]。有研究表明,啤酒酵母细胞壁中的酵母多糖、葡聚糖在维持细胞正常的生理形态、抗氧化、抗肿瘤、抗菌、抗病毒、增强机体免疫力、调节肠道菌群平衡以及降低胆固醇含量等方面具有重要作用[5-10],但是蛋氨酸和赖氨酸是其第一、二限制性氨基酸,故而通常在饲料中补充一定比例的赖氨酸和蛋氨酸以平衡替代产生的影响。目前,已经证实啤酒酵母粉可部分替代大西洋鲑(Salmo salar)[11]、虹鳟(Oncorhynchus mykiss)[12]、欧洲鲈(Dicentrarchus labrax)[13]、胡子鲶(Clarias batrachus L.)[14]、锯腹脂鲤(Piaractus mesopotamicus)[15]、金鱼(Carassius auratus)[16]、尼罗罗非鱼(Oreochromis niloticus)[17]、欧洲鳇(Huso huso)[18]、泰国鲶鱼(Pangasianodon hypophthalmus×Pangasius bocourti)[19]等饲料中的部分鱼粉。其中,在饲料中添加135 g/kg啤酒酵母粉可显著提高泰国鲶鱼的生长性能和摄食率,而在欧洲鲈饲料中用啤酒酵母粉替代30%的鱼粉对其生长无显著影响,但显著提高了饲料利用率。
牛蛙[Rana (Lithobates) catesbeiana]隶属于脊椎动物门,两栖纲,无尾目,蛙科,原产于北美洲,20世纪50年代引入我国进行养殖[20],因其肉鲜味美、产量高、生长迅速,近年来牛蛙养殖产业在我国得到迅速发展。2016年我国蛙养殖总产量为9.104 6万t,养殖区域主要集中在江西省、湖南省、辽宁省、福建省和浙江省,而且产业规模相较于2015年增加4 454 t[21]。近年来,国内外学者针对牛蛙的植物蛋白质源、脂肪源替代物以及部分必需氨基酸的需求量开展了大量研究[20, 22-31],然而,关于牛蛙饲料中单细胞蛋白质源替代鱼粉的研究尚未见报道。鉴于此,本试验拟研究啤酒酵母粉部分替代鱼粉对牛蛙生长、抗氧化能力、血清生化指标、消化酶活性以及肝脏和肠道组织形态学的影响,旨在探讨啤酒酵母粉替代鱼粉的适宜比例,以期为牛蛙低鱼粉饲料的开发提供数据支撑。
1 材料与方法 1.1 试验饲料试验用饲料啤酒酵母粉由广东雅琪生物科技有限公司提供,其粗蛋白质、粗脂肪含量分别为67.43%、7.96%。本试验以含20%鱼粉的饲料为对照饲料,用啤酒酵母粉分别替代对照饲料中25%(Y25%)和50%的鱼粉(Y50%),配制3种等氮等脂的试验饲料。试验饲料组成及营养水平见表 1,试验饲料、鱼粉和啤酒酵母粉氨基酸组成见表 2。所有饲料原料均过60目筛,采用逐级扩大法将各原料按配比定量混合均匀后,加入40%左右的水搅拌后,通过水产饲料膨化机制成直径4.0 mm的颗粒饲料,然后在烘箱中45 ℃鼓风烘干8 h后,-20 ℃冰箱保存。
|
|
表 1 试验饲料组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of experimental diets (DM basis) |
|
|
表 2 试验饲料、鱼粉和啤酒酵母粉氨基酸组成 Table 2 Amino acid composition of experimental diets, fish meal and brewer's yeast meal |
试验用牛蛙购于厦门市同安区一养殖场,为同一批培育的牛蛙。在正式试验前,牛蛙于室内暂养,以对照饲料投喂,使之逐渐适应试验饲料及养殖环境。暂养15 d后,将牛蛙饥饿24 h,挑选个体大小均匀、体重为(34.15±1.00) g的健康牛蛙共135只,随机分配到9个水族桶,每桶15只,每种试验饲料投喂3个水族桶。试验水温为(27±2) ℃,水位为5~7 cm,水面放置消毒清洁泡沫浮板以适应牛蛙的两栖习性。每天饱食投喂2次(08:00和17:00),摄食30 min后,记录残饵数量,并换水,养殖周期为8周。
1.3 样品采集及指标测定方法养殖8周后,停饲24 h,对各组试验牛蛙逐一称重并计数。每桶随机取3只牛蛙,-20 ℃冰箱中保存,用于牛蛙体组成分析。每桶随机取6只牛蛙,双毁髓法处理,心脏动脉取血,静置12 h,2 500 r/min离心10 min,收集血清,-80 ℃保存,用于检测血清生化指标;取采血后的3只蛙,将肝脏和肠道取出放入波恩氏液,4 ℃保存,用于组织切片制作,每只牛蛙每个组织选取2张完整切片用于试验分析(n=18);采血后的另外3只牛蛙取肝脏和肠道,放入液氮,-80 ℃保存,用于肠道消化酶活性和肝脏抗氧化指标检测;然后将这6只牛蛙的后腿全部剪下称重,用于牛蛙后腿指数分析。每桶另取3只牛蛙,取肝脏(冰上操作)放入冻存管中,-80 ℃保存,用于总RNA的提取。试验进行6周后,收集牛蛙粪便20 g[23],-20 ℃保存,用于测定营养物质表观消化率。
试验饲料、粪便、蛙体中水分、粗蛋白质、粗脂肪和粗灰分含量的测定参照AOAC(1995)[32]的方法,其中粗蛋白质含量采用杜马斯燃烧定氮法(Rapid N Ⅲ氮/蛋白质分析仪)测定;粗脂肪含量采用索氏抽提法(乙醚为溶剂)测定;粗灰分含量经马弗炉550 ℃灼烧8 h后测定;水分采用105 ℃恒温干燥法测定。试验饲料、粪便中矿物元素磷(P)、钇(Y)含量的测定方法为加酸微波消解(JUPITER-B,多通量微波消解仪,上海新仪微波化学科技有限公司),稀释定容后,通过电感耦合等离子体原子发射光谱仪(ICP-OES,Prodigy7,LEEMAE LABS,美国)测定。
肝脏总抗氧化能力(T-AOC)以及总超氧化物歧化酶(T-SOD)、过氧化氢酶(CAT)活性与还原型谷胱甘肽(GSH)、丙二醛(MDA)含量,血清碱性磷酸酶(AKP)、溶菌酶(LZM)、谷草转氨酶(AST)、谷丙转氨酶(ALT)活性,肠道淀粉酶(amylase)(碘-淀粉比色法)、脂肪酶(lipase)(化学比浊法)活性以及各组织蛋白质含量(考马斯亮兰法)测定所用试剂盒均购自南京建成生物工程研究所。肠道蛋白酶(protease)活性测定采用福林-酚试剂法[33]。所有样品测定所用仪器为瑞士的TECAN infinite M200 pro NanoQuant多功能酶标仪。
使用TRIzol试剂(TaKaRa公司)提取-80 ℃冻存的肝脏组织总RNA,用Bio-Rad SmartSpec plus对所提取总RNA的OD260 nm和OD280 nm值进行检测并计算二者比值,以确定提取的总RNA的纯度,用1.5%的琼脂糖凝胶电泳鉴定其完整性。使用PrimeScript RT Reagent Kit With gDNA Eraser (Perfect Real Time)试剂盒(TaKaRa公司)将总RNA反转录为cDNA,-20 ℃保存备用。使用SYBR ® Premix Ex TaqTM (TliRNase HPlus)试剂盒(TaKaRa公司),通过QuantStudioTM 6 Flex荧光定量PCR仪进行实时荧光定量PCR。以β-肌动蛋白(β-actin)为内参基因,目的基因热休克蛋白70(HSP70)和胰岛素样生长因子-Ⅰ(IGF-Ⅰ)的表达结果采用相对表达量的形式,以2-ΔΔCt法[34]进行计算。引物使用Primer 5.0设计,如表 3所示。
|
|
表 3 实时荧光定量PCR引物序列 Table 3 Primer sequences used for RT-qPCR |

|
式中:W0为初始蛙总重量(g);Wt为终末蛙总重量(g);Wd为死亡蛙重量(g);WHL为后腿总重(g);W为终末单只蛙体重(g);Wf为摄入的饲料总量(干物质基础,g);Wp为摄入饲料蛋白质总量(g);t为饲喂天数(d);Ni为初始蛙数;Nf为终末蛙数;DY为饲料中钇的含量(%);FY为粪便中钇的含量(%);Di为饲料中某营养成分的含量(%);Fi为粪便中某营养成分的含量(%)。
1.5 数据统计与分析试验数据使用SPSS 22.0统计软件进行one-way ANOVA分析,用Tukey’s法进行多重比较,差异显著水平为P<0.05。试验数据均用平均值±标准误(mean±SE)表示。
2 结果与分析 2.1 啤酒酵母粉替代部分鱼粉对牛蛙生长性能的影响由表 4可知,与对照组相比,啤酒酵母粉替代25%或50%鱼粉对牛蛙的存活率、增重率、摄食率、特定生长率、饲料效率、蛋白质效率和后腿指数均未产生显著影响(P>0.05)。
|
|
表 4 啤酒酵母粉部分替代鱼粉对牛蛙生长性能的影响 Table 4 Effects of partially replacing fish meal with brewer's yeast meal on growth performance of bullfrog |
由表 5可知,啤酒酵母粉替代25%或50%的鱼粉对蛙体中粗蛋白质含量未产生显著影响(P>0.05)。对照组蛙体粗脂肪含量与2个替代组差异不显著(P>0.05),但Y25%组显著低于Y50%组(P < 0.05)。Y25%组蛙体水分含量显著高于对照组(P < 0.05),Y50%组与对照组无显著差异(P > 0.05)。Y25%、Y50%组蛙体粗灰分含量均显著低于对照组(P < 0.05)。
|
|
表 5 啤酒酵母粉替代部分鱼粉对牛蛙体组成的影响(湿重基础) Table 5 Effects of partially replacing fish meal with brewer's yeast meal on body composition of bullfrog (wet weight basis) |
由表 6可知,对照组牛蛙干物质和粗蛋白质的表观消化率与Y25%组没有显著差异(P>0.05),但二者均显著高于Y50%组(P < 0.05)。粗脂肪的表观消化率随着啤酒酵母粉替代水平的升高而显著降低(P < 0.05),而磷的表观消化率则随着啤酒酵母粉替代水平的升高而显著升高(P < 0.05)。
|
|
表 6 啤酒酵母粉替代部分鱼粉对牛蛙营养物质表观消化率的影响 Table 6 Effects of partially replacing fish meal with brewer's yeast meal on nutrient apparent digestibility coefficients of bullfrog |
由表 7可知,啤酒酵母粉替代25%或50%的鱼粉对牛蛙血清中AST、ALT的活性均无显著影响(P>0.05),而血清LZM的活性则随着啤酒酵母粉替代水平的升高而显著升高(P<0.05)。对照组血清中ALP的活性与Y25%组没有显著差异(P>0.05),但二者均显著低于Y50%组(P<0.05)。
|
|
表 7 啤酒酵母粉替代部分鱼粉对牛蛙血清生化指标的影响 Table 7 Effects of partially replacing fish meal with brewer's yeast meal on serum biochemical indexes of bullfrog |
由表 8可知,啤酒酵母粉替代25%或50%鱼粉对牛蛙肝脏中MDA含量无显著影响(P > 0.05)。Y25%和Y50%组肝脏中T-AOC显著高于对照组(P<0.05)。肝脏中T-SOD与CAT活性以及GSH含量均随啤酒酵母粉替代水平的升高而显著升高(P<0.05)。
|
|
表 8 啤酒酵母粉替代部分鱼粉对牛蛙肝脏抗氧化指标的影响 Table 8 Effects of partially replacing fish meal with brewer's yeast meal on liver antioxidant indexes of bullfrog |
由表 9可知,啤酒酵母粉替代25%或50%鱼粉后,牛蛙肠道中蛋白酶、脂肪酶活性显著降低(P<0.05),而淀粉酶活性则显著升高(P<0.05)。
|
|
表 9 啤酒酵母粉替代鱼粉后对牛蛙肠道消化酶活性的影响 Table 9 Effects of partially replacing fish meal with brewer's yeast meal on intestine digestive enzyme activities of bullfrog |
由肝脏切片(图 1)可观察到,对照组肝细胞可见明显的脂肪沉积,2个替代组牛蛙肝脏形态均未见明显异常,但肝细胞脂肪沉积明显减少。各组肝脏细胞索清晰连接呈网状,细胞界限明显,细胞呈椭圆形或多边形,细胞核位于中央清晰可见。
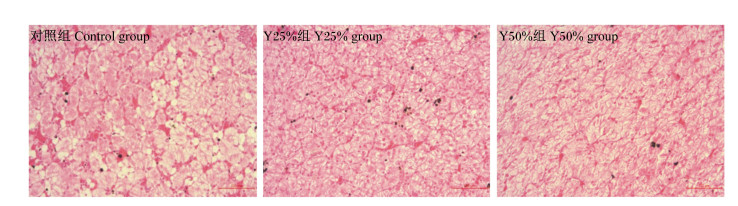
|
图 1 啤酒酵母粉替代部分鱼粉对牛蛙肝脏组织形态学的影响 Fig. 1 Effects of partially replacing fish meal with brewer's yeast meal on liver tissue morphology of bullfrog |
由表 10可知,啤酒酵母粉替代25%或50%鱼粉后,牛蛙肠道黏膜绒毛高度、绒毛宽度以及肌层厚度均未受到显著影响(P>0.05),同时肠道黏膜结构完整,绒毛簇形状规整(图 2)。
|
|
表 10 啤酒酵母粉替代部分鱼粉对牛蛙肠道组织结构的影响 Table 10 Effects of partially replacing fish meal with brewer's yeast meal on intestinal tissue structure of bullfrog |
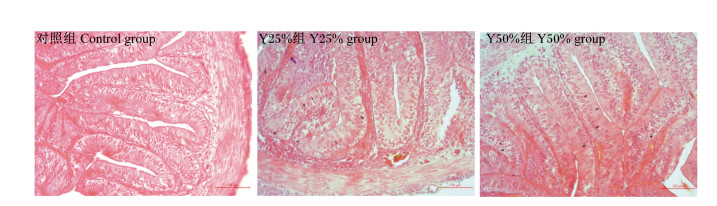
|
图 2 啤酒酵母粉替代部分鱼粉对牛蛙肠道组织形态学的影响 Fig. 2 Effects of partially replacing fish meal with brewer's yeast meal on intestinal tissue morphology of bullfrog |
由图 3可知,啤酒酵母粉替代鱼粉后,Y25%和Y50%组肝脏中HSP70基因的相对表达量均显著高于对照组(P<0.05),而肝脏中IGF-Ⅰ基因的相对表达量各组间均无显著差异(P>0.05)。
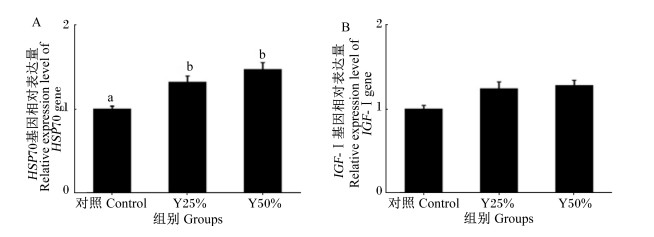
|
图 3 啤酒酵母粉替代部分鱼粉对牛蛙肝脏HSP70和IGF-Ⅰ基因相对表达量的影响 Fig. 3 Effects of partially replacing fish meal with brewer's yeast meal on relative expression levels of HSP70 and IGF-Ⅰ genes in liver of bullfrog |
本试验结果表明,啤酒酵母粉替代鱼粉水平达50%时,牛蛙的生长和饲料利用并未受到显著影响,这与在欧洲鲈[13]、尼罗罗非鱼[35-36]、草鱼(Ctenopharyngodon idellus)[37]、军曹鱼(Rachycentron canadum)[38]、方斑东风螺(Babylonia areolata Link)[39]、中华鳖(Trionyx Sinensis)[40]上的研究结果相似。已有研究表明,在含43%鱼粉的基础饲料中添加21.8%啤酒酵母粉时,大菱鲆的摄食率、特定生长率、饲料系数和蛋白质效率均不及添加等量蛋白的谷朊粉组,饲料转化率和蛋白质效率也低于添加等量蛋白的鸡肉粉组[41];而啤酒酵母粉替代饲料中鱼粉水平至61%时,褐点石斑鱼(Epinephelus fuscoguttatus)摄食8周后,增重率、饲料效率、摄食率均显著降低。导致上述结果差异的原因主要是试验饲料以及养殖动物食性等因素不同[42]。本课题组已有研究证明,豆粕替代牛蛙饲料中鱼粉水平达80%时,生长性能未出现显著差异[28],同时结合本试验结果可知杂食性的牛蛙[43]可以很好地利用豆粕和啤酒酵母粉等非鱼粉蛋白质源。
IGF-Ⅰ是一种由肝脏合成和分泌,并通过调节生长激素(GH)的分泌,促进动物生长的生长调节素,它是动物生长和代谢的主要调节因子[44]。研究表明,硬骨鱼类对饲料摄食率的不同可能会引起IGF-Ⅰ表达量的变化[45]。本试验中牛蛙肝脏中IGF-Ⅰ基因表达所展现的变化趋势与摄食率相似,各组间无显著差异,说明啤酒酵母粉替代50%鱼粉并不会影响牛蛙饲料的诱食性以及适口性。
3.2 啤酒酵母粉替代部分鱼粉对牛蛙体组成和营养物质表观消化率的影响本试验中,啤酒酵母粉替代50%鱼粉后,蛙体粗蛋白质和粗脂肪含量并未表现出显著差异,这与在欧洲鲈鱼[13]上的研究结果相似,说明牛蛙可以很好地利用酵母蛋白质转化为体蛋白质,而牛蛙后腿是肌肉最发达的部位,啤酒酵母粉替代50%鱼粉对牛蛙的后腿比例并未产生显著影响,因此饲料中大量使用啤酒酵母粉不会影响牛蛙可食部分比例。啤酒酵母粉中矿物元素含量低于鱼粉,这可能是引起蛙体粗灰分含量降低的主要原因,说明啤酒酵母粉替代部分鱼粉时需要进一步补充矿物元素。
啤酒酵母粉替代50%鱼粉后显著降低了牛蛙对饲料干物质、粗蛋白质、粗脂肪的表观消化率。有研究表明,如果饲料中含有多种复杂碳水化合物时,会降低鱼类对于蛋白质和脂肪的消化利用[46],而啤酒酵母粉中含有大量酵母多糖,这可能是导致干物质、粗蛋白质、粗脂肪的表观消化率显著降低的主要原因。另有研究表明,以啤酒酵母粉替代10%鱼粉时,褐点石斑鱼的粗蛋白质表观消化率受到负面影响[42]。本试验中磷的表观消化率2个替代组均显著高于对照组,说明啤酒酵母粉中的磷更易被牛蛙利用,是很好的饲料磷源。
3.3 啤酒酵母粉替代部分鱼粉对牛蛙血清生化指标的影响ALT、AST主要存在于肝细胞中,是机体氨基酸代谢转化过程中的2种关键酶,正常情况下,血清中转氨酶的活性较低,而当肝组织受损时,血清中ALT、AST的活性显著增强[47]。本试验中,啤酒酵母粉替代50%鱼粉后牛蛙血清中ALT、AST活性均无显著差异,说明啤酒酵母粉替代50%鱼粉对牛蛙肝功能没有造成不良影响。
ALP是一种非特异性磷酸单酯酶,它在促进营养物的代谢以及血清钙、磷的吸收方面具有重要作用[48]。本试验显示,血清ALP活性随着啤酒酵母粉替代水平的升高而显著升高,可能与啤酒酵母粉替代鱼粉后牛蛙对磷的表观消化率升高有关。LZM是一类广泛存在于动物、微生物中天然抗菌肽,其特殊的免疫保护机理在机体免疫防御中起着重要作用[49]。本试验中,LZM活性随着啤酒酵母粉替代水平的升高的增加,2个替代组均显著高于对照组,可能是啤酒酵母粉中含有的各种免疫促进物使牛蛙的非特异性免疫功能得以加强。因为啤酒酵母粉中含有的核酸、甘露聚糖、几丁质、葡聚糖等因子,在促进和激活机体免疫机制、维持细胞正常生理功能方面起着重要作用;并且,β-葡聚糖是酵母细胞壁的主要物质,它能够促进鱼类非特异性免疫、增强血清中补体含量以及LZM活性[11-12, 19],从而在增强机体细胞吞噬作用和预防病菌方面发挥着重要作用。
3.4 啤酒酵母粉替代部分鱼粉对牛蛙肝脏抗氧化指标、组织形态学和HSP70基因表达的影响大量的活性氧(ROS)会对机体造成氧化损伤,其存在是由于ROS的产生和抗氧化体系的清除不能维持动态平衡而造成的。本试验中,Y25%和Y50%组肝脏中T-AOC、T-SOD与CAT活性以及GSH含量显著高于对照组,而肝脏中MDA的含量未受到显著影响,说明饲料中啤酒酵母粉能使牛蛙肝脏抗氧化能力得到加强,从而使脂质过氧化产物MDA含量保持稳定。孙伟峰等[3]通过提取废啤酒酵母中的功能活性物质证明酵母细胞中的GSH含量较多,超氧化物歧化酶(SOD)活性较高,这二者分别作为抗氧化酶和非酶性抗氧化物质的典型代表,在机体抵抗ROS损害的过程中发挥重要作用。另外,肝脏组织形态学结果显示对照组牛蛙肝脏有脂肪沉积现象,而啤酒酵母粉替代25%或50%鱼粉后肝脏脂肪沉积明显减少,说明啤酒酵母粉可以促进牛蛙脂肪代谢,减少脂肪沉积,有利于肝脏健康。但2个替代组牛蛙肝脏HSP70的相对表达量显著高于对照组,这可能是由于啤酒酵母粉所含不利于牛蛙消化吸收的非淀粉多糖等次优营养物导致的营养胁迫效应[50-51]。
3.5 啤酒酵母粉替代部分鱼粉对牛蛙肠道消化酶活性和组织形态学的影响肠道消化酶的活性常常受到饲料原料和营养水平的影响而表现出差异变化。本试验结果显示,啤酒酵母粉替代50%鱼粉后,牛蛙肠道蛋白酶、脂肪酶活性显著降低,这与本试验中牛蛙对粗蛋白质和粗脂肪的表观消化率的变化趋势一致,说明粗蛋白质和粗脂肪表观消化率降低的本质是由牛蛙肠道蛋白酶、脂肪酶活性降低引起的。而牛蛙肠道淀粉酶的活性则随着啤酒酵母粉替代水平的升高而显著升高,可能是由于啤酒酵母粉中存在的大量碳水化合物能够诱导牛蛙分泌更多的淀粉酶。众所周知,肠道是动物体进行营养物质消化吸收的主要场所,肠道细胞的快速生长需要大量核苷酸,而小肠细胞不能将氨基酸转化为核苷酸,故而需要补充足够的外源核苷酸才能满足肠细胞的生长[52]。酵母饲料中含有大量核苷酸,故而有利于改善肠道健康。本试验中肠道组织切片结果显示,啤酒酵母粉替代50%鱼粉时牛蛙肠道组织未见异常,说明啤酒酵母粉替代50%鱼粉后虽然导致了肠道蛋白酶、脂肪酶活性下降,但是并没有对牛蛙肠道组织造成影响。
4 结论综上所述,啤酒酵母粉可以作为牛蛙饲料的优质替代蛋白质源,且替代鱼粉水平在50%以内不会对牛蛙的生长造成负面影响,并可减少肝脏脂肪沉积,维护肝脏健康。
| [1] |
FERREIRA I M P L V O, PINHO O, VIEIRA E, et al. Brewer's Saccharomyces yeast biomass:characteristics and potential applications[J]. Trends in Food Science & Technology, 2010, 21(2): 77-84. |
| [2] |
RUMSEY G L, HUGHES S G, KINSELLA J L. Use of dietary yeast Saccharomyces cerevisiae nitrogen by lake trout[J]. Journal of the World Aquaculture Society, 1990, 21(3): 205-209. DOI:10.1111/jwas.1990.21.issue-3 |
| [3] |
孙伟峰, 周素梅, 王强. 废啤酒酵母综合利用研究进展[J]. 化工进展, 2008, 27(7): 990-994, 1000. DOI:10.3321/j.issn:1000-6613.2008.07.006 |
| [4] |
白晓婷. 酵母类产品在饲料中的研究与应用[J]. 中国饲料, 2005(2): 8-10. DOI:10.3969/j.issn.1004-3314.2005.02.003 |
| [5] |
HALVER J E, HARDY R W. Fish nutrition[M]. 3rd ed. San Diego: Academic Press, 2002.
|
| [6] |
刘红芝, 王强, 周素梅, 等. 酵母β-葡聚糖的功能活性及其分离提取研究进展[J]. 食品科学, 2006, 27(11): 552-556. DOI:10.3321/j.issn:1002-6630.2006.11.138 |
| [7] |
周传兵, 徐泽平, 刘结磊, 等. 酵母多糖的提纯及化学组成[J]. 食品研究与开发, 2014, 35(2): 92-94. DOI:10.3969/j.issn.1005-6521.2014.02.023 |
| [8] |
崔敏.饲料酵母替代鱼粉对大菱鲆生长、免疫及肠道显微结构的影响[D].硕士学位论文, 保定: 河北农业大学, 2012: 5-11. http://cdmd.cnki.com.cn/Article/CDMD-11920-1012332114.htm
|
| [9] |
黄旭雄, 罗词兴, 危立坤, 等. 饲料中添加酵母提取物对凡纳滨对虾免疫相关基因表达及抗菌机能的影响[J]. 水产学报, 2014, 38(12): 2049-2058. |
| [10] |
KIESSLING A, ASKBRANDT S. Nutritive value of two bacterial strains of single-cell protein for rainbow trout (Oncorhynchus mykiss)[J]. Aquaculture, 1993, 109(2): 119-130. DOI:10.1016/0044-8486(93)90209-H |
| [11] |
ENGSTAD R E, ROBERTSEN B, FRIVOLD E. Yeast glucan induces increase in lysozyme and complement-mediated haemolytic activity in Atlantic salmon blood[J]. Fish & Shellfish Immunology, 1992, 2(4): 287-297. |
| [12] |
SIWICKI A K, ANDERSON D P, RUMSEY G L. Dietary intake of immunostimulants by rainbow trout affects non-specific immunity and protection against furunculosis[J]. Veterinary Immunology and Immunopathology, 1994, 41(1/2): 125-139. |
| [13] |
OLIVA-TELES A, GONÇALVES P. Partial replacement of fishmeal by brewers yeast (Saccaromyces cerevisae) in diets for sea bass (Dicentrarchus labrax) juveniles[J]. Aquaculture, 2001, 202(3/4): 269-278. |
| [14] |
KUMARI J, SAHOO P K. Dietary β-1, 3 glucan potentiates innate immunity and disease resistance of Asian catfish, Clarias batrachus (L.)[J]. Journal of Fish Diseases, 2006, 29(2): 95-101. DOI:10.1111/jfd.2006.29.issue-2 |
| [15] |
OZÍRIO R O A, TURINI B G S, MÔRO G V, et al. Growth, nitrogen gain and indispensable amino acid retention of pacu (Piaractus mesopotamicus, Holmberg 1887) fed different brewers yeast (Saccharomyces cerevisiae) levels[J]. Aquaculture Nutrition, 2010, 16(3): 276-283. |
| [16] |
GUMUS E, AYDIN B, KANYILMAZ M. Growth and feed utilization of goldfish (Carassius auratus) fed graded levels of brewers yeast (Saccharomyces cerevisiae)[J]. Iranian Journal of Fisheries Sciences, 2016, 15(3): 1124-1133. |
| [17] |
ARA-FLORES M, OLVERA-NOVOA M A, GUZMAN-MENDEZ B E, et al. Use of the bacteria Streptococcus faecium and Lactobacillus acidophilus, and the yeast Saccharomyces cerevisiae as growth promoters in Nile tilapia (Oreochromis niloticus)[J]. Aquaculture, 2003, 216(1/2/3/4): 193-201. |
| [18] |
HOSEINIFAR S H, MIRVAGHEFI A, MERRIFIELD D L. The effects of dietary inactive brewer's yeast Saccharomyces cerevisiae var. ellipsoideus on the growth, physiological responses and gut microbiota of juvenile beluga (Huso huso)[J]. Aquaculture, 2011, 318(1/2): 90-94. |
| [19] |
PONGPET J, PONCHUNCHOOVONG S, PAYOOHA K. Partial replacement of fishmeal by brewer's yeast (Saccharomyces cerevisiae) in the diets of Thai panga (Pangasianodon hypophthalmus×Pangasius bocourti)[J]. Aquaculture Nutrition, 2016, 22(3): 575-585. DOI:10.1111/anu.2016.22.issue-3 |
| [20] |
ZHANG C X, FENG W, WANG L, et al. Optimal dietary methionine requirement of bullfrog Rana (Lithobates) catesbeiana[J]. Aquaculture, 2016, 464: 576-581. DOI:10.1016/j.aquaculture.2016.08.011 |
| [21] |
中国渔业统计年鉴编委会. 2017年中国渔业统计年鉴[M]. 北京: 中国农业出版社, 2017: 24-34.
|
| [22] |
ZHANG C X, HUANG K K, WANG L, et al. Optimal dietary carbohydrate to lipid ratio for bullfrog Rana (Lithobates) catesbeiana[J]. Aquaculture Research, 2016, 47(10): 3332-3340. DOI:10.1111/are.2016.47.issue-10 |
| [23] |
ZHANG C X, HUANG K K, WANG L, et al. Apparent digestibility coefficients and amino acid availability of common protein ingredients in the diets of bullfrog, Rana (Lithobates) catesbeiana[J]. Aquaculture, 2015, 437: 38-45. DOI:10.1016/j.aquaculture.2014.11.015 |
| [24] |
徐德平, 曾训江, 刘素文, 等. 牛蛙饲料中最适蛋白质含量的研究[J]. 湖南水产, 1989(6): 15-18. |
| [25] |
OLVERA-NOVOA M A, ONTIVEROS-ESCUTIA V M, FLORES-NAVA A. Optimum protein level for growth in juvenile bullfrog (Rana catesbeiana Shaw, 1802)[J]. Aquaculture, 2007, 266(1/2/3/4): 191-199. |
| [26] |
皇康康, 张春晓, 王玲, 等. 饲料蛋白质和脂肪水平对牛蛙生长性能的影响[J]. 水产学报, 2014, 38(6): 877-887. |
| [27] |
胡田恩, 王玲, 张春晓, 等. 饲料中添加胆汁酸对牛蛙生长性能、体组成和营养物质表观消化率的影响[J]. 水生生物学报, 2015, 39(4): 677-685. |
| [28] |
方卫东, 鲁康乐, 张春晓, 等. 豆粕替代鱼粉对牛蛙生长、体组成、消化酶活力及肝脏生化指标的影响[J]. 水产学报, 2016, 40(11): 1742-1752. |
| [29] |
ZENG Q H, RAHIMNEJAD S, WANG L, et al. Effects of guanidinoacetic acid supplementation in all-plant protein diets on growth, antioxidant capacity and muscle energy metabolism of bullfrog Rana (Lithobates) catesbeiana[J]. Aquaculture Research, 2018, 49(2): 748-756. DOI:10.1111/are.13505 |
| [30] |
CARMONA-OSALDE C, OLVERA-NOVOA M A, RODRÍGUEZ-SERNA M, et al. Estimation of the protein requirement for bullfrog (Rana catesbeiana) tadpoles, and its effect on metamorphosis ratio[J]. Aquaculture, 1996, 141(3/4): 223-231. |
| [31] |
DORNELLES M F, OLIVEIRA G T. Effect of atrazine, glyphosate and quinclorac on biochemical parameters, lipid peroxidation and survival in bullfrog tadpoles (Lithobates catesbeianus)[J]. Archives of Environmental Contamination and Toxicology, 2014, 66(3): 415-429. DOI:10.1007/s00244-013-9967-4 |
| [32] |
AOAC.Official methods of analysis of AOAC international[S]. 18th ed.Washington, D.C.: Association of Official Analytical Chemists International, 2005.
|
| [33] |
北京大学生物系生物化学教研室. 生物化学实验指导[M]. 北京: 人民教育出版社, 1979: 73-74.
|
| [34] |
SCHMITTGEN T D, LIVAK K J. Analyzing real-time PCR data by the comparative CT method[J]. Nature Protocols, 2008, 3(6): 1101-1108. DOI:10.1038/nprot.2008.73 |
| [35] |
SCHNEIDER O, AMIRKOLAIE A K, VERA-CARTAS J, et al. Digestibility, faeces recovery, and related carbon, nitrogen and phosphorus balances of five feed ingredients evaluated as fishmeal alternatives in Nile tilapia, Oreochromis niloticus L[J]. Aquaculture Research, 2004, 35(14): 1370-1379. DOI:10.1111/are.2004.35.issue-14 |
| [36] |
ZERAI D B, FITZSIMMONS K M, COLLIER R J, et al. Evaluation of brewer's waste as partial replacement of fish meal protein in Nile tilapia, Oreochromis niloticus, diets[J]. Journal of the World Aquaculture Society, 2008, 39(4): 556-564. DOI:10.1111/jwas.2008.39.issue-4 |
| [37] |
李自金, 邱波, 童运彬, 等. 啤酒酵母取代鱼粉在草鱼上的应用[J]. 饲料工业, 2009, 30(20): 25-26. DOI:10.3969/j.issn.1001-991X.2009.20.007 |
| [38] |
ZHOU H, CHEN G, GU B H, et al. Relative contribution of alternative proteins to the growth of Juvenile Cobia, Rachycentron canadum (Linnaeus)[J]. Aquaculture Research, 2016, 47(5): 1639-1651. |
| [39] |
吴建国, 黄兆斌, 王波, 等. 不同蛋白源饲料对方斑东风螺生长的影响[J]. 厦门大学学报(自然科学版), 2009, 48(4): 600-605. DOI:10.3321/j.issn:0438-0479.2009.04.030 |
| [40] |
周贵谭. 啤酒酵母替代部分鱼粉对中华鳖生长的试验[J]. 广东饲料, 2003, 12(3): 11-12. DOI:10.3969/j.issn.1005-8613.2003.03.009 |
| [41] |
张瑞玲, 冀芳烁, 杨振才, 等. 不同蛋白源对大菱鲆生长性能和体成分的影响[J]. 中国饲料, 2014(5): 35-38. DOI:10.3969/j.issn.1004-3314.2014.05.012 |
| [42] |
周晖, 陈刚, 纪多亮, 等. 3种蛋白替代鱼粉对褐点石斑鱼生长、体成分及能量收支的影响[J]. 广东海洋大学学报, 2012, 32(6): 10-16. DOI:10.3969/j.issn.1673-9159.2012.06.004 |
| [43] |
HIRAI T. Diet composition of introduced bullfrog, Rana catesbeiana, in the Mizorogaike Pond of Kyoto, Japan[J]. Ecological Research, 2004, 19(4): 375-380. DOI:10.1111/ere.2004.19.issue-4 |
| [44] |
DAUGHADAY W H, ROTWEIN P. Insulin-like growth factors Ⅰ and Ⅱ.Peptide, messenger ribonucleic acid and gene structures, serum, and tissue concentrations[J]. Endocrine Reviews, 1989, 10(1): 68-91. |
| [45] |
DUAN C M. Nutritional and developmental regulation of insulin-like growth factors in fish[J]. The Journal of Nutrition, 1998, 128(Suppl.2): 306S-314S. |
| [46] |
WILSON R P. Utilization of dietary carbohydrate by fish[J]. Aquaculture, 1994, 124(1/2/3/4): 67-80. |
| [47] |
郑永华, 蒲富永. 汞对鲤鲫鱼组织转氨酶活性的影响[J]. 西南农业大学学报, 1997, 19(1): 41-45. |
| [48] |
HE W Q, RAHIMNEJAD S, WANG L, et al. Effects of organic acids and essential oils blend on growth, gut microbiota, immune response and disease resistance of Pacific white shrimp (Litopenaeus vannamei) against Vibrio parahaemolyticus[J]. Fish & Shellfish Immunology, 2017, 70: 164-173. |
| [49] |
徐永平, 汪婷婷, 孙永欣, 等. 水产动物溶菌酶研究的最新进展[J]. 水产科学, 2011, 30(5): 307-310. DOI:10.3969/j.issn.1003-1111.2011.05.013 |
| [50] |
MARTIN S A M, VILHELMSSON O, MÉDALE F M, et al. Proteomic sensitivity to dietary manipulations in rainbow trout[J]. Biochimica et Biophysica Acta:Proteins and Proteomics, 2003, 1651(1/2): 17-29. |
| [51] |
HEMRE G I, DENG D F, WILSON R P, et al. Vitamin A metabolism and early biological responses in juvenile sunshine bass (Morone chrysops×M. saxatilis) fed graded levels of vitamin A[J]. Aquaculture, 2004, 235(1/2/3/4): 645-658. |
| [52] |
TSUJINAKA T, KISHIBUCHI M, ⅡJIMA S, et al. Nucleotides and intestine[J]. Journal of Parenteral and Enteral Nutrition, 1999, 23(5S): S74-S77. |




