家禽肠道是一个开放的生态系统,栖居着大量的微生物并形成功能复杂的微生态环境。肠道微生物对宿主具有重要的作用,比如发酵不溶纤维提供能量[1]、维持机体免疫功能[2]、调节机体新陈代谢[3]等。而肠道菌群失衡或微生物多样性降低会导致机体免疫力下降、养分利用率降低,且可能与乳糜泄和炎症性肠病等的发生有关[4-5]。可见,健康的肠道菌群有利于维持宿主正常的生理功能和发挥生长或生产潜能。蒙脱石(montmorillonite,MMT)是一种铝硅酸盐类黏土,比表面积大,表面分布着无数微孔,具有很好的吸附性,已被证实能在动物肠道中吸附细菌及其毒素,改善肠道菌群[6-7]。枯草芽孢杆菌(Bacillus subtilis,BS)是生产中应用广泛的饲用益生菌之一,它可通过消耗肠道游离氧、竞争肠腔内养分和分泌类抗生素物质等抑制有害菌增殖,促进有益菌生长,进而调节肠道微生态平衡[8-9]。在断奶仔猪上的研究表明,MMT和嗜酸乳杆菌联用对调节肠道菌群和降低肠道通透性的作用优于二者单独使用[10],提示MMT和益生菌在改善肠道菌群和肠道屏障功能方面可能具有协同作用,因此,我们推测MMT和BS联用可能更有利于优化产蛋鸡肠道菌群、降低肠道通透性。但目前尚未有关于BS及其与MMT互作对产蛋鸡肠道通透性影响的报道,且二者对调节肠道菌群是否具有协同作用尚不明确。此外,本课题组最近的研究表明,饲粮添加0.5 g/kg MMT、5×108 CFU/kg BS及其联用均提高了产蛋鸡的生产性能[11],鉴于肠道微生物与宿主免疫、养分吸收、生长发育或维持生产的相关性,我们推测它们对产蛋鸡生产性能的影响与肠道菌群存在一定关联。因此,本试验旨在探讨饲粮添加MMT和BS对产蛋鸡肠道菌群和肠道通透性的影响,并观察MMT和BS是否具有协同作用,以期为其在产蛋鸡生产中的应用提供依据。
1 材料与方法 1.1 试验材料MMT由美国安牧然国际公司提供,其主要成分为:钙基MMT含量>70%,其中钙含量为0.5%~1.5%;无定形水合二氧化硅含量 > 15%;其他矿物(如斜发沸石、伊利石、高岭石和黄铁矿等)含量 < 15%。BS(BS-C3102)由上海牧冠企业发展有限公司提供,活菌数≥1×109 CFU/g。
1.2 试验设计与饲养管理本试验于2017年7月21日至2017年10月7日在湖南生安赛特农牧科技有限公司进行。采用2×2双因子随机设计,选择360只29周龄健康的罗曼粉壳蛋鸡,随机分成4组,每组6个重复,每个重复15只,分别饲喂基础饲粮(对照组)、基础饲粮+0.5 g/kg MMT(MMT组)、基础饲粮+5×108 CFU/kg BS(BS组)、基础饲粮+0.5 g/kg MMT+5×108 CFU/kg BS(MMT+BS组)。预试期7 d,正试期70 d。预试期各组产蛋鸡统一饲喂基础饲粮,每天对鸡群进行观察,并及时调整鸡群,使各组间产蛋鸡的平均日采食量[(116.61±0.45) g,P=0.603]、产蛋率[(95.72±0.48)%,P=0.955]和平均蛋重[(59.90±0.21) g,P=0.689]差异不显著。试验用基础饲粮参考《鸡饲养标准》(NY/T 33—2004)并结合生产实际配制,基础饲粮组成及营养水平见表 1。在基础饲粮配制好后,准确称取所需的MMT和BS添加到基础饲粮中,逐级充分混匀(先将MMT或BS混匀于小份饲粮中,然后逐步拌于大份饲粮中),在配制MMT+BS组试验饲粮时,先将所需的MMT和BS充分混匀后再逐级混匀于基础饲粮中。配制好的试验饲粮,按照组别装于带盖的塑料大桶中,并储存于饲料贮藏室。正试期间,每隔3~4 d配制1次试验饲粮。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet(air-dry basis) |
产蛋鸡采用上、中、下3层阶梯式笼养,每笼3只,每5笼1个重复,各组的试验鸡保证分布在上、中、下层的数量相等。每日喂料2次,捡蛋2次,上午、下午各匀料2次。各组产蛋鸡饲养管理条件相同,试验第1~5周鸡舍温度、相对湿度分别为(27.06±2.27) ℃、(77.39±6.13)%;试验第6~10周鸡舍温度、相对湿度分别为(24.03±2.40) ℃、(77.07±6.21)%。产蛋鸡自由采食、饮水,每日光照时间为16 h,自然光照和人工光照相结合。每日清扫鸡舍1次,每周对鸡舍喷雾消毒2次,每隔3 d清粪1次。
1.3 样品采集试验第70天清晨,以重复为单位随机选取2只产蛋鸡,采血前禁食12 h,自由饮水。通过翅下静脉采集5 mL左右血液于肝素抗凝管中,于3 000 r/min离心10 min制备血浆,置于-20 ℃冰箱保存。采血结束后,立即饲喂试验鸡只,当天下午从每个重复随机选取1只鸡,颈部放血后剖开腹腔,取适量盲肠内容物置于1.5 mL的高压灭菌离心管中,并迅速放置液氮中保存,然后放入-80 ℃冰箱冻存。
1.4 检测指标与方法 1.4.1 盲肠微生物分析细菌DNA提取及检测:分别从每组的6份盲肠内容物样品中随机选取5份,称取每份盲肠内容物样品(200±10) mg置于2 mL离心管中,采用粪便基因组DNA提取试剂盒(DP328,天根生化科技有限公司)提取细菌DNA。用超微量分光光度计(NanoDrop ND-2000 UV,赛默飞)检测DNA浓度,0.8%琼脂糖凝胶电泳检测纯度,之后将合格的DNA样品送上海美吉生物医药科技有限公司测序分析。
Illumina MiSeq高通量测序:利用Illumina MiSeq平台进行Barcoded Illumina Miseq测序,对样品16S rRNA的V4区建立文库并上机测序。具体操作如下,选择16S rDNA的V4区作为目的扩增区域,用引物对515F/806R目的片段进行扩增。根据PCR产物浓度进行等量混样,充分混匀后使用2%的琼脂糖凝胶电泳检测PCR产物。目标条带用DNA切胶回收试剂盒进行回收,得纯化样本,并用BioTek酶标仪测定各样本浓度并定量。每个样品DNA等量混合,采用标准的Illumina TruSeq DNA文库制备流程构建所需的宏基因组上机文库,最后在Illumina Miseq分析平台上进行Barcoded Illumina Miseq测序,采用PE250测序策略。
数据处理与分析:对经过双端(pair-end)测序的数据进行质量控制,截断或舍弃低质量序列(50个连续碱基平均质量 > Q30,接头污染、含有N和低复杂度的reads)。用软件Flash v1.2.11连接通过质量控制的序列,舍弃无法连接的序列。利用软件USEARCH 7.0.1090去掉纯化后数据的嵌合体,应用Qiime 1.8.0分析软件合并去掉嵌合体的数据,并将数据按照Ulust算法将序列相似性≥97%的操作分类单元(operational taxonomic units, OTU)进行聚类。选取每个类最长的序列为代表序列,通过RDP-classifier v2.2软件将OTU代表序列与数据库有比对进行物种注释,得到每个OTU的分类学信息。通过软件Mothur 1.31.2对生成的OTU信息进行细菌群落多样性和丰富度分析。
1.4.2 血浆指标测定使用北京华英生物技术研究所生产的试剂盒测定血浆二胺氧化酶(DAO)活性和内毒素、D-乳酸含量,相应试剂盒的货号分别为HY-60106、HY-70055、HY-60026。
1.5 数据统计与分析盲肠微生物测序数据采用SAS 9.2统计软件中Kruskal-Wallis检验,血浆DAO活性和内毒素、D-乳酸含量采用一般线性模型(GLM)程序进行2×2因子分析,差异显著者用Duncan氏法进行多重比较。结果以平均值和集合标准误(SEM)表示,用P < 0.05表示差异显著,0.05≤P < 0.10表示有提高或降低的趋势。
2 结果 2.1 饲粮添加MMT和BS对产蛋鸡盲肠菌群测序数据和Alpha多样性的影响由表 2可知,BS组测序获得的有效序列显著多于其他各组(P < 0.05),试验组测序获得的优质序列较对照组均有一定增加(P > 0.05)。各组测序覆盖率均在99.30%以上,说明测序深度已经基本覆盖到样品中的所有物种。各组间Ace指数、Chao1指数、香农指数和辛普森指数均无显著差异(P > 0.05)。
|
|
表 2 97%相似性水平下物种丰富度和Alpha多样性指数 Table 2 Richness and Alpha diversity index of species at 97% similarity level |
Beta多样性分析可以比较不同样品间在物种多样性方面存在的差异大小。如图 1所示,经主坐标分析(principal coordinates analysis, PCoA)方法分析,结果显示对照组、MMT组和BS组菌群结构分布相对紧凑,相似度较高,而MMT+BS组菌群结构分布相对零散,相似度低,群落构成差异较大。
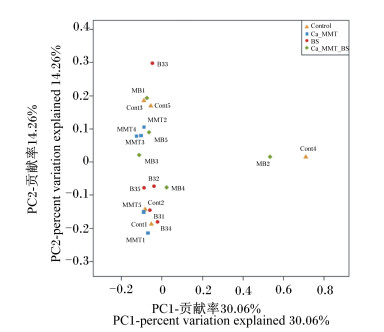
|
Control:对照组control group;Ca_MMT:蒙脱石组MTT group;BS:枯草芽孢杆菌组BS group;Ca_MMT_BS:蒙脱石+枯草芽孢杆菌组MTT+BS group。 图 1 饲粮添加MMT和BS对产蛋鸡盲肠菌群Beta多样性的影响 Fig. 1 Effects of dietary MMT and BS on Beta diversity of cecum microflora in laying hens |
由表 3可知,在门水平上,各组中拟杆菌门、厚壁菌门、变形菌门和梭杆菌门均为优势菌门,其中拟杆菌门和厚壁菌门相对含量分别为45.42%~59.12%和34.86%~43.41%。统计结果表明:各组间相对含量大于0.15%的菌门相对含量均无显著差异(P > 0.05)。与对照组相比,MMT组梭杆菌门相对含量有降低的趋势(P=0.072),MMT+BS组迷踪菌门相对含量有降低的趋势(P=0.053)。
|
|
表 3 相对含量大于0.15%(序列占测序总量比例)的菌门 Table 3 Bacterial phyla with relative abundance above 0.15% (sequence percentage of total sequence amount) |
由表 4可知,在相对含量大于1%的菌属中,各组间优势菌属存在一定差异,且拟杆菌属的相对含量最高,其序列占测序总量的32.25%。统计结果表明:与对照组相比,试验组巨单胞菌属和乳杆菌属相对含量均有不同程度的提高,其中,BS组和MMT+BS组巨单胞菌属相对含量较对照组显著提高(P < 0.05),BS组乳杆菌属相对含量显著高于对照组和MMT组(P < 0.05);试验组梭杆菌属和梭菌属相对含量均有降低,其中,MMT组梭杆菌属相对含量较对照组有降低的趋势(P=0.072),MMT+BS组梭菌属相对含量显著低于对照组(P < 0.05)。此外,MMT组普雷沃氏菌科Ga6A1群相对含量显著高于BS组(P < 0.05);MMT+BS组丁酸弧菌属相对含量较BS组显著提高(P < 0.05),理研菌科RC9群相对含量较BS组有降低的趋势(P=0.075)。
|
|
表 4 相对含量大于1%(序列占测序总量比例)或差异显著的菌属 Table 4 Bacterial genus with relative abundance above 1% (sequence percentage of total sequence amount) or significant difference |
由表 5可知,主效应分析表明,饲粮中添加MMT对产蛋鸡血浆DAO活性、D-乳酸和内毒素含量均无显著影响(P > 0.05);添加BS显著降低了血浆DAO活性和内毒素含量(P < 0.05),有降低血浆D-乳酸含量的趋势(P=0.051);MMT和BS互作对血浆DAO活性、D-乳酸和内毒素含量均无显著影响(P > 0.05)。BS组血浆内毒素含量显著低于对照组和MMT组(P < 0.05),血浆D-乳酸含量较对照组有降低的趋势(P=0.085)。
|
|
表 5 饲粮添加MMT和BS对产蛋鸡血浆DAO活性、D-乳酸和内毒素含量的影响 Table 5 Effects of dietary MMT and BS on diamine oxidase activity and contents of D-lactic acid and endotoxin in plasma of laying hens |
本研究采用高通量测序技术对产蛋鸡20个盲肠内容物样品进行了测序,BS组样品测序获得的有效序列显著多于其他各组,试验组的优质序列较对照组均有一定增加。对菌群进行多样性分析发现,试验组和对照组样品间Alpha多样性指数均无显著差异;另外,经PCoA方法分析Beta多样性发现,MMT+BS组菌群结构分布相对零散,相似度较低,提示样品中群落构成差异较大。本课题组前期的研究表明,添加0.6 g/kg MMT在一定程度上提高了产蛋鸡盲肠菌群的丰富度和Alpha多样性[12],提示MMT对产蛋鸡肠道菌群多样性的影响与其添加水平有关。Guo等[8]报道,添加BS提高了产蛋鸡盲肠的香农指数和Chao1指数;本试验中,BS组香农指数和Chao1指数较对照组有一定提高,提示添加BS对产蛋鸡盲肠微生物多样性的影响是正面的。
3.2 饲粮添加MMT和BS对产蛋鸡盲肠菌群结构和物种丰度的影响MMT、BS及其联用对产蛋鸡盲肠优势菌门的相对含量没有产生显著影响,与前人的报道[8, 12]一致;而Li等[13]研究指出,添加BS显著提高了肉仔鸡盲肠拟杆菌门和变形菌门相对含量,降低了厚壁菌门相对含量,与本试验的结果不一致,可能与开始饲喂BS时鸡的年龄有关,即健康成年鸡肠道中已形成较稳定的微生态环境,添加BS(肠道非定植菌)很难引起肠道内主要微生物发生大的变化。本试验发现,试验组梭杆菌门相对含量较对照组均有一定程度降低。研究表明,梭杆菌门相对含量提高与消化道疾病有关[14],且此菌门的一些成员不利于机体脂质代谢[15],提示梭杆菌门相对含量的降低可能对产蛋鸡有一定益处。此外,试验组迷踪菌门相对含量有不同程度降低,本课题组前期的研究也发现MMT降低了产蛋鸡盲肠迷踪菌门相对含量[12]。梁惠等[16]报道,酒精性肝损伤大鼠粪便迷踪菌门相对含量明显提高,并指出此菌门相对含量升高可能与肠道损伤有关。本试验中,MMT+BS组迷踪菌门相对含量最低,且较对照组有降低的趋势,提示二者联用可能有利于改善产蛋鸡盲肠菌群。
在属水平上,MMT、BS及其联用对盲肠优势菌属相对含量没有产生显著影响。与对照组相比,BS组乳杆菌属相对含量显著提高,BS组和MMT+BS组巨单胞菌属相对含量显著提高。Guo等[8]报道,BS增加了产蛋鸡盲肠乳杆菌属的相对丰度;Forte等[17]也指出,BS和嗜酸乳杆菌促进了产蛋鸡肠道乳杆菌属的增殖,本试验的结果与以上学者的报道基本一致。乳杆菌属是肠道有益菌群,其利用葡萄糖发酵后能产生乳酸和乙酸等。巨单胞菌属化能有机营养型微生物,发酵各种碳水化合物生成乳酸、乙酸和丁酸等,它们能够降低肠道pH,间接抑制外来病原菌的入侵。同时,丁酸还可为宿主肠上皮细胞生长提供能量,有利于维持肠道屏障功能[18]。本试验中,MMT组梭杆菌属相对含量较对照组有降低的趋势,MMT+BS组梭菌属相对含量显著低于对照组,与前人的报道[8, 17]基本一致。梭杆菌属和梭菌属均是肠道有害菌群,梭杆菌属包含坏死梭杆菌和核梭杆菌等多种致病菌,对动物和人类均具有毒害作用;苗慧芳等[19]报道,结直肠癌患者粪便梭杆菌属丰度明显高于健康人,提示此菌属数量增加可能与肠道疾病有关。有学者证明,梭菌属的一些菌能够产生α-毒素,与坏死性肠炎的发生有关[20]。此外,本研究表明,MMT显著提高了普雷沃氏菌科Ga6A1群相对含量,普雷沃氏菌与短链脂肪酸的合成有关,而短链脂肪酸的缺乏减弱了其对肠道屏障的保护作用;Shen等[21]报道,非酒精性脂肪肝患者粪便中普雷沃氏菌相对含量在科和属水平出现显著下降,因此,普雷沃氏菌通常被认为是有益菌。丁酸弧菌属化能有机营养型微生物,可发酵底物广且发酵产物丰富,其发酵葡萄糖的主要产物是丁酸和乳酸[22],本试验中,MMT和BS降低了丁酸弧菌属的相对含量,但二者联用可使此菌的相对含量升高。此外,本试验发现,试验组另枝菌属相对含量较对照组均有一定提高。据报道,此菌是一种耐胆盐的微生物,能产生溶纤维蛋白酵素,发酵碳水化合物生成乙酸、丙酸,并可高效表达木糖异构酶[23]。
本课题组最近的研究表明,饲粮添加0.5 g/kg MMT、5×108 CFU/kg BS及其联用均提高了产蛋鸡的产蛋率、日产蛋重,且二者联用降低了料蛋比[11]。综上,MMT和BS在一定程度上提高了盲肠部分有益菌属相对含量,降低了部分有害菌属相对含量,说明二者可改善产蛋鸡盲肠菌群,可能对提高产蛋性能有一定作用。鉴于MMT和BS联用提高了巨单胞菌属、丁酸弧菌属和乳杆菌属相对含量,降低了梭菌属和梭杆菌属相对含量,提示二者联用对优化肠道菌群可能具有协同作用,进而有益于提高产蛋鸡的生产性能。本研究的结果与Cao等[10]的报道基本一致,可能是在MMT的保护作用下,BS的益生功效增强[11]。综合分析,MMT和BS联用对提高产蛋鸡生产性能和盲肠菌群的效果优于二者单独使用。
3.3 饲粮添加MMT和BS对产蛋鸡肠道通透性的影响当动物肠黏膜屏障受损时,肠道通透性增大,血液中内毒素和D-乳酸含量增加,DAO活性提高。本试验中,添加MMT不影响产蛋鸡血浆DAO活性、内毒素和D-乳酸含量。孟艳莉[24]研究指出,添加MMT显著降低了断奶仔猪血浆D-乳酸含量和DAO活性;此外,Lei等[25]报道,肉牛饲粮中添加MMT,其血浆、瘤胃液、肠道食糜和粪便中内毒素水平均显著降低。本试验的结果与以上学者的研究结果不一致,其可能原因有以下几方面:1)动物的生理状况。仔猪断奶后,肠黏膜屏障在一定程度上受损,使肠道通透性增加,故此时在饲粮中添加MMT,有利于发挥其功效;而本试验蛋鸡处于产蛋高峰期阶段,其肠道发育成熟,且产蛋鸡处于正常的生产条件下,肠黏膜屏障相对完整,进而添加MMT难以对上述指标产生显著影响。2)饲粮因素。肉牛饲粮中添加一定比例的草料会降低瘤胃pH和影响体内微生态环境,容易造成瘤胃酸中毒和产生大量的内毒素[26],而MMT具有吸附内毒素的作用,因而添加MMT显著降低了内毒素含量。3)MMT的添加水平。上述肉牛和断奶仔猪试验中MMT的添加水平分别为2、3 g/kg,而本试验MMT的添加水平为0.5 g/kg,可能该水平下的MMT对产蛋鸡肠道通透性不产生显著影响。
目前,关于BS对家禽肠道通透性影响的研究很少。本研究表明,BS显著降低了血浆DAO活性和内毒素含量,且有降低血浆D-乳酸含量的趋势,提示BS能增强产蛋鸡肠道屏障功能,降低肠道通透性,推测对提高产蛋鸡的生产性能起一定作用[11]。这可能与BS一定程度上降低了肠道有害菌数量、优化肠道菌群有关,已知一些细菌能够产生内毒素,肠道内毒素含量降低,一方面,能够进入血液循环的内毒素减少;另一方面,肠道有害菌和内毒素减少,肠黏膜受损的几率降低,机体维持正常的屏障功能和肠道通透性,进而内毒素、DAO和D-乳酸释放减少或难以穿过肠道屏障进入血液。此外,本试验中,MMT和BS对血浆DAO活性和内毒素、D-乳酸含量不产生显著交互作用。Cao等[10]报道,MMT和嗜酸乳杆菌联用对提高肠上皮细胞跨膜电阻值和降低荧光素异硫氰酸酯葡聚糖4 ku渗透率的作用略优于二者单独添加,但没有表现出明显优势,与本试验的结果基本一致。
4 结论① 饲粮添加MMT有降低盲肠梭杆菌门和梭杆菌属相对含量的趋势,对肠道通透性没有显著影响;添加BS提高了盲肠巨单胞菌属和乳杆菌属的相对含量,降低了肠道通透性。
② MMT和BS联用降低了盲肠迷踪菌门和梭菌属的相对含量,提高了巨单胞菌属相对含量,提示二者对调节产蛋鸡肠道菌群可能具有协同作用。
③ 肠道中这些菌群丰度的变化与肠道健康相关,可能对提高产蛋鸡的生产性能有作用。
| [1] |
TROMPETTE A, GOLLWITZER E S, YADAVA K, et al. Gut microbiota metabolism of dietary fiber influences allergic airway disease and hematopoiesis[J]. Nature Medicine, 2014, 20(2): 159-166. DOI:10.1038/nm.3444 |
| [2] |
HORAI R, SEN H N, CASPI R R. Commensal microbiota as a potential trigger of autoimmune uveitis[J]. Expert Review of Clinical Immunology, 2017, 13(4): 291-293. DOI:10.1080/1744666X.2017.1288098 |
| [3] |
TREMAROLI V, BÄCKHED F. Functional interactions between the gut microbiota and host metabolism[J]. Nature, 2012, 489(7415): 242-249. DOI:10.1038/nature11552 |
| [4] |
VERDU E F, GALIPEAU H J, JABRI B. Novel players in coeliac disease pathogenesis:role of the gut microbiota[J]. Nature Reviews Gastroenterology & Hepatology, 2015, 12(9): 497-506. |
| [5] |
KAMADA N, SEO S U, CHEN G Y, et al. Role of the gut microbiota in immunity and inflammatory disease[J]. Nature Reviews Immunology, 2013, 13(5): 321-335. DOI:10.1038/nri3430 |
| [6] |
HU C H, QIAN Z C, SONG J, et al. Effects of zinc oxide-montmorillonite hybrid on growth performance, intestinal structure, and function of broiler chicken[J]. Poultry Science, 2013, 92(1): 143-150. DOI:10.3382/ps.2012-02250 |
| [7] |
XIA M S, HU C H, XU Z R. Effects of copper-bearing montmorillonite on growth performance, digestive enzyme activities, intestinal microflora and morphology of male broilers[J]. Poultry Science, 2004, 83(11): 1868-1875. DOI:10.1093/ps/83.11.1868 |
| [8] |
GUO J R, DONG X F, LIU S, et al. Effects of long-term Bacillus subtilis CGMCC 1.921 supplementation on performance, egg quality, and fecal and cecal microbiota of laying hens[J]. Poultry Science, 2017, 96(5): 1280-1289. |
| [9] |
GAO Z H, WU H H, SHI L, et al. Study of Bacillus subtilis on growth performance, nutrition metabolism and intestinal microflora of 1 to 42 d broiler chickens[J]. Animal Nutrition, 2017, 3(2): 109-113. DOI:10.1016/j.aninu.2017.02.002 |
| [10] |
CAO S T, WANG L, JIAO L F, et al. Effects of diosmectite-Lactobacillus acidophilus on growth performance, intestine microbiota, mucosal architecture of weaned pigs[J]. Animal Feed Science and Technology, 2016, 220: 180-186. DOI:10.1016/j.anifeedsci.2016.08.012 |
| [11] |
陈继发, 朱瑾, 康克浪, 等. 枯草芽孢杆菌、蒙脱石及其互作对产蛋鸡生产性能、养分表观利用率和肠黏膜养分转运载体基因表达的影响[J]. 动物营养学报, 2018, 30(9): 3693-3701. DOI:10.3969/j.issn.1006-267x.2018.09.040 |
| [12] |
陈继发, 彭灿阳, 曲湘勇, 等. 蒙脱石对产蛋鸡生产性能和盲肠菌群的影响[J]. 动物营养学报, 2017, 29(11): 4026-4035. DOI:10.3969/j.issn.1006-267x.2017.11.024 |
| [13] |
LI Y, XU Q, HUANG Z, et al. Effect of Bacillus subtilis CGMCC 1.1086 on the growth performance and intestinal microbiota of broilers[J]. Journal of Applied Microbiology, 2016, 120(1): 195-204. |
| [14] |
KOSTIC A D, GEVERS D, PEDAMALLU C S, et al. Genomic analysis identifies association of Fusobacterium with colorectal carcinoma[J]. Genome Research, 2012, 22(2): 292-298. |
| [15] |
KOREN O, SPOR A, FELIN J, et al. Human oral, gut, and plaque microbiota in patients with atherosclerosis[J]. Proceedings of the National Academy of Sciences of the United States of America, 2011, 108(Suppl.1): 4592-4598. |
| [16] |
梁惠, 吕锐, 傅泳, 等. 益生菌对大鼠酒精性肝损伤的保护作用及机制研究[J]. 中国药理学通报, 2016, 32(7): 991-997. DOI:10.3969/j.issn.1001-1978.2016.07.021 |
| [17] |
FORTE C, ACUTI G, MANUALI E, et al. Effects of two different probiotics on microflora, morphology, and morphometry of gut in organic laying hens[J]. Poultry Science, 2016, 95(11): 2528-2535. DOI:10.3382/ps/pew164 |
| [18] |
FUKUDA S, TOH H, HASE K, et al. Bifidobacteria can protect from enteropathogenic infection through production of acetate[J]. Nature, 2011, 469(7331): 543-547. DOI:10.1038/nature09646 |
| [19] |
苗慧芳, 武娜, 栾春光, 等. 结直肠腺瘤及结直肠癌患者肠道中梭杆菌属与产丁酸菌的定量研究[J]. 微生物学报, 2014, 54(10): 1228-1234. |
| [20] |
HEIDA F H, VAN ZOONEN A J G F, HULSCHER J B F, et al. A necrotizing enterocolitis-associated gut microbiota is present in the meconium:results of a prospective study[J]. Clinical Infectious Diseases, 2016, 62(7): 863-870. DOI:10.1093/cid/ciw016 |
| [21] |
SHEN F, ZHENG R D, SUN X Q, et al. Gut microbiota dysbiosis in patients with non-alcoholic fatty liver disease[J]. Hepatobiliary & Pancreatic Diseases International, 2017, 16(4): 375-381. |
| [22] |
VOS P, GARRITY G, JONES D, et al. Bergey's manual of systematic bacteriology[M]. New York: Springer, 2011.
|
| [23] |
POLANSKY O, SEKELOVA Z, FALDYNOVA M, et al. Important metabolic pathways and biological processes expressed by chicken cecal microbiota[J]. Applied and Environmental Microbiology, 2016, 82(5): 1569-1576. DOI:10.1128/AEM.03473-15 |
| [24] |
孟艳莉.凹凸棒石、蒙脱石及其复合物对断奶仔猪肠道的保护作用研究[D].硕士学位论文.北京: 中国农业科学院, 2011: 24-25. http://cdmd.cnki.com.cn/Article/CDMD-82101-1011159013.htm
|
| [25] |
LEI C L, DONG G Z, JIN L, et al. Effects of dietary supplementation of montmorillonite and yeast cell wall on lipopolysaccharide adsorption, nutrient digestibility and growth performance in beef cattle[J]. Livestock Science, 2013, 158(1/2/3): 57-63. |
| [26] |
DONG G Z, LIU S M, WU Y X, et al. Diet-induced bacterial immunogens in the gastrointestinal tract of dairy cows:impacts on immunity and metabolism[J]. Acta Veterinaria Scandinavica, 2011, 53: 48. DOI:10.1186/1751-0147-53-48 |




