仔猪早期断奶过程中饲粮从液体转化到固体,肠道直接吸收死粮中的植物性蛋白质,导致肠黏膜产生过敏反应,易造成胃肠道物理损害,有害菌感染导致肠黏膜细胞凋亡加速[1]。Cabrera等[2]研究发现,仔猪断奶后14 d生长缓慢,增重显著下降,尤其是在断奶后第1天,平均日头增重为12 g,生长率为0.11%。Campbell等[3]报道仔猪断奶后第1天平均日增重从断奶前的210.0 g降低为9.8 g,生长率由断奶前的42.00%降低为0.14%,生长同样停滞不前。牛磺酸(Tau)和谷氨酰胺(Gln)是断奶仔猪的条件性必需氨基酸,具有多种生物学功能,能够缓解断奶应激症状。Gln和Tau在早期断奶仔猪饲粮中的最佳添加量分别为1.0%和0.1%[4-5],Gln的添加量是Tau的10倍,且Gln价格昂贵,饲粮单独添加Gln在实际生产中增加了养殖成本,而Gln和Tau配合使用能降低养殖成本,从而增加经济效益。本试验旨在研究用0.1% Tau替代断奶仔猪饲粮中部分Gln的应用效果和作用机理,以期降低养殖成本。
1 材料与方法 1.1 试验材料Tau和Gln购自上海源聚生物科技有限公司,Tau为药用级, Gln的纯度>98.5%。
1.2 试验设计选择40头21日龄断奶、平均体重为(5.17±0.04) kg的健康荣昌内三元[(长白×大白)×荣昌猪)]早期断奶仔猪,采用单因素完全随机设计分为4组,每组10头。4个组分别饲喂基础饲粮+1.0%Gln(对照组,CON组)、基础饲粮+0.1%Tau+0.4%Gln(Ⅰ组)、基础饲粮+0.1%Tau+0.6%Gln(Ⅱ组)、基础饲粮+0.1%Tau+0.8%Gln(Ⅲ组)。Ⅰ组、Ⅱ组和Ⅲ组饲粮中分别添加0.660 1%、0.416 1%和0.172 6%的丙氨酸维持氮平衡。整个试验共持续21 d,其中预试期3 d。
1.3 基础饲粮和饲养管理试验用基础饲粮组成及营养水平见表 1。试验在全封闭猪舍进行,试验前对猪舍进行消毒,采用单栏饲喂,自由采食和饮水,其他饲养管理措施、驱虫及免疫接种按猪场常规程序进行。
|
|
表 1 基础饲粮组成及其营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验期第15天清晨从每组随机抽取5头试验猪于前腔静脉采血10 mL,静置1 h后于4 ℃、3 000 r/min离心8 min,取血清置于-20 ℃下保存。采血后,每组随机屠宰5头试验猪,测量胸腺、肝脏、脾脏、空肠和回肠重量及空肠和回肠长度。取空肠和回肠中段约1 cm的肠壁2段,用0.9%氯化钠(NaCl)溶液将其冲洗干净,贴于滤纸上展平修剪,放入10%的福尔马林中固定。在空肠和回肠处用载玻片轻轻刮取黏膜,用无菌铝箔包好后,编号,迅速置于液氮,然后于-80 ℃保存。
1.5 测定指标及方法 1.5.1 生长性能的测定根据以下公式计算生长性能:
平均日增重(g/d,ADG)=全期增重(g)/试验天数(d);
平均日采食量(g/d,ADFI)=全期采食量(g)/试验天数(d);
料重比(F/G)=全期采食量(g)/全期增重(g)。
1.5.2 腹泻指数的测定每日固定时间观察各组仔猪的粪便情况,按正常、稀软、黏稠、水样4个等级进行划分,分别以0、1、2、3分表示,具体参考Castillo等[6]的方法,最后计算各组腹泻指数,该指数越高,代表腹泻越严重。
腹泻指数=试验期粪便评分之和/供试猪总头数。
1.5.3 器官指数的测定根据以下公式计算器官指数:
肝脏指数(g/kg)=肝脏湿重(g)/猪活体重(kg);
脾脏指数(g/kg)=脾脏湿重(g)/猪活体重(kg);
肾脏指数(g/kg)=肾脏湿重(g)/猪活体重(kg);
空肠重量指数(g/kg)=空肠湿重(g)/猪活体重(kg);
回肠重量指数(g/kg)=回肠湿重(g)/猪活体重(kg);
空肠长度指数(cm/kg)=空肠长度(cm)/猪活体重(kg);
回肠长度指数(cm/kg)=回肠长度(cm)/猪活体重(kg)。
1.5.4 血清指标的测定采用南京建成生物工程研究所的相应试剂盒按照说明书测定血清中生化[钙离子(Ca2+)、总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)、尿素氮(UN)、总胆红素(TBil)、肌酐(Cr)浓度和碱性磷酸酶(AKP)、谷草转氨酶(AST)、谷丙转氨酶(ALT)、乳酸脱氢酶(LDH)、肌酸激酶(CK)活性]、脂类[总胆固醇(TC)、甘油三酯(TG)浓度]和抗氧化指标[超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)、过氧化氢酶(CAT)、一氧化氮合酶(NOS)活性,丙二醛(MDA)、一氧化氮(NO)含量,总抗氧化能力(T-AOC)与超氧阴离子自由基(O2-·)清除能力]。用4%磺基水杨酸2倍稀释血清氨基酸样品,16 000 r/min离心2 min,用0.22 μm滤膜过滤后使用日立L-8800型全自动氨基酸分析仪分析血清氨基酸组成。1)分离柱:4.6 mm×60 mm,洗脱液流速0.4 mL/min,柱温70 ℃,柱压10.627 MPa;2)反应柱:茚三酮及茚三酮缓冲液流速0.35 mL/min,柱温135 ℃,柱压0.982 MPa。样品分析周期53 min。
1.5.5 肠道黏膜形态的测定肠道黏膜形态的测定参照Wang等[7]的方法进行,程序如下:从固定液中取出样品,乙醇脱水,二甲苯透明,石蜡包埋,制作5 mm厚切片,苏木精-伊红(HE)染色后显微镜下观察。利用OPTPro图像处理软件进行绒毛高度(VH)和隐窝深度(CD)等空肠黏膜形态学指标的测定,双盲法读片,每张切片取5个视野进行观察。
1.5.6 肠道黏膜β-连环蛋白(β-catenin)和再生胰岛衍生蛋白-3γ(Reg-3γ)基因表达的测定取-80 ℃保存的空肠和回肠黏膜分别置于冰上,用已灭菌的剪刀将空肠和回肠黏膜剪细,倒入液氮充分研磨(防止空肠和回肠组织升温失活),待研磨均匀后将粉末状空肠和回肠黏膜装入EP管内。用Total RNA Extractor提取空肠和回肠黏膜mRNA,已提取的空肠和回肠黏膜mRNA用MMLV First Strand cDNA Synthesis Kit(生工生物工程股份有限公司)进行反转录得到cDNA。根据GenBank中猪的甘油醛-3-磷酸脱氢酶(GAPDH)、β-catenin和Reg-3γ mRNA序列,取保守区域设计GAPDH(上游引物:GAAGGT CGGAGTGAACGGAT,下游引物:CATGGGTAGAATCATACTGGAACA)、β-catenin(上游引物:CACGACCACA GCT CCTTCT,下游引物:GACACGAAGGATGCCTCAGC)和Reg-3γ(上游引物:GATTCCCCAGCAGACACGC,下游引物:GACACGAA GGATGCCTCAGC)引物,所有的引物至少跨越1个内含子,引物由生工生物工程股份有限公司合成。Trizol和荧光定量PCR试剂及SYBR Green Ⅰ均购自Invitrogen公司。荧光定量PCR反应体系总体积为25 μL,其中包括Hotstart Fluo-PCR mix 12 μL,上、下游引物(25 μmol/L)各1 μL,cDNA 1 μL,ddH2O 10 μL。荧光定量PCR的反应条件为:94 ℃预变性4 min,94 ℃变性30 s,63 ℃退火30 s,72 ℃延伸30 s,共35个循环。每个样品设3个重复。以GAPDH为内参基因,采用比较Ct法进行目的基因相对表达量的计算。

|
式中:2-△△Ct表示试验组目的基因的表达相对于对照组的变化倍数。
1.6 数据处理试验数据用Excel 2013进行整理,采用SAS 9.0软件进行方差分析,差异显著时采用LSD法进行多重比较。P < 0.05为差异显著。
2 结果与分析 2.1 生长性能与经济效益由表 2可知,与CON组相比,Ⅰ组、Ⅱ组和Ⅲ组的平均日增重分别提高了4.96%(P < 0.05)、12.84%(P < 0.05)和7.54%(P < 0.05),平均日采食量分别提高了1.14%(P>0.05)、4.33%(P < 0.05)和1.28%(P>0.05),料重比分别降低了4.64%(P < 0.05)、8.25%(P < 0.05)和6.19%(P < 0.05),表明各复合组断奶仔猪的生长性能均有不同程度的提高,其中Ⅱ组效果最好。目前,国内市场Tau的价格约为90元/kg,Gln的价格约为180元/kg,断奶仔猪的价格约为22元/kg,基础饲粮价格约为5.5元/kg。早期断奶仔猪饲粮中添加0.1%Tau替代0.6%、0.4%和0.2%Gln后日均纯利润分别提高了30%(P < 0.05)、42%(P < 0.05)和26%(P < 0.05)。
|
|
表 2 Tau替代部分Gln对早期断奶仔猪生长性能与经济效益的影响 Table 2 Effects of partial replacement of Gln by Tau on growth performance and economic benefit of early-weaned piglets |
由表 3可知,各组脾脏指数、空肠长度指数和回肠长度指数差异不显著(P>0.05)。Ⅱ组肝脏指数、胸腺指数、空肠重量指数和回肠重量指数均显著高于其他组(P < 0.05),Ⅰ组、Ⅲ组和CON组之间差异不显著(P>0.05)。
|
|
表 3 Tau替代部分Gln对早期断奶仔猪器官指数的影响 Table 3 Effects of partial replacement of Gln by Tau on organ indexes of early-weaned piglets |
由表 4可知,除血清ALB浓度与AST和AKP活性存在差异显著(P < 0.05)外,各组其他血清指标均差异不显著(P>0.05)。血清ALB浓度表现为Ⅱ组和Ⅲ组显著高于CON组(P < 0.05),Ⅰ组显著低于CON组(P < 0.05),Ⅱ组和Ⅲ组差异不显著(P>0.05)。与CON组相比,Ⅰ组、Ⅱ组和Ⅲ组血清AST活性显著降低(P < 0.05),其中Ⅱ组、Ⅲ组降低效果较明显。Ⅱ组血清AKP活性显著高于其他组(P < 0.05),其他3个组之间差异不显著(P>0.05)。
|
|
表 4 Tau替代部分Gln对早期断奶仔猪血清生化指标的影响 Table 4 Effects of partial replacement of Gln by Tau on serum biochemical indexes of early-weaned piglets |
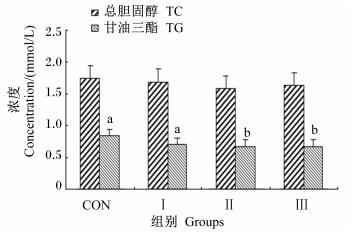
由图 1可知,各组血清TC浓度差异不显著(P>0.05),但与CON组相比,3个复合组血清TC浓度有下降趋势。Ⅱ组和Ⅲ组血清TG浓度显著低于CON组和Ⅰ组(P < 0.05),且Ⅱ组和Ⅲ之间差异不显著(P>0.05)。
|
数据柱标注不同小写字母表示差异显著(P < 0.05)。下图同。 Value columns with different small letters mean significant difference (P < 0.05). The same as below. 图 1 Tau替代部分Gln对早期断奶仔猪血清脂类指标的影响 Fig. 1 Effects of partial replacement of Gln by Tau on serum lipid indexes of early-weaned piglets |
由表 5可知,与CON组相比,Ⅰ组、Ⅱ组和Ⅲ组血清SOD活性显著升高(P < 0.05),各复合组之间差异不显著(P>0.05)。Ⅱ组血清CAT活性显著高于其他组(P < 0.05),且其他3个组之间差异不显著(P>0.05)。Ⅱ组血清超氧阴离子自由基清除能力和T-AOC显著高于CON组(P < 0.05),Ⅰ组和Ⅱ组与CON组相比也有提高的趋势,但差异不显著(P>0.05)。与CON相比,Ⅰ组、Ⅱ组和Ⅲ组血清MDA浓度分别降低了4.39%、3.41%和4.88%,但差异均不显著(P>0.05)。
|
|
表 5 Tau替代部分Gln对早期断奶仔猪血清抗氧化指标的影响 Table 5 Effects of partial replacement of Gln by Tau on serum antioxidant indexes of early-weaned piglets |
由表 6可知,各组血清色氨酸(Try)、脯氨酸(Pro)和酪氨酸(Tyr)浓度差异不显著(P>0.05)。与CON组相比,各复合组血清必需氨基酸(EAA)中的赖氨酸(Lys)、蛋氨酸(Met)、精氨酸(Arg)、半胱氨酸(Cys)、组氨酸(His)、异亮氨酸(Ile)、苯丙氨酸(Phe)、缬氨酸(Val)和苏氨酸(Thr)浓度均有不同程度的升高,其中,Ⅱ组和Ⅲ组升高趋势较明显,除Ⅱ组血清Ile浓度外,其他指标Ⅱ组和Ⅲ组与CON组的差异均达到显著水平(P < 0.05)。与CON组相比,各复合组血清非必需氨基酸(NEAA)中丙氨酸(Ala)、天冬氨酸(Asp)、谷氨酸(Glu)和甘氨酸(Gly)浓度均有不同程度的升高,其中Ⅲ组升高趋势最明显,上述各指标与CON组的差异均达到显著水平(P < 0.05)。
|
|
表 6 Tau替代部分Gln对早期断奶仔猪血清氨基酸组成的影响 Table 6 Effects of partial replacement of Gln by Tau on serum amino acid composition of early-weaned piglets |
由表 7可知,各复合组回肠VH均显著高于CON组(P < 0.05),且Ⅱ组和Ⅲ组显著高于Ⅰ组(P < 0.05),Ⅱ组和Ⅲ组之间差异不显著(P>0.05)。空肠和回肠CD各组之间差异不显著(P>0.05)。与CON组相比,Ⅰ组、Ⅱ组、Ⅲ组空肠VH分别提高了4.29%、7.47%和7.58%,空肠VH/CD分别提高了6.00%、13.33%和8.67%,回肠VH/CD分别提高了12.50%、12.50%和8.59%,但差异均不显著(P>0.05)。
|
|
表 7 Tau替代部分Gln对早期断奶仔猪肠道黏膜形态的影响 Table 7 Effects of partial replacement of Gln by Tau on intestinal mucosa morphology of early-weaned piglets |
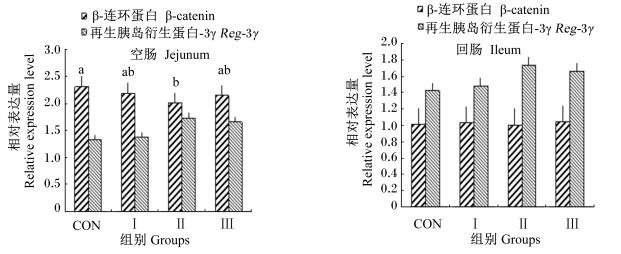
由图 2可知,Ⅱ组空肠β-catenin基因的相对表达量低于其他各组,且与对照组的差异达到显著水平(P < 0.05);与CON组相比,Ⅰ组和Ⅲ组空肠β-catenin基因的相对表达量与CON组相比有降低趋势,但差异不显著(P>0.05)。各组回肠β-catenin基因的相对表达量无显著差异(P>0.05)。与CON组相比,Ⅰ组、Ⅱ组、Ⅲ组空肠Reg-3γ基因的相对表达量分别提高了3.01%、18.45%和9.02%,回肠Reg-3γ基因的相对表达量分别提高了4.23%、21.83%和16.91%,但差异均未达到显著水平(P>0.05)。
|
图 2 Tau替代部分Gln对早期断奶仔猪肠道β-catenin和Reg-3γ基因相对表达量的影响 Fig. 2 Effects of partial replacement of Gln by Tau on relative expression levels of intestinal β-catenin and Reg-3γ genes of early-weaned piglets |
本研究发现与1.0% Gln组相比,0.1% Tau+0.6% Gln组日均纯利润分别提高42%。邹晓庭[8]研究发现,在28日龄断奶仔猪饲粮中添加1.0% Gln对提高仔猪生长性能效果最佳,当Gln添加量达到1.5%时,影响仔猪采食量。Gln与其他营养物质配合使用更有益其生物学活性的发挥。张金秋等[9]研究发现,0.1%Tau添加量组与空白对照组以及0.01%和1.00%添加量组相比,在提高蛋鸡成活率和平均产蛋率方面效果最明显。张建斌等[10]研究发现,与0.1%Tau组相比,0.25%甘氨酰谷氨酰胺(Gly-Gln)+0.1%Tau组对提高断奶仔猪的生产性能和减少腹泻率的效果更好,可能的原因是此添加比例下Gly-Gln和Tau在仔猪腹泻方面存在协同作用。本试验中,在早期断奶仔猪生长性能方面,随Gln浓度增加呈现先正效应后负效应的变化规律,即Gln与Tau在一定浓度下存在协调作用,而随着Gln浓度的增加,两者又出现拮抗作用,因此也可以推测随着Gln添加量的进一步加大,其拮抗作用更大,更不利于断奶仔猪生长性能的提高。Wu等[11]研究发现,在21日龄断奶仔猪的饲粮中添加1.0%Gln能显著提高断奶第7天的空肠绒毛高度,防止空肠萎缩。本试验中,在早期断奶仔猪肠道发育方面,Tau替代部分Gln能够显著提高空肠绒毛高度。刘涛[12]研究发现,在断奶仔猪中添加0.7%、1.0%和1.3%的Gln能显著提高第5天小肠绒毛膜中分泌型免疫球蛋白A(SIgA)阳性细胞的数量,提高白细胞介素-6(IL-6)基因的表达量,促进肠道局部免疫功能的正常。
Tau具有调节细胞内Ca2+稳态和抗脂质过氧化损伤等广泛的生物学效应,通过抑制肠道内毒素位移缓解仔猪肠道断奶应激,促进肠道相关基因表达,Tau还可通过降低肠道氧化应激保护肠黏膜,从而保护肠道完整性[13]。Tau提高断奶仔猪免疫器官指数的可能原因如下:Tau可以与次氯酸(HClO)发生反应,形成较稳定的氯化牛磺酸,从而清除HClO的氧化作用,使免疫器官的细胞免受攻击;Tau提高断奶仔猪采食量,提高了与免疫器官发育相关的矿物质营养元素的摄取,促进免疫器官发育;Tau降低了机体内免疫应激水平,缓解免疫器官损伤。
3.2 Tau替代部分Gln对早期断奶仔猪血清抗氧化与生化指标的影响本试验结果表明,早期断奶仔猪饲粮中添加0.1%Tau替代0.4%Gln显著提高了血清中SOD、CAT活性以及超氧阴离子自由基清除能力和T-AOC。Winiarska等[14]研究表明,Tau可提高兔血清及肝脏中SOD和GSH-Px活性,提高机体的抗氧化能力,降低血清中MDA的浓度,具有直接和间接的抗氧化作用。王芙蓉等[15]报道,饲粮中添加Tau可降低产蛋鹌鹑血清MDA的浓度,说明Tau具有减少过氧化脂质、提高机体抗氧化功能的作用。王洁[16]报道,给大鼠腹腔连续注射3 d 0.1%Tau能显著升高血清中SOD活性,降低心肌肌钙蛋白I(cTnI)含量及肌酸激酶同工酶(CK-MB)活性,并降低血清MDA含量,说明其能减少自由基生产,抗氧化损伤,与本研究结果类似。
本试验中,在早期断奶仔猪饲粮中添加0.1%Tau替代0.4% Gln显著降低了血清中ALB、AST、Ca2+、TC浓度和AKP活性。在应激状态下,Tau能够调节细胞膜Ca2+通道,促进胞内Ca2+外流,增加血清中Ca2+的浓度[17]。Ca2+浓度升高还可能与血清ALB浓度的增加有关,因为Ca2+能够与血清ALB结合,当机体在应激状态下细胞内Ca2+浓度升高时,血清ALB作为Ca2+载体,与Ca2+结合并将其运出胞外,维持细胞Ca2+平衡[18]。血清AST活性变化与断奶时生理、环境应激有关,正常情况下,以肝脏和心肌细胞中活性最高,血清中AST的活性很低。断奶时仔猪的采食量下降,造成机体损伤,细胞膜受损,AST从肝脏、心肌和骨骼肌细胞中逸出,致使血清AST活性升高[19]。Tau能提高机体抗氧化性能,降低细胞膜脂质反应水平,从而保护细胞膜的完整性,减少AST从组织细胞逸出量。AKP能加速物质的摄取和转运,为二磷酸腺苷(ADP)磷酸化为三磷酸腺苷(ATP)提供更多的无机磷酸;AKP还与动物体内骨的钙化有关,具有高度的成骨作用[20]。Tau能在一定程度上平衡断奶仔猪骨骼营养,抑制成骨细胞活性,获得适宜的骨骼矿化,促进骨骼生长。
本试验结果表明,在早期断奶仔猪饲粮中添加0.1%Tau替代0.4%Gln显著提高了血清EAA中Lys、Met、Arg、Cys和Leu的浓度。Leu和Lys浓度的增加可能与血清ALB浓度的增加有关,因为ALB是肝脏中合成的一种重要蛋白质,是反映动物营养状况的重要指标,主要由Leu和Lys等氨基酸构成,ALB浓度的增加常常伴随着Leu和Lys浓度的增加[21]。郑萍等[22]报道,在氧化应激状态下,组织代谢需要更多的氨基酸,这增强了组织对血浆游离氨基酸的吸收,使得断奶仔猪血清中Met、Arg和Cys浓度显著降低。本试验中仔猪血清中Met、Arg和Cys浓度增加可能是因为Tau降低了仔猪机体的氧化应激,组织对血清游离氨基酸的吸收降低,从而使得血清中Met、Arg和Cys的浓度增加。本试验还发现,在早期断奶仔猪饲粮中添加0.1%Tau替代0.4%Gln显著降低了血清NEAA中Ala、Gly和Pro的浓度。血清中Ala和Gly浓度降低的原因可能是仔猪在断奶应激状态下组织代谢需要更多的氨基酸,增强了组织对血清游离氨基酸的吸收,而Tau与Ala和Gly的代谢无关[23]。而Pro作为Arg代谢的产物,其在血清中的浓度受Arg合成量的影响,本试验中血清Arg浓度显著升高,导致Arg的代谢产物浓度降低,Pro的浓度随之降低[24]。
3.3 Tau替代部分Gln对早期断奶仔猪肠道β-catenin基因表达的影响断奶使仔猪肠道黏膜遭受严重损伤,小肠形态发生明显变化,出现严重变形和萎缩。肠黏膜受损后,肠道上皮干细胞沿隐窝绒毛轴分化为成熟细胞,取代受损脱落和凋亡的成熟细胞。肠黏膜损伤后修复是在多种信号分子构成的网络调控下进行的[25]。Wnt/β-catenin信号通路在肠黏膜损伤后的修复中起重要作用。β-catenin基因的相对表达量在一定程度上能反映肠道上皮损伤后修复情况和修复程度。Tau降低β-catenin基因的相对表达量可能与Tau能够提高机体抗氧化性有关[26]。本研究表明,Tau能够提高早期断奶仔猪血清SOD和GSH-Px的活性,降低MDA浓度。田黎明[27]研究发现,β-catenin基因的相对表达量在过氧化氢(H2O2)所诱导的人成纤维细胞的氧化模型中显著提高,抑制Wnt/β-catenin信号通路能够降低机体氧化应激反应。Tau通过降低机体内H2O2的浓度,从而影响Wnt/β-catenin信号通路的激活,β-catenin从复合物中释放量降低,β-catenin基因的表达量也随之降低。Tau还能通过降低肿瘤坏死因子-α(TNF-α)的含量影响β-catenin基因的表达[28]。范正伟[29]研究发现,TNF-α通过与细胞膜上受体结合,进入细胞基质,维持β-catenin不被降解而进去细胞核,从而激活Wnt/β-catenin信号通路。Tau能够降低机体TNF-α的含量,从而减少对Wnt/β-catenin信号通路的激活,使β-catenin基因的表达量降低。
4 结论① 饲粮中复合添加Tau和Gln可提高早期断奶仔猪血清ALB、氨基酸的浓度及APK、SOD、CAT的活性和T-AOC,降低血清TG浓度和AST的活性,同时提高回肠VH,降低空肠β-catenin基因的相对表达量,其中以0.1%Tau+0.6%Gln组效果最佳。
② 复合添加Tau和Gln效果优于单独添加Gln的原因在于:Tau和Gln都是断奶仔猪的条件性必需氨基酸,Gln作为肠道的主要能源物质促进肠道发育,Tau作为抗氧化剂降低肠道氧化应激,共同促进肠道修复和发育。Gln和Tau发挥出各自的功能,体现出一定的复合效应。
| [1] |
MONTAGNE L, BOUDRY G, FAVIER C, et al. Main intestinal markers associated with the changes in gut architecture and function in piglets after weaning[J]. British Journal of Nutrition, 2007, 97(1): 45-57. DOI:10.1017/S000711450720580X |
| [2] |
CABRERA R A, LIN X, CAMPBELL J M, et al. Influence of birth order, birth weight, colostrum and serum immunoglobulin G on neonatal piglet survival[J]. Journal of Animal Science and Biotechnology, 2012, 3(1): 42. DOI:10.1186/2049-1891-3-42 |
| [3] |
CAMPBELL J M, CRENSHAW J D, POLO J. The biological stress of early weaned piglets[J]. Journal of Animal Science and Biotechnology, 2013, 4(1): 19. DOI:10.1186/2049-1891-4-19 |
| [4] |
田莉莉, 李丽. 牛磺酸对肉仔鸡生产性能和消化功能的影响[J]. 饲料研究, 2012(3): 21-22. |
| [5] |
蒋宗勇, 郑卫川, 林映才, 等.谷氨酰胺对人工饲养新生仔猪生长性能及血液激素水平的研究[C]//中国畜牧兽医学会养猪学分会2009年学术年会"回盛生物"杯全国养猪技术论文大赛论文集.北京: 中国畜牧兽医学会养猪学分会, 2009. http://d.old.wanfangdata.com.cn/Conference/7180030
|
| [6] |
CASTILLO M, MARTIN-ORUE S M, GASA T J, et al. Use of mannan-oligosaccharides and zinc chelate as growth promoters and diarrhea preventative in weaning pigs:effects on microbiota and gut function[J]. Journal of Animal Science, 2008, 86(1): 94-101. DOI:10.2527/jas.2005-686 |
| [7] |
WANG W C, GU W T, TANG X F, et al. Molecular cloning, tissue distribution and ontogenetic expression of the amino acid transporter b0, + cDNA in the small intestine of Tibetan suckling piglets[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2009, 154(1): 157-164. DOI:10.1016/j.cbpb.2009.05.014 |
| [8] |
邹晓庭.谷氨酰胺对断奶仔猪生长、免疫的影响及其机理研究[D].博士学位论文.杭州: 浙江大学, 2007: 53. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1714190
|
| [9] |
张金秋, 马子力, 韩立秋, 等. 牛磺酸对绿壳蛋鸡生长性能和健康状况相关指标的影响[J]. 南京农业大学学报, 2014, 37(3): 145-151. |
| [10] |
张建斌, 车向荣, 陈娟娟. 谷氨酰胺和牛磺酸对断奶仔猪生产性能的影响[J]. 饲料研究, 2010(7): 9-11. |
| [11] |
WU G, MEIER S A, KNABE D A. Dietary glutamine supplementation prevents jejunal atrophy in weaned pigs[J]. The Journal of Nutrition, 1996, 126(10): 2578-2584. DOI:10.1093/jn/126.10.2578 |
| [12] |
刘涛.谷氨酰胺对早期断奶仔猪肠道营养与免疫功能影响机理的研究[D].博士学位论文.武汉: 华中农业大学, 2002: 68-70. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y468778
|
| [13] |
王建军.牛磺酸对不完全性肠梗阻大鼠肠屏障保护作用的研究[D].硕士学位论文.天津: 天津医科大学, 2008: 47-48. http://cdmd.cnki.com.cn/Article/CDMD-11904-2008168390.htm
|
| [14] |
WINIARSKA K, SZYMANSKI K, GORNIAK P, et al. Hypoglycaemic, antioxidative and nephroprotective effects of taurine in alloxan diabetic rabbits[J]. Biochimie, 2009, 91(2): 261-270. DOI:10.1016/j.biochi.2008.09.006 |
| [15] |
王芙蓉, 佟建明, 张晓鸣, 等. 牛磺酸对鹌鹑生产性能、免疫功能及抗氧化能力的影响[J]. 食品与生物技术学报, 2011, 30(2): 190-193. |
| [16] |
王洁. 牛磺酸预处理对大鼠心肌梗死的保护作用[J]. 中国药理学通报, 2012(5): 647-650. DOI:10.3969/j.issn.1001-1978.2012.05.013 |
| [17] |
KATSUBE Y, SPERELAKIS N. Na+/Ca2+ exchange current:lack of effect of taurine[J]. European Journal of Pharmacology, 1996, 316(1): 97-103. |
| [18] |
LAKSHMI DEVI S, ANURADHA C V. Mitochondrial damage, cytotoxicity and apoptosis in iron-potentiated alcoholic liver fibrosis:amelioration by taurine[J]. Amino Acids, 2010, 38(3): 869-879. DOI:10.1007/s00726-009-0293-0 |
| [19] |
OLIVEIRA M W S, MINOTTO J B, DE OLIVEIRA M R, et al. Scavenging and antioxidant potential of physiological taurine concentrations against different reactive oxygen/nitrogen species[J]. Pharmacological Reports, 2010, 62(1): 185-193. DOI:10.1016/S1734-1140(10)70256-5 |
| [20] |
JANKOVIC A, KORAC Z, BOZIC N B, et al. Influence of knee flexion and atraumatic mobilisation of infrapatellar fat pad on incidence and severity of anterior knee pain after tibial nailing[J]. Injury, 2013, 44(Suppl.3): S33-S39. |
| [21] |
DAI Z L, ZHANG J, WU G Y, et al. Utilization of amino acids by bacteria from the pig small intestine[J]. Amino Acids, 2010, 39(5): 1201-1215. DOI:10.1007/s00726-010-0556-9 |
| [22] |
郑萍, 余冰, 田刚, 等. 精氨酸对氧化应激仔猪生长性能和血浆游离氨基酸浓度的影响[J]. 中国畜牧杂志, 2012, 48(21): 38-42. DOI:10.3969/j.issn.0258-7033.2012.21.011 |
| [23] |
LI X L, REZAEI R, LI P, et al. Composition of amino acids in feed ingredients for animal diets[J]. Amino Acids, 2011, 40(4): 1159-1168. DOI:10.1007/s00726-010-0740-y |
| [24] |
MURPHY J M, MURCH S J, BALL R O. Proline is synthesized from glutamate during intragastric infusion but not during intravenous infusion in neonatal piglets[J]. The Journal of Nutrition, 1996, 126(4): 878-886. DOI:10.1093/jn/126.4.878 |
| [25] |
IRELAND H, KEMP R, HOUGHTON C, et al. Inducible Cre-mediated control of gene expression in the murine gastrointestinal tract:effect of loss of β-catenin[J]. Gastroenterology, 2004, 126(5): 1236-1246. DOI:10.1053/j.gastro.2004.03.020 |
| [26] |
PINTO D, GREGORIEFF A, BEGTHEL H, et al. Canonical Wnt signals are essential for homeostasis of the intestinal epithelium[J]. Genes Development, 2003, 17(14): 1709-1713. DOI:10.1101/gad.267103 |
| [27] |
田黎明.β-catenin抗氧化应激所致人皮肤成纤维细胞衰老的机制研究[D].博士学位论文.长沙: 中南大学, 2011: 2. http://med.wanfangdata.com.cn/Paper/Detail/DegreePaper_Y1918256
|
| [28] |
KUHNERT F, DAVIS C R, WANG H T, et al. Essential requirement for Wnt signaling in proliferation of adult small intestine and colon revealed by adenoviral expression of Dickkopf-1[J]. Proceedings of the National Academy of Sciences of the United States of America, 2004, 101(1): 266-271. DOI:10.1073/pnas.2536800100 |
| [29] |
范正伟.探讨TNF-α与Wnt/β-catenin信号通路在小鼠原代前脂肪分化过程中相互作用机制[D].硕士学位论文.济南: 山东师范大学, 2013: 6-8. http://cdmd.cnki.com.cn/Article/CDMD-10445-1013216194.htm
|




