宿主防御肽(host defense peptides,HDPs)又称抗菌肽(antimicrobial peptides,AMPs)是能有效杀灭病原体的小分子多肽,作为先天免疫成分之一,在机体抵抗病原体入侵方面起着重要作用。根据分子结构特征,HDPs主要分为二大类:防御素(defensin)和抗菌肽(cathelicidin)[1]。HDPs能够识别和杀死入侵病原体,并激发免疫防御。奶牛乳房炎是一种多因素导致的奶牛常见疾病,严重影响奶牛养殖业的健康发展。目前奶牛乳房炎的预防与治疗主要依赖抗生素,由于公众对健康问题的极度关注,抗生素在动物体内的残留及耐药性的问题越来越受到人们的重视[2]。Stevens等[3]研究表明,奶牛乳房炎的复发率与抗生素的用量呈正相关,牛奶中的体细胞数(SCC)与抗生素残留量呈正相关。在美国,大部分用于治疗奶牛乳房炎的抗生素未能获得批准,氟喹诺酮类抗生素、大环内酯类抗生素、第三代头孢菌素、第四代头孢菌素以及糖肽已经被明令限制使用,只能严格按照适应症条件用于特定的病例[4]。在德国,奶牛在干奶期治疗时,强制要求严格筛选抗生素[5]。如何有效治疗奶牛乳房炎一直困扰着全世界的奶农们[6],因此,亟需抗生素替代品治疗奶牛乳房炎。
1 HDPs在先天免疫系统中的作用先天性免疫系统是抵抗病原微生物感染的第1道防线。当病原体侵入家畜的乳腺、消化道和生殖道后,迅速激活动物机体的先天免疫系统细胞和腺体分泌多种HDPs,如唾液腺分泌富组蛋白、潘氏细胞分泌α-防御素、胰腺分泌β-防御素和牛乳腺上皮细胞产生乳清蛋白。奶牛乳房炎是由病原微生物破坏乳头管乳腺屏障侵入乳房内而引发的一系列炎症反应[7],动物机体受病原菌感染后会释放大量的炎性介质,如白细胞介素、肿瘤坏死因子、干扰素等,它们能趋化体内免疫细胞在炎症处聚集,进而杀灭病原菌。同时,动物机体也会动员先天免疫系统分泌一系列HDPs来抵抗病原体的入侵。任何体液免疫和细胞免疫分泌可溶性蛋白编码的基因都显示出多态性或发生突变,导致等位基因互换,进而出现不同功能的肽。HDPs可以通过参与机体的免疫调节起到抗细菌感染的作用(图 1),通过诱导细胞因子的分泌、抑制由内毒素(LPS)引起的炎症反应、激活免疫细胞3种方式参与机体的免疫调节。总之,HDPs作为先天免疫的第1道防线,不但能直接杀灭细菌,还能参与到机体的免疫调节中,增强动物机体免疫力。
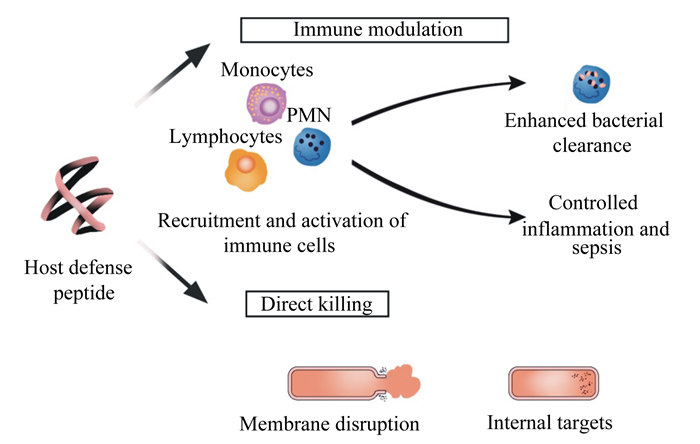
|
Immune modulation:免疫调节;Monocytes:单核细胞;Lymphocytes:淋巴细胞;PMN:多性核中性白细胞polymorphonuclear;Enhanced bacterial clearance:增强细菌清除能力;Host defense peptide:宿主防御肽;Recruitment and activation of immune cells:免疫细胞的招募和激活;Controlled inflammation and sepsis:控制炎症和败血症;Direct killing:直接杀伤;Membrane disruption:细胞膜破坏;Internal targets:内部目标。 图 1 宿主防御肽的生物学功能 Fig. 1 Biological roles of host defense peptides |
抗菌肽是富含赖氨酸和精氨酸并带有一定量正电荷的阳离子肽。其前体由N-端信号肽区域(约30个氨基酸残基)、高度特异的C-端成熟肽区域(12~100个氨基酸残基)及信号肽与成熟肽之间高度保守的抗菌肽区域(94~114个氨基酸残基)3部分构成[8]。抗菌肽区域的相对分子质量约为11 000,末端具有4个保守的半胱氨酸残基,形成2对二硫键,具有稳定抗菌肽分子结构的作用[8]。根据抗菌肽的二级结构可以将其分为4类:α-螺旋抗菌肽、延伸螺旋抗菌肽、环状抗菌肽和β-片层抗菌肽。
2.1.2 抗菌肽的分布表达牛源抗菌肽主要有以下3种:牛骨髓抗菌肽(BMAPs)属于α-螺旋抗菌肽,其家族包含BMAP-27、BMAP-28和BMAP-34;牛抗菌肽(Bac)是从牛中性粒细胞中分离得到的延伸螺旋抗菌肽,且富含精氨酸,该家族由Bac1、Bac5和Bac7组成;Indolicidin因含有特殊的氨基酸组成,不易形成α-螺旋构型,而折叠成更细长的结构,属于延伸螺旋抗菌肽,到目前为止它是已知的最小的天然线性HDPs[9]。
Whelehan等[10]研究表明,在40%患乳房炎的奶牛中,除Indolicidin以外,所有类型的抗菌肽均有表达,而其他情况仅有几种类型的抗菌肽出现表达。Varshney等[11]研究表明,抗菌肽在泌乳早期[产后(25±5) d]没有表达,在中期[(160±15) d]检测到其表达量上调,而在晚期[(275±25) d]呈现下调趋势。在产奶高峰期,较高的抗菌肽表达量反映出奶牛存在乳房感染的风险。Uhlar等[12]研究表明,在第1次和第2次泌乳期间BMAP-28的表达量高于第3次和第4次,相比之下,BMAP-27的表达量在第4次泌乳期呈上调趋势。因此,在不同的泌乳阶段,奶牛乳房中抗菌肽的表达量也会有所不同。
牛乳房炎是由多种致病菌引起的,包括金黄色葡萄球菌、大肠杆菌、无乳链球菌、克雷伯菌属、停乳链球菌及牛支原体等。通过蛋白质组学研究证实了患乳房炎奶牛的牛奶中有抗菌肽表达,并在感染无乳链球菌奶牛的牛奶中发现有Bac1表达[13]。同样,Ibeagha-Awemu等[14]试验表明,感染大肠杆菌和金黄色葡萄球菌后均能促进Bac1、Bac5和Indolicidin的表达,其中Bac1呈现出较高的表达量。Isobe[15]研究发现,大肠杆菌能够诱导多种抗菌肽的表达,包括Bac1、Bac5、Bac7和Indolicidin,由此可以看出临床乳房炎的严重程度与牛奶中抗菌肽的分泌有关。Yang等[16]研究表明轻度感染大肠杆菌奶牛的牛奶中Bac1的表达量上调,而在严重感染大肠杆菌的情况下,Bac1和Bac5的表达量均上调。蛋白质组学分析也证实LPS刺激奶牛的乳房后牛奶中抗菌肽合成增加,在LPS刺激后的4 h内能迅速检测到Bac1、Bac5、Bac7和Indolicidin的表达[17-18]。这些结果表明多种抗菌肽是乳房炎的关键免疫效应物。
牛嗜中性粒细胞能够产生一系列的抗菌肽。Tomasinsig等[19]对体外培养的牛中性粒细胞进行基因组分析发现,细胞受LPS诱导产生了BMAP-27、BMAP-28和Bac5。抗菌肽在乳腺组织中的表达与不同的病原体有关[20]。在凝固酶阳性和阴性葡萄球菌感染的奶牛乳腺组织中,Indolicidin和BMAP-28的表达量均下降。在感染凝固酶阴性葡萄球菌的乳腺组织中,BMAP-27的表达量呈上调趋势[21]。同样,在健康奶牛中,尽管被金黄色葡萄球菌感染后抗菌肽的表达量没有升高,但BMAP-28在乳腺的所有区域均有表达[10]。Ibeagha-Awemu等[14]研究表明,大肠杆菌和金黄色葡萄球菌刺激牛乳腺上皮细胞(BMECs)后,Bac1和Indolicidin的表达量均增加,这表明乳腺中抗菌肽的来源广泛并具有病原体特异性。Tomasinsig等[19]试验表明,在乳球菌培养基中,患乳房炎奶牛的牛奶中BMAP-27、BMAP-28、Bac5和Indolicidin均表现出一定的杀菌作用,但只有BMAP-27在牛血清和乳清中具有抗菌活性,这些抗菌肽在健康牛奶中没有表现出抗菌作用。当检测来自临床乳房炎的牛奶时发现BMAP-27和BMAP-28抑制大肠杆菌生长[19]。此外,这些肽诱导了BMECs中肿瘤坏死因子-α(TNF-α)基因的表达量[19]。
2.2 防御素 2.2.1 防御素的分子结构特征防御素是广泛分布于生物界的一类富含精氨酸和半胱氨酸残基的阳离子内源性HDPs,其分子结构具有亲水和亲脂两重性。防御素家族是一种由β-折叠结构组成的带正电荷的多肽,β-折叠结构由半胱氨酸残基形成分子内二硫键来固定,根据防御素分子内半胱氨酸的位置、连接方式、前体性质及表达位置的差异,可分为α-防御素、β-防御素和θ-防御素。其中β-防御素是最大的一个家族,在人类和家畜的组织内均有表达[22]。β-防御素(约10 ku)是富含半胱氨酸的HDPs,在半胱氨酸残基之间呈现出不同的半胱氨酸间距和二硫键结合模式[22]。
2.2.2 β-防御素的分布表达牛源β-防御素主要有舌抗菌肽(LAP)、气管上皮抗菌肽(TAP)及牛中性粒细胞β-防御素(DEFB1~13)。Roosen等[23]和Goldammer等[24]研究发现一些β-防御素基因在乳腺中丰富度较高,可在感染乳房炎的奶牛乳腺中诱导表达。
LAP是从发炎的鳞状舌上皮细胞中分离出来的。Swanson等[25]发现除了舌上皮细胞外,LAP在感染的肠道、呼吸道和乳腺上皮组织中也有表达。Roosen等[23]试验表明,LAP在奶牛幼龄时期、泌乳期(健康和受感染)和非泌乳期的牛乳腺组织中呈组成型表达。然而,Swanson等[25]通过注入乳房链球菌的野生型菌株感染乳房并对乳腺泡和外周组织进行分析发现LAP只在被感染的牛中有表达。此外,Kawai等[26]试验表明,感染金黄色葡萄球菌、链球菌、停乳链球菌和大肠杆菌奶牛的牛奶中LAP的表达量均高于未感染奶牛。
TAP是第1个从哺乳动物气管黏膜中分离出来的牛β-防御素[27]。Roosen等[23]从奶牛乳房中提取mRNA进行PCR检测发现TAP在患乳房炎奶牛及健康奶牛的BMECs中均有表达。用金黄色葡萄球菌人工感染奶牛乳腺过程中,发现LAP和TAP的表达量较低,其表达受Oct-1转录因子调控[28]。
β-防御素3(DEFB3)在多种类型组织中均有表达。Merriman等[29]表明在LPS刺激的牛单核细胞培养物中,DEFB3的表达量升高。β-防御素4(DEFB4)在1993年首次被报道[30],发现其在牛肺泡组织中呈较高量的组成型表达,而在小肠中其表达量较低[31]。在感染金黄色葡萄球菌的乳腺泡和乳池组织中,DEFB4的表达量较高[32]。DEFB4在感染凝固酶阳性葡萄球菌乳腺中的表达量比感染凝固酶阴性葡萄球菌的表达量要高[33-34]。
曹随忠等[35]构建了具有高消减效率的奶牛乳房炎抗性相关cDNA文库,发现β-防御素5(DEFB5)的表达量在患乳房炎奶牛的外周血白细胞中呈上调趋势。Boehmer等[36]和Overhage等[37]表明最初发现位于牛肺泡巨噬细胞中的DEFB5表达量较高,在乳房内感染期间BMECs中DEFB5的表达量更高。在感染金黄色葡萄球菌奶牛的乳腺泡、乳导管和乳池组织中,发现DEFB5的表达量要高于DEFB4[32]。Kościuczuk等[34]试验表明,在奶牛哺乳后期DEFB4和DEFB5均有较高的表达量,但在泌乳早期只有DEFB4有表达量。β-防御素10(DEFB10)在凝固酶阳性葡萄球菌感染的早期阶段的表达量高于后期阶段,而β-防御素1(DEFB1)、DEFB4、LAP和DEFB5的表达量在被凝固酶阳性葡萄球菌感染后期较高[30]。Alva-Murillo等[38]用金黄色葡萄球菌感染BMECs,DEFB10的表达量不断升高。在被牛支原体感染的情况下,DEFB10的表达量出现下降[39]。
3 HDPs在奶牛乳房炎诊断上的应用目前,通常用细菌学方法和SCC法来检测奶牛乳房炎。在荷兰,奶农们主要根据临床指征和SCC来选择抗生素进行奶牛乳房炎的预防与治疗[40]。Addis等[41]以牛奶中抗菌肽为包被物建立的酶联免疫吸附测定(ELISA)方法表现出较高的灵敏度,被感染的奶牛牛奶样品中抗菌肽的表达量升高,表明SCC与抗菌肽的表达量相关。Pongthaisong等[42]在感染无乳链球菌奶牛的奶样中检测到有Bac1表达,并且其表达量随着SCC的升高而增加。Bagnicka等[43]研究表明,奶牛的DEFB4内含子区域表现出很大程度的单核苷酸多态性,在10个单核苷酸多态性中发现有2个与乳成分及SCC相关。
HDPs作为患乳房炎奶牛牛奶的炎性介质释放标志物之一,它的表达情况与SCC相关,以HDPs为包被物建立的ELISA方法不仅能提高奶牛乳房炎检测的灵敏度,同时还能体现出该检测方法的高度特异性[44]。因此,HDPs可以用作牛乳房炎早期诊断的新型标记物并且具有良好的应用前景。
4 HDPs在奶牛乳房炎防治上的应用由于抗生素耐药性的出现,传统抗生素在家畜中的广泛使用是不可持续的。在寻找新治疗方法的过程中,研究学者们对HDPs的应用进行了大量的研究。合成的抗菌肽已经被改造成具有很强抗菌活性的肽。Bac2A是新的合成肽,它是一个长度为12个氨基酸残基的肽[46]。Bac2A来源于牛抗菌肽(bactenecin),其中2个半胱氨酸残基被2个丙氨酸残基取代并成线性结构[9]。Bac2A对革兰氏阴性菌的最小抑菌浓度(MIC)介于2~32 μg/mL,对革兰氏阳性菌的MIC介于0.25~16.00 μg/mL,表现出抗菌活性[45]。先天防御调节肽1018(IDR-1018)也是新合成的衍生肽,与Bac2A结构相似,IDR-1018的长度仅有12个氨基酸残基。IDR-1018对金黄色葡萄球菌的MIC为5 μg/mL时表现出较高的活性[46]。IDR-1018也是合成免疫调节肽之一,在20 μg/mL的浓度下,IDR-1018显著降低单核细胞中LPS诱导的TNF-α促炎反应[45]。这种特性为IDR-1018成为替代传统抗生素的理想候选者提供支持。Bac2A和IDR-1018的结构可塑性能够导致不同的杀菌活性,使得这些肽作为抗生素的治疗替代品更具吸引力。
由于从宿主有机体中分离HDPs成本极高,使得HDPs的利用受到限制,一些学者利用基因工程手段对HDPs进行外源性改造后发现其通过诱导内源HDPs的表达表现出抗菌活性,为HDPs代替抗生素成为新型的抗菌药物提供理论依据。李宏滨等[46]将DEFB5作为乳房炎抗性的候选基因,克隆DEFB5的编码区成功构建了毕赤酵母表达载体(pPICZαA/DEFB5),并利用毕赤酵母表达系统表达了DEFB5蛋白。符梅等[47]用RT-PCR方法扩增DEFB5成熟肽编码区,将DEFB5亚克隆到原核表达载体[pET-32a(+)]的BamHⅠ和XhoⅠ双酶切位点上构建重组表达质粒,将重组表达质粒转化至大肠杆菌BL21,用异丙基-β-D-硫代半乳糖苷(IPTG)进行诱导表达发现牦牛DEFB5成熟肽在大肠杆菌中成功表达,其表达产物对大肠杆菌及金黄色葡萄球菌均表现出抗性。Aghaei等[48]将密码子优化的DEFB2整个编码序列置于上游进入pET-48b(+)载体,并将密码子优化的pelB信号序列添加到DEFB2的上游用于周质定位,通过渗透休克和十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)对释放的蛋白质评估重组DEFB2的周质分选。DEFB2的周质生成成功,并表现出对一些曲霉菌的抗真菌活性及抗菌活性,成功抑制大肠杆菌和金黄色葡萄球菌的生长。Wei等[49]用醋酸钠处理金黄色葡萄球菌感染的BMECs,醋酸钠以剂量依赖方式抑制金黄色葡萄球菌诱导BMECs中的核因子-κB(NF-κB)活化,TAP及DEFB5表达量增加,表明醋酸钠通过诱导内源性HDPs的表达对金黄色葡萄球菌内化起抑制作用。
5 小结HDPs在宿主的先天防御机制中扮演着重要的角色。通过充分了解HDPs在奶牛乳腺中的分布表达情况,可以增强它们在诊断及治疗奶牛乳房炎中应用的可能性。然而,HDPs作为抗生素替代品的理想候选物之一,在奶牛乳腺上皮细胞的作用机制以及如何调控机体的免疫反应,怎样通过信号通路的调控来发挥作用,如何提高其使用效果及其安全性等方面还需要进一步研究。
| [1] |
SAHOO B R, MARUYAMA K, EDULA J R, et al. Mechanistic and structural basis of bioengineered bovine cathelicidin-5 with optimized therapeutic activity[J]. Scientific Reports, 2017, 7: 44781. DOI:10.1038/srep44781 |
| [2] |
SCHERPENZEEL C G M, DEN UIJL I E M, VAN SCHAIK G, et al. Effect of different scenarios for selective dry-cow therapy on udder health, antimicrobial usage, and economics[J]. Journal of Dairy Science, 2016, 99(5): 3753-3764. DOI:10.3168/jds.2015-9963 |
| [3] |
STEVENS M, PIEPERS S, SUPRÉ K, et al. Quantification of antimicrobial consumption in adult cattle on dairy herds in Flanders, Belgium, and associations with udder health, milk quality, and production performance[J]. Journal of Dairy Science, 2016, 99(3): 2118-2130. DOI:10.3168/jds.2015-10199 |
| [4] |
OBRITZHAUSER W, TRAUFFLER M, RAITH J, et al. Antimicrobial drug use on Austrian dairy farms with special consideration of the use of "highest priority critically important antimicrobials"[J]. Berliner und Munchener Tierarztliche Wochenschrift, 2016, 129(5/6): 185-195. |
| [5] |
KIESNER K, WENTE N, VOLLING O, et al. Selection of cows for treatment at dry-off on organic dairy farms[J]. Journal of Dairy Research, 2016, 83(4): 468-475. DOI:10.1017/S0022029916000662 |
| [6] |
SWINKELS J M, HILKENS A, ZOCHE-GOLOB V, et al. Social influences on the duration of antibiotic treatment of clinical mastitis in dairy cows[J]. Journal of Dairy Science, 2015, 98(4): 2369-2380. DOI:10.3168/jds.2014-8488 |
| [7] |
郝景锋, 李静姬, 张宇航, 等. 奶牛隐性乳房炎诊断技术研究新进展[J]. 黑龙江畜牧兽医, 2018(3): 63-65, 69. |
| [8] |
SANCHEZ J F, WOJCIK F, YANG Y S, et al. Overexpression and structural study of the cathelicidin motif of the protegrin-3 precursor[J]. Biochemistry, 2002, 41(1): 21-30. DOI:10.1021/bi010930a |
| [9] |
BOWDISH D M E, DAVIDSON D J, SCOTT M G, et al. Immunomodulatory activities of small host defense peptides[J]. Antimicrobial Agents and Chemotherapy, 2005, 49(5): 1727-1732. DOI:10.1128/AAC.49.5.1727-1732.2005 |
| [10] |
WHELEHAN C J, BARRY-REIDY A, MEADE K G, et al. Characterisation and expression profile of the bovine cathelicidin gene repertoire in mammary tissue[J]. BMC Genomics, 2014, 15: 128. DOI:10.1186/1471-2164-15-128 |
| [11] |
VARSHNEY N, MOHANTY A K, KUMAR S, et al. Selection of suitable reference genes for quantitative gene expression studies in milk somatic cells of lactating cows (Bos indicus)[J]. Journal of Dairy Science, 2012, 95(6): 2935-2945. DOI:10.3168/jds.2011-4442 |
| [12] |
UHLAR C M, WHITEHEAD A S. Serum amyloid A, the major vertebrate acute-phase reactant[J]. FEBS Journal, 1999, 265(2): 501-523. |
| [13] |
BAUMANN A, KIENER M S, HAIGH B, et al. Differential ability of bovine antimicrobial cathelicidins to mediate nucleic acid sensing by epithelial cells[J]. Frontiers in Immunology, 2017, 8(2): 59. |
| [14] |
IBEAGHA-AWEMU E M, IBEAGHA A E, MESSIER S, et al. Proteomics, genomics, and pathway analyses of Escherichia coli and Staphylococcus aureus infected milk whey reveal molecular pathways and networks involved in mastitis[J]. Journal of Proteome Research, 2010, 9(9): 4604-4619. DOI:10.1021/pr100336e |
| [15] |
ISOBE N. Control mechanisms for producing antimicrobial factors in ruminant mammary gland[J]. Animal Science Journal, 2017, 88(7): 937-943. DOI:10.1111/asj.2017.88.issue-7 |
| [16] |
YANG Y X, CAO S Z, ZHAO X W, et al. Determination of changes in bovine plasma and milk proteins during naturally occurring Escherichia coli mastitis by comparative proteomic analysis[J]. Animal Production Science, 2015, 56(11): 1888-1896. |
| [17] |
DANIELSEN M, CODREA M C, INGVARTSEN K L, et al. Quantitative milk proteomics-host responses to lipopolysaccharide-mediated inflammation of bovine mammary gland[J]. Proteomics, 2010, 10(12): 2240-2249. DOI:10.1002/pmic.v10:12 |
| [18] |
HINZ K, LARSEN L B, WELLNITZ O, et al. Proteolytic and proteomic changes in milk at quarter level following infusion with Escherichia coli lipopolysaccharide[J]. Journal of Dairy Science, 2012, 95(4): 1655-1666. DOI:10.3168/jds.2011-4813 |
| [19] |
TOMASINSIG L, DE CONTI G, SKERLAVAJ B, et al. Broad-spectrum activity against bacterial mastitis pathogens and activation of mammary epithelial cells support a protective role of neutrophil cathelicidins in bovine mastitis[J]. Infection and Immunity, 2010, 78(4): 1781-1788. DOI:10.1128/IAI.01090-09 |
| [20] |
吴洁.TOLL样受体4/核转录因子-κB信号通路在脂多糖诱导奶牛乳腺炎症反应中的作用[D].博士学位论文.南京: 南京农业大学, 2016.
|
| [21] |
KOŚCIUCZUKÁ E M, LISOWSKI P, JARCZAK J, et al. Expression patterns of β-defensin and cathelicidin genes in parenchyma of bovine mammary gland infected with coagulase-positive or coagulase-negative Staphylococci[J]. BMC Veterinary Research, 2014, 10: 246. DOI:10.1186/s12917-014-0246-z |
| [22] |
GUILHELMELLI F, VILELA N, ALBUQUERQUE P, et al. Antibiotic development challenges:the various mechanisms of action of antimicrobial peptides and of bacterial resistance[J]. Frontiers in Microbiology, 2013, 4: 353. |
| [23] |
ROOSEN S, EXNER K, PAUL S, et al. Bovine β-defensins:identification and characterization of novel bovine β-defensin genes and their expression in mammarygland tissue[J]. Mammalian Genome, 2004, 15(10): 834-842. DOI:10.1007/s00335-004-2387-z |
| [24] |
GOLDAMMER T, ZERBE H, MOLENAAR A, et al. Mastitis increases mammary mRNA abundance of beta-defensin 5, toll-like-receptor 2(TLR2), and TLR4 but not TLR9in cattle[J]. Clinical and Vaccine Immunology, 2004, 11(1): 174-185. DOI:10.1128/CDLI.11.1.174-185.2004 |
| [25] |
SWANSON K, GORODETSKY S, GOOD L, et al. Expression of a β-defensin mRNA, lingual antimicrobial peptide, in bovine mammary epithelial tissue is induced by mastitis[J]. Infection and Immunity, 2004, 72(12): 7311-7314. DOI:10.1128/IAI.72.12.7311-7314.2004 |
| [26] |
KAWAI K, AKAMATSU H, OBAYASHI T, et al. Relationship between concentration of lingual antimicrobial peptide and somatic cell count in milk of dairy cows[J]. Veterinary Immunology and Immunopathology, 2013, 153(3/4): 298-301. |
| [27] |
TAHA-ABDELAZIZ K, WYER L, BERGHUIS L, et al. Regulation of tracheal antimicrobial peptide gene expression in airway epithelial cells of cattle[J]. Veterinary Research, 2016, 47: 44. DOI:10.1186/s13567-016-0329-x |
| [28] |
WHELEHAN C J, MEADE K G, ECKERSALL P D, et al. Experimental Staphylococcus aureus infection of the mammary gland induces region-specific changes in innate immune gene expression[J]. Veterinary Immunology and Immunopathology, 2011, 140(3/4): 181-189. |
| [29] |
MERRIMAN K E, KWEH M F, POWELL J L, et al. Multiple β-defensin genes are upregulated by the vitamin D pathway in cattle[J]. The Journal of Steroid Biochemistry and Molecular Biology, 2015, 154: 120-129. DOI:10.1016/j.jsbmb.2015.08.002 |
| [30] |
SELSTED M E, TANG Y Q, MORRIS W L, et al. Purification, primary structures, and antibacterial activities of β-defensins, a new family of antimicrobial peptides from bovine neutrophils[J]. Journal of Biological Chemistry, 1996, 271(27): 16430. DOI:10.1074/jbc.271.27.16430 |
| [31] |
TAHA-ABDELAZIZ K, PEREZ-CASAL J, SCHOTT C, et al. Bactericidal activity of tracheal antimicrobial peptide against respiratory pathogens of cattle[J]. Veterinary Immunology and Immunopathology, 2013, 152(3/4): 289-294. |
| [32] |
STOLZENBERG E D, ANDERSON G M, ACKERMANN M R, et al. Epithelial antibiotic induced in states of disease[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(16): 8686-8690. DOI:10.1073/pnas.94.16.8686 |
| [33] |
RYAN L K, RHODES J, BHAT M, et al. Expression of β-defensin genes in bovine alveolar macrophages[J]. Infection and Immunity, 1998, 66(2): 878-881. |
| [34] |
KOŚCIUCZUKÁ E M, LISOWSKI P, JARCZAK J, et al. Expression patterns of β-defensin and cathelicidin genes in parenchyma of bovine mammary gland infected with coagulase-positive or coagulase-negative Staphylococci[J]. BMC Veterinary Research, 2014, 10: 246. DOI:10.1186/s12917-014-0246-z |
| [35] |
曹随忠, 李宏滨, 王爱华, 等. 抑制性消减杂交构建奶牛乳房炎抗性相关cDNA文库[J]. 畜牧兽医学报, 2005, 36(6): 526-530. DOI:10.3321/j.issn:0366-6964.2005.06.002 |
| [36] |
BOEHMER J L, DEGRASSE J A, LANCASTER V A, et al. Evaluation of protein expression in bovine bronchoalveolar fluid following challenge with Mannheimia haemolytica[J]. Proteomics, 2011, 11(18): 3685-3697. DOI:10.1002/pmic.v11.18 |
| [37] |
OVERHAGE J, CAMPISANO A, BAINS M, et al. Human host defense peptide LL-37 prevents bacterial biofilm formation[J]. Infection and Immunity, 2008, 76(9): 4176-4182. DOI:10.1128/IAI.00318-08 |
| [38] |
ALVA-MURILLO N, OCHOA-ZARZOSA A, LÓPEZ-MEZA J E. Effects of sodium octanoate on innate immune response of mammary epithelial cells during staphylococcus aureus internalization[J]. BioMed Research International, 2013, 2013: 927643. |
| [39] |
MCLOUGHLIN K E, NALPAS N C, RUE-ALBRECHT K, et al. RNA-seq transcriptional profiling of peripheral blood leukocytes from cattle infected with mycobacterium bovis[J]. Frontiers in Immunology, 2014, 5: 396. |
| [40] |
GRIFFIOEN K, HOP G E, HOLSTEGE M M C, et al. Dutch dairy farmers' need for microbiological mastitis diagnostics[J]. Journal of Dairy Science, 2016, 99(7): 5551-5561. DOI:10.3168/jds.2015-10816 |
| [41] |
ADDIS M F, BRONZO V, PUGGIONI G M G, et al. Relationship between milk cathelicidin abundance and microbiologic culture in clinical mastitis[J]. Journal of Dairy Science, 2017, 100(4): 2944-2953. DOI:10.3168/jds.2016-12110 |
| [42] |
PONGTHAISONG P, KATAWATIN S, THAMRONGYOSWITTAYAKUL C, et al. Milk protein profiles in response to Streptococcus agalactiae subclinical mastitis in dairy cows[J]. Animal Science Journal, 2016, 87(1): 92-98. DOI:10.1111/asj.12391 |
| [43] |
BAGNICKA E, STRZAŁKOWSKA N, FLISIKOWSKI K, et al. The polymorphism in the β4-defensin gene and its association with production and somatic cell count in Holstein-Friesian cows[J]. Journal of Animal Breeding and Genetics, 2015, 124(3): 150-156. |
| [44] |
ADDIS M F, TEDDE V, PUGGIONI G M G, et al. Evaluation of milk cathelicidin for detection of bovine mastitis[J]. Journal of Dairy Science, 2016, 99(10): 8250-8258. DOI:10.3168/jds.2016-11407 |
| [45] |
WIECZOREK M, JENSSEN H, KINDRACHUK J, et al. Structural studies of a peptide with immune modulating and direct antimicrobial activity[J]. Chemistry & Biology, 2010, 17(9): 970-980. |
| [46] |
李宏滨, 龙晶, 杜立新. 牛β-防御素BNBD5基因在毕赤酵母中的表达[J]. 畜牧兽医学报, 2010, 41(1): 123-126. |
| [47] |
符梅, 熊显荣, 兰道亮, 等. 牦牛β-防御素5基因的原核表达及表达产物的抑菌活性[J]. 西北农林科技大学学报(自然科学版), 2014, 42(10): 22-28, 34. |
| [48] |
AGHAEI S, SAFFAR B, GHAEDI K, et al. Functional analysis of recombinant codon-optimized bovine neutrophil β-defensin[J]. Journal of Advanced Research, 2016, 7(5): 815-821. DOI:10.1016/j.jare.2015.12.003 |
| [49] |
WEI Z K, CHONG X, GUO C M, et al. Sodium acetate inhibits Staphylococcus aureus internalization into bovine mammary epithelial cells by inhibiting NF-κB activation[J]. Microbial Pathogenesis, 2017, 107: 116-121. DOI:10.1016/j.micpath.2017.03.030 |




