2. 西南大学食品科学学院, 重庆 400715
2. College of Food Science, Southwest University, Chongqing 400715, China
炎症反应实质上是机体与炎性因子进行抗争的过程,大量炎性细胞因子如白细胞介素-1β(IL-1β)、白细胞介素-6(IL-6)、肿瘤坏死因子-α(TNF-α)能够促进免疫细胞生长、分化,加强细胞功能。但这些炎性因子连续释放会导致血管舒张,渗透性增强,液体分泌物大量积聚,刺激痛神经纤维,加剧炎症反应的症状,如发热、红肿、疼痛等,最终结果是机体免疫功能增强,清除体内过多的炎性因子,使内环境达到新的平衡。机体抗炎过程会消耗能量,竞争用于生产的营养,持续的炎症会造成动物组织损伤,影响动物生产。因此,需要将炎症反应控制在一定水平,减少经济损失。
核苷酸结合寡聚域样受体蛋白3(nucleotide binding oligomeric domain like receptor protein 3,NLRP3)炎性小体是动物先天免疫系统中由模式识别受体参与组装的一种多蛋白复合体,由NLRP3、凋亡相关斑点样蛋白(ASC)和前天冬氨酸半胱氨酸蛋白水解酶-1(pro-caspase-1)组成[1],主要存在于细胞浆内,是诱导炎症疾病的关键分子。NLRP3炎性小体一旦被激活,会促进无活性的酶原pro-caspase-1转变为天冬氨酸半胱氨酸蛋白水解酶-1(caspase-1),进一步刺激前白细胞介素-1β(pro-IL-1β)和前白细胞介素-18(pro-IL-18)分裂,诱导其成熟并产生IL-1β和白细胞介素-18(IL-18),整个过程最终会产生多种炎性因子,如TNF-α、IL-6、干扰素-γ(IFN-γ)等,这些炎性因子在加剧炎症反应中起到核心作用[2]。
作为机体炎性反应链的启动蛋白,细胞表面Toll样受体(Toll-like receptors,TLRs)被激活后,可以活化核转录因子-κB(nuclear transcription factor-κB,NF-κB),进而促进炎症相关基因的表达,启动机体的炎症反应[3],其中也包括刺激NLRP3炎性小体的表达。褪黑素是一种吲哚类激素,对炎症有显著的抑制效果,研究褪黑素对TLRs和NF-κB相关通路的影响,对于解释其抗炎作用有重要意义。
动物生产中炎症反应往往会造成不利影响,如减少动物脂肪储存、延缓动物的生长发育、降低动物产品品质等,这些影响都会带来经济损失。因此,抑制和预防炎症反应带来的不利影响,是保证动物正常生产的重要环节。
1 NLRP3炎性小体与炎症疾病 1.1 NLRP3炎性小体的激活NLRP3炎性小体的活化与2种类型的信号识别有关:一种是由微生物分子和内源性细胞因子调节的信号,这些因子直接激活NF-κB通路,增加pro-IL-1β的表达;另一种是由多种病原体相关分子识别模式介导的信号,这类信号能够诱导NLRP3多蛋白复合物的装配,刺激其活化[4]。具体的诱导信号包括多种内源和外源性因子,如细菌、病毒、真菌以及线粒体损伤破裂释放的线粒体DNA和活性氧所引起的细胞应激[5-6]。此外,外源性的三磷酸腺苷和死亡细胞释放的组分也可以引起NLRP3炎性小体的活化[3]。
1.2 NLRP3炎性小体诱导的疾病NLRP3炎性小体的活化可以帮助宿主抵抗细菌和病原体的入侵,但过度活化会导致炎性因子的积累,造成炎症相关的细胞组织损伤[7]。许多疾病的发生都与NLPR3炎性小体的激活有关,如NLRP3炎性小体参与了心血管失常[8]、代谢综合征[9]和结肠癌[10]的发病过程,缺血性中风[11]和脑膜炎[12]发病也都涉及到NLRP3炎性小体的激活。此外,抑制NLRP3炎性小体的表达能够有效减少细胞凋亡的发生[13]。
2 NLRP3炎性小体与TLRs、NF-κBTLRs是一类模式识别受体,通过对不同病原体的病原相关分子模式进行识别,在天然免疫和炎症反应中发挥重要作用。TLRs活化后能够引起一系列的免疫反应,包括刺激NLRP3在机体内的表达[14]。NF-κB可以看作是细胞溶质中的一种感受器,是氧化应激、免疫应激和其他环境应激中细胞调节涉及到的广泛分子机制的枢纽。其具体结构本文不再赘述,NF-κB活化后会上调炎性细胞因子基因的表达[15],最终使炎性因子分泌增加,因此活化TLRs-NF-κB通路是诱导炎症的重要途径。
TLRs属于Ⅰ型跨膜蛋白,其胞外域是一段重复的亮氨酸序列,为β折叠-环-α螺旋的结构,整个结构域呈马蹄型,介导病原相关分子模式的识别。TLRs的胞内区含有Toll/白细胞介素-1(IL-1)受体同源区(TIR),其中包括3个保守盒,参与信号转导。TIR是一保守结构,许多TLRs信号转导通路上的蛋白,如髓样分化因子88(MyD88)、IL-1受体相关蛋白激酶(IRAK)、肿瘤坏死因子受体相关因子6(TRAF6)等都具有TIR结构域[16]。
TLRs配体按来源可分为内源性和外源性配体。内源性配体(如热休克蛋白、细胞外基质降解成分等)来自宿主细胞,外源性配体(如细菌脂多糖、胞壁酸、肽聚糖以及细菌和病毒的核酸等)是微生物进化过程中的保守成分,主要来自病原微生物。
TLRs通过2条途径诱导炎症产物的表达,分别是MyD88和β-干扰素TIR结构域衔接蛋白(TRIF)依赖性途径。其中MyD88依赖性途径是除TLR3以外所有的TLRs的共同信号。当病原微生物进入体内时,TLRs与其特异的病原相关识别模式结合后促使本身二聚化,并通过TIR区域传递信号和激发下游效应。首先是TIR结构域与MyD88羧基端的TIR结构域相互作用,然后依次激活IRAK、TRAF6、NF-κB抑制物的激酶(IKK),最终使NF-κB抑制物(IκB)磷酸化而降解,促使激活的NF-κB移位入核内,启动炎症相关基因的表达,导致炎性介质(如炎性细胞因子)的合成与释放[17]。TRIF是TLRs下游的一种适配分子,主要响应非MyD88依赖性途径的调节。TRIF激活后能够活化下游的相关激酶,导致干扰素调节因子-3(IRF-3)的磷酸化并最终引起干扰素(IFN)诱导型基因的表达,增加炎性因子TNF-α、IL-1β等的合成与分泌[18]。虽然在抗感染免疫及先天性免疫中TLRs信号通路起着关键作用,但是过度激活该信号通路也会带来一系列不利的影响。研究表明,TLRs信号通路的过度激活与许多疾病的病理过程密切相关,如脓毒症和炎症性肠病等[19]。因此,TLRs启动的炎症反应应控制在适当的水平,这样既能杀灭病原体,又不会损伤组织。
炎症试验中,用脂多糖和肽聚糖能够诱导小鼠巨噬细胞NLRP3蛋白表达增加。而使用NF-κB抑制剂4-甲基-N-苯基-1, 2-二胺后显著抑制了NLRP3的蛋白和mRNA表达。进一步启动子荧光酶素克隆排除法分析表明,NLRP3的顺式作用元件存在于-1 434~-1 113 bp之间。在这之间有2个NF-κB的结合位点,单位点突变和双位点突变试验表明这2个结合位点都参与了脂多糖诱导的NLRP3转录,说明NF-κB活化参与了对NLRP3炎性小体的转录调节,通过结合到NLRP3启动子上的保守NF-κB结合位点对其产生重要影响[20]。在原代培养的小鼠肝细胞中,NLRP3几乎是不存在的。用脂多糖刺激后可以显著促进NLRP3的表达,而加入NF-κB的活性抑制剂N-4-[2-(4-苯氧基苯基)乙基]4-6-喹唑啉二胺可以显著抑制NLRP3的表达[21]。由此可见,NF-κB的活化既能在基因层面调节炎性反应,也能通过活化NLRP3炎性小体增加IL-1β和各种炎性因子的分泌,这种调节是过度炎症产生的主要因素。
3 褪黑素对NLRP3炎性小体的影响褪黑素在哺乳动物体内主要由松果体合成和分泌,是一种吲哚类激素,随着对褪黑素研究的深入,越来越多的研究发现褪黑素在抗炎症反应方面也有良好的表现。
在辐射诱导的小鼠口腔黏膜炎和盲肠结扎诱导的小鼠败血症试验中均发现褪黑素能够抑制NLRP3炎性小体相关蛋白的表达[22-23]。其他试验也表明,褪黑素对NLRP3炎性小体的活性有明显的抑制作用。例如,通过给小鼠气管滴注脂多糖得到急性肺损伤的模型,研究发现经过褪黑素的治疗能够有效地抑制NLRP3的活化,减少caspase-1 p20蛋白的表达和IL-1β的分泌[24]。进一步的分析表明,褪黑素治疗显著减少细胞外组蛋白释放,进而抑制由组蛋白诱导的NLRP3炎性小体的过度活化。褪黑素还能够减轻小鼠蛛网膜下腔出血造成的脑损伤,抑制ASC、caspase-1的蛋白和mRNA表达,从而减少IL-1β、IL-6的分泌[25]。
4 褪黑素的作用机制虽然试验证明褪黑素能缓解炎症反应,但目前褪黑素抑制NLRP3炎性小体的机制尚未研究清楚,可能涉及到多个信号通路,其中褪黑素最重要的作用是抑制TLRs-NF-κB通路的活性。
4.1 褪黑素对TLRs的抑制作用TLRs识别病原相关的刺激后,通过MyD88和TRIF依赖性途径增加NF-κB的表达,刺激NLRP3多蛋白复合物的活性,褪黑素对这2种途径都有抑制作用。
褪黑素可以治疗局部缺血再灌注导致肝损伤的大鼠,试验发现缺血再灌注使大鼠肝脏中TLR3和TLR4蛋白表达水平显著升高,而褪黑素能显著抑制这种升高。进一步分析表明再灌注增加了血清中高迁移率族蛋白1的表达水平,这种蛋白能够与TLRs结合,刺激TLRs的活化,褪黑素处理后能显著抑制这种蛋白的释放[26]。褪黑素还能抑制再灌注引起的MyD88和TRIF蛋白表达的增加,抑制TNF-α、IL-6 mRNA的表达。不仅如此,褪黑素治疗后可以抑制卵巢癌引起的多种蛋白表达水平增加,包括TLR4、MyD88、NF-κB p65、IκBα、IKKα、TRIF等,这些蛋白都与TLR4调节的信号通路相关[27]。由此可见,褪黑素对于TLRs信号通路的调节主要是通过抑制相关下游信号蛋白如MyD88和TRIF的表达来发挥作用。
4.2 褪黑素对NF-κB的抑制作用褪黑素除了对TLRs及其相关分子蛋白有抑制作用,对下游的NF-κB也有抑制作用。目前许多试验都研究了褪黑素对NF-κB通路的影响,如褪黑素能够改善烧伤引起的肝损伤,其作用是抑制NF-κB的活性,减少促炎性细胞因子的释放[28]。用脂多糖孵育小鼠单核巨噬细胞(RAW 264.7细胞),会引起NF-κB的表达显著增加,同时发现褪黑素的合成也增加,NF-κB的激活诱导褪黑素相关合成基因(AA-NAT)转录水平提高,说明巨噬细胞通过这种途径抑制NF-κB过度活化带来的不利影响[29]。
Carrillo-Vico等[30]和Manchester等[31]通过研究指出,用佛波醇刺激大鼠肥大细胞后NF-κB与其抑制因子IκB的离解显著增加,导致NF-κB向细胞核的迁移增加,促进细胞因子的合成和分泌;而用佛波醇刺激外源性褪黑素预处理过的肥大细胞,能够显著减少TNF-α、IL-6的分泌水平,原因是褪黑素抑制了NF-κB活性,减少NF-κB向细胞核的迁移。进一步研究发现,NF-κB的活化涉及到IκB激酶IKKβ上177和181位点丝氨酸的磷酸化以及IKKα上176和180位点丝氨酸的磷酸化。褪黑素预处理能够有效阻止IKKα的磷酸化,防止NF-κB/IκB复合物的离解,从而抑制NF-κB的活性[32]。
NF-κB的活性受到生物钟基因Bmal1、Clock的循环调控[33-34]。Clock基因通过增加NF-κB p65位点的磷酸化和乙酰化作用,上调NF-κB的转录活性。Bmal1能够与Clock相结合,阻碍其对NF-κB的调控,降低NF-κB的转录活性[35]。此外,Bmal1/Clock复合体能够调节先天免疫的生理节律活性,诱导烟酰胺磷酸核糖转移酶基因的表达和氧化态烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的合成,并最终影响NAD+依赖的沉默信息调节因子1(Sirt 1)去乙酰化酶的活性。Sirt 1能够与Bmal1/Clock复合体相互作用,关闭Sirt 1控制的时钟回路,使NF-κB去乙酰化,减少和DNA的结合。比较褪黑素治疗后的野生败血症小鼠和NLRP3基因敲除的败血症小鼠,发现2种途径对小鼠败血症引起的炎症反应起到相似的抑制作用,相关的基因分析证明褪黑素的治疗能够恢复被败血症破坏的Clock/Bmal1/NF-κB/NLRP3/Sirt 1循环[36]。此外,褪黑素能够结合并提高视黄酸相关孤儿核受体α(RORα)的转录活性,促进Bmal1/Clock复合体的形成[37-38]。同时,褪黑素阻碍NF-κB和NLRP3的联系也需要结合到RORα,并且褪黑素还能在氧化应激状态下维持细胞NAD+水平,间接调节Sirt 1的表达和活性,最终抑制NF-κB与DNA的结合以及后续促炎性介质的表达[23]。由此可见,褪黑素对NF-κB的影响是多方面的,不仅能直接抑制其活性,也能在基因层面间接影响其活性。
综上所述,褪黑素对NLRP3炎性小体的抑制作用主要是通过影响上游TLRs-NF-κB通路来实现的。如图 1所示,褪黑素的作用是多方面的,对TLRs-NF-κB通路中多个信号分子有抑制作用。
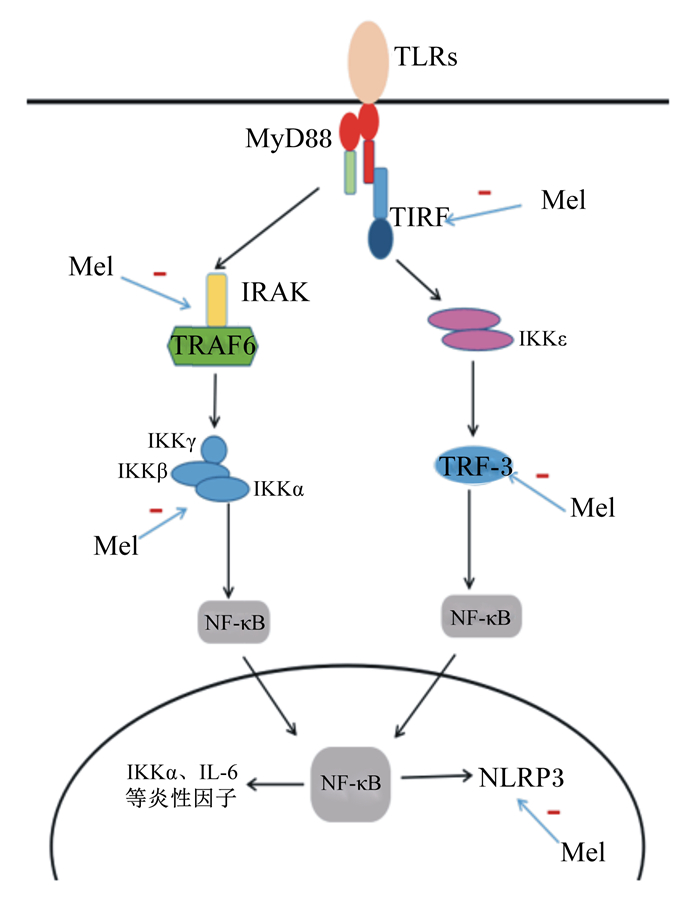
|
TLRs:Toll样受体Toll-like receptors;MyD88:髓样分化因子88 myeloid differentiation primary response protein 88;TRIF:β-干扰素TIR结构域衔接蛋白TIR-domain-containing adapter-inducing interferon-β;IRAK:白细胞介素-1受体相关蛋白激酶IL-1 receptor associated kinase;TRAF6:肿瘤坏死因子受体相关因子6 tumor necrosis factor receptor-associated factor 6;TRF3:TBP相关因子3 TBP-related factor 3;NF-κB:核转录因子-κB nuclear transcription factor-κB;IKK:NF-κB抑制物的激酶inhibitor of NF-κB kinase;IL-6:白细胞介素-6 interleukin-6;TNF-α:肿瘤坏死因子-α tumor necrosis factor-α;NLRP3:核苷酸结合寡聚域样受体蛋白3 nucleotide binding oligomeric domain like receptor protein 3;Mel:褪黑素melatonin。 图 1 褪黑素抑制NLRP3炎性小体的信号途径 Fig. 1 Signal pathway of melatonin inhibiting NLRP3 inflammatory corpuscle |
炎症反应是免疫反应的重要组成部分。机体发生炎症反应时会消耗能量,原本用于生产的营养会被用来保证免疫应答的过程,其结果是造成动物体组织的分解代谢[39]。LPS组的鸡平均体增重比对照组减少了22%,其中59%是由于采食量减少造成的,而其余41%则被认为用于参与免疫相关的过程[40]。相等采食量的情况下,急性免疫反应大约会消耗掉鸡摄取营养的10%[41]。炎症反应也会影响生长仔猪早期的能量利用,剩余采食量低或者高的仔猪,发生炎症反应后用于维持和储存脂肪的能量都会减少,而采食量并没有受到显著影响[42]。不仅如此,炎症反应会影响动物的生长发育。给予大鼠三硝基苯磺酸处理可以导致结肠炎,炎性因子IL-6的增加会引起生长阻碍[43],而使用抗IL-6抗体治疗能够让大鼠的生长显著增加,同样对采食量没有显著影响[44]。此外,氨化引起的炎症反应会改变犊牛肝脏的代谢,优先产生用于宿主防御的急性期蛋白,降低生产性能和胴体品质[45]。而围产期奶牛由于脂肪的大量动员,血液中非酯化脂肪酸的生成速度超过肝脏的利用能力,呈持续的积累状态,这种状态引发亚急性炎症反应。炎症信号可直接诱导胰岛素耐受,主要是由于免疫活动加强,竞争用于维持产奶和正常生理功能的葡萄糖供应所致。胰岛素耐受进一步加强了脂肪动员,进而加重了代谢应激,提高奶牛患酮病的几率,不仅降低奶牛的产奶量,还影响牛奶的品质。
发生炎症反应时,动物个体所需要的营养成本可能取决于许多因素,包括特定病原体毒性和暴露水平、动物的基因型和免疫表型以及饮食成分。经预测,动物免疫反应消耗的营养约为维持所需营养的1.3倍或者是每日需要消耗0.27 g/kg BW的理想蛋白质[46-47]。这些营养被用于缓冲疾病带来的直接威胁,延长组织修复和恢复正常生理功能的时间,最终使机体恢复健康。
6 小结炎症反应在动物养殖过程中普遍存在,除了各种疾病带来的炎症,环境和饲料改变等因素容易引起动物应激,也能够诱发炎症。NLRP3炎性小体的激活与炎性疾病密切相关,目前治疗炎症的新思路是抑制NLRP3炎性小体的活性,而NLRP3炎性小体也被认为是众多抗炎药物的新靶点。由于NLRP3炎性小体是一种多蛋白复合物,因此在研究药物的分子机制时,应该考虑到药物对其各个组成部分的影响。此外,几条信号通路如NF-κB、TLRs等都与NLRP3炎性小体产生联系,在探讨药物影响NLRP3炎性小体活性的原因时,也应该和这些通路联系起来,多方面地分析作用的具体机制。
随着对褪黑素作用机理的研究越来越深入,褪黑素治疗对NLRP3炎性小体的影响也逐渐成为研究热点,然而其中涉及到的信号通路和分子机制还没有完全阐明,因此将褪黑素研发为一种新型的抗炎药物还有待进一步的试验研究。相信经过不断的探索,褪黑素治疗在动物生产中的运用会越来越广泛。
| [1] |
LEVY M, THAISS C A, ELINAV E. Taming the inflammasome[J]. Nature Medicine, 2015, 21(3): 213-215. DOI:10.1038/nm.3808 |
| [2] |
ZHOU R B, YAZDI A S, MENU P, et al. A role for mitochondria in NLRP3 inflammasome activation[J]. Nature, 2011, 469(7329): 221-225. DOI:10.1038/nature09663 |
| [3] |
SABROE I, PARKER L C, DOWER S K, et al. The role of TLR activation in inflammation[J]. Journal of Pathology, 2010, 214(2): 126-135. |
| [4] |
LATZ E, XIAO T S, STUTZ A. Activation and regulation of the inflammasomes[J]. Nature Reviews Immunology, 2013, 13(6): 397-411. DOI:10.1038/nri3452 |
| [5] |
HERNANDEZ-CUELLAR E, TSUCHIYA K, HARA H, et al. Cutting edge:nitric oxide inhibits the NLRP3 inflammasome[J]. Journal of Immunology, 2012, 189(11): 5113-5117. DOI:10.4049/jimmunol.1202479 |
| [6] |
RATHINAM V A K, VANAJA S K, FITZGERALD K A. Regulation of inflammasome signaling[J]. Nature Immunology, 2012, 13(4): 333-342. DOI:10.1038/ni.2237 |
| [7] |
LEE S, SUH G Y, RYTER S W, et al. Regulation and function of the nucleotide binding domain leucine-rich repeat-containing receptor, pyrin domain-containing-3 inflammasome in lung disease[J]. American Journal of Respiratory Cell and Molecular Biology, 2016, 54(2): 151-60. DOI:10.1165/rcmb.2015-0231TR |
| [8] |
MARTÍNEZ G J, ROBERTSON S, BARRACLOUGH J, et al. Colchicine acutely suppresses local cardiac production of inflammatory cytokines in patients with an acute coronary syndrome[J]. Journal of the American Heart Association, 2015, 4(8): e002128. |
| [9] |
KIM S, JOE Y, JEONG S O, et al. Endoplasmic reticulum stress is sufficient for the induction of IL-1β production via activation of the NF-κB and inflammasome pathways[J]. Innate Immunity, 2014, 20(8): 799-815. DOI:10.1177/1753425913508593 |
| [10] |
OVERLEY-ADAMSON B, ARTLETT C M, STEPHENS C, et al. Targeting the unfolded protein response, XBP1, and the NLRP3 inflammasome in fibrosis and cancer[J]. Cancer Biology & Therapy, 2014, 15(4): 452-462. |
| [11] |
FANN D Y W, SANTRO T, MANZANERO S, et al. Intermittent fasting attenuates inflammasome activity in ischemic stroke[J]. Experimental Neurology, 2014, 257: 114-119. DOI:10.1016/j.expneurol.2014.04.017 |
| [12] |
HOEGEN T, TREMEL N, KLEIN M, et al. The NLRP3 inflammasome contributes to brain injury in pneumococcal meningitis and is activated through ATP-dependent lysosomal cathepsin B release[J]. The Journal of Immunology, 2011, 187(10): 5440-5451. DOI:10.4049/jimmunol.1100790 |
| [13] |
LI J, WANG Y L, WANG Y P, et al. Pharmacological activation of AMPK prevents Drp1-mediated mitochondrial fission and alleviates endoplasmic reticulum stress-associated endothelial dysfunction[J]. Journal of Molecular and Cellular Cardiology, 2015, 86: 62-74. DOI:10.1016/j.yjmcc.2015.07.010 |
| [14] |
BECKER C E, O'NEILL L A J. Inflammasomes in inflammatory disorders:the role of TLRs and their interactions with NLRs[J]. Seminars in Immunopathology, 2007, 29(3): 239-248. DOI:10.1007/s00281-007-0081-4 |
| [15] |
TAKEDA K, KAISHO T, AKIRA S. Toll-like receptors[J]. Annual Review of Immunology, 2003, 21(1): 335-376. DOI:10.1146/annurev.immunol.21.120601.141126 |
| [16] |
AKIRA S, TAKEDA K. Toll-like receptor signalling[J]. Nature Reviews Immunology, 2004, 4(7): 499-511. DOI:10.1038/nri1391 |
| [17] |
陈洁, 姜虹. TLR4信号通路与炎性反应[J]. 医学综述, 2009, 15(19): 2902-2904. DOI:10.3969/j.issn.1006-2084.2009.19.008 |
| [18] |
FITZGERALD K A, MCWHIRTER S M, FAIA K L, et al. IKKε epsilon and TBK1 are essential components of the IRF3 signaling pathway[J]. Nature Immunology, 2003, 4(5): 491-496. DOI:10.1038/ni921 |
| [19] |
SHIBOLET O, PODOLSKY D K. TLRs in the Gut.Ⅳ.negative regulation of Toll-like receptors and intestinal homeostasis:addition by subtraction[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2007, 292(6): 1469-1473. DOI:10.1152/ajpgi.00531.2006 |
| [20] |
QIAO Y, WANG P, QI J N, et al. TLR-induced NF-κB activation regulates NLRP3 expression in murine macrophages[J]. FEBS Letters, 2012, 586(7): 1022-1026. DOI:10.1016/j.febslet.2012.02.045 |
| [21] |
BOARU S G, BORKHAM-KAMPHORST E, VAN DE LEUR E, et al. NLRP3 inflammasome expression is driven by NF-κB in cultured hepatocytes[J]. Biochemical and Biophysical Research Communications, 2015, 458(3): 700-706. DOI:10.1016/j.bbrc.2015.02.029 |
| [22] |
ORTIZ F, ACUÑA-CASTROVIEJO D, DOERRIER C, et al. Melatonin blunts the mitochondrial/NLRP3 connection and protects against radiation-induced oral mucositis[J]. Journal of Pineal Research, 2015, 58(1): 34-49. DOI:10.1111/jpi.2014.58.issue-1 |
| [23] |
GARCÍA J A, VOLT H, VENEGAS C, et al. Disruption of the NF-κB/NLRP3 connection by melatonin requires retinoid-related orphan receptor-α and blocks the septic response in mice[J]. FASEB Journal, 2015, 29(9): 3863-3875. DOI:10.1096/fj.15-273656 |
| [24] |
ZHANG Y, LI X R, GRAILER J J, et al. Melatonin alleviates acute lung injury through inhibiting the NLRP3 inflammasome[J]. Journal of Pineal Research, 2016, 60(4): 405-414. DOI:10.1111/jpi.2016.60.issue-4 |
| [25] |
DONG Y S, FAN C X, HU W, et al. Melatonin attenuated early brain injury induced by subarachnoid hemorrhage via regulating NLRP3 inflammasome and apoptosis signaling[J]. Journal of Pineal Research, 2016, 60(3): 253-262. DOI:10.1111/jpi.2016.60.issue-3 |
| [26] |
KANG J W, KOH E J, LEE S M. Melatonin protects liver against ischemia and reperfusion injury through inhibition of Toll-like receptor signaling pathway[J]. Journal of Pineal Research, 2011, 50(4): 403-411. DOI:10.1111/j.1600-079X.2011.00858.x |
| [27] |
CHUFFA L G A, FIORUCI-FONTANELLI B A, MENDES L O, et al. Melatonin attenuates the TLR4-mediated inflammatory response through MyD88-and TRIF-dependent signaling pathways in an in vivo model of ovarian cancer[J]. BMC Cancer, 2015, 15: 34. DOI:10.1186/s12885-015-1032-4 |
| [28] |
BEKYAROVA G, BRATCHKOVA Y, TANCHEVA S, et al. Effective melatonin protection of burn-induced hepatic disorders in rats[J]. Central European Journal of Medicine, 2012, 7(4): 533-538. |
| [29] |
MUXEL S M, PIRES-LAPA M A, MONTEIRO A W A, et al. NF-κB drives the synthesis of melatonin in RAW 264.7 macrophages by inducing the transcription of the arylalkylamine-N-acetyltransferase (AA-NAT) gene[J]. PLoS One, 2012, 7(12): e52010. DOI:10.1371/journal.pone.0052010 |
| [30] |
CARRILLO-VICO A, LARDONE P J, ÁLVAREZ-SÁNCHEZ N, et al. Melatonin:buffering the immune system[J]. International Journal of Molecular Sciences, 2013, 14(4): 8638-8683. DOI:10.3390/ijms14048638 |
| [31] |
MANCHESTER L C, COTO-MONTES A, BOGA J A, et al. Melatonin:an ancient molecule that makes oxygen metabolically tolerable[J]. Journal of Pineal Research, 2015, 59(4): 403-419. DOI:10.1111/jpi.2015.59.issue-4 |
| [32] |
MALDONADO M D, GARCÍA-MORENO H, GONZÁLEZ-YANES C, et al. Possible involvement of the inhibition of NF-κB factor in anti-inflammatory actions that melatonin exerts on mast cells[J]. Journal of Cellular Biochemistry, 2016, 117(8): 1926-1933. DOI:10.1002/jcb.v117.8 |
| [33] |
AKASHI M, TAKUMI T. The orphan nuclear receptor RORα regulates circadian transcription of the mammalian core-clock Bmal1[J]. Nature Structural & Molecular Biology, 2005, 12(5): 441-448. |
| [34] |
CRUMBLEY C, WANG Y J, KOJETIN D J, et al. Characterization of the core mammalian clock component, NPAS2, as a REV-ERBα/RORα target gene[J]. Journal of Biological Chemistry, 2010, 285(46): 35386-35392. DOI:10.1074/jbc.M110.129288 |
| [35] |
SPENGLER M L, KUROPATWINSKI K K, COMAS M, et al. Core circadian protein CLOCK is a positive regulator of NF-κB-mediated transcription[J]. Proceedings of the National Academy of Sciences of the United States of America, 2012, 109(37): E2457-E2465. DOI:10.1073/pnas.1206274109 |
| [36] |
RAHIM I, DJERDJOURI B, SAYED R K, et al. Melatonin administration to wild-type mice and nontreated NLRP3 mutant mice share similar inhibition of the inflammatory response during sepsis[J]. Journal of Pineal Research, 2017, 63(1): e12410. DOI:10.1111/jpi.2017.63.issue-1 |
| [37] |
ACUÑACA-STROVIEJO D, REITER R J, MENÉNDEZ-PELÁEZ A, et al. Characterization of high-affinity melatonin binding sites in purified cell nuclei of rat liver[J]. Journal of Pineal Research, 1994, 16(2): 100-112. DOI:10.1111/jpi.1994.16.issue-2 |
| [38] |
WIESENBERG I, MISSBACH M, CARLBERG C. The potential role of the transcription factor RZR/ROR as a mediator of nuclear melatonin signaling[J]. Restorative Neurology & Neuroscience, 1998, 12(2/3): 143-150. |
| [39] |
BROOM L J, KOGUT M H. Inflammation:friend or foe for animal production?[J]. Poultry Science, 2017, 97(2): 510-514. |
| [40] |
JIANG Z, SCHATZMAYR G, MOHNL M, et al. Net effect of an acute phase response-partial alleviation with probiotic supplementation[J]. Poultry Science, 2010, 89(1): 28-33. DOI:10.3382/ps.2009-00464 |
| [41] |
CHANDRA R K. Nutrition and the immune system[J]. Proceedings of the Nutrition Society, 1993, 52(1): 77-84. |
| [42] |
LABUSSIōRE E, DUBOIS S, GILBERT H, et al. Effect of inflammation stimulation on energy and nutrient utilization in piglets selected for low and high residual feed intake[J]. Animal, 2015, 9(10): 1653-1661. DOI:10.1017/S1751731115000932 |
| [43] |
BALLINGER B A, AZOOZ O, EL-HAJ T, et al. Growth failure occurs through a decrease in insulin-like growth factor 1 which is independent of undernutrition in a rat model of colitis[J]. Gut, 2000, 46(5): 695-700. DOI:10.1136/gut.46.5.695 |
| [44] |
SAWCZENKO A, AZOOZ O, PARASZCZUK J, et al. Intestinal inflammation-induced growth retardation acts through IL-6 in rats and depends on the-174 IL-6 G/C polymorphism in children[J]. Proceedings of the National Academy of Sciences of the United States of America, 2005, 102(37): 13260-13265. DOI:10.1073/pnas.0503589102 |
| [45] |
CONNOR E E, BALDWIN R L, BLANTON J R, Jr, et al. Growth and development symposium:understanding and mitigating the impacts of inflammation on animal growth and development[J]. Journal of Animal Science, 2012, 90(5): 1436-1437. DOI:10.2527/jas.2011-5234 |
| [46] |
SANDBERG F B, EMMANS G C, KYRIAZAKIS I. The effects of pathogen challenges on the performance of naïe and immune animals:the problem of prediction[J]. Animal, 2007, 1(1): 67-86. |
| [47] |
WEBEL D M, JOHNSON R W, BAKER D H. Lipopolysaccharide-induced reductions in food intake do not decrease the efficiency of lysine and threonine utilization for protein accretion in chickens[J]. The Journal of Nutrition, 1998, 128(10): 1760-1766. DOI:10.1093/jn/128.10.1760 |




