2. 中国农业科学院饲料研究所, 农业部饲料生物技术重点实验室, 北京 100081;
3. 中国农业科学院农产品加工研究所, 北京 100193;
4. 巴彦淖尔市农牧业科学研究院, 巴彦淖尔 015000;
5. 内蒙古富川饲料科技股份有限公司, 巴彦淖尔 015000
2. Key Laboratory of Feed Biotechnology of Ministry of Agriculture, Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China;
3. Institute of Agro-Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China;
4. Scientific Research Institute of Agricultural and Animal Husbandry in Bayanur, Bayanur 015000, China;
5. Inner Mongolia Fuchuan Feed Science and Technology Ltd., Co., Bayanur 015000, China
维生素是动物维持机体健康生长至关重要的一类有机物,虽然既不为动物机体创造能量所需,也不作为构成动物机体的物质,但具有重要的生理功能。目前已有15种维生素被认为是动物必需的,且根据化学性质分为脂溶性维生素和水溶性维生素[1]。脂溶性维生素中,维生素E参与营养性疾病、视网膜变性退化、红细胞溶血、前列腺素生物合成以及T-和B-淋巴细胞反应性[2-3],以全消旋-α-生育酚乙酸酯的形式存在,是一种高效的断链抗氧化剂,能降低肌肉对脂质氧化的易感性[4]。除了在脂质氧化中作为高效抗氧化剂之外,补充维生素E对舍饲肉羊生长性能和肉品质均有积极作用[5-7]。其原因可能是维生素E能够保护肉制品中的多不饱和脂肪酸(PUFA),防止其过氧化或改变饲粮PUFA在瘤胃中的生物氢化途径,间接改变肉制品中的脂肪酸组成和含量[8]。维生素A能够维持视觉,促进动物生长和细胞分化,提高繁殖力,以及通过脂肪细胞和碳水化合物代谢在能量代谢平衡中起到重要作用[9]。有研究表明,视黄酸能够提高小鼠胰岛素敏感性,减少体脂肪水平[10];维生素A与高脂肪饲粮能够发生协同效应,增加大鼠体脂肪水平[11]。β-胡萝卜素作为生理性抗氧化剂,能保护动物机体避免过氧化作用[1]。因此,脂溶性维生素对动物机体和肉制品的抗氧化保护有积极作用。
关于脂溶性维生素对于肉羊肉品质影响的研究主要侧重在维生素A和维生素E,如添加维生素E防止脂质过氧化和提高肉类保质期[12],维生素A参与脂质代谢,较高的类胡萝卜素能够导致脂肪的奶油色变为黄色,脂肪颜色评估与β-胡萝卜素之间的相关性很强[13],Kruk等[14]也发现维生素A添加水平减少时,屠宰观察肉牛的脂肪颜色由黄色变为奶油色,表明机体内类胡萝卜素浓度显著降低。有关反刍动物维生素营养的研究国外开展的最早,大多集中在20世纪80年代,NRC(2007)更新了肉羊对脂溶性维生素相关需要量:育肥期肉羊对维生素A的需要量为330 IU/kg BW[15-16],妊娠期或哺乳期则会增加1.8~2.1倍[17];对于维生素D的维持需要量为30 IU/kg BW,育肥阶段时每增重50 g要额外添加维生素D 54 IU/d;由于维生素E和微量元素砷在动物机体内的作用相辅相成,故饲粮中不缺乏砷的条件下,其对维生素E的需要量为15 IU/kg DM[18]。前人研究集中在添加或补充单一脂溶性维生素对反刍动物胴体质量和肉品质的影响,且国外肉羊养殖主要以放牧为主[19],以新鲜青绿饲草为主要饲料原料。我国肉羊养殖模式主要特点为舍饲养殖,以传统农副产品为主要饲料原料,因此国外研究的肉羊脂溶性维生素适宜添加量以及对羊肉品质的影响是否适用于我国肉羊养殖还需进一步探讨验证。因此,本试验通过研究育肥期肉羊饲粮中限制或过量添加维生素A、维生素D、维生素E后,对肉羊屠宰性能、内脏器官发育及肉品质的影响,旨在评估NRC(2007)提出的脂溶性维生素推荐量是否适用于我国肉羊养殖。
1 材料与方法 1.1 试验条件试验于2017年8月22日至2017年10月22日在内蒙古富川养殖科技股份有限公司进行,试验期间最低温度为0 ℃,最高温度为29 ℃,平均温度为16.5 ℃。试验中所用维生素A、维生素D、维生素E购自北京精准动物营养研究中心。
1.2 试验设计与饲粮试验选用120只90日龄断奶后体重为(26.00±0.11) kg的杜寒杂交肉用绵羊,公母各1/2。按照体重相近平均分配原则随机分到5个组中,每组24只,每个圈饲养2只相同性别的羔羊,即每个组12个重复,每个重复2只(公母各占1/2)。试验采用单因素完全随机试验设计,分别设置对照组(PC组)、对照组基础上扣除30%维生素A组(PC-VA组)、对照组基础上扣除30%维生素D组(PC-VD组)、对照组基础上扣除30%维生素E组(PC-VE组)以及过量添加组(维生素A、维生素D、维生素E添加量为对照组的7.5倍,即PC-7.5组)。对照组维生素A添加量为330 IU/kg BW,维生素D添加量为30 IU/kg BW(按增重额外添加维生素D 350 IU/d),维生素E添加量为15 IU/kg BW。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
试验羊于70~75日龄接受免疫,于76~90日龄进行过渡,于90日龄开始正式试验。每日于06:00和18:00饲喂羔羊。饲粮均为自由采食,剩料量不超过饲喂量的10%。试验前每只羊打耳标,用强力消毒灵溶液对羊舍的顶部、地面、四壁等喷洒消毒。每个栏位每隔半月消毒1次并按羊场规定进行四联苗(羊快疫、羊碎死、羊肠毒血症和羔羊痢疾)防疫和饲喂驱虫药。
1.4 样品采集与指标测定及方法 1.4.1 屠宰性能和内脏器官发育指标组织器官、胃肠道发育检测:试验羊于180日龄时每组每个重复选取健康、体重接近平均体重的母羊6只屠宰。所有试验羊于06:00空腹称重,并抽血,之后进行屠宰。宰前禁食16 h,禁水6 h。试验羊经二氧化碳(CO2)致晕后,颈静脉放血屠宰。屠宰前称取所有羔羊宰前活重(LWBS),去头、蹄、内脏,剥皮后称胴体重及内脏各器官重量,计算屠宰率。将瘤胃、网胃、瓣胃、皱胃分割并去除食糜,同时将消化道内容物清除并冲洗干净后,分别称取瘤胃、网胃、瓣胃、皱胃、小肠鲜重并记录,计算复胃总重(TCSW)。
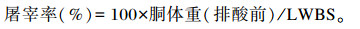
|
屠宰时现场测定肉品质物理指标。用硫酸纸描绘倒数第1~2根肋骨之间脊椎上的眼肌(背最长肌)轮廓,测定眼肌面积;用游标卡尺测量背部第12~13根肋骨之间,距离背脊中线11 cm处组织的厚度记为GR值。
用色差计(CM-600D Minolt)对肉色指标[亮度(L*)、红度(a*)和黄度(b*)值]进行测定,参数设置为CIE D65 10°观察角和2.5 cm的孔径。每个样品的表面随机选择4个点进行测定。
取宰后24 h胴体左侧背最长肌第1~2腰椎处肉块,称重(W1)后用S型钩钩住其一端,准备1个塑料袋,向袋内吹气使袋膨胀起来,小心将肉悬空于袋中,使肉样不与袋接触,用细线将袋口扎紧,悬挂于4 ℃条件下静置24 h,取出样品再次称重(W2),按如下公式计算滴水损失:
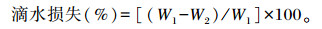
|
采集5 cm×10 cm面积的背最长肌样品于-20 ℃保存。分析肉样品剪切力及脂肪酸、氨基酸含量。脂肪酸含量测定参考GB 5009.168—2016的方法,使用气相色谱仪(GC2010 FID检测器,岛津公司,日本)进行测定;氨基酸含量的测定参考GB/T 18246—2000的方法,使用全自动氨基酸分析仪(L8900型氨基酸自动分析仪,日立公司,日本)进行测定。
1.5 统计分析所有数据经过Excel 2010处理,应用SPSS 17.0统计软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行多重比较,以P < 0.05作为判断差异显著性的标准,0.05≤P < 0.10代表有升高或降低的趋势。
2 结果 2.1 限制和过量添加脂溶性维生素对育肥期杜寒杂交肉羊屠宰性能和内脏器官发育的影响由表 2和表 3可见,各组肉羊的LWBS、胴体重和屠宰率均没有显著差异(P > 0.05)。PC-VA组和PV-7.5组的眼肌面积有高于PC组的趋势(P=0.06)。各组肉羊的内脏器官重量及其占LWBS比例均没有显著差异(P > 0.05)。PC-VD组和PC-7.5组的肾脏占LWBS比例有高于PC组的趋势(P=0.06)。各组肉羊的各胃室重量及其占TCWS比例均没有显著差异(P > 0.05)。
|
|
表 2 限制和过量添加脂溶性维生素对杜寒杂交肉羊屠宰性能的影响 Table 2 Effects of restriction and excess amount of fat-soluble vitamins on slaughter performance of Dorper×thin-tailed Han crossbred lambs |
|
|
表 3 限制和过量添加脂溶性维生素对杜寒杂交肉羊内脏器官发育和复胃重量的影响 Table 3 Effects of restriction and excess amount of fat-soluble vitamins on internal organ development and stomach weight of Dorper×thin-tailed Han crossbred lambs |
由表 4可见,各组肉羊的剪切力、滴水损失及肉色a*、b*值均没有显著差异(P > 0.05)。PC-7.5组的肉色L*值显著低于除PC组外的其他各组(P < 0.05),PC-VD组的肉色L*值显著高于PC组和PC-7.5组(P < 0.05)。
|
|
表 4 限制和过量添加脂溶性维生素对杜寒杂交肉羊肉品质的影响 Table 4 Effects of restriction and excess amount of fat-soluble vitamins on meat quality of Dorper×thin-tailed Han crossbred lambs |
由表 5可见,各组的背最长肌中脂肪酸含量均没有显著差异(P > 0.05)。各组的背最长肌中饱和脂肪酸(SFA)、单不饱和脂肪酸(MUFA)、PUFA含量均没有显著差异(P > 0.05)。PC-VA组和PC-VE组的背最长肌中C10 : 0含量有低于PC组的趋势(P=0.07),PC-VA组和PC-VE组的背最长肌中C20 : 0含量有低于PC-7.5组的趋势(P=0.09)。
|
|
表 5 限制和过量添加脂溶性维生素对杜寒杂交肉羊胴体脂肪酸含量的影响 Table 5 Effects of restriction and excess amount of fat-soluble vitamins on carcass fatty acid contents of Dorper×thin-tailed Han crossbred lambs |
由表 6可见,PC-7.5组的背最长肌中苯丙氨酸(Phe)含量有高于PC组的趋势(P=0.05);PC组的背最长肌中赖氨酸(Lys)、亮氨酸(Leu)和异亮氨酸(Ile)含量有低于其他各组的趋势(P=0.06、P=0.07、P=0.06)。PC组的背最长肌中半胱氨酸(Cys)含量显著低于其他各组(P < 0.05),且PC组的背最长肌中丝氨酸(Ser)含量显著低于PC-VA组和PC-7.5组(P < 0.05);PC组的背最长肌中精氨酸(Arg)和酪氨酸(Tyr)含量有低于其他各组的趋势(P=0.06、P=0.07)。
|
|
表 6 限制和过量添加维生素对杜寒杂交肉羊胴体氨基酸含量的影响 Table 6 Effects of restriction and excess amount of fat-soluble vitamins on carcass amino acid contents of Dorper×thin-tailed Han crossbred lambs |
屠宰性能反映了动物在不同生理阶段胴体重和产肉性能,是评价动物生产性能的重要指标之一。前人关于脂溶性维生素添加水平对反刍动物屠宰性能影响的研究较为有限,饲粮低维生素E水平不影响肉牛的胴体品质和产量等级[20-21]以及pH[21];过量添加方面,Kruk等[22]在成年肉牛的饲粮中添加60 000 IU/d维生素A,发现其对屠宰率、胴体重、眼肌面积和pH均没有显著影响;此外,在4月龄的滩羊饲粮中补充不同水平的维生素E,其胴体重、眼肌面积和背最长肌pH没有显著差异,当添加量低于100 IU/kg时屠宰率和总瘦肉率显著提高;添加量高于200 IU/kg时,皮下脂肪含量和脂肪深度显著降低[23]。本试验屠宰性能各指标在个组间也不存在显著差异,一方面可能是脂溶性维生素缺乏或过量对育肥期肉羊生理功能的影响并不能通过屠宰性能体现出来;另一方面本试验肉羊育肥期时间较短,可能不足以表现出维生素缺乏或过量造成的负面影响。
肉色是消费者观察和判断羊肉品质的重要感官指标[24],一般认为鲜肉的颜色应该是鲜红色或者亮粉色。肉色的L*值随着肉样的老化而增加,这与屠宰后肌肉中残留的线粒体呼吸与氧渗透到暴露的肌肉表面的深度有关[25]。Liu等[26]指出,肉色显示的时间长短和肌肉衰老期的延迟取决于饲粮中的维生素E水平添加,饲粮中添加500 IU/d的维生素E能够影响牛肉的肉色,延长肉色的保持期。本试验中PC-7.5组的肉色L*值与PC组一致,肉色b*值与肌肉中脂肪含量呈正相关,脂肪中含有较多的黄色素[27],但本研究结果显示各组肉色b*值无显著差异,表明部分扣除30%或者添加7.5倍高倍剂量的脂溶性维生素对于杜寒杂交肉羊来说,还未达到影响其脂肪含量的范围,因此过量添加脂溶性维生素可能会造成资源的浪费。
3.2 限制和过量添加脂溶性维生素对育肥期肉羊肌肉脂肪酸组成和含量的影响脂肪酸按碳链长度分为短链脂肪酸(C < 6)、中链脂肪酸(6≤C≤12)和长链脂肪酸(C > 12)。其中长链脂肪酸又根据其化学键的饱和度分为SFA和不饱和脂肪酸(UFA),根据化学结构的不同进而分为MUFA和PUFA[28]。羊肉中脂肪酸以及其比例影响着人类健康[29],例如,摄入UFA能够降低心脏病的患病风险,因其有降低血压的作用[30]。短链和中链脂肪酸是导致不同种属的动物之间特殊肉品风味的主要原因[31],研究表明,肌肉中短链SFA的含量与羊肉的膻味呈显著正相关,其中羊蜡酸(C10 : 0)和丁酸(C4 : 0)可显著加膻味程度[32]。本研究中,PC-VA组和PC-VE组杜寒杂交肉羊背最长肌中C10 : 0含量显著低于PC组,表明长期扣除30%的维生素E可能会影响羊肉制品的风味。
研究表明,肉羊饲粮中添加维生素E能够保护PUFA,避免其受到氧化作用,从而增加UFA在肌肉中的比例[33-34]。本研究结果表明,各组背最长肌中SFA、MUFA和PUFA含量等指标均无显著差异。但从数值的趋势上看,部分扣除脂溶性维生素组相较PC组和PC-7.5组背最长肌中SFA含量更低,SFA含量的减少有利于人体健康;部分扣除脂溶性维生素组相较PC组背最长肌中MUFA和PUFA含量更低,脂质抗氧化性随之降低,从而对货架延长期有负面影响。Neto等[12]的研究发现,补充维生素E对肌肉或皮下脂肪中的脂肪酸含量没有影响。Arnett等[35]给3月龄肉羊饲粮中添加6 600 IU/kg的维生素A,结果发现维生素A与羔羊背最长肌中脂肪酸的含量呈线性相关,同时背最长肌中PUFA含量降低。本试验与上述结果不一致的原因,可能是一方面由于部分扣除脂溶性维生素后其添加量仍不至于引起肌肉脂肪酸含量的变化;另一方面,肉羊品种不同,例如大尾寒羊脂质中C18 : 0的含量显著高于小尾寒羊;肉羊性别差异,公羊肌肉中PUFA含量均显著高于母羊[36]。
3.3 限制和过量添加脂溶性维生素对育肥期肉羊肌肉氨基酸组成和含量的影响目前还没有关于脂溶性维生素对肉羊肌肉氨基酸组成影响的相关报道。本试验表明,限制和过量添加脂溶性维生素对肌肉中半胱氨酸和丝氨酸含量有显著影响,其中半胱氨酸是羊毛中含量丰富的含硫氨基酸,作为一种饲料营养强化剂主要针对畜禽,对机体发育、肝肾功能以及毛皮质量有积极影响[37]。Murdoch[38]认为半胱氨酸可能是限制羊毛生长的主要营养因子,并且研究观察到给绵羊皮下注射L-半胱氨酸(1 g/d),羊毛生长增加了34%。Kato等[39]和Katayama等[40]发现在饲粮中添加高水平的半胱氨酸(0.35%)后,大鼠的血清α-生育酚含量和组织抗坏血酸含量呈正相关[39-40]。上述研究表明,含硫氨基酸在维生素E的代谢中起关键作用,虽然本研究中没有涉及羊毛生长的相关指标,但根据肌肉中半胱氨酸含量的差异,结合前人研究结果表明限制和过量添加脂溶性维生素对羊毛的生长可能均有负面影响。丝氨酸作为代谢中间产物参与蛋氨酸、甘氨酸、半胱氨酸等的合成[1],主要在脂类代谢、免疫系统和中枢神经中发挥作用。在哺乳动物机体中,丝氨酸与蛋氨酸合成半胱氨酸[41],2分子半胱氨酸氧化得到胱氨酸。其中半胱氨酸合成过程需要胱硫醚合成酶催化,研究发现缺乏B族维生素会影响胱硫醚合成酶的合成[41]。本试验结果说明限制和过量添加脂溶性维生素可能导致半胱氨酸合成受阻,进而影响了胱氨酸的合成,因此有必要进一步研究脂溶性维生素对氨基酸代谢通路的影响,明确发生上述变化的原因。
4 结论扣除30%或摄入过量的脂溶性维生素对杜寒杂交肉羊的屠宰性能和肌肉脂肪酸含量均无显著影响,但影响了肌肉氨基酸含量,从而对肉品质产生影响。
| [1] |
冯仰廉. 反刍动物营养学[M]. 北京: 科学出版社, 2004.
|
| [2] |
BENDICH A, GABRIEL E, MACHLIN L J. Dietary vitamin E requirement for optimum immune responses in the rat[J]. The Journal of Nutrition, 1986, 116(4): 675-681. DOI:10.1093/jn/116.4.675 |
| [3] |
MACHLIN L J. Handbook of vitamins[M]. 2nd ed. New York: Marcel Dekker, Inc., 1991.
|
| [4] |
SALVATORI G, PANTALEO L, DI CESARE C, et al. Fatty acid composition and cholesterol content of muscles as related to genotype and vitamin E treatment in crossbred lambs[J]. Meat Science, 2004, 67(1): 45-55. DOI:10.1016/j.meatsci.2003.09.004 |
| [5] |
TURNER K E, MCCLURE K E, WEISS W P, et al. Alpha-tocopherol concentrations and case life of lamb muscle as influenced by concentrate or pasture finishing[J]. Journal of Animal Science, 2002, 80(10): 2513-2521. |
| [6] |
MACIT M, AKSAKAL V, EMSEN E, et al. Effects of vitamin E supplementation on fattening performance, non-carcass components and retail cut percentages, and meat quality traits of Awassi lambs[J]. Meat Science, 2003, 64(1): 1-6. DOI:10.1016/S0309-1740(02)00115-8 |
| [7] |
ALVAREZ I, DE LA FUENTE J, DÍAZ M T, et al. Estimation of α-tocopherol concentration necessary to optimise lamb meat quality stability during storage in high-oxygen modified atmosphere using broken-line regression analysis[J]. Animal, 2008, 2(9): 1405-1411. DOI:10.1017/S1751731108002590 |
| [8] |
BHATT R S, SAHOO A, KARIM S A, et al. Effects of calcium soap of rice bran oil fatty acids supplementation alone and with DL-α-tocopherol acetate in lamb diets on performance, digestibility, ruminal parameters and meat quality[J]. Journal of Animal Physiology and Animal Nutrition, 2016, 100(3): 578-589. DOI:10.1111/jpn.2016.100.issue-3 |
| [9] |
OBROCHTA K M, KROIS C R, CAMPOS B, et al. Insulin regulates retinol dehydrogenase expression and all-trans-retinoic acid biosynthesis through FoxO1[J]. Journal of Biological Chemistry, 2015, 290(11): 7259-7268. DOI:10.1074/jbc.M114.609313 |
| [10] |
MANOLESCU D C, SIMA A, BHAT P V. All-trans retinoic acid lowers serum retinol-binding protein 4 concentrations and increases insulin sensitivity in diabetic mice[J]. The Journal of Nutrition, 2010, 140(2): 311-316. DOI:10.3945/jn.109.115147 |
| [11] |
REDONNET A, FERRAND C, BAIRRAS C, et al. Synergic effect of vitamin A and high-fat diet in adipose tissue development and nuclear receptor expression in young rats[J]. British Journal of Nutrition, 2008, 100(4): 722-730. DOI:10.1017/S0007114508967568 |
| [12] |
NETO O R M, CHIZZOTTI M L, RAMOS E M, et al. Fatty acid profile and meat quality of young bulls fed ground soybean or ground cottonseed and vitamin E[J]. Animal, 2015, 9(2): 362-372. DOI:10.1017/S1751731114002377 |
| [13] |
ZHOU G H, YANG A, TUME R K. A relationship between bovine fat colour and fatty acid composition[J]. Meat Science, 1993, 35(2): 205-212. DOI:10.1016/0309-1740(93)90050-R |
| [14] |
KRUK Z A, MALAU-ADULI A E O, PITCHFORD WS, et al.Genetics of fat colour in cattle[C]//Proceedings of the 6th World Congress on Genetics Applied to Livestock.Armidale, NSW, Australia, 1998, 23: 121-124.
|
| [15] |
DONOGHUE S, KRONFELD D S, SKLAN D. Retinol homeostasis in lambs given low and high intakes of vitamin A[J]. British Journal of Nutrition, 1983, 50(2): 235-248. DOI:10.1079/BJN19830093 |
| [16] |
DONOGHUE S, DONAWICK W J, KRONFELD D S. Transfer of vitamin a from intestine to plasma in lambs fed low and high intakes of vitamin A[J]. The British Journal of Nutrition, 1983, 113(11): 2197-2204. DOI:10.1093/jn/113.11.2197 |
| [17] |
NRC.Nutrient requirements of sheep[S]. 6th ed.Washington D.C.: National Academy Press, 1985.
|
| [18] |
HENSEL D R, DIRECTOR C.Agricultural research center[Z]. Hastings: Florida, 1981.
|
| [19] |
DE RANCOURT M, FOIS N, LAVÍN M P, et al. Mediterranean sheep and goats production:an uncertain future[J]. Small Ruminant Research, 2006, 62(3): 167-179. DOI:10.1016/j.smallrumres.2005.08.012 |
| [20] |
KOBAYASHI S, TAKASAKI K. Effects of DL-α-tocopherol on body weight gains and meat qualities of holstein steers[J]. Nihon Chikusan Gakkaiho, 1985, 56(10): 802-806. DOI:10.2508/chikusan.56.802 |
| [21] |
ARNOLD R N, SCHELLER K K, ARP S C, et al. Effect of long- or short-term feeding of α-tocopheryl acetate to Holstein and crossbred beef steers on performance, carcasscharacteristics, and beef color stability[J]. Journal of Animal Science, 1992, 70(10): 3055-3065. DOI:10.2527/1992.70103055x |
| [22] |
KRUKA Z A, BOTTEMA C D K, DAVIS J J, et al. Effects of vitamin A on growth performance and carcass quality in steers[J]. Livestock Science, 2008, 119(1/2/3): 12-21. |
| [23] |
BIRCH K S, THOMAS J D, ROSS T T. Growth and carcass characteristics of newly received feeder lambs treated with probiotics and vitamin E[J]. Sheep and Goat Research Journal, 1994, 10: 201-206. |
| [24] |
CASSENSRG, FAUSTMAN C, JIMENEZ-COLMENEROF.Modern developments in research on color of meat[M]//KROL B, VAN ROON P, HOUBEN J.Trends in modern meat technology.Wageningen: The Netherlands, 1988.
|
| [25] |
MCKENNA D R, MIES P D, BAIRD B E, et al. Biochemical and physical factors affecting discoloration characteristics of 19 bovine muscles[J]. Meat Science, 2005, 70(4): 665-682. DOI:10.1016/j.meatsci.2005.02.016 |
| [26] |
LIU Q, LANARI M C, SCHAEFER D M. A review of dietary vitamin e supplementation for improvement of beef quality[J]. Journal of Animal Science, 1995, 73(10): 3131-3140. DOI:10.2527/1995.73103131x |
| [27] |
D'ALESSANDRO A G, MAIORANO G, KOWALISZYNB, et al. How the nutritional value and consumer acceptability of suckling lambs meat is affected by the maternal feeding system[J]. Small Ruminant Research, 2012, 106(2/3): 83-91. |
| [28] |
李晓亚, 唐德富, 李发弟, 等. 反刍动物肌肉脂肪酸对肉品质的影响及其调控因素[J]. 动物营养学报, 2016, 28(12): 3749-3756. |
| [29] |
CABRERA M C, SAADOUN A. An overview of the nutritional value of beef and lamb meat from South America[J]. Meat Science, 2014, 98(3): 435-444. DOI:10.1016/j.meatsci.2014.06.033 |
| [30] |
ORIANI G, MAIORANO G, FILETTI F, et al. Effect of age on fatty acid composition of Italian Merino suckling lambs[J]. Meat Science, 2005, 71(3): 557-562. DOI:10.1016/j.meatsci.2005.04.040 |
| [31] |
ELMORE J E, MOTTRAM D S. The role of lipid in the flavour of cooked beef[J]. Developments in Food Science, 2006, 43: 375-378. DOI:10.1016/S0167-4501(06)80089-0 |
| [32] |
双金, 敖力格日玛, 敖长金. 苏尼特羊体脂脂肪酸组成的研究[J]. 畜牧兽医学报, 2015, 46(8): 1363-1374. |
| [33] |
ÁLVAREZ I, DE LA FUENTE J, CAÑEQUE V, et al. Changes in the fatty acid composition of M.longissimusdorsi of lamb during storage in a high-oxygen modified atmosphere at different levels of dietary vitamin E supplementation[J]. Journal of Agricultural and Food Chemistry, 2009, 57(1): 140-146. DOI:10.1021/jf801940c |
| [34] |
BELLÉS M, LEAL L N, DÍAZ V, et al. Effect of dietary vitamin E on physicochemical and fatty acid stability of fresh and thawed lamb[J]. Food Chemistry, 2018, 239: 1-8. DOI:10.1016/j.foodchem.2017.06.076 |
| [35] |
ARNETT A M, DIKEMAN M E, SPAETH C W, et al. Effects of vitamin A supplementation in young lambs on performance, serumlipid, andlongissimus muscle lipid composition[J]. Journal of Animal Science, 2007, 85(11): 3062-3071. DOI:10.2527/jas.2007-0176 |
| [36] |
LIND V, BERG J, EILERTSEN S M, et al. Effect of gender on meat quality in lamb from extensive and intensive grazing systems when slaughtered at the end of the growing season[J]. Meat Science, 2011, 88(2): 305-310. DOI:10.1016/j.meatsci.2011.01.008 |
| [37] |
WHEELER K B, LATSHAW J D. Sulfur amino acid requirements and interactions in broilers during two growth periods[J]. Poultry Science, 1981, 60(1): 228-236. DOI:10.3382/ps.0600228 |
| [38] |
MURDOCH R N. Metabolic fate of parenterally administered sulphur-containing amino acids in sheep and effects on growth and composition of wool[J]. Australian Journal of Biological Sciences, 1970, 23(5): 1077-1088. |
| [39] |
KATO N, MOCHIZUKI S, KAWAI K, et al. Effect of dietary level of sulfur-containing amino acids on liver drug-metabolizing enzymes, serum cholesterol and urinary ascorbic acid in rats fed PCB[J]. The Journal of Nutrition, 1982, 112(5): 848-854. DOI:10.1093/jn/112.5.848 |
| [40] |
KATAYAMA T, MOMOTA Y, WATANABE Y, et al. Elevated concentrations of α-tocopherol, ascorbicacid, and serum lipids in rats fed polychlorinated biphenyls, chlorobutanol, or phenobarbital[J]. The Journal of Nutritional Biochemistry, 1991, 2(2): 92-96. DOI:10.1016/0955-2863(91)90036-5 |
| [41] |
PACK M, RODEHUTSCORD M, JACOBS S, et al. Amino acid requirements of rainbow trout (Oncorhynchusmykiss) Ⅱ.Protein deposition as function of dietary methionine, threonine and arginine[J]. Journal of Applied Ichthyology, 1995, 11(3/4): 390-393. |




