动物的营养状态会显著影响机体的生长,细胞的增殖、能量的储存以及肌肉的发育等生理过程都离不开营养物质的参与[1]。随着饲料资源日益短缺,如何提高畜禽蛋白质饲料的利用效率以节省饲料资源,逐渐成为国内外学者近些年来的研究热点。降低饲粮蛋白质水平,不仅可以减少氮排放,同时还可以节约生产成本,但在以大鼠为模型的试验中关于低蛋白质饲粮对生长性能的影响诸多报道中结论各异。Swick等[2]研究了饲粮蛋白质水平(5%和15%酪蛋白)对成年大鼠(300 g)生长速度的影响,发现大鼠对低蛋白质饲粮的采食量比高蛋白质饲粮高15%,但体增重下降了28%。Masanés等[3]扩大酪蛋白添加量的梯度(9.5%、20.0%和36.0%)后发现,饲粮酪蛋白含量降至9.5%时,得到了类似的生长性能结果。但Ward等[4]研究发现,生长大鼠采食15%和25%酪蛋白的饲粮,其生长速度和氮沉积量未见显著差异。另有Howarth[5]以断奶仔鼠为试验对象,研究不同饲粮酪蛋白含量对大鼠机体生长和肌肉生长的影响,结果发现,6%、12%和18%酪蛋白饲粮组大鼠的末重和腓肠肌重量显著低于24%酪蛋白饲粮组,当酪蛋白添加量降低至0时,甚至出现大鼠的末重和肌肉重比初始重量下降的现象。这些结果的差异可能是饲粮蛋白质降低水平与必需氨基酸的外源添加不同步所致。因此,本试验的目的在于,通过给成年大鼠饲喂酪蛋白含量分别为20%、15%、10%、5%和0的饲粮,并按AIN-93G标准需要量逐级补充所有必需氨基酸,研究饲喂低蛋白质水平但氨基酸平衡的饲粮对成年大鼠生长性能、氮平衡和骨骼肌蛋白质周转的影响,从而为低蛋白质饲粮在畜禽方面的应用提供数据参考。
1 材料与方法 1.1 试验动物与饲粮本试验选取35只13周龄、体重为200~300 g的成年SD雄性大鼠,购于北京实验动物中心。大鼠购回后,先进行为期5 d的适应期,饲喂普通基础饲粮。试验开始后饲喂试验饲粮,5种试验饲粮分别含有20%(20%C, 此为AIN-93G标准饲粮)、15%(15%C)、10%(10%C)、5%(5%C)和0酪蛋白(0C),其他营养水平均满足AIN-93G营养需要量[6-7],并参照此需要量分别在各组中添加适宜种类和数量的合成氨基酸。5种试验饲粮组成及营养水平见表 1。饲粮制粒在北京科奥协力饲料有限公司完成。
|
|
表 1 试验饲粮组成及营养水平(饲喂基础) Table 1 Composition and nutrient levels of experimental diets (as-fed basis) |
本试验在农业部饲料效价和安全评价监督检验测试中心(北京)鼠营养代谢室进行,试验鼠房为万级清洁实验室。大鼠饲喂在控温和控湿的房间内,温度为(20±2) ℃,相对湿度为(45±10)%。光照制度为昼夜光照交替12 h:12 h,大鼠单个饲喂在代谢笼(0.3 m×0.3 m×0.3 m)内,粪和尿分开收集,自由采食和饮水。
1.3 试验设计和样品采集选取35只体重为(238.6±2.3) g的成年SD雄性大鼠,按体重相近的原则随机分为5组(每组7个重复,每个重复1只大鼠),分别饲喂5种试验饲粮。试验期12 d。在试验第1天和第12天早晨分别进行空腹称重,计算生长性能。
于试验第6天08:00开始收集粪尿,至第11天08:00结束,共5 d。收集期间准确记录大鼠的采食量,每日将收集到的粪便称重,并储存于-20 ℃冰箱待分析。收集期结束后,将所有粪便混匀后进行冷冻干燥、粉碎和分析。同时,收集期内将每日收集到的尿液用量筒测量体积,记录排尿量。按照尿量的5%(体积比)加入10%硫酸(98%的硫酸与水以体积比1:9混合)固氮,将每日的尿液保存于4 ℃冰箱,收集期结束后将所有尿液混匀并取样待测。
收集期结束后,在第12天08:00进行空腹称重。称重后,根据大鼠体重,大剂量一次性腹腔注射1.50 μmol/g BW L-苯丙氨酸(用生理盐水溶解),其中含有0.60 μmol/g BW的L-[ring-2H5]苯丙氨酸,腹腔注射在5~10 s内完成。腹腔注射30 min后,大鼠通过戊巴比妥钠麻醉,眼眶静脉采血于真空采血管,4 ℃、2 000 r/min离心25 min,分离血清,-70 ℃冻存备用。采血后,将大鼠颈部脱臼处死,采集后肢的比目鱼肌和腓肠肌样品,放入液氮中冷冻,之后于-70 ℃冻存备用。
1.4 检测指标和方法 1.4.1 饲粮成分饲粮干物质、粗蛋白质、钙和磷含量及总能的检测方法参照AOAC(2000)中方法。
饲粮氨基酸含量的检测:试验饲粮样品粉碎后分别在110 ℃下经6 mol/L盐酸水解24 h和0 ℃下经过甲酸氧化16 h后再经盐酸水解24 h,用氨基酸自动分析仪(L-8800型,日立公司,日本)测定15种氨基酸和含硫氨基酸含量;试验饲粮样品粉碎后用4 mol/L氢氧化钠在110 ℃下水解22 h后,使用高效液相色谱仪测定色氨酸含量。
1.4.2 生长性能在试验第1天和第12天早晨分别对大鼠进行空腹称重,并准确记录试验期大鼠的采食量,计算大鼠在整个试验期的干物质采食量、平均日增重和料重比。
1.4.3 氮平衡粪样和尿样中氮的含量测定方法参照AOAC(2000),根据平均日采食量、日排粪量和日排尿量计算大鼠每日氮摄入量、氮排出量和氮沉积量,并计算氮沉积率。
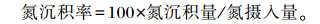
|
移取0.5 mL血清样品于5 mL离心管中,加入1.5 mL的10%磺基水杨酸和0.175 mL锂稀释液,振荡混匀后,冰上静置20 min,取上清液2 mL于4 ℃、50 000 r/min离心30 min,取上清液用0.1 μm滤膜过滤,装入上机小瓶中,上机,根据茚三酮柱后衍生测定血清游离氨基酸浓度。
1.4.5 骨骼肌蛋白质合成速度蛋白质合成速度测定方法参考毛湘冰等[8]的报道,具体过程如下:用研钵将骨骼肌样品磨碎后,用2 mL 2 mol/L的三氯乙酸溶液将样品(0.08 g)溶解,在冰上匀浆,之后4 ℃、2 000 r/min离心20 min。将上清液(含有游离态苯丙氨酸)倒出,过阳离子交换树脂柱。沉淀部分(含有结合态苯丙氨酸)则用2 mL 2 mol/L的三氯乙酸溶液洗涤3次,再用3 mL 6 mol/L的盐酸溶液在110 ℃水解24 h,冷却、过滤和蒸干后,用超纯水溶解,过阳离子交换树脂柱。阳离子交换树脂柱先用1 mol/L盐酸洗涤,然后用超纯水洗至中性,游离和结合氨基酸用4 mL 4 mol/L的氨水溶液洗脱,并在充氮环境中将收集的样品溶液蒸干。
样品中的游离态和结合态L-[ring-2H5]苯丙氨酸经七氟丁酸酐衍生后,使用气相色谱-质谱(GC-MS)仪测定苯丙氨酸的含量。其中,游离态苯丙氨酸测定在电子质荷比为91和96时的含量,而结合态苯丙氨酸测定电子质荷比为148和153时的含量,根据标准曲线,换算为百分摩尔丰度(mol%)。蛋白质合成速度以蛋白质相对合成率表示,蛋白质相对合成率定义为1 d内蛋白质更新的百分率。蛋白质相对合成率的计算方法参照Garlick等[9],公式如下:。
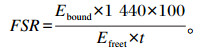
|
式中:FSR表示蛋白质相对合成率(%/d);Ebound表示结合态L-[ring-2H5]苯丙氨酸的同位素丰度(%);1 440表示1 d中的分钟数;Efreet表示在时间t时,游离态L-[ring-2H5]苯丙氨酸的同位素丰度(%);t表示从腹腔注射同位素后到处死取样的时间,本试验中为30 min。
1.4.6 骨骼肌蛋白质降解速度蛋白质降解速度测定方法参照Tawa等[10]的报道,具体方法如下:将骨骼肌样品称重后,放入2 mL离心管中,内含95%氧气-5%二氧化碳混合气体饱和的预孵育液,于37 ℃培养箱中孵育30 min之后弃去预孵育液,加入2 mL 95%氧气-5%二氧化碳混合气体饱和的孵育液,于37 ℃振荡孵育2 h。孵育后,弃去肌肉,收集孵育液于新的离心管中,于-70 ℃保存待测。
测定时,移取1 mL孵育液于2 mL离心管中,后续操作方法同血清游离氨基酸含量测定过程,测得孵育液中酪氨酸的含量。
通过肌肉湿重和孵育液中酪氨酸的总含量,计算出2 h内单位重量骨骼肌释放入孵育液中酪氨酸的含量,用其来表示骨骼肌蛋白质降解速度,单位为nmol酪氨酸/(mg湿重·2 h)。
1.5 统计分析本试验测定结果以每只大鼠为统计单位,试验数据用平均值表示,采用SAS 8.1版软件中单因素方差分析(one-way ANOVA)进行方差分析,差异显著时采用Duncan氏法进行多重比较检验,当P < 0.05时确定为差异显著。
2 结果 2.1 饲粮蛋白质水平降低对成年大鼠生长性能的影响由表 2可知,饲粮蛋白质水平降低能够显著影响成年大鼠的平均日增重(P < 0.05)。当酪蛋白含量从20%分别降至15%并添加合成氨基酸后,成年大鼠的平均日增重上升42.2%(P < 0.05),但酪蛋白含量进一步下降至10%时,平均日增重则大幅下降,下降了46.5%(P < 0.05)。而当酪蛋白含量从20%分别下降至5%和0时,即使添加了各种合成氨基酸满足了大鼠对氨基酸的需要,大鼠的生长仍然受到抑制,出现体重下降的现象,且蛋白质水平越低,体重下降越多。与20%C组相比,完全由合成氨基酸提供氮源的0C组末重减少了106.57 g(减少了38.81%,P < 0.05)。当酪蛋白含量降至15%以下时,大鼠的干物质采食量均出现显著下降(P < 0.05)。
|
|
表 2 饲粮蛋白质水平降低对成年大鼠生长性能的影响 Table 2 Effects of decreasing dietary protein level on growth performance of adult rats (n=7) |
由表 3可知,随着饲粮蛋白质水平的降低,精氨酸、异亮氨酸、亮氨酸、苏氨酸和缬氨酸这5种必需氨基酸的浓度也随之下降,且饲粮蛋白质水平对上述氨基酸的浓度存在显著影响(P < 0.05),而其他必需氨基酸的浓度并非呈线性下降。15%C组的组氨酸浓度高于20%C组,但差异未到达显著水平(P>0.05),之后随着饲粮蛋白质水平的降低,组氨酸浓度逐渐下降,0C组显著低于20%C组(P < 0.05),下降了31.85%。15%C组与10%C组赖氨酸浓度均高于20%C组,但差异未到达显著水平(P>0.05),5%C组与0C组赖氨酸浓度较20%C组分别下降了25.19%和20.07%,差异达到显著水平(P < 0.05)。4个低蛋白质水平组的蛋氨酸浓度均高于20%C组,且15%C组和10%C组与20%C组的差异达到显著水平(P < 0.05),分别增加了20.85%和26.68%。20%C组的色氨酸浓度最低,15%C组、10%C组、5%C组和0C组的色氨酸浓度分别较20%C组增加了26.13%、18.19%、46.82%和31.75%,差异均达到显著水平(P < 0.05)。苯丙氨酸浓度各组之间未见显著差异(P>0.05)。在非必需氨基酸中,与20%C组相比,15%C组的天冬氨酸浓度显著升高了17.24%(P < 0.05),5%C组与0C组则分别下降了37.75%(P < 0.05)和44.68%(P < 0.05),10%C组与20%C组无显著差异(P>0.05)。与20%C组相比,10%C组、5%C组和0C组脯氨酸浓度显著下降(P < 0.05),分别下降了34.68%、60.53%和67.87%,15%C组与20%C组无显著差异(P>0.05)。其他非必需氨基酸浓度各组之间未见显著差异(P>0.05)。
|
|
表 3 饲粮蛋白质水平降低对成年大鼠血清游离氨基酸浓度的影响 Table 3 Effects of decreasing dietary protein level on free amino acid concentrations in serum of adult rats |
由表 4可知,与20%C组相比,15%C组、10%C组、5%C组和0C组大鼠的氮摄入量显著下降(P < 0.05),分别下降了27.23%、49.87%、78.26%和87.69%,继而粪氮排出量和氮沉积量也显著下降(P < 0.05),氮沉积量分别下降了29.87%、52.74%、88.81%和98.60%。随着饲粮蛋白质水平的下降,氮沉积率也随之下降,5%C组和0C组氮沉积率分别比20%C组减少了48.51%(P < 0.05)和88.60%(P < 0.05),15%C组与10%C组则与20%C组无显著差异(P>0.05)。
|
|
表 4 饲粮蛋白质水平降低对成年大鼠氮平衡的影响 Table 4 Effects of decreasing dietary protein level on nitrogen balance of adult rats |
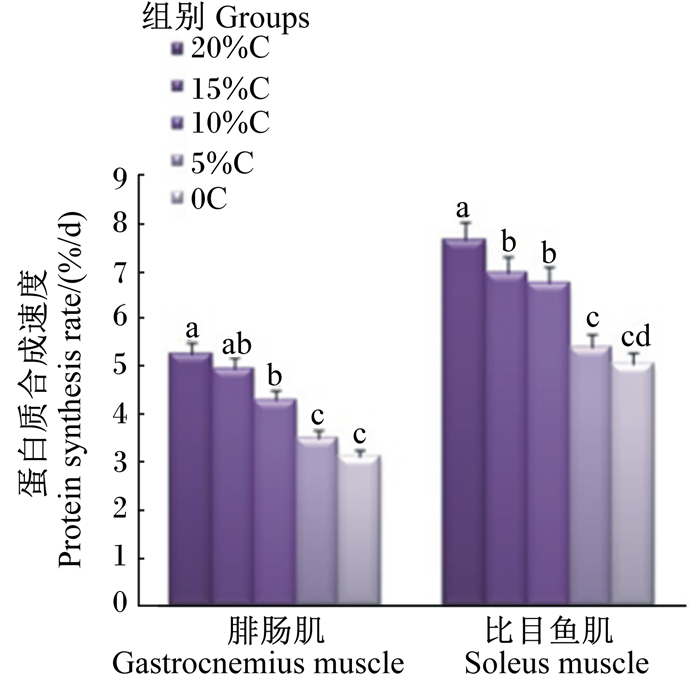
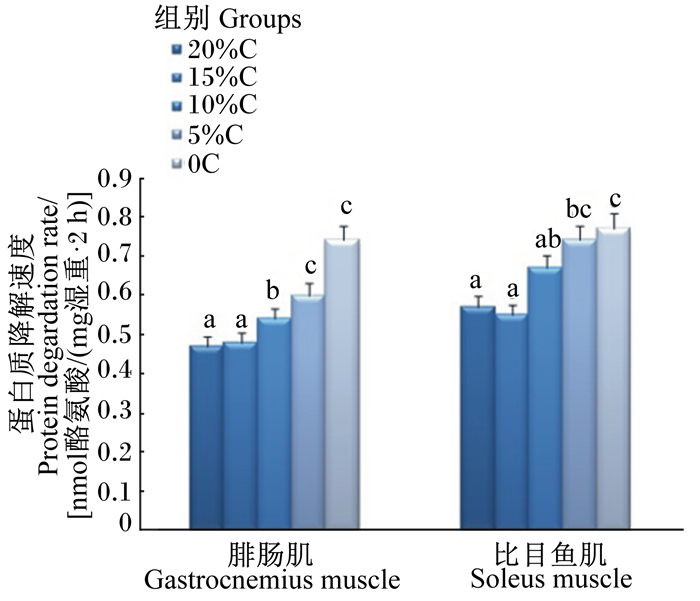
从图 1和图 2中可以看出,饲粮蛋白质水平的降低会导致腓肠肌和比目鱼肌蛋白质合成速度下降,而蛋白质降解速度升高。在腓肠肌中,与20%C组相比,15%C组蛋白质合成和降解速度无显著差异(P>0.05),当饲粮酪蛋白含量从15%分别下降至10%、5%和0时,肌肉蛋白质合成速度分别下降了18.25%(P>0.05)、33.65%(P < 0.05)和40.68%(P < 0.05),而蛋白质降解速度分别提高了17.54%(P < 0.05)、29.82%(P < 0.05)和35.09%(P < 0.05)。在比目鱼肌中,与20%C组相比,4个蛋白质水平降低组大鼠蛋白质合成速度均显著下降(P < 0.05),分别下降了9.00%、11.55%、29.15%和33.99%,而15%C组与10%C组大鼠蛋白质降解速度与20%C组无显著差异(P>0.05),5%C组和0C组蛋白质降解速度增加,分别比20%C组升高了27.66%(P < 0.05)和57.45%(P < 0.05)。
|
数据柱形标注不同小写字母表示差异显著(P<0.05),无字母或相同字母表示差异不显著(P>0.05)。图 2同。 Value columns with different small letters mean significant difference (P<0.05), while with no letter or the same letter superscripts mean no significant difference (P > 0.05). The same as Fig. 2. 图 1 饲粮蛋白质水平降低对成年大鼠骨骼肌蛋白质合成的影响 Fig. 1 Effects of decreasing dietary protein level on protein synthesis of skeletal muscle of adult rats |
|
图 2 饲粮蛋白质水平降低对成年大鼠骨骼肌蛋白质降解的影响 Fig. 2 Effects of decreasing dietary protein level on protein degradation of skeletal muscle of adult rats |
已有研究表明,饲粮中营养物质的水平发生变化时,会影响到大鼠的采食量及生长速度。Leung等[11]研究发现,当向大鼠颈动脉注射氨基酸不平衡混合液(缺乏组氨酸或苏氨酸)时,大鼠的采食量下降,补充缺乏的氨基酸后,采食量立即恢复。De Angelis等[12]发现大鼠的采食量与饲粮蛋白质中必需氨基酸与非必需氨基酸的比例有关。Krauss等[13]报道,当饲粮蛋白质水平低于10%或高于40%时,成年肥胖大鼠的自由采食量降低。Mercer等[14]研究了饲粮蛋白质水平(0、12%和30%酪蛋白)对断奶仔鼠采食量和生长性能的影响,结果发现,与30%酪蛋白组相比,12%酪蛋白组和无酪蛋白组仔鼠的采食量分别下降了30%和60%,而12%酪蛋白组的平均日增重也显著下降,无酪蛋白组则出现了体重比试验初始时下降的现象,这与本试验所观察到的情况相吻合,大鼠体重的下降可能是由采食量降低引起的。Madani等[15]在生长大鼠上所得的研究结果与本试验一致,当饲粮酪蛋白含量低于10%时,大鼠的采食量会下降,继而导致生长速度低于正常及高蛋白质水平组。Ribeiro等[16]给断奶仔鼠分别饲喂蛋白质水平为14%、21%和28%的饲粮,发现21%蛋白质水平饲粮仔鼠的平均日增重最大,蛋白质水平过高或过低都会降低仔鼠的增重。因此,饲粮蛋白质水平以及蛋白质中氨基酸比例、氨基酸混合物中某种氨基酸的含量都会影响大鼠的采食量或生长性能。
3.2 饲粮蛋白质水平降低对成年大鼠血清游离氨基酸浓度的影响对比试验饲粮配方可见,当饲粮酪蛋白含量为200 g/kg时(20%C组),饲粮需添加蛋氨酸和色氨酸才能满足成年大鼠对氨基酸的需要,这说明,酪蛋白对于成年大鼠是一种氨基酸不平衡的蛋白质原料。但补充了合成蛋氨酸和色氨酸后,与其他组相比,20%C组血清中这2种氨基酸的浓度仍较低,这可能是由于酪蛋白中这2种氨基酸的利用率比较低。
3.3 饲粮蛋白质水平降低对成年大鼠氮平衡的影响Ward等[4]研究了饲粮蛋白质水平(5%、15%和25%酪蛋白含量)对生长大鼠氮平衡的影响,结果发现,在15%酪蛋白组与25%酪蛋白组中,大鼠平均日采食量和氮沉积量无显著差异,而5%酪蛋白组大鼠平均日采食量及氮沉积量显著低于这2组。本试验中,20%C组平均日增重低于15%C组,这是因为15%C组的能量沉积最高,而20%C组多沉积的氮可能用于骨骼沉积、体内蛋白质周转等。Wang等[17]研究发现,低蛋白质水平会影响哺乳动物雷帕霉素靶蛋白(mTOR)信号通路,蛋白质水平过度降低时会影响核糖体蛋白S6激酶1(S6K1)的磷酸化,进而抑制mTOR信号通路,从而限制蛋白质的合成;同时,蛋白质水平过度降低也会导致蛋白质在体内从头合成过程中氮源不足,机体自身内源蛋白质过度降解,进而影响大鼠的生长发育。因此,综合本试验与上述研究的结果可知,在按AIN-93G标准需要量逐级补充所有必需氨基酸的前提下,大鼠低蛋白质饲粮中酪蛋白含量降低至10%可以满足大鼠正常生长代谢所需的氮量。
3.4 饲粮蛋白质水平降低对成年大鼠骨骼肌蛋白质合成和降解的影响Smith等[18]研究了15%和25%酪蛋白含量的饲粮对断奶仔鼠骨骼肌蛋白质合成的影响,发现2种饲粮对断奶仔鼠比目鱼肌和伸趾长肌蛋白质合成均无显著影响。Yoshizawa等[19]给饥饿大鼠分别饲喂0和20%酪蛋白含量的饲粮,研究发现,与饥饿对照组相比,20%酪蛋白组大鼠的蛋白质合成速度显著升高,而无酪蛋白组则无显著变化,且20%酪蛋白组促进蛋白质合成是因为提高了翻译起始水平。Brodsky等[20]以成人为对象,研究了高低蛋白质摄入量对骨骼肌蛋白质合成的影响,结果发现,当成人每日蛋白质摄入量(每天供给0.71 g/kg BW无脂瘦肉)过低时,肌肉蛋白质合成速度比正常蛋白质摄入组(每天供给1.67 g/kg BW无脂瘦肉)低81%。Frank等[21]发现,给新生仔猪饲喂蛋白质水平分别为21%、33%和45%的饲粮,之后饥饿一晚时测定的肌肉蛋白质合成速度比重新饲喂试验饲粮时测定的合成速度均降低,饲粮蛋白质水平越高,仔猪饥饿时肌肉蛋白质合成速度越低,而在重新饲喂后,蛋白质合成速度各组间无显著差异。本试验中骨骼肌蛋白质合成速度均为试验结束时大鼠饥饿空腹状态下测定的,这些试验结果与Frank等[21]所得结果相反,高蛋白质水平组大鼠蛋白质合成速度较高,造成这种差异的原因可能是物种不同、饥饿时间长短不同以及饲粮蛋白质水平不同等。
Ward等[4]给生长大鼠分别饲喂5%、15%和25%酪蛋白含量的饲粮,通过体内试验研究其对大鼠蛋白质降解的影响,结果发现15%与25%酪蛋白组大鼠肌肉蛋白质降解速度无显著差异,而5%酪蛋白组大鼠虽体增重较低,但其肌肉降解速度在饲喂初始时高于另外2个组,之后趋于平缓,并仍低于另外2个组。造成此差异的原因可能是测定方法不同,本研究是通过体外培养大鼠肌肉组织研究各组大鼠肌肉蛋白质降解的潜能,而Ward等[4]是通过体内试验研究了肌肉降解的动态变化过程,由此可以看出,通过不同的技术或不同的方法,研究的结果可能会不同。Sugawara等[22]给生长大鼠分别饲喂0、5%和20%酪蛋白含量的饲粮,通过屠宰后体外培养肌肉组织研究肌肉蛋白质降解,结果发现无酪蛋白组和5%酪蛋白组大鼠伸趾长肌蛋白质降解速度显著高于20%酪蛋白组,而无酪蛋白组和5%酪蛋白组之间无显著差异,这与本试验中按AIN-93G标准需要量逐级补充所有必需氨基酸后,0C组、5%C组和20%C组的蛋白质降解速度比较结果相吻合。
4 结论给成年大鼠饲喂不同蛋白质水平(按AIN-93G标准需要量补充各种合成氨基酸)的饲粮,会影响大鼠的生长性能、氮平衡以及骨骼肌蛋白质周转。与饲粮酪蛋白含量为20%相比,当饲粮酪蛋白含量低于10%时,大鼠生长受到抑制,体重显著下降,氮沉积量显著减少,骨骼肌蛋白质合成减少、降解增加。因此,在以酪蛋白为唯一氮源的情况下,成年大鼠低蛋白质饲粮中酪蛋白含量降低至15%较适宜。
| [1] |
PREWITT T E, D'ERCOLE A J, SWITZER B R, et al. Relationship of serum immunoreactive somatomedin-C to dietary protein and energy in growing rats[J]. The Journal of Nutrition, 1982, 112(1): 144-150. |
| [2] |
SWICK R W, GRIBSKOV C L. The effect of dietary protein levels on diet-induced thermogenesis in the rat[J]. The Journal of Nutrition, 1983, 113(11): 2289-2294. DOI:10.1093/jn/113.11.2289 |
| [3] |
MASANÉS R, FERNÁNDEZ-LÓPEZ J A, ALEMANY M, et al. Effect of dietary protein content on tissue protein synthesis rates in Zucker lean rats[J]. Nutrition Research, 1999, 19(7): 1017-1026. DOI:10.1016/S0271-5317(99)00062-7 |
| [4] |
WARD L C, BUTTERY P J. Dietary protein intake and 3-methylhistidine excretion in the rat[J]. British Journal of Nutrition, 1980, 44(3): 381-390. DOI:10.1079/BJN19800053 |
| [5] |
HOWARTH R E. Influence of dietary protein on rat skeletal muscle growth[J]. The Journal of Nutrition, 1972, 102(1): 37-43. |
| [6] |
REEVES P G. Components of the AIN-3 diets as improvements in the AIN-76A diet[J]. Journal of Nutrition, 1997, 127(Suppl.5): :838S-841S. |
| [7] |
REEVES P G, NIELSEN F H, FAHEY G C, Jr. AIN-93 purified diets for laboratory rodents:final report of the American Institute of Nutrition ad hoc writing committee on the reformulation of the AIN-76A rodent diet[J]. The Journal of Nutrition, 1993, 123(11): 1939-1951. DOI:10.1093/jn/123.11.1939 |
| [8] |
毛湘冰, 曾祥芳, 蔡传江, 等. 日粮中添加亮氨酸对生长大鼠血浆瘦素水平和骨骼肌蛋白质代谢的影响[J]. 中国畜牧杂志, 2011, 47(15): 26-30. |
| [9] |
GARLICK P J, FERN M, PREEDY V R. The effect of insulin infusion and food intake on muscle protein synthesis in postabsorptive rats[J]. Biochemical Journal, 1983, 210(3): 669-676. |
| [10] |
TAWA N E, J r, GOLDBERG A L. Suppression of muscle protein turnover and amino acid degradation by dietary protein deficiency[J]. American Journal of Physiology, 1992, 263: E317-E325. |
| [11] |
LEUNG P M B, ROGERS Q R. Food intake:regulation by plasma amino acid pattern[J]. Life Sciences, 1969, 8(2): 1-9. DOI:10.1016/0024-3205(69)90110-6 |
| [12] |
DE ANGELIS R C, TAKAHASHI N, AMARAL L A, et al. Imbalanced protein and appetite[J]. Arquivos de Gastroenterologia, 1978, 15(4): 194-198. |
| [13] |
KRAUSS R M, MAYER J. 'Safety valve' effect of excess dietary amino-acids and protein on food intake in hyperphagic rats[J]. Nature, 1963, 200(4912): 1213-1214. DOI:10.1038/2001213a0 |
| [14] |
MERCER L P, WATSON D F, RAMLET J S. Control of food intake in the rat by dietary protein concentration[J]. The Journal of Nutrition, 1981, 111(6): 1117-1123. DOI:10.1093/jn/111.6.1117 |
| [15] |
MADANI S, PROST J, BELLEVILLE J. Dietary protein level and origin (casein and highly purified soybean protein) affect hepatic storage, plasma lipid transport, and antioxidative defense status in the rat[J]. Nutrition, 2000, 16(5): 368-375. DOI:10.1016/S0899-9007(00)00237-9 |
| [16] |
RIBEIRO S M, ROGERO M M, BACURAU R F, et al. Effects of different levels of protein intake and physical training on growth and nutritional status of young rats[J]. Journal of Nutritional Science and Vitaminology, 2010, 56(3): 177-184. DOI:10.3177/jnsv.56.177 |
| [17] |
WANG D, WAN X B, PENG J, et al. The effects of reduced dietary protein level on amino acid transporters and mTOR signaling pathway in pigs[J]. Biochemical and Biophysical Research Communications, 2017, 485(2): 319-327. DOI:10.1016/j.bbrc.2017.02.084 |
| [18] |
SMITH C K, DURSCHLAG R P, LAYMAN D K. Response of skeletal muscle protein synthesis and breakdown to levels of dietary protein and fat during growth in weanling rats[J]. The Journal of Nutrition, 1982, 112(2): 255-262. DOI:10.1093/jn/112.2.255 |
| [19] |
YOSHIZAWA F, KIMBALL S R, VARY T C, et al. Effect of dietary protein on translation initiation in rat skeletal muscle and liver[J]. American Journal of Physiology, 1998, 275: E814-E820. |
| [20] |
BRODSKY I G, SUZARA D, HORNBERGER T A, et al. Isoenergetic dietary protein restriction decreases myosin heavy chain Ⅱx fraction and myosin heavy chain production in humans[J]. The Journal of Nutrition, 2004, 134(2): 328-334. DOI:10.1093/jn/134.2.328 |
| [21] |
FRANK J W, ESCOBAR J, SURYAWAN A, et al. Protein synthesis and translation initiation factor activation in neonatal pigs fed increasing levels of dietary protein[J]. The Journal of Nutrition, 2005, 135(6): 1374-1381. |
| [22] |
SUGAWARA T, ITO Y, NISHIZAWA N, et al. Supplementation with dietary leucine to a protein-deficient diet suppresses myofibrillar protein degradation in rats[J]. Journal of Nutritional Science and Vitaminology, 2007, 53(6): 552-555. DOI:10.3177/jnsv.53.552 |




