肠毒性大肠杆菌(enterotoxigenic Escherichia coli,ETEC)是一种常见的可导致宿主机体发生腹泻的病原菌[1],可破坏肠道紧密连接和细胞完整性,降低动物生产性能,这种致病作用与其细胞表面所带的菌毛有关。有研究报道ETEC可通过Toll样受体(TLR)-髓样分化因子88(MyD88)信号通路提高机体炎症反应[2],与此同时,有研究者证实凝结芽孢杆菌、短小芽孢杆菌等可以拮抗大肠杆菌的生长与毒性[3-4],其机制为一些芽孢杆菌能产生有机酸,有助于优势菌的生长[5]。
食物经摄取后,被消化道酶类水解为小分子营养物质,再经肠上皮细胞吸收进入血液循环。转运载体在其中起着至关重要的作用,常见的转运载体有葡萄糖转运载体、小肽转运载体和氨基酸转运载体,如Na+依赖性葡萄糖转运载体1(SGLT1)和葡萄糖转运载体2(GLUT2),各种酸、碱和中性氨基酸转运载体,小肽转运载体1(PepT1)等[6]。肠道结构与功能的完整性是机体对营养物质消化吸收的重要保障,食物或外界中的病原菌进入肠道后会引起机体一系列的防御反应,使机体产生炎症,导致动物患上炎性肠病如克罗恩病。近年来的大量研究表明,益生菌可改善肠道结构和菌群组成,增强免疫水平,从而提高畜禽的生产性能[7-9];同时,益生菌还在降低动物肠道通透性,增加多种紧密连接蛋白的表达,下调凋亡蛋白的表达等方面具有显著效果[10]。
本课题组前期从土壤中分离出1株解淀粉芽孢杆菌SC06(以下简称SC06),研究发现其可缓解肠上皮细胞氧化应激状态[11]、增强小鼠机体免疫功能[12]、诱导自噬并抵御大肠杆菌侵袭[13]、改善仔猪生长性能和肠屏障功能[14],同时证实其可以替代抗生素应用于仔猪养殖[15]。关于益生菌对ETEC感染的研究主要集中在炎症免疫方面,而有关对肠上皮吸收和完整性的研究并不多。因此,本试验通过建立ETEC感染猪肠上皮细胞模型,观察SC06对细胞转运载体、紧密连接、凋亡和免疫相关基因表达的影响,旨在为其在畜禽生产中的应用提供可靠的理论依据。
1 材料与方法 1.1 试验材料IPEC-1细胞由浙江省农业科学院畜牧兽医研究所惠赠;SC06从土壤中分离获得,保藏在中国武汉典型培养物保藏中心,保藏号为CCTCC No:M 2012280;ETEC K88(以下简称K88)购自国家兽医微生物菌种保藏管理中心。试验中用到的材料还有DMEM/F12培养基(Gibco)、胰蛋白胨、酵母提取物、氯化钠、胎牛血清(Gibco)、青霉素/链霉素双抗(碧云天)、胰蛋白酶消化液(Hyclone)、磷酸盐缓冲液(PBS)(索莱宝)、RNA提取试剂盒(TaKaRa)、反转录试剂盒(TaKaRa)、SYBR实时定量PCR试剂盒(TaKaRa)。
1.2 试验设计取胰蛋白胨、酵母提取物和氯化钠按照常规配方制成LB液体培养基,用于培养SC06和K88。按2%接种量在摇床内以37 ℃、180 r/min的转速发酵至对数生长期后,4 ℃、5 000 r/min离心10 min,将细菌用无菌PBS洗涤与重悬,在600 nm下检测调整菌液浓度为108 CFU/mL。IPEC-1细胞用含有胎牛血清、青霉素/链霉素双抗的DMEM/F12培养基培养于37 ℃、5% CO2培养箱内,每隔1 d换1次新鲜的培养基,连续培养12 d后可形成致密的单层肠上皮细胞[16]。将IPEC-1细胞用胰蛋白酶消化液消化、计数后,接种在6孔板内,分为4个组,每组3个重复。待细胞贴壁后,CK组为空白对照,不作处理;SC06组和SC06+K88组先用含有108 CFU/mL SC06的DMEM/F12培养基培养6 h,之后弃去培养基,用PBS洗涤3遍后,K88组和SC06+K88组加入含有108 CFU/mL K88的DMEM/F12培养基培养3 h。乳酸脱氢酶(LDH)活性测定另设以含1%Trinton X-100的DMEM/F12培养基处理的Trinton组为阳性对照。各组细胞均培养9 h。
1.3 测定指标与方法 1.3.1 IPEC-1细胞完整性的测定通过细胞培养上清中LDH的活性反映IPEC-1细胞的完整性。各组IPEC-1细胞培养结束后,收集细胞培养上清,采用南京建成生物工程研究所的试剂盒测定LDH活性。
1.3.2 IPEC-1细胞转运载体、紧密连接、凋亡和免疫相关基因表达的测定各组IPEC-1细胞培养结束后,用PBS洗涤2遍,然后按照RNA提取试剂盒说明书操作,提取总RNA,制备反应体系,进行实时定量PCR[17],引物序列详见表 1。目的基因的相对表达量用2-ΔΔCt表示。
|
|
表 1 引物序列信息 Table 1 Primer sequences |
使用SPSS 16.0统计软件,通过one-way ANOVA程序进行单因素方差分析,LSD法比较组间差异显著性。LDH活性结果使用GraphPad Prism 7软件作图。数据以“平均值±标准差”表示,P < 0.05表示具有统计学意义。
2 结果与分析 2.1 SC06与K88对IPEC-1细胞完整性的影响由图 1可知,与CK组相比,Trinton组与K88组细胞培养上清中LDH的活性显著增加(P < 0.05),SC06组则无显著变化(P>0.05),说明K88攻毒模型成功建立,而SC06对IPEC-1细胞无破坏性。与K88组相比,SC06+K88组细胞培养上清中LDH的活性显著降低(P < 0.05),表明SC06缓解了K88对IPEC-1细胞完整性的破坏。
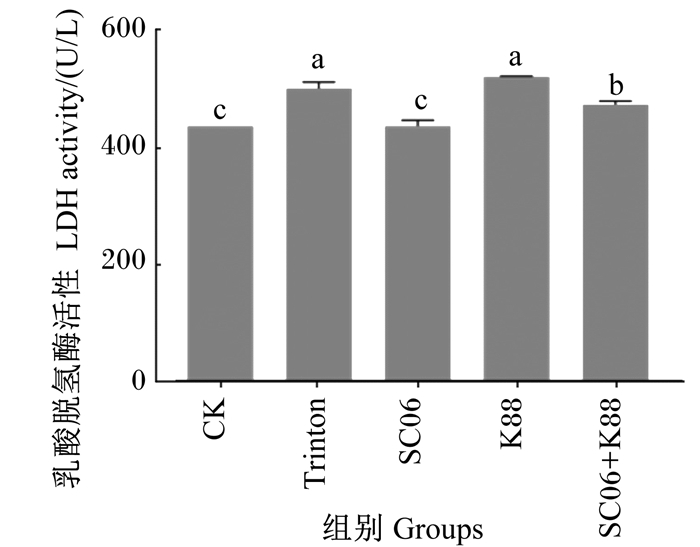
|
数据柱形标注相同字母表示差异不显著(P>0.05),不同小写字母表示差异显著(P < 0.05)。 Value columns with the same letters mean no significant difference (P>0.05), while with different small letters mean significant difference (P < 0.05). 图 1 IPEC-1细胞培养上清中LDH的活性 Fig. 1 LDH activity in IPEC-1 cell supernatant |
由表 2可知,与CK组相比,K88和SC06单独处理显著降低了IPEC-1细胞中GLUT2和PepT1基因的相对表达量(P < 0.05),但显著增加了兴奋性氨基酸转运载体1(EAAC1)基因的相对表达量(P < 0.05);另外,SC06单独处理还显著增加了丙氨酸/丝氨酸/半胱氨酸/苏氨酸转运载体2(ASCT2)基因的相对表达量(P < 0.05)。与K88单独处理相比,SC06预处理进一步显著降低了IPEC-1细胞中GLUT2基因的相对表达量(P < 0.05),并显著抑制了K88诱导的EAAC1基因相对表达量的增加(P < 0.05),但对PepT1基因的相对表达量无显著影响(P>0.05)。虽然K88和SC06单独处理对ASCT1、L型氨基酸转运载体1(LAT1)和脂肪酸转位酶(FAT/CD36)基因的相对表达量并无显著影响(P>0.05),但与K88单独处理相比,SC06预处理显著增加了这些转运载体基因的相对表达量(P < 0.05)。
|
|
表 2 IPEC-1细胞内转运载体基因的相对表达量 Table 2 Relative expression levels of transporter genes in IPEC-1 cells |
细胞紧密连接相关基因表达结果(表 3)显示,与CK组相比,K88单独处理显著增加了IPEC-1细胞间闭锁小带蛋白-1(ZO-1)和闭合蛋白(occludin)基因的相对表达量(P < 0.05),显著降低了密封蛋白-3(claudin-3)、密封蛋白-4(claudin-4)和黏蛋白1(MUC1)基因的相对表达量(P < 0.05);SC06单独处理显著增加了IPEC-1细胞间ZO-1与claudin-4基因的相对表达量(P < 0.05)。与K88单独处理相比,SC06预处理显著缓解了IPEC-1细胞间ZO-1基因的过高表达(P < 0.05),且使occludin基因的相对表达量继续显著升高(P < 0.05),并显著增加了claudin-3、claudin-4和MUC1基因的相对表达量(P < 0.05),其中claudin-4基因的相对表达量恢复到了SC06组的水平。IPEC-1细胞间绒毛蛋白样蛋白(Vill)基因的相对表达量各组之间均无显著差异(P>0.05)。
|
|
表 3 IPEC-1细胞间紧密连接蛋白、黏蛋白及绒毛基因的相对表达量 Table 3 Relative expression levels of intercellular tight junction protein, mucin and villus genes in IPEC-1 cells |
细胞凋亡相关基因表达结果(表 4)显示,与CK组相比,K88和SC06单独处理显著增加了IPEC-1细胞中天冬氨酸水解酶-3(caspase-3)、凋亡相关因子(Fas)及B淋巴细胞瘤-2(Bcl-2)基因的相对表达量(P < 0.05),显著降低了天冬氨酸蛋白水解酶-9(caspase-9)和Bcl-2相关X蛋白(Bax)基因的相对表达量(P < 0.05);另外,K88单独处理还显著降低了IPEC-1细胞中天冬氨酸蛋白水解酶-8(caspase-8)基因的相对表达量(P < 0.05)。与K88单独处理相比,SC06预处理显著逆转了IPEC-1细胞中caspase-3、Bcl-2、caspase-9和Bax基因的表达(P < 0.05)。
|
|
表 4 IPEC-1细胞中凋亡相关基因相对表达量 Table 4 Relative expression levels of related apoptosis genes in IPEC-1 cells |
由表 5可知,与CK组相比,K88单独处理显著增加了IPEC-1细胞中肿瘤坏死因子-α(TNF-α)、白细胞介素-6(IL-6)和白细胞介素-8(IL-8)基因的相对表达量(P < 0.05),SC06单独处理显著降低了白细胞介素-6(IL-6)基因的相对表达量(P < 0.05),且二者均可显著增加转化生长因子-β(TGF-β)基因的相对表达量(P < 0.05)。与K88单独处理相比,SC06预处理进一步上调了TNF-α、IL-8、IL-6和TGF-β这些细胞因子基因的表达(P < 0.05)。
|
|
表 5 IPEC-1细胞中免疫因子基因的相对表达量 Table 5 Relative expression levels of immune factor genes in IPEC-1 cells |
由表 6可知,与CK组相比,K88单独处理显著增加了IPEC-1细胞中核转录因子-κB-p50(NF-κB-p50)、肿瘤坏死因子受体相关因子-6(TRAF-6)、MyD88、核苷酸结合寡聚域-1(NOD-1)及Toll样受体4(TLR4)基因的相对表达量(P < 0.05),SC06单独处理显著增加了IPEC-1细胞中MyD88基因的相对表达量(P < 0.05),显著降低了NOD-1与Toll样受体6(TLR6)基因的相对表达量(P < 0.05)。与K88单独处理相比,SC06预处理显著促进了IPEC-1细胞中TRAF-6基因的表达(P < 0.05),显著抑制了MyD88、NOD-1及TLR4基因的表达(P < 0.05)。
|
|
表 6 IPEC-1细胞中免疫相关信号通路蛋白基因相对表达量 Table 6 Relative expression levels of related immune signaling pathway protein genes in IPEC-1 cells |
正常情况下,细胞内的LDH不会被释放出来,当细胞膜遭到破坏,培养上清中的LDH活性会增加。LDH活性测定结果表明,与CK组相比,SC06对IPEC-1细胞无破坏作用,并缓解了K88对细胞完整性的损伤,说明该益生菌在病原菌入侵条件下对细胞有一定的保护作用。
机体摄入的食物被消化后,特别是碳水化合物与氨基酸等小分子物质需经过肠道上皮的转运载体转运到细胞内被吸收利用。常见的转运载体有SGLT1和GLUT2、各种酸碱和中性氨基酸转运载体、PepT1及FAT/CD36[6]。Jahromi等[18]发现2种乳杆菌混合制剂能提高肉鸡肠道包括GLUT2及SGLT1在内的4种单糖转运载体基因的表达。也有作者报道乳杆菌与抗生素混合使用可显著提高肉鸡小肠PepT1的mRNA表达量[19]。吴云鹏[20]研究发现,K88处理IPEC-J2细胞3 h后,显著下调了SGLT1、碱性氨基酸转运载体1(CAT1)、y+L氨基酸转运体1(y+LAT1)和ASCT2基因的表达,植物乳杆菌预处理显著抑制了这些转运载体基因表达的下调。本试验结果表明,与CK组相比,SC06单独处理显著增加了IPEC-1细胞中ASCT2和EAAC1基因的相对表达量,K88单独处理显著降低IPEC-1细胞中GLUT2和PepT1基因的相对表达量,显著增加了EAAC1基因的相对表达量,与K88单独处理相比,SC06预处理显著降低了IPEC-1细胞中EAAC1基因的相对表达量,这说明K88对一些转运载体具有破坏或刺激作用,而SC06在一定程度上保护了机体对营养物质的吸收能力。
肠黏膜稳态是由附着在肠黏膜上的黏液层、多种微生物及细胞之间的平衡所构成,黏液屏障是抵御内外源性刺激及病原菌的第1道防线。黏液层中的黏蛋白是肠道杯状细胞和上皮细胞的主要产物,至今发现共存在21种黏蛋白基因[21]。炎症性肠病(IBD)的发生通常伴随着黏蛋白基因的异常表达,此外,炎症因子的分泌也可影响黏蛋白基因的表达[22]。黏膜物理屏障即细胞间的紧密连接蛋白,它是一种多蛋白复合物,用于封闭上皮细胞间的间隙,以控制各种离子及溶质的进出[23]。有试验表明,K88攻毒组或IBD模型中MUC1基因的mRNA表达量显著高于对照组[24-25],这与本试验结果相反,这可能与攻毒处理条件不同有关。本试验结果表明,与K88单独处理相比,SC06预处理显著上调了IPEC-1细胞间MUC1基因的表达。Lodemann等[26]研究显示,ETEC虽然没有显著降低肠上皮细胞间claudin-4基因的表达,但显著降低了其蛋白的表达;Wang等[27]利用免疫荧光方法发现ETEC可破坏猪肠上皮细胞间ZO-1的分布,且益生菌猪源罗伊氏乳杆菌(Lactobacillus reuteri) LR1预培养2 h后再与ETEC共培养可显著抑制ETEC的破坏作用;另有研究结果同样得出活益生菌预处理显著阻止了ETEC引起的肠上皮电阻降低及磷酸化occludin和ZO-1蛋白表达减少的结论[28]。本试验结果与上述研究结果相似,SC06不仅显著提高了ZO-1与claudin-4基因的表达,还显著抑制了K88对claudin-3、claudin-4和MUC1基因表达的下调,说明SC06改善了肠道物理屏障功能。然而,K88处理引起IPEC-1细胞间ZO-1和occludin基因的高表达,而SC06预处理阻止了ZO-1基因的这种高表达,却继续上调occludin的表达,此结果可能与机体处于防御状态有关,具体机制还有待进一步研究。
细胞增殖与凋亡属于机体正常的新陈代谢,但异常的增殖或凋亡会使机体产生疾病。凋亡途径可分为2条:死亡受体通路(外源途径)和线粒体通路(内源途径)。发生细胞凋亡时会伴随着天冬氨酸蛋白水解酶(caspase)家族的活化、蛋白质交联和DNA降解等,一旦caspase酶原被激活,就会进一步作用于通路下游的其他caspase酶原产生级联反应,最终诱导细胞凋亡。凋亡过程的启动者caspase-8、caspase-9及凋亡的执行者caspase-3均是caspase家族的主要成员。在外源途径中,FasL/FasR是比较经典的配体与死亡受体结合的类型,Fas受体发生一系列结构变化后与Fas相关死亡结构域结合再与caspase-8、caspase-10前体结合,随后引发caspase级联反应;在内源途径中,Bcl-2蛋白家族起关键作用,此家族不仅包括抗凋亡蛋白Bcl-2、Bcl-x等,还包含促凋亡蛋白Bax等[29-30]。相关研究显示,乳酸杆菌表面的蛋白质分子S-层蛋白能显著抑制caspase-3的活性并显著拮抗鼠伤寒沙门氏菌诱导的细胞凋亡[31];Tang等[32]的研究结果显示,ETEC感染IEC-1细胞2 h后,显著增加凋亡阳性细胞个数及caspase-3蛋白的表达,降低Bcl-2蛋白的表达,而Syed等[33]研究发现ETEC处理IEC-18细胞24 h后显著激活caspase-3和caspase-9。此外,免疫染色结果显示益生菌混合制剂能很好地抑制结肠炎小鼠肠道caspase-3的高表达,阻止细胞凋亡[34],且寡聚化的NOD-1可与caspase-9前体结合,促进细胞凋亡[35]。本研究发现K88可诱导NOD-1基因的相对表达量增加,而SC06则使其相对表达量降低,这也一定程度上说明K88促进细胞凋亡,而SC06抑制细胞凋亡。相比CK组,K88单独处理显著促进了caspase-3和Fas基因的表达,诱导细胞凋亡;而SC06单独处理则显著抑制了caspase-3基因的表达,并且能显著上调Bcl-2基因的表达,显著抑制caspase-9和Bax基因的表达,说明SC06在一定程度上缓解了细胞凋亡。
当肠道物理屏障受到破坏后,病原菌等就极易攻击化学屏障即肠黏膜免疫屏障。肠黏膜免疫屏障主要由相关淋巴组织、分泌型免疫球蛋白A和细胞因子构成。激活免疫系统可促使细胞分泌细胞因子,如肿瘤坏死因子(TNFs)、白细胞介素(ILs)、干扰素(IFNs)等,这些细胞因子在炎症反应中发挥着重要作用。TLRs是一类能识别抗原引发先天免疫应答,使免疫细胞释放细胞因子的功能性细胞膜和细胞质受体,属于免疫细胞表面模式识别受体(PRRs)中的一种。通常TLRs被病原体表面的病原分子相关模式识别后会激活2种信号通路:MyD88依赖途径和非MyD88依赖途径,其中TRAF6参与MyD88信号转导,最终激活核转录因子-κB(NF-κB)等信号通路。同样作为胞内PRRs的NOD-1及核苷酸结合寡聚域2(NOD-2),在介导NF-κB通路活化过程中必不可少,最终引发炎症免疫反应,而NF-κB家族又包括p65、p50、p52等成员[35, 36-37]。体外培养IPEC-J2细胞的研究发现,ETEC处理显著上调了炎性因子TNF-α、白细胞介素-1α(IL-1α)和IL-6 mRNA的表达,而与屎肠球菌共同处理后发现此菌可抑制TNF-α和IL-6 mRNA的表达[38],另一种屎肠球菌预处理则能显著抑制ETEC引起的细胞炎性因子IL-8基因表达的上调[39],这与本试验结果一致。同样,ETEC处理3 h显著提高了IPEC-J2细胞中TLR4和NOD-2 mRNA的表达量,鼠李糖乳杆菌缓解此结果且上调TLR2和NOD-1 mRNA的表达,并可中和ETEC诱导的TNF-α含量的增加[40]。在本试验中,K88单独处理显著提高了TNF-α、IL-6、IL-8、NF-κB-p50、TRAF-6、MyD88、NOD-1及TLR4基因的相对表达量,说明K88通过激活MyD88-NF-κB信号通路使细胞产生炎性反应;SC06单独处理显著降低了IL-6、NOD1和TLR6基因的相对表达量,且显著增加了TGF-β基因的相对表达量,说明SC06有抑炎作用;SC06预处理虽然显著抑制了MyD88、NOD-1及TLR4基因的表达,却进一步显著促进了其他炎症因子及通路蛋白的基因表达,与薛俊敬[41]得出的枯草芽孢杆菌上调了草鱼MyD88、IL-6与TLR-4基因表达的结果类似,表明SC06虽在某种程度上抑制了炎症反应的发生,但可能因本试验使用的是活益生菌处理或因处理时间的影响,使得SC06与K88共处理时对细胞的刺激加大,炎症水平提高,具体原因还需进一步验证。
4 结论SC06和K88均能影响IPEC-1细胞营养物质吸收转运、紧密连接蛋白、凋亡和炎症等相关基因的表达,且SC06通过抑制MyD88-NF-κB信号通路缓解K88所致的过度炎症反应和对细胞的破坏。
| [1] |
陈清, 俞守义, 申洪, 等. 产毒性大肠杆菌的致病机制[J]. 第一军医大学学报, 2003, 23(8): 826-829. DOI:10.3321/j.issn:1673-4254.2003.08.017 |
| [2] |
李海花, 朱琪, 王世琼, 等. 产肠毒素大肠杆菌K88诱导仔猪炎症反应的分子机制[J]. 中国畜牧兽医, 2017, 44(1): 262-267. |
| [3] |
王磊, 吕阳, 张越, 等. 抑制大肠杆菌K88的益生菌体外筛选[J]. 中国畜牧兽医, 2016, 43(5): 1355-1360. |
| [4] |
朱红梅.产肠毒素性大肠杆菌致病特性及益生菌的筛选与疾病控制研究[D].硕士学位论文.厦门: 厦门大学, 2006. http://cdmd.cnki.com.cn/article/cdmd-10384-2007055678.htm
|
| [5] |
淳泽, 何明清. 芽孢杆菌对肠道致病菌体外生物拮抗作用的研究[J]. 四川农业大学学报, 1994, 12(增刊): 627-634. |
| [6] |
周玲, 王晓清, 刘臻, 等. 营养素转运载体的研究进展[J]. 饲料研究, 2013(4): 18-23. DOI:10.3969/j.issn.1002-2813.2013.04.006 |
| [7] |
ABUDABOS A M, AL-BATSHAN H A, MURSHED M A. Effects of prebiotics and probiotics on the performance and bacterial colonization of broiler chickens[J]. South African Journal of Animal Science, 2015, 45(4): 419-428. |
| [8] |
DONG X L, ZHANG N F, ZHOU M, et al. Effects of dietary probiotics on growth performance, faecal microbiota and serum profiles in weaned piglets[J]. Animal Production Science, 2014, 54(5): 616-621. DOI:10.1071/AN12372 |
| [9] |
TUFARELLI V, CROVACE A M, ROSSI G, et al. Effect of a dietary probiotic blend on performance, blood characteristics, meat quality and faecal microbial shedding in growing-finishing pigs[J]. South African Journal of Animal Science, 2017, 47(6): 875-882. DOI:10.4314/sajas.v47i6.15 |
| [10] |
CUI Y J, LIU L, DOU X X, et al. Lactobacillus reuteri ZJ617 maintains intestinal integrity via regulating tight junction, autophagy and apoptosis in mice challenged with lipopolysaccharide[J]. Oncotarget, 2017, 8(44): 77489-77499. |
| [11] |
WANG Y, WU Y P, WANG Y B, et al. Bacillus amyloliquefaciens SC06 alleviates the oxidative stress of IPEC-1 via modulating Nrf2/Keap1 signaling pathway and decreasing ROS production[J]. Applied Microbiology and Biotechnology, 2017, 101(7): 3015-3026. DOI:10.1007/s00253-016-8032-4 |
| [12] |
杜威, 黄琴, 付爱坤, 等. 解淀粉芽孢杆菌SC06对环磷酰胺诱导的免疫抑制小鼠免疫功能的影响[J]. 中国畜牧杂志, 2015, 51(1): 60-64. DOI:10.3969/j.issn.0258-7033.2015.01.013 |
| [13] |
WU Y P, WANG Y, ZOU H, et al. Probiotic Bacillus amyloliquefaciens SC06 induces autophagy to protect against pathogens in macrophages[J]. Frontiers in Microbiology, 2017, 8: 469. |
| [14] |
杜威, 曹雪芳, 付爱坤, 等.解淀粉芽孢杆菌对仔猪生长性能、肠黏膜屏障功能及其相关信号通路的影响[C]//中国畜牧兽医学会动物微生态学分会第五届第十二次全国学术研讨会论文集.青岛: 中国畜牧兽医学会动物微生态学分会, 2016: 1.
|
| [15] |
WANG Y, WU Y P, WANG B K, et al. Effects of probiotic Bacillus as a substitute for antibiotics on antioxidant capacity and intestinal autophagy of piglets[J]. AMB Express, 2017, 7(1): 52. DOI:10.1186/s13568-017-0353-x |
| [16] |
计坚.解淀粉芽孢杆菌SC06介导猪肠道免疫机理的研究[D].博士学位论文.杭州: 浙江大学, 2013.
|
| [17] |
DU W, XU H, MEI X, et al. Probiotic Bacillus enhance the intestinal epithelial cell barrier and immune function of piglets[J]. Beneficial Microbes, 2018, 9(5): 743-752. DOI:10.3920/BM2017.0142 |
| [18] |
JAHROMI M F, ALTAHER Y W, SHOKRYAZDAN P, et al. Dietary supplementation of a mixture of Lactobacillus strains enhances performance of broiler chickens raised under heat stress conditions[J]. International Journal of Biometeorology, 2016, 60(7): 1099-1110. DOI:10.1007/s00484-015-1103-x |
| [19] |
PAVLOVA I, MILANOVA A, DANOVA S, et al. Enrofloxacin and probiotic lactobacilli influence PepT1 and LEAP-2 mRNA expression in poultry[J]. Probiotics and Antimicrobial Proteins, 2016, 8(4): 215-220. DOI:10.1007/s12602-016-9225-y |
| [20] |
吴云鹏.植物乳杆菌调节猪肠上皮细胞屏障功能和转运载体的研究[D].博士学位论文.广州: 华南农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10564-1016923607.htm
|
| [21] |
胡艳艳. 肠道杯状细胞结构和功能的研究进展[J]. 国际病理科学与临床杂志, 2013, 33(5): 424-430. |
| [22] |
赵美华, 龚陈, 楼江明, 等. 黏蛋白与炎症性肠病关系的研究进展[J]. 世界华人消化杂志, 2014, 22(27): 4100-4106. |
| [23] |
CAPALDO C T, POWELL D N, KALMAN D. Layered defense:how mucus and tight junctions seal the intestinal barrier[J]. Journal of Molecular Medicine, 2017, 95(9): 927-934. DOI:10.1007/s00109-017-1557-x |
| [24] |
杨宽民, 蒋宗勇, 王丽, 等.植物乳杆菌对感染大肠杆菌K88幼龄仔猪肠黏膜先天免疫反应的影响[C]//第七届中国饲料营养学术研讨会论文集.郑州: 中国畜牧兽医学会动物营养学分会, 2014: 1.
|
| [25] |
杨占清.黏蛋白1、黏蛋白2 mRNA在炎症性肠病大鼠肠黏膜细胞表达规律的研究[D].硕士学位论文.长春: 吉林大学, 2007.
|
| [26] |
LODEMANN U, AMASHEH S, RADLOFF J, et al. Effects of ex vivo infection with ETEC on jejunal barrier properties and cytokine expression in probiotic-supplemented pigs[J]. Digestive Diseases and Sciences, 2017, 62(4): 922-933. DOI:10.1007/s10620-016-4413-x |
| [27] |
WANG Z L, WANG L, CHEN Z, et al. In vitro evaluation of swine-derived Lactobacillus reuteri:probiotic properties and effects on intestinal porcine epithelial cells challenged with enterotoxigenic Escherichia coli K88[J]. Journal of Molecular Biology, 2016, 26(6): 1018-1025. |
| [28] |
RESTA-LENERT S, BARRETT K E. Live probiotics protect intestinal epithelial cells from the effects of infection with enteroinvasive Escherichia coli (EIEC)[J]. Gut, 2003, 52(7): 988-997. DOI:10.1136/gut.52.7.988 |
| [29] |
高薇, 侯微, 李伟, 等. 细胞凋亡机制研究进展[J]. 中国畜牧兽医, 2014, 41(10): 150-156. |
| [30] |
ELMORE S. Apoptosis:a review of programmed cell death[J]. Toxicologic Pathology, 2007, 35(4): 495-516. |
| [31] |
李鹏成.嗜酸乳酸杆菌S-层蛋白拮抗肠道病原菌黏附或入侵宿主细胞机制的研究[D].博士学位论文.南京: 南京农业大学, 2011.
|
| [32] |
TANG Y L, TAN B, XIONG X, et al. Methionine deficiency reduces autophagy and accelerates death in intestinal epithelial cells infected with enterotoxigenic Escherichia coli[J]. Amino Acids, 2015, 47(10): 2199-2204. DOI:10.1007/s00726-014-1781-4 |
| [33] |
SYED H C, DUBREUIL J D. Escherichia coli STb toxin induces apoptosis in intestinal epithelial cell lines[J]. Microbial Pathogenesis, 2012, 53(3/4): 147-153. |
| [34] |
MENNIGEN R, NOLTE K, RIJCKEN E, et al. Probiotic mixture VSL#3 protects the epithelial barrier by maintaining tight junction protein expression and preventing apoptosis in a murine model of colitis[J]. American Journal of Physiology:Gastrointestinal and Liver Physiology, 2009, 296(5): G1140-G1149. DOI:10.1152/ajpgi.90534.2008 |
| [35] |
黄鸿眉, 程茜. NOD1、NOD2:两个重要的天然免疫胞内识别受体[J]. 国际免疫学杂志, 2006, 29(1): 23-26. DOI:10.3760/cma.j.issn.1673-4394.2006.01.008 |
| [36] |
李影, 陈镜宇, 张玲玲, 等. 肿瘤坏死因子受体相关因子参与炎症免疫调节的研究进展[J]. 中国药理学通报, 2015, 31(9): 1206-1211. DOI:10.3969/j.issn.1001-1978.2015.09.006 |
| [37] |
AKIRA S, TAKEDA K. Toll-like receptor signalling[J]. Nature Reviews Immunology, 2004, 4(7): 499-511. DOI:10.1038/nri1391 |
| [38] |
KERN M, GūNZEL D, ASCHENBACH J R, et al. Altered cytokine expression and barrier properties after in vitro infection of porcine epithelial cells with enterotoxigenic Escherichia coli and probiotic Enterococcus faecium[J]. Mediators of Inflammation, 2017, 2017: 2748192. |
| [39] |
TIAN Z Y, LIU X F, DAI R, et al. Enterococcus faecium HDRsEf1 protects the intestinal epithelium and attenuates ETEC-induced IL-8 secretion in enterocytes[J]. Mediators of Inflammation, 2016, 2016: 7474306. |
| [40] |
ZHANG W, ZHU Y H, YANG J C, et al. A selected Lactobacillus rhamnosus strain promotes EGFR-independent Akt activation in an enterotoxigenic Escherichia coli K88-infected IPEC-J2 cell model[J]. PLoS One, 2015, 10(4): e0125717. DOI:10.1371/journal.pone.0125717 |
| [41] |
薛俊敬.益生菌对草鱼生长、营养代谢和机体免疫的影响[D].硕士学位论文.南昌: 南昌大学, 2018. http://cdmd.cnki.com.cn/Article/CDMD-10403-1018226377.htm
|




