2. 山东省畜禽疫病防治与繁育重点实验室, 济南 250100;
3. 山东省肉牛生产性能测定中心, 济南 250100;
4. 山东省畜禽健康养殖工程技术中心, 济南 250100
2. Shandong Key Lab of Animal Disease Control and Breeding, Ji'nan 250100, China;
3. Shandong Provincial Testing Center of Beef Cattle Performance, Ji'nan 250100, China;
4. Shandong Provincial Engineering Technology Center of Animal Healthy Breeding, Ji'nan 250100, China
肠道上皮具有复杂的功能,既能在调控外源物质如细菌的侵袭过程中提供屏障作用,同时也是体内最重要的营养吸收和转运营养因子场所[1]。肠道上皮细胞形成的屏障能够将肠腔中有害物质从间质中隔离出来,在生理和病理条件下对维持肠道完整性和系统稳态具有重要作用[2]。目前,关于小肠上皮细胞的分离培养在人[3]、禽[4]、猪[5]、鼠[6]、羊[7]、兔[8]上均有报道,国外已有学者成功建立了猪的永生化肠道上皮细胞系,包括来源于成年公猪回肠的IPI-2I以及来源于未吃初乳的乳猪空肠的IPEC-J2和IPEC-1[9]。尽管国内外已有关于牛的肠道上皮细胞分离培养的报道,但多是利用成年牛肠道组织,分离得到的细胞活力低且增殖速度慢;并且,在分离方法上多是利用组织块培养法进行,杂细胞较多,纯化难度大[10-11]。另外,在细胞鉴定方面主要是通过鉴定细胞角蛋白,但有研究表明,角蛋白不仅在上皮组织类型细胞中表达,在其他处于分化状态的细胞中也有表达[12-13],因此不能仅仅通过细胞角蛋白验证分离细胞源于小肠上皮细胞。本试验在参照国内外方法的基础上,使用胶原酶Ⅰ和中性酶联合消化法分离刚出生未吮乳犊牛的小肠上皮细胞,并对获得的原代细胞进行纯化和多种方法联合鉴定,以此来探索牛肠道上皮细胞简便可行的分离纯化方法及准确有效的鉴定方法,为国内外相关领域的研究提供基础的技术平台,并为营养物质吸收、免疫调控、肠道屏障功能的研究提供有效的细胞模型。
1 材料与方法 1.1 试验材料刚出生未吸吮母乳的利鲁牛犊牛,注射过量的戊巴比妥钠处以安乐死后,选取空肠中段将两端结扎,用无菌剪刀剪下,放入含有1%青霉素和链霉素(购自Sigma公司)的磷酸盐缓冲液(PBS)中冰浴保存,2 h内带回实验室,备用。试验得到山东省农业科学院动物保护和使用委员会的许可(IACUC20060101),并符合相关试验动物福利的规则和制度。
1.2 试验方法 1.2.1 犊牛小肠上皮细胞的原代培养在实验室超净台内无菌取出犊牛空肠肠段,放入含有1%青霉素和链霉素的PBS中清洗数次,尽量剔除脂肪组织和肠系膜,在Loret[14]、Föllmann等[11]分离培养方法的基础上进行改良。将组织移至另一灭菌的培养皿中,用PBS再次清洗,直至上清液清亮。用眼科剪刀纵向剖开肠管,用PBS清洗5~6次去除内容物,将肠段剪成1 cm2左右的组织块,再用PBS清洗数次至上清液变澄清。静置10 min,去除PBS,转移至无菌烧杯中,加入体积比为1:1的0.1 μg/mL中性酶和300 U/mLⅠ型胶原酶(均购自Sigma公司)混合液,在37 ℃、低速(100 r/min)下磁力搅拌消化组织块。消化1 h后吸取消化液上层,未消化部分加入上述消化酶继续消化1 h,将前后2次消化的组织液放入50 mL离心管中,300×g离心5 min,离心后弃掉上清液。再用PBS和DMEM/F12培养基(购自Gibco公司)分别清洗1遍,直至上清液澄清。此时显微镜下可见大量隐窝,用含10%胎牛血清(购自Gibco公司)的DMEM/F12完全培养基悬浮隐窝并接种至T25培养瓶(购自Nunc公司)中,37 ℃、5%CO2条件下培养48 h后更换培养液,以后每2~3 d更换1次培养液。
1.2.2 犊牛小肠上皮细胞的纯化和传代培养48 h后显微镜下可见小肠上皮细胞集落,同时有大量成纤维细胞,利用差速消化法可以使成纤维细胞脱落[15],肠上皮细胞纯度可达90%以上。具体操作如下:培养瓶中加入胰酶-乙二胺四乙酸(EDTA)(购自Gibco公司)混合溶液2 mL(其中含0.25%胰蛋白酶,0.53 mol/L EDTA),消化3 min,在倒置相差显微镜下观察细胞皱缩和发亮的程度,当成纤维细胞收缩变圆后立即加入含10%胎牛血清的DMEM/F12培养基终止消化,此时犊牛小肠上皮细胞仍然贴壁。用无菌玻璃管吸弃终止的消化液,再用PBS轻轻冲洗培养瓶瓶底2~3次,重新加入含10%胎牛血清的DMEM/F12培养基继续培养。48 h后,显微镜下观察仍有少量成纤维细胞,利用上述方法再次进行纯化,直至显微镜下的视野中大部分为上皮细胞为止。将贴壁的上皮细胞用PBS清洗3次,加入1 mL 0.05%胰酶-EDTA消化液,37 ℃培养箱内放置1~2 min,至大部分细胞变圆、发亮时,加入2 mL完全培养基终止消化,吹打并悬浮细胞,台盼蓝染色计数活细胞,调整细胞密度为0.2×104~0.5×104个/mL,种植至新的培养瓶进行传代。
1.2.3 犊牛小肠上皮细胞生长曲线的测定待第3代犊牛小肠上皮细胞融合达90%以上时,将细胞消化下来后按6×105个/mL的密度接种至96孔培养板内培养,此后每隔24 h取8孔,每孔加入10 μL细胞增殖剂WST-1[16](购自Roche公司),静置培养4 h。将96孔培养板置于振荡器上振荡1 min,用酶标仪(Biotek ELx808,Biotek公司)测定各孔在450 nm下的吸光度(OD)值,并取8孔所测的平均值,连续测定9 d。以时间为横轴,细胞孔测定OD平均值与空白孔测定OD平均值之差为纵轴绘制细胞生长曲线。
1.2.4 犊牛小肠上皮细胞的鉴定免疫荧光鉴定:将细胞按1×106个/mL接种到含载玻片的激光共聚焦用平皿中,待融合至90%,用PBS清洗2~3次,加入固定液多聚甲醛,4 ℃处理20~30 min。将多聚甲醛去除,加入预冷的PBS洗3次,每次5 min。加入含0.5%聚乙二醇辛基苯基醚(Triton X-100,购自Alladin公司)的PBS(PBS-T),在冰上将细胞膜穿刺10 min。去除PBS-T,加入预冷的PBS洗3次,每次5 min。加入含3%牛血清白蛋白(BSA,购自Sigma公司)的PBS,常温封闭30 min。将细胞角蛋白13(CK13)、波形蛋白(vimentin)、绒毛蛋白(villin)单克隆抗体(购自Santa Cruz公司)分别按照1:100的比例稀释在含1%BSA的PBS中,去除封闭液后,加入一抗,4 ℃孵育过夜。去除一抗,加入含0.35%吐温20的PBS,洗3次,每次5 min。将荧光二抗Alexa Fluor 488羊抗兔(H+L)免疫球蛋白G(IgG)(购自Invitrogen公司)按照1:400比例稀释在含1%BSA的PBS中,去除PBS后,加入二抗,室温避光孵育1 h。去除二抗,加入含0.35%吐温20的PBS,洗3次,每次5 min。加入100 ng/mL荧光染料4’, 6-二脒基-2-苯基吲哚(DAPI),室温避光孵育10 min。去除DAPI,加入含0.35%吐温20的PBS,洗3次,每次5 min。加入防荧光淬灭溶液,用激光共聚焦显微镜(Nikon ECLIPSE Ti,日本Nikon株式会社)观察拍照。
电镜检查鉴定:对原代培养细胞进行透射电镜观察,将细胞按照1×106个/mL接种到转移小室(transwell)中,待90%融合后,PBS清洗2次,加入2.5%戊二醛,4 ℃固定过夜,按照透射电镜(Model JEM-1230,日本JEOL株式会社)制作程序观察、拍片。
1.2.5 犊牛小肠上皮细胞二倍体核型分析根据詹康等[15]、王治国等[17]染色体核型分析方法,取第5代犊牛小肠上皮细胞,加秋水仙素到培养液中至终浓度为0.05 μg/mL,在37 ℃培养箱中继续培养3~4 h,大部分处于细胞分裂中期。胰蛋白酶消化分离细胞后转入15 mL离心管,4 ℃下560×g离心3 min收集细胞。吸去上清液加入预热至37 ℃的0.075 mol/L氯化钾(KCl)溶液7 mL,轻轻吹打均匀,37 ℃培养箱中温育17 min。悬液中加入新鲜固定液1 mL,轻轻吹打混匀。将悬液以780×g离心10 min去上清。加入新鲜固定液7 mL吹打混匀,室温静置30 min,780×g离心10 min弃上清液,重复上个步骤1次。视细胞量加入固定液0.5 mL,吹打均匀。取出预冷的载玻片,将载玻片倾斜45°,在载玻片上方用吸管迅速滴上2~3滴细胞悬液,用嘴轻轻吹散使细胞分散均匀,室温干燥。吉姆萨(Giemsa)工作液染色15 min,冲洗,空气干燥。先用低倍镜寻找良好的分裂相,再使用高倍镜观察。
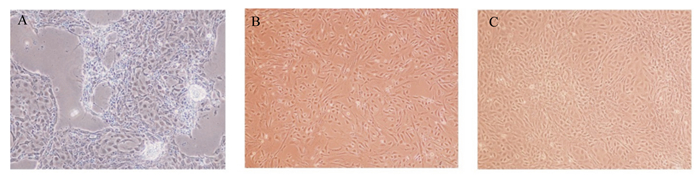
2 结果 2.1 犊牛小肠上皮细胞的分离培养及纯化经消化酶消化下来的多为肠隐窝器官样单位、部分细胞团和少量单细胞,细胞贴壁能力强,生长良好。在倒置显微镜下观察,可见培养的细胞在1~2 d内贴壁,培养4~6 d可见明显增殖,培养8~9 d汇成一片(图 1),此时可见肠上皮细胞典型的生长特征:单层生长不重叠,呈多角形或鹅卵石样,铺路石状排列。利用差速离心法纯化小肠上皮细胞,细胞生长状态良好,分裂旺盛,界限清晰,可铺满瓶底,并得到较纯的犊牛小肠上皮细胞。
|
A:培养1 d;B:培养4 d;C:培养8 d。 A: cultured after 1 d; B: cultured after 4 d; C: cultured after 8 d. 图 1 培养不同时间的犊牛小肠上皮细胞 Fig. 1 Calf intestinal epithelial cells cultured at different time (100×) |
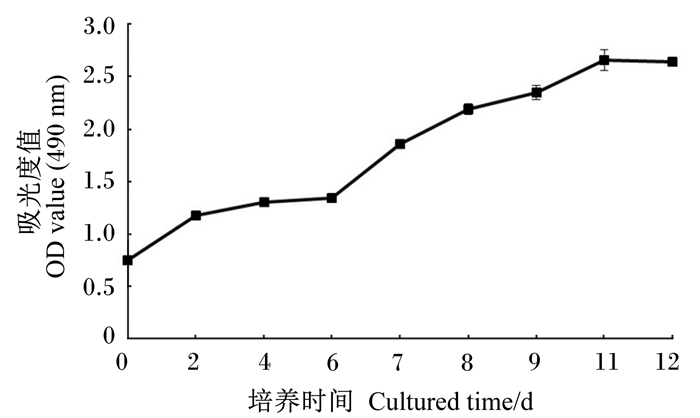
由图 2可知,第1~4天细胞生长缓慢,第6~10天细胞处于对数生长期,增殖旺盛,第11~12天细胞达到平台期,11 d之后细胞增殖减缓。可以看出细胞生长曲线为“S”形,符合细胞生长的一般规律。
|
图 2 犊牛小肠上皮细胞生长曲线 Fig. 2 Growth curve of calf intestinal epithelial cells |
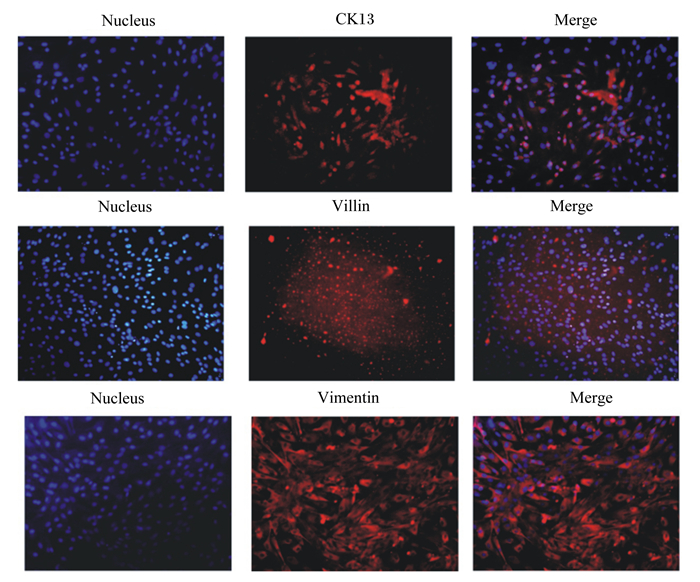
本试验选择在小肠上皮细胞中特异性表达的细胞角蛋白13和绒毛蛋白,以及在成纤维细胞中特异性表达的波形蛋白。由图 3可知,在小肠上皮细胞中特异性表达的角蛋白13和绒毛蛋白呈阳性表达,而在成纤维细胞中特异性表达的波形蛋白也呈阳性表达。
|
Nucelus:细胞核;CK-13:细胞角蛋白13 cytokeratin 13;Villin:绒毛蛋白;Vimentin:波形蛋白;Merge:融合。 图 3 犊牛小肠上皮细胞的免疫荧光鉴定 Fig. 3 Immunofluorescence identification of calf intestinal epithelial cells (200×) |
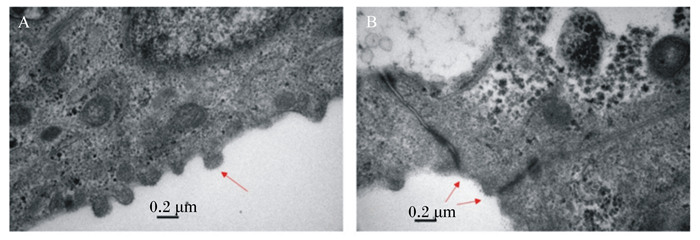
透射电镜观察(图 4)显示细胞形态完整,并观察到小肠黏膜上皮细胞的标志性结构如微绒毛、紧密接连结构等,其中微绒毛排列致密,紧密连接复合体与桥粒结构明显,表明分离得到的细胞为肠道上皮细胞。
|
A:箭头所指为微绒毛;B:箭头所指为紧密连接结构。 A: arrow heading to microvillus; B: arrow heading to tight junction. 图 4 犊牛小肠上皮细胞的透射电镜鉴定 Fig. 4 Transmission electron microscope identification of calf intestinal epithelial cells |
对传至第5代的犊牛小肠上皮细胞进行染色体核型分析,由图 5可知,第5代的犊牛小肠上皮细胞染色体数为60条,其核型与哺乳动物细胞染色体图谱一致,进一步表明传至第5代的犊牛小肠上皮细胞具有稳定的生物学功能。
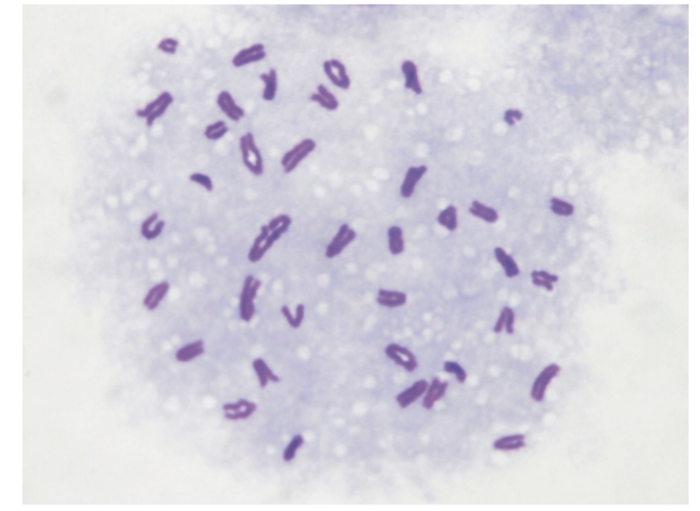
|
图 5 犊牛小肠上皮细胞核型分析 Fig. 5 Karyotype analysis of calf intestinal epithelial cells (1 000×) |
小肠上皮细胞是犊牛体内最重要的营养吸收和转运营养因子的场所,对犊牛肠道微生物调控以及作为肠道免疫屏障都发挥重要作用[18]。目前犊牛腹泻等胃肠道疾病的发生导致养殖业经济和社会的损失不断加大,而这些疾病的发生和肠道屏障功能的丧失有密切联系[19]。位于消化管内壁的肠上皮是肠道屏障的重要组成部分,通过与成纤维细胞、细胞外基质之间的相互作用来维持自身的平衡。但这个平衡系统在离体组织样品中很脆弱,因组织突然供血不良、温度调节失衡、细胞和细胞、细胞和细胞外基质的相互作用也会紊乱。这种紊乱会导致上皮细胞出现失巢凋亡现象[20],这也是肠上皮细胞原代培养很难获得成功的主要原因。
3.1 犊牛小肠上皮细胞的原代培养目前小肠上皮细胞的分离方法主要有组织块培养法、非酶消化法(螯合或解聚溶液)和酶消化法[21]。利用组织培养细胞首先容易导致细菌污染,因为肠道是一个开放的组织,具有很多条件致病菌,仅靠清洗难以完全去除。另外,抗生素的大量使用,使肠道内细菌产生一定的耐药性[22-23],所以即使在培养基中加入双抗也很难抑制细菌生长繁殖。同时,高浓度抗生素的使用也会影响原代培养细胞的形态及功能[24]。因此,本试验选择利用酶消化法分离小肠上皮细胞,而且选用的是出生12 h内未吮乳的新生犊牛,此时的犊牛未采食,可避免源头污染,且小肠上皮细胞生长迅速,增殖能力强。我们也尝试了从出栏母牛小肠中分离细胞进行培养,但与刚出生未吮乳的犊牛相比出现污染的几率较大,分离得到的细胞量少且活力低,过早出现拉丝结网等凋亡现象。
在利用酶消化法分离细胞时应尽量选择对细胞损伤小的消化酶,研究表明,使用胰蛋白酶仅能获得少量肠绒毛隐窝单位和单个细胞,细胞贴壁和生长能力较弱。而联合使用胶原酶(Ⅺ型)和中性蛋白酶(Ⅰ型)、多次(短时间)快速消化收获细胞法可获得大量健全肠绒毛隐窝单位和单个细胞[25]。利用嗜热菌蛋白酶消化法及胶原酶Ⅺ与中性蛋白酶Ⅰ联合消化法均适合肠道上皮细胞的分离和培养[26]。尹博文等[27]、Graves等[28]采用胶原酶Ⅺ与中性蛋白酶Ⅰ及二硫苏糖醇(DTT)联合消化法,成功分离得到树鼩、人和小鼠的小肠上皮细胞,同时研究发现消化2~3 h得到的细胞从数量到活力上来说是相对比较好的。本试验参考上述消化法,采用Ⅰ型胶原酶和中性蛋白酶联合消化,并增加了磁力搅拌的步骤,37 ℃、低速(100 r/min)下磁力搅拌消化组织块,既缩短了消化作用时间、减轻了酶对细胞的毒性损害,又能使得消化更为充分完全。
肠道上皮细胞原代培养很难获得成功的一个关键因素是杂细胞污染,主要是成纤维细胞的污染,且随着培养时间的延长,成纤维细胞的比例会越来越大,而上皮细胞的生长则受到较大抑制。本试验利用成纤维细胞和上皮细胞对胰蛋白酶的敏感性不同以及贴壁速度不同而采用相差消化-相差贴壁法来纯化分离得到犊牛小肠上皮细胞。成纤维细胞对胰酶作用非常敏感,传代消化时往往先脱落;而在细胞接种后,贴壁速度比上皮细胞快。研究表明成纤维细胞贴壁时间为90 min,而上皮细胞贴壁时间为12~24 h[8]。因此,利用2种细胞贴壁速度的差异可以在单细胞悬液接种时去除成纤维细胞。当胰酶可以轻松把成纤维细胞消化下来时,犊牛小肠上皮细胞只有一小部分脱落,仍继续贴壁。接下来,用0.05%胰酶消化细胞,并使细胞完全脱落加完全培养基终止消化。
3.2 犊牛小肠上皮细胞生长曲线的测定小肠上皮细胞生长曲线的绘制多数研究采用的方法为噻唑蓝(MTT)法,本试验采用WST-1法测定细胞增殖率,相对于MTT法节省了后续的溶解步骤,且灵敏度更高、试验结果更加稳定。本试验接种的细胞数量为6×105个/mL,细胞培养2 d后没有出现明显的增殖,反而细胞数量变少,这可能是因为小肠上皮细胞并非是永生化细胞,在接种时已经有一部分细胞死亡的原因。培养至6~10 d时,细胞增殖明显,呈现对数生长期,形成一簇簇的细胞集落。培养至11~12 d时,细胞融合成片不再增殖,达到平台期。小肠上皮细胞生长具有群体依赖性,极少出现脱离细胞群而单独存在的细胞。当紧密连接的细胞群经过一段时间的生长增殖后,细胞的形态增大、数量增多,相互接触连成片,此时细胞的运动感和生长也随即受到抑制,细胞数量不再增加,表现出接触性抑制现象[29]。因此,当原代培养的上皮细胞生长到一定密度时,必须进行传代培养。本研究发现,传至第10代之后细胞生长速度明显减慢,无法增殖,细胞开始出现衰老,细胞间隙变大,细胞体积变大并伴随着细胞从瓶底脱落。
3.3 犊牛小肠上皮细胞的鉴定用消化酶分离培养的细胞仅凭光学显微镜形态学观察不能准确鉴定为肠道上皮细胞,因为在培养过程中,成纤维细胞占有绝对优势。当成纤维细胞生长密度至100%时,开始相互挤压,原来梭形的成纤维细胞会改变自身的形态,呈现与上皮细胞类似的铺路石样形态,因此通常需采用其他特异性鉴定方法。目前,关于上皮细胞的鉴定多是利用细胞角蛋白[4-5, 7-8, 25-27],角蛋白是鉴定上皮细胞的理想标记分子且可用来检测上皮细胞的分化。然而,越来越多的研究表明,角蛋白不仅在上皮组织类型细胞中表达,在其他处于分化状态的细胞中也有表达,如在乳腺及前列腺等腺体组织中,基底层细胞也表达角蛋白5/14[12],在山羊乳腺的肌肉上皮细胞也发现了细胞角蛋白[13]。因此,不能仅仅通过细胞角蛋白验证分离细胞源于小肠上皮细胞。绒毛蛋白是一类组织特异性的肌动蛋白结合蛋白,也是一种细胞骨架蛋白。可以标记肠道的刷状缘,常作为肠道的特异性标记[30]。波形蛋白是成纤维细胞重要的分化标志蛋白,一般只在间充质细胞中表达且负责维持其骨架的完整性[10]。肌间线蛋白是肌细胞重要的标志性蛋白[31]。一般研究认为,波形蛋白和肌间线蛋白不能在上皮细胞中表达。因此,通常利用这些细胞表面的不同标志蛋白来进一步鉴定和区分上皮细胞。如Schierack等[9]、李小芬等[7]利用角蛋白以及波形蛋白和肌间线蛋白鉴定猪小肠上皮细胞、山羊小肠上皮细胞。我们在试验初期选择了角蛋白13对分离得到的犊牛小肠上皮细胞进行特异性鉴别,同时利用波形蛋白作为阴性对照,结果如图 4所示。和大多数报道的哺乳动物小肠上皮细胞原代培养的结论不同,本试验分离得到的犊牛小肠上皮细胞不仅阳性表达角蛋白13,同时也阳性表达波形蛋白。随后进行了多次重复验证试验,仍得出上述结论,这是否表明我们分离纯化的不够彻底,使得成纤维细胞与肠上皮细胞夹杂生长呢?为此,我们进一步利用透射电镜观察分离得到的细胞,电镜下观察可见视野内的细胞边缘有大量微绒毛,而且细胞和细胞之间有明显致密的紧密连接结构,表明我们分离纯化后得到的细胞确实是小肠上皮细胞,而检测到波形蛋白的阳性表达也不能表明细胞被间充质细胞污染了。另外,通过图 4可以看到,波形蛋白的分布模式与其基因表达的位置也不能很贴切的吻合。事实上,之前已有类似的报道,Loret等[14]在原代培养的以及利用猿病毒40肿瘤T抗原(tumour large T antigen of the simian leukaemia virus 40,SV40LT)转染后得到的牛肠道上皮细胞中也发现了波形蛋白的表达,Kaeffer等[32]对猪小肠发育的研究也表明波形蛋白呈阳性表达。Rusu等[33]进一步分析,肠道上皮细胞表达波形蛋白很可能是由于原代培养时肠道上皮层分离后细胞复合体的后转录去抑制作用,并提出一种假设,即培养的细胞在体外经历了一种“间充质转变”,体外波形蛋白的再表达对维持与膜脂筏有关的特殊细胞的结构以及/或功能有一定作用[34]。除了原代分离的肠道上皮细胞具有“间充质转变”的可能,越来越多的研究更倾向于波形蛋白在未分离的肠道上皮中自然发生这一说法[35]。例如,很多研究表明肠道上皮中的M细胞也表达波形蛋白[35-38],表明波形蛋白的产生和前体肠道上皮细胞刷状缘的消解具有一定关联。还有研究表明,波形蛋白可能作为肠上皮细胞分化变体的标志[39]。培养的小肠上皮细胞分化水平较低的原因可能是分离过程中对低分化细胞的择优选择(比如属于上皮隐窝增殖区域的细胞),也可能归因于培养的亚适宜条件。接下来我们将通过提高犊牛小肠上皮细胞体外分化水平来验证是否与波形蛋白合成抑制有关,并进一步研究反转录过程中在小肠上皮细胞分化时沉默波形蛋白的表达,尤其是在微绒毛和刷状缘形成的过程中,以期揭开波形蛋白在肠道上皮细胞中表达的神秘面纱。
3.4 犊牛小肠上皮细胞的核型分析细胞核型分析对于细胞的生物学功能具有重要的指示作用,是鉴定细胞株种属、性别来源较为确切的指标。研究染色体最好的时期是细胞处于分裂中期时,此时细胞呈对数生长,且状态良好,紧密度高。一般情况下,原代上皮细胞在第2~5代时生命力最为旺盛,经过6~10代传代培养后,细胞增殖逐渐衰退,细胞形状随之出现变化,细胞核也会失去二倍体特性甚至发生细胞转化。而当细胞到达衰退或转化期时,细胞便不再增殖或增殖很慢,细胞形状紊乱,轮廓增强,此时细胞会出现凋亡[40]。如果出现这样的问题,下游的细胞吸收营养物质、肠道免疫功能研究等试验就很难模拟体内牛小肠上皮细胞。本试验研究表明,传至第5代的犊牛小肠上皮细胞保持着二倍体的核型,具有稳定的生物学功能。
4 结论本试验采用胶原酶Ⅰ和中性酶联合消化法成功分离培养了犊牛小肠上皮细胞,并通过相差消化法和相差贴壁法进行了纯化,犊牛小肠上皮细胞具有铺路石样形态并能稳定传代至第10代。采用免疫荧光分析及透射电镜观察进一步鉴定表明分离得到的细胞为犊牛小肠上皮细胞,可为研究犊牛小肠上皮细胞的营养转运吸收、肠道免疫和微生物调控机制提供理想的试验细胞模型。
| [1] |
GROSCHWITZ K R, HOGAN S P. Intestinal barrier function:molecular regulation and disease pathogenesis[J]. Journal of Allergy and Clinical Immunology, 2009, 124(1): 3-20. DOI:10.1016/j.jaci.2009.05.038 |
| [2] |
LIEVIN-LE MOAL V, SERVIN A L. The front line of enteric host defense against unwelcome intrusion of harmful microorganisms:mucins, antimicrobial peptides, and microbiota[J]. Clinical Microbiology Reviews, 2006, 19(2): 315-337. DOI:10.1128/CMR.19.2.315-337.2006 |
| [3] |
KAEFFER B. Mammalian intestinal epithelial cells in primary culture:a mini-review[J]. In Vitro Cellular & Developmental Biology-Animal, 2002, 38(3): 123-134. |
| [4] |
李艳, 彭春燕, 梁榕旺, 等. 鸡小肠上皮细胞的分离培养与鉴定[J]. 中国畜牧兽医, 2011(2): 68-72. |
| [5] |
王静, 张彦明, 仝钢, 等. 新生仔猪小肠上皮细胞的分离培养和鉴定[J]. 畜牧兽医学报, 2010, 41(1): 92-98. |
| [6] |
EVANS G S, FLINT N, SOMERS A S, et al. The development of a method for the preparation of rat intestinal epithelial cell primary cultures[J]. Journal of Cell Science, 1992, 101: 219-231. |
| [7] |
李小芬, 詹康, 张响英, 等. 山羊小肠上皮细胞分离培养与鉴定[J]. 中国农业大学学报, 2017, 22(10): 91-96. |
| [8] |
刘飞飞, 车东升, 穆成龙, 等. 兔小肠上皮细胞体外分离培养[J]. 吉林农业大学学报, 2011, 33(4): 429-432. |
| [9] |
SCHIERACK P, NORDHOFF M, POLLMANN M, et al. Characterization of a porcine intestinal epithelial cell line for in vitro studies of microbial pathogenesis in swine[J]. Histochemistry and Cell Biology, 2006, 125(3): 293-305. |
| [10] |
MIYAZAWA K, HONDO T, KANAYA T, et al. Characterization of newly established bovine intestinal epithelial cell line[J]. Histochemistry and Cell Biology, 2010, 133(1): 125-134. |
| [11] |
FÖLLMANN W, WEBER S, BIRKNER S. Primary cell cultures of bovine colon epithelium:isolation and cell culture of colonocytes[J]. Toxicology in Vitro, 2000, 14(5): 435-445. DOI:10.1016/S0887-2333(00)00033-3 |
| [12] |
克莱尔·怀斯.上皮细胞培养指南[M].段恩奎, 王莉, 译.北京: 科学出版社, 2005: 114.
|
| [13] |
LI P, WILDE C J, FINCH L M, et al. Identification of cell types in the developing goat mammary gland[J]. The Histochemical Journal, 1999, 31(6): 379-393. DOI:10.1023/A:1003700224900 |
| [14] |
LORET S, RUSU D, EL MOUALIJ B, et al. Preliminary characterization of jejunocyte and colonocyte cell lines isolated by enzymatic digestion from adult and young cattle[J]. Research in Veterinary Science, 2009, 87(1): 123-132. |
| [15] |
詹康, 左晓昕, 陈银银, 等. 猪小肠上皮细胞分离培养与鉴定[J]. 动物营养学报, 2015, 27(5): 1477-1484. DOI:10.3969/j.issn.1006-267x.2015.05.018 |
| [16] |
XU Q B, WU Y M, LIU H Y, et al. Establishment and characterization of an omasal epithelial cell model derived from dairy calves for the study of small peptide absorption[J]. PLoS One, 2014, 9(3): e88993. DOI:10.1371/journal.pone.0088993 |
| [17] |
王治国, 卜登攀, 王加启. 牛乳腺上皮细胞β酪蛋白的检测及核型分析[J]. 中国畜牧兽医, 2007, 34(2): 8-11. DOI:10.3969/j.issn.1671-7236.2007.02.002 |
| [18] |
XAVIER R J, PODOLSKY D K. Unravelling the pathogenesis of inflammatory bowel disease[J]. Nature, 2007, 448(26): 427-434. |
| [19] |
RODA G, SARTINI A, ZAMBON E, et al. Intestinal epithelial cells in inflammatory bowel diseases[J]. World Journal of Gastroenterology, 2010, 16(34): 4264-4271. DOI:10.3748/wjg.v16.i34.4264 |
| [20] |
GLAYBURGH D R, SHEN L, TURNER J R. A porous defense:the leaky epithelial barrier in intestinal disease[J]. Laboratory Investigation, 2004, 84(3): 282-291. |
| [21] |
王清静, 张恒, 龙民慧, 等. 小肠上皮细胞的培养及在动物营养上的研究进展[J]. 饲料工业, 2012, 33(4): 53-56. |
| [22] |
MANICHANH C, REEDER J, GIBERT P, et al. Reshaping the gut microbiome with bacterial transplantation and antibiotic intake[J]. Genome Research, 2010, 20(10): 1411-1419. DOI:10.1101/gr.107987.110 |
| [23] |
WILLING B P, RUSSELL S L, FINLAY B B. Shifting the balance:antibiotic effects on host-microbiota mutualism[J]. Nature Reviews Microbiology, 2011, 9(4): 233-243. DOI:10.1038/nrmicro2536 |
| [24] |
KUHLMANN I. The prophylactic use of antibiotics in cell culture[J]. Cytotechnology, 1996, 19(2): 95-105. DOI:10.1007/BF00749764 |
| [25] |
李融, 韩庆广, 赵国琦. 鹅小肠上皮细胞的分离培养研究[J]. 中国家禽, 2009, 31(16): 22-25. |
| [26] |
孙秀梅, 程帆, 刘维, 等. 4种小鼠肠上皮细胞方法分离培养方法的比较[J]. 西北农林科技大学学报(自然科学版), 2013, 41(5): 25-31. |
| [27] |
尹博文, 陈玲霞, 李振宇, 等. 树鼩小肠上皮细胞的体外分离培养与鉴定[J]. 实验动物科学, 2017, 34(2): 11-15. DOI:10.3969/j.issn.1006-6179.2017.02.003 |
| [28] |
GRAVES C L, HARDEN S W, LAPATO M, et al. A method for high purity intestinal epithelial cell culture from adult human and murine tissues for the investigation of innate immune function[J]. Journal of Immunological Methods, 2014, 414: 20-31. DOI:10.1016/j.jim.2014.08.002 |
| [29] |
薛庆善. 体外培养的原理与技术[M]. 北京: 科学出版社, 2001.
|
| [30] |
KHALIL H A, LEI N Y, BRINKLEY G, et al. A novel culture system for adult porcine intestinal crypts[J]. Cell and Tissue Research, 2016, 365(1): 123-134. |
| [31] |
EHMANN U K, DEVRIES J T, CHEN M S C, et al. An in vitro model of epithelial cell growth stimulation in the rodent mammary gland[J]. Cell Proliferation, 2003, 36(4): 177-190. DOI:10.1046/j.1365-2184.2003.00265.x |
| [32] |
KAEFFER B, BOTTREAU E, VELGE P, et al. Epithelioid and fibroblastic cell lines derived from the ileum of an adult histocompatible miniature boar (d/d haplotype) and immortalized by SV40 plasmid[J]. European Journal of Cell Biology, 1993, 62(1): 152-162. |
| [33] |
RUSU D, LORET S, PEULEN O, et al. Immunochemical, biomolecular and biochemical characterization of bovine epithelial intestinal primocultures[J]. BMC Cell Biology, 2005, 6: 42. DOI:10.1186/1471-2121-6-42 |
| [34] |
RUNEMBERT I, QUEFFEULOU G, FEDERICI P, et al. Vimentin affects localization and activity of sodium-glucose cotransporter SGLT1 in membrane rafts[J]. Journal of Cell Science, 2002, 115(4): 713-724. |
| [35] |
SNIDER N T, OMARY M B. Post-translational modifications of intermediate filament proteins:mechanisms and functions[J]. Nature Reviews Molecular Cell Biology, 2014, 15(3): 163-177. |
| [36] |
LELOUARD H, REGGIO H, MANGEAT P, et al. Mucin-related epitopes distinguish M cells and enterocytes in rabbit appendix and Peyer's patches[J]. Infection and Immunity, 1999, 67(1): 357-367. |
| [37] |
ONORI P, FRANCHITTO A, SFERRA R, et al. Peyer's patches epithelium in the rat:a morphological, immunohistochemical, and morphometrical study[J]. Digestive Diseases and Sciences, 2001, 46(5): 1095-1104. DOI:10.1023/A:1010778532240 |
| [38] |
BEYAZ F, ERGÜN E, BAYRAKTAROĞLU A G, et al. The identification of intestinal M cells in the sacculus rotundus and appendix of the Angora rabbit[J]. Veterinary Research Communications, 2010, 34(3): 255-265. DOI:10.1007/s11259-010-9349-6 |
| [39] |
IWATSUKI H, OGAWA C, SUDA M. Vimentin-positive cells in the villus epithelium of the rabbit small intestine[J]. Histochemistry and Cell Biology, 2002, 117(4): 363-370. |
| [40] |
周传丽, 刘铮铸, 俞英, 等. 仔猪小肠黏膜上皮细胞体外分离培养及鉴定[J]. 中国农业科学, 2011, 44(21): 4516-4524. |




