2. 西北农林科技大学动物科技学院, 杨凌 712100
2. College of Animal Science and Technology, Northwest Agriculture and Forestry University, Yangling 712100, China
山羊奶具有丰富的营养价值,是现代人类的营养佳品[1]。与牛奶相比,羊奶在乳脂方面具有独特优势:一方面,羊奶乳脂滴较小,更易被消化吸收;另一方面,羊奶中短中链脂肪酸含量更高[1-2]。乳脂作为羊奶的主要成分之一,其组成及含量是影响羊奶口感及营养价值的主要因素[3],研究外源营养物质对奶山羊泌乳性能的影响并揭示其调控机理对提高羊奶品质具有重要意义。
山茱萸果核是山茱萸科山茱萸属植物山茱萸的干燥果核,其重量约为山茱萸果肉的1/3[4],山茱萸主要分布于我国长江以北,秦岭、伏牛山以南和浙江天目山区的广大中低山丘陵地区[5]。现代研究证明,山茱萸果肉中含有丰富的多糖类成分以及黄酮类物质、熊果酸、山茱萸苷等有效成分,具有增强免疫功能、降血糖、抗氧化等作用[6]。人们在以往对山茱萸的研究过程中只注重对果肉的研究而对果核的研究极少,临床上一般采用果肉入药,而其果核长期以来则被视为废弃物扔掉,造成很大的浪费。近年来也有研究表明,山茱萸果核的部分成分与果肉的成分相似,只是含量有所不同,并且山茱萸果核中的某些营养成分甚至优于果肉[7]。白成科等[7]研究山茱萸果肉和果核脂溶性成分的差异时发现,果肉中含有31种脂溶性成分,果核中含有30种脂溶性成分;果核中脂肪酸含量为97.84%,比果肉中多36.38%。果核和果肉中均以C18 : 1n9c和C18 : 2n6c为主,果核中C18 : 1n9c的含量为58.86%、C18 : 2n6c的含量为4.08%;果肉中C18 : 1n9c的含量为18.73%、C18 : 2n6c的含量为27.23%,提示山茱萸果核也有较高的、潜在的利用价值。在饲粮中添加富含多不饱和脂肪酸(polyunsaturated fatty acids, PUFAs)的油脂和籽实是提高反刍动物体组织中不饱和脂肪酸沉积,获得有益于人类健康的奶、肉制品的有效方法[8-10]。
山羊奶风味别致、不含过敏源、营养成分完全,正成为奶业市场的新宠。随着人们对保健意识的增强,对奶类的要求也越来越高。为了开发功能性保健型羊奶,减少农业副产品的浪费,本研究以河南奶山羊为研究对象,在奶山羊饲粮中添加山茱萸果核,探讨山茱萸果核对奶山羊产奶量、乳成分、乳脂肪酸组成和乳腺脂质代谢相关基因表达的影响,为生产富含有益脂肪酸的羊奶、改善羊奶品质提供理论依据和实践指导。
1 材料与方法 1.1 试验设计与饲养管理选取同胎次(2胎次)、泌乳天数[(20±7) d]相近、体重相近、健康状况良好的奶山羊50只,随机分为2组,每组5个重复,每个重复5只羊。参考NRC(2007)山羊饲养标准配制基础饲粮,对照组饲喂基础饲粮,试验组饲喂以1%山茱萸果核替代基础饲粮中等量玉米的试验饲粮。饲粮组成及营养水平见表 1。养殖试验在河南西峡新太阳乳业有限公司进行,整个试验期为55 d,其中预试期10 d,正试期45 d。试验前对羊舍进行清洗消毒,每日观察羊只采食情况,试验羊自由采食和饮水。
|
|
表 1 饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of diets (DM basis) |
试验期内每日早晚各挤奶1次,每次挤奶后记录产奶量。试验期结束时对所有试验羊采集乳样,于早晚各采集20 mL制成混合样2份,收集全部试验羊样本50个,一份送至河南省奶牛生产性能测定中心分析乳糖率、乳脂率、乳蛋白率等乳成分指标;另一份于-20 ℃冰箱中保存,用于乳脂肪酸组成测定。试验期结束时对全部试验羊于清晨时空腹静脉采血,收集全部试验羊样本50个,于郑州市颐和医院进行血清谷丙转氨酶(alanine aminotransferase, ALT)、谷草转氨酶(aspartate aminotransferase, AST)活性及总蛋白(total protein, TP)、白蛋白(albumin, ALB)、尿素氮(urea nitrogen, UN)、总胆固醇(total cholesterol, TC)、葡萄糖(glucose, GLU)、甘油三酯(triglyceride, TG)、高密度脂蛋白(high density lipoprotein, HDL)、低密度脂蛋白(low density lipoprotein, LDL)含量测定。试验结束时每组选取3只羊采用手术法采集乳腺组织1 g左右,置于液氮中,用于脂质代谢相关基因表达的检测。
1.2.2 脂肪酸提取与组成测定采用甲酯化方法提取乳中脂肪酸,具体操作为:将混合乳样放入30 ℃水浴锅中孵育,至乳样完全融化后室温条件下17 800×g离心30 min;将上层脂肪转移至2 mL离心管中,19 300×g离心20 min;吸取离心管中80 μL的上层油状液体于10 mL玻璃管中,并加入5 mL正己烷,摇匀混合;再向其中加入0.2 mL甲酯化试剂,密封,涡旋振荡1 min,室温静置30 min,然后添加0.5 g无水硫酸钠,350×g离心3 min。吸取1 mL上清液于2 mL的色谱瓶中,用于气相色谱测定。将提取的脂肪酸于西北农林科技大学奶山羊研究室进行组成测定。脂肪酸的种类通过保留时间与标准品对比确定,按峰面积计算含量,用面积归一法计算出羊奶中的各种脂肪酸占总脂肪酸的百分含量。
1.2.3 乳腺组织总RNA提取与反转录采用北京天根生化科技有限公司生产的组织总RNA提取试剂盒(DP431),按照说明书操作提取乳腺组织总RNA。所有RNA样品通过紫外分光光度计(NANODROP 2000)测定其OD260 nm/OD280 nm值,检测浓度及纯度合格后,以提取的RNA为模板,按照反转录试剂盒(RR047A, TaKaRa公司,日本)说明书步骤,将所有检测合格的RNA反转录成cDNA,用于实时荧光定量PCR检测脂质代谢相关基因的相对表达量。
1.2.4 实时荧光定量PCR检测脂质代谢相关基因的相对表达量以甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase, GAPDH)和线粒体核糖体蛋白L39(mitochondrial ribosomal protein L39, MRPL39)作为内参基因[11],参照文献[12]设计引物,脂质代谢相关基因及内参基因实时荧光定量PCR引物序列见表 2。按照TaKaRa实时荧光定量PCR试剂盒操作说明配制PCR反应液,PCR反应体系为:2×SYBR Premix Ex Taq Mix 10.0 μL,cDNA模板1.0 μL,上、下游引物混合物(10 μmol/L)1.6 μL,加RNase free H2O补足20 μL。于ABI 7500荧光定量PCR仪上进行反应,反应条件为:95 ℃ 30 s,95 ℃ 5 s,60 ℃ 30 s,40个循环;绘制熔解曲线。每个样品设置3个加样重复,采用2-△△Ct法对数据进行分析,其中△Ct=Ct目的基因-Ct内参基因;△△Ct=△Ct试验组-△Ct对照组。
|
|
表 2 实时荧光定量PCR引物序列 Table 2 Primer sequences of real-time quantitative PCR |
试验数据用平均值±标准差(mean±SD)表示,采用SPSS 22.0软件的t检验进行差异显著性分析,以P < 0.05表示差异显著,以P < 0.01表示差异极显著。
2 结果 2.1 山茱萸果核对奶山羊血清生化指标的影响由表 3可知,试验组奶山羊血清中TP和ALB含量极显著高于对照组(P < 0.01),并且AST活性显著高于对照组(P < 0.05),其他指标如GLU、UN、TC、HDL、LDL含量与ALT活性试验组与对照组之间均没有显著差异(P>0.05)。
|
|
表 3 山茱萸果核对奶山羊血清生化指标的影响 Table 3 Effects of fructus corni fruit core on serum biochemical indexes of dairy goats |
由表 4可知,试验开始时试验组与对照组奶山羊的产奶量差异不显著(P>0.05),2组间的差异属于正常个体间产奶性状的差异。随着试验的进行,奶山羊由泌乳前期进入泌乳盛期,其产奶量在试验结束时均比试验开始时有所增长,且试验组奶山羊试验结束时产奶量显著高于对照组(P < 0.05)。
|
|
表 4 山茱萸果核对奶山羊产奶量的影响 Table 4 Effects of fructus corni fruit core on milk yield of dairy goats |
由表 5可知,试验组奶山羊奶中乳脂率和乳总固形物含量极显著低于对照组(P < 0.01);乳糖率和乳蛋白率试验组与对照组之间没有显著差异(P>0.05)。
|
|
表 5 山茱萸果核对奶山羊乳成分的影响 Table 5 Effects of fructus corni fruit core on milk composition of dairy goats |
由表 6可知,试验组奶山羊乳中短中链脂肪酸中C4 : 0、C6 : 0、C8 : 0、C10 : 0,饱和脂肪酸中C14 : 0、C16 : 0、C20 : 0以及多不饱和脂肪酸中C18 : 3n6的含量显著高于对照组(P < 0.05),而单不饱和脂肪酸中C15 : 1的含量则显著低于对照组(P < 0.05);试验组奶山羊乳中其他脂肪酸的含量与对照组相比无显著变化(P>0.05)。
|
|
表 6 饲粮添加山茱萸果核对奶山羊乳脂肪酸组成的影响 Table 6 Effects of fructus corni fruit core on milk fatty acid composition of dairy goats |
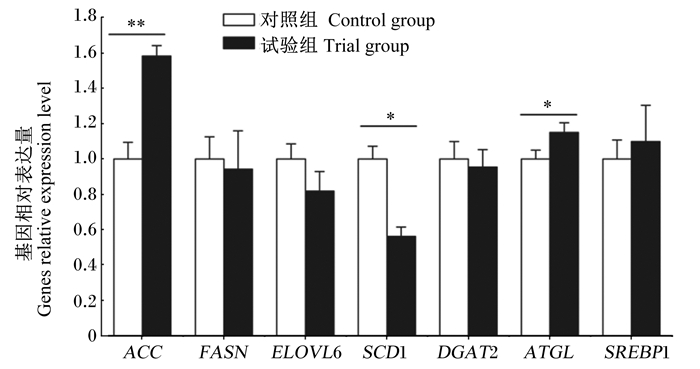
由图 1可知,与对照组相比,试验组奶山羊乳腺中脂肪酸从头合成基因乙酰辅酶A羧化酶(acetyl-CoA carboxylase, ACC)的相对表达量极显著上调(P < 0.01),甘油三酯水解酶(adipose triglyceride lipase, ATGL)的相对表达量显著上调(P < 0.05),硬脂酰辅酶A去饱和酶1(stearoyl-CoA desaturase 1, SCD1)的相对表达量则显著下调(P < 0.05);脂肪酸合酶(fatty acid synthase, FASN)、超长链脂肪酸延伸酶6(elongase of very long chain fatty acids 6, ELOVL6)、二脂酰甘油酰基转移酶2 (diacylglycerol acyltransferase 2, DGAT2)、固醇调节元件结合蛋白1(sterol regulatory element-binding transcription protein 1, SREBP1)的相对表达量试验组与对照组之间均没有显著差异(P>0.05)。
|
ACC:乙酰辅酶A羧化酶acetyl-CoA carboxylase;FASN:脂肪酸合酶fatty acid synthase;ELOVL6:超长链脂肪酸延伸酶6 elongase of very long chain fatty acid 6;SCD1:硬脂酰辅酶A去饱和酶1 stearoyl-CoA desaturase 1;DGAT2:二脂酰甘油酰基转移酶2 diacylglycerol acyltransferase 2;ATGL:甘油三酯水解酶adipose triglyceride lipase;SREBP1:固醇调节元件结合蛋白1 sterol regulatory element-binding protein 1。 数据柱形标注*表示试验组与对照组差异显著(P < 0.05),标注**表示试验组与对照组差异极显著(P < 0.01)。 Value columns with * mean significant difference between control group and trial group (P < 0.05), and ** mean extremely significant difference between control group and trial group (P < 0.01). 图 1 山茱萸果核对奶山羊乳腺脂质代谢相关基因表达的影响 Fig. 1 Effects of fructus corni fruit core on expression of lipid metabolism related genes in mammary gland of dairy goats |
山茱萸富含的多糖和苷类等活性物质不仅具有营养作用,更能对机体产生保健作用[13]。曾有类似的中草药成分添加入畜禽饲粮的试验,结果显示对畜禽的机体和泌乳性能有积极影响[14]。本试验中,试验结束时添加山茱萸果核的试验组奶山羊产奶量较对照组有显著提高,比对照组增长了近10%,而提高奶山羊产奶量的原因有很多,分析可能为山茱萸果核的抗炎、抗氧化等作用对奶山羊机体产生了保健作用,提高了代谢水平,从而提高了奶山羊的生产性能,进而提高了产奶量。奶山羊血清生化指标的测定结果证明了这一推断。本试验中,饲粮添加山茱萸果核后血清中TP和ALB含量极显著增加,TP和ALB有利于提高机体的代谢水平和免疫力,促进动物健康快速生长。上述结果表明饲粮中添加山茱萸果核可以提高奶山羊机体的免疫力,从而提高产奶量。
乳脂合成取决于饲粮脂肪酸的种类和水平[3, 15]。冯自立等[16]通过优化提取工艺条件,发现山茱萸籽含有6种主要脂肪酸,分别为C18 : 2n6c(71.190%)、C18 : 1n9c(18.594%)、C15 : 1n10c(5.377%)、C18 : 0(2.176%)、C18 : 3n3(1.226%)、C20 : 1n11c(0.450%)。李红等[17]研究发现山茱萸籽中还原糖、总糖、粗蛋白质和粗脂肪含量分别为29.2%、64.7%、21.7%和13.1%;饱和脂肪酸以C16 : 0(10.40%)为主,其次是C18 : 0(3.49%)和C22 : 0(3.32%);不饱和脂肪酸中C18 : 1n9c(35.80%)和C18 : 2n6c(34.60%)含量较高。本研究发现,饲粮添加山茱萸果核显著降低了羊奶的乳脂率,这可能是因为山茱萸果核富含C18 : 1n9c和C18 : 2n6c,不饱和脂肪酸经瘤胃氢化,生成共轭亚油酸和C18 : 1n9t,抑制乳脂合成[18]。本研究也发现,饲粮添加山茱萸果核显著降低了羊奶的乳总固形物含量,而对乳糖率和乳蛋白率的影响不显著。研究表明,低产奶山羊品种乳成分中乳脂、乳蛋白和乳总固形物含量较高,即产奶量与乳脂率呈负相关[19],本研究结果与其报道一致。
3.2 山茱萸果核对奶山羊乳脂肪酸组成的影响在饲粮中添加富含多不饱和脂肪酸的油脂或籽实是提高反刍动物机体不饱和脂肪酸沉积,获得有益于人类健康的奶制品的有效方法[20]。Razzaghi等[21]研究表明,饲粮中添加葵花籽油可增加奶山羊乳中总共轭亚油酸和C18系列脂肪酸含量,同时研究也发现,奶山羊饲喂不同不饱和脂肪酸与糖的组合时,并没有改变乳脂肪酸组成。当饲粮中添加过瘤胃保护的共轭亚油酸时,羊奶中乳脂含量下降,而乳脂中长链不饱和脂肪酸的比例上升[22]。本研究发现,饲粮中添加山茱萸果核显著增加了羊奶中短中链脂肪酸C4 : 0~C10 : 0, 饱和脂肪酸C14 : 0、C16 : 0、C20 : 0和多不饱和脂肪酸C18 : 3n6的含量。尽管山茱萸果核中的有效成分及活性物质和其他籽实类有一定差异,但本研究结果表明饲粮中添加山茱萸果核能够改变乳中脂肪酸组成,尤其是短中链脂肪酸。乳脂中的脂肪酸主要有2个来源:一是短中链脂肪酸在乳腺中的内源合成,二是乳腺从血浆中摄取长链脂肪酸(LCFA)及部分C16系列脂肪酸[23]。因此,为了深入了解山茱萸果核对乳脂肪酸组成的影响,我们进一步研究了山茱萸果核对乳腺中脂质代谢相关基因表达的影响。
3.3 山茱萸果核对奶山羊乳腺脂质代谢相关基因表达的影响反刍动物乳腺的脂肪酸主要有2个来源:一是乳腺细胞内源合成脂肪酸。乳腺细胞以乙酸和丙酸为原料,利用ACC和FASN合成饱和脂肪酸,再在SCD1作用下生成不饱和脂肪酸;二是乳腺上皮细胞从血浆中吸收脂肪酸。乳腺上皮细胞吸收的外源脂肪酸中,只有一小部分是不饱和脂肪酸,大部分的饱和脂肪酸都需要在SCD1作用下发生去饱和化反应[24]。乳腺上皮细胞的内质网是TG合成的部位,脂肪酸从头合成过程中产生的脂酰辅酶A及外源摄取的脂肪酸被酯化后形成3-磷酸甘油骨架,进一步形成TG。DGAT2对乳中TG的合成具有重要的影响。TG经脂质和蛋白质包被后形成乳脂滴,经释放进入细胞质内,转运到乳腺上皮细胞的顶端质膜并进一步释放和分泌[25]。本试验中,饲粮中添加山茱萸果核显著上调了乳腺中ACC的表达,ACC是脂肪酸内源合成的关键酶,这也是山茱萸果核显著提高羊奶中短中链脂肪酸含量的原因之一。本研究发现,山茱萸果核可上调ATGL的表达,ATGL是甘油三酯水解酶,这与山茱萸果核降低乳脂率的结果相一致;山茱萸果核同时下调了SCD1的表达,SCD1表达的下调与羊奶中饱和脂肪酸含量增多相呼应。Yao等[26]研究发现,SCD1的表达能够改变奶山羊乳腺上皮细胞中长链脂肪酸的组成,本试验结果与其一致。
在乳脂形成过程中,SREBP1是乳脂合成过程中的关键调控因子[24]。对奶山羊乳腺组织的研究表明,SREBP1在脂肪酸代谢调控方面发挥着决定性的作用[27]。成熟的SREBP1进入细胞核,结合在下游基因(FASN、SCD、ACC等)的启动子上,进而调节下游基因的转录[28-30]。山茱萸果核中富含的脂肪酸通过细胞膜信号传递途径激活转录因子过氧化物酶体增殖物激活受体γ(PPARγ)和SREBP1参与调控FASN、SCD、ACC等脂质代谢相关基因的表达。脂肪酸作为PPARγ的天然配体,通过特异性激活PPARγ,进而调节靶基因的表达[31],而PPARγ对SREBP1同样具有调节作用[32]。然而,本试验发现,饲粮中添加山茱萸果核对乳腺中SREBP1的相对表达量没有产生显著影响,可能原因是山茱萸果核中含有的脂肪酸成分如共轭亚油酸可抑制SREBP1的表达,共轭亚油酸的抑制机制主要是直接阻断SREBP1蛋白的裂解活化过程,使其不能与自身启动子上的固醇应答元件(sterol response element, SRE)结合,抑制其转录,形成一个自反馈调节系统[33-34]。此外,山茱萸果核中含有的脂肪酸又是PPARγ的天然配体,可激活PPARγ的表达,进而调控SREBP1的表达。2种作用机制同时存在,导致山茱萸果核对SREBP1的表达没有产生显著影响。
4 结论① 饲粮中添加山茱萸果核可提高奶山羊的产奶量,对乳脂率有显著的抑制作用。
② 山茱萸果核可通过促进羊奶中短中链脂肪酸的合成,调控乳腺中ACC、SCD1和ATGL的表达,改善奶山羊乳品质。
| [1] |
HAENLEIN G F W. Goat milk in human nutrition[J]. Small Ruminant Research, 2004, 51(2): 155-163. DOI:10.1016/j.smallrumres.2003.08.010 |
| [2] |
WILLIAMS C. Dietary fatty acids and human health[J]. Annales de Zootechnie, 2000, 49(3): 165-180. DOI:10.1051/animres:2000116 |
| [3] |
BAUMAN D E, GRIINARI J M. Nutritional regulation of milk fat synthesis[J]. Annual Review of Nutrition, 2003, 23: 203-227. DOI:10.1146/annurev.nutr.23.011702.073408 |
| [4] |
李晓明.山茱萸果核抗氧化活性的相关研究[D].硕士学位论文.洛阳: 河南科技大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10464-1012042776.htm
|
| [5] |
张聪, 金德庄. 山茱萸的研究进展[J]. 上海医药, 2008, 29(10): 464-467. DOI:10.3969/j.issn.1006-1533.2008.10.011 |
| [6] |
朱丹, 徐少军, 杜梨果, 等. 山茱萸及其果核的研究现状[J]. 河南科技大学学报(医学版), 2011, 29(4): 312-315. DOI:10.3969/j.issn.1672-688X.2011.04.036 |
| [7] |
白成科, 李鹏毛, 王喆之. 山茱萸肉和种子脂溶性成分的GC-MS分析[J]. 食品科学, 2007, 28(11): 493-496. DOI:10.3321/j.issn:1002-6630.2007.11.117 |
| [8] |
FACIOLA A P, BRODERICK G A. Effects of feeding lauric acid or coconut oil on ruminal protozoa numbers, fermentation pattern, digestion, omasal nutrient flow, and milk production in dairy cows[J]. Journal of Dairy Science, 2014, 97(8): 5088-5100. DOI:10.3168/jds.2013-7653 |
| [9] |
TSIPLAKOU E, ZERVAS G. The effect of fish and soybean oil inclusion in goat diet on their milk and plasma fatty acid profile[J]. Livestock Science, 2013, 155(2/3): 236-243. |
| [10] |
SELEGATO A L M, GENTIL R S, NOLLI C P, et al. Association between soybean oil and fish oil in the diet of lactating goats as a strategy to improve milk fatty acids profile[J]. Arquivo Brasileiro de Medicina Veterinária e Zootecnia, 2015, 67(5): 1429-1437. DOI:10.1590/1678-4162-8044 |
| [11] |
BONNET M, BERNARD L, BES S, et al. Selection of reference genes for quantitative real-time PCR normalisation in adipose tissue, muscle, liver and mammary gland from ruminants[J]. Animal, 2013, 7(8): 1344-1353. DOI:10.1017/S1751731113000475 |
| [12] |
LIN X Z, LUO J, ZHANG L P, et al. miR-27a suppresses triglyceride accumulation and affects gene mRNA expression associated with fat metabolism in dairy goat mammary gland epithelial cells[J]. Gene, 2013, 521(1): 15-23. DOI:10.1016/j.gene.2013.03.050 |
| [13] |
CHEN C C, HSU C Y, CHEN C Y, et al. Fructus corni suppresses hepatic gluconeogenesis related gene transcription, enhances glucose responsiveness of pancreatic beta-cells, and prevents toxin induced beta-cell death[J]. Journal of Ethnopharmacology, 2008, 117(3): 483-490. DOI:10.1016/j.jep.2008.02.032 |
| [14] |
劳雪芬, 曹铮, 汤里平, 等. 富硒女贞子对山羊生产性能、血液学和血清生化指标的影响[J]. 江苏农业科学, 2016, 44(3): 256-259. |
| [15] |
HARVATINE K J, BOISCLAIR Y R, BAUMAN D E. Recent advances in the regulation of milk fat synthesis[J]. Animal, 2009, 3(1): 40-54. DOI:10.1017/S1751731108003133 |
| [16] |
冯自立, 张辰露, 周建军, 等. 山茱萸籽油提取工艺优化及脂肪酸组成分析[J]. 食品工业科技, 2012, 33(24): 147-149, 153. |
| [17] |
李红, 张培旗, 刘军, 等. 山茱萸籽油的理化性质及脂肪酸组成分析[J]. 中国油脂, 2012, 37(3): 85-87. DOI:10.3969/j.issn.1003-7969.2012.03.022 |
| [18] |
魏宏阳.18碳不饱和脂肪酸的氢化及共轭亚油酸前体累积规律研究[D].博士学位论文.北京: 中国农业科学院畜牧研究所, 2003.
|
| [19] |
史怀平, 罗军, 代邦国, 等. 奶山羊产奶量影响因素及提高途径[J]. 中国奶牛, 2018(5): 11-15. |
| [20] |
EMAMI A, NASRI M H F, GANJKHANLOU M, et al. Effect of pomegranate seed oil as a source of conjugated linolenic acid on performance and milk fatty acid profile of dairy goats[J]. Livestock Science, 2016, 193: 1-7. DOI:10.1016/j.livsci.2016.09.004 |
| [21] |
RAZZAGHI A, VALIZADEH R, NASERIAN A A, et al. Effects of sucrose and sunflower oil addition to diet of Saanen dairy goats on performance and milk fatty acid profile[J]. Livestock Science, 2015, 173: 14-23. DOI:10.1016/j.livsci.2014.12.002 |
| [22] |
LOCK A L, ROVAI M, GIPSON T A, et al. A conjugated linoleic acid supplement containing trans-10, cis-12 conjugated linoleic acid reduces milk fat synthesis in lactating goats[J]. Journal of Dairy Science, 2008, 91(9): 3291-3299. DOI:10.3168/jds.2008-1071 |
| [23] |
BERNARD L, ROUEL J, LEROUX C, et al. Mammary lipid metabolism and milk fatty acid secretion in Alpine goats fed vegetable lipids[J]. Journal of Dairy Science, 2005, 88(4): 1478-1489. DOI:10.3168/jds.S0022-0302(05)72816-2 |
| [24] |
BIONAZ M, LOOR J J. Gene networks driving bovine milk fat synthesis during the lactation cycle[J]. BMC Genomics, 2008, 9: 366. DOI:10.1186/1471-2164-9-366 |
| [25] |
MATHER I H, KEENAN T W. Origin and secretion of milk lipids[J]. Journal of Mammary Gland Biology and Neoplasia, 1998, 3(3): 259-273. DOI:10.1023/A:1018711410270 |
| [26] |
YAO D W, LUO J, HE Q Y, et al. SCD1 alters long-chain fatty acid (LCFA) composition and its expression is directly regulated by SREBP-1 and PPARγ1 in dairy goat mammary cells[J]. Journal of Cellular Physiology, 2016, 232(3): 635-649. |
| [27] |
XU H F, LUO J, MA G Z, et al. Acyl-CoA synthetase short-chain family member 2(ACSS2) is regulated by SREBP-1 and plays a role in fatty acid synthesis in caprine mammary epithelial cells[J]. Journal of Cellular Physiology, 2018, 233(2): 1005-1016. |
| [28] |
XU H F, LUO J, ZHAO W S, et al. Overexpression of SREBP1 (sterol regulatory element binding protein 1) promotes de novo fatty acid synthesis and triacylglycerol accumulation in goat mammary epithelial cells[J]. Journal of Dairy Science, 2016, 99(1): 783-795. DOI:10.3168/jds.2015-9736 |
| [29] |
LI J, LUO J, XU H F, et al. Fatty acid synthase promoter:characterization, and transcriptional regulation by sterol regulatory element binding protein-1 in goat mammary epithelial cells[J]. Gene, 2015, 561(1): 157-164. DOI:10.1016/j.gene.2015.02.034 |
| [30] |
YAO D W, LUO J, HE Q Y, et al. Liver X receptor α promotes the synthesis of monounsaturated fatty acids in goat mammary epithelial cells via the control of stearoyl-coenzyme A desaturase 1 in an SREBP-1-dependent manner[J]. Journal of Dairy Science, 2016, 99(8): 6391-6402. DOI:10.3168/jds.2016-10990 |
| [31] |
MARTIN G, SCHOONJANS K, LEFEBVRE A M, et al. Coordinate regulation of the expression of the fatty acid transport protein and acyl-CoA synthetase genes by PPARα and PPARγ activators[J]. Journal of Biological Chemistry, 1997, 272(45): 28210-28217. DOI:10.1074/jbc.272.45.28210 |
| [32] |
SHI H B, ZHAO W S, ZHANG C H, et al. Transcriptome-wide analysis reveals the role of PPARγ controlling the lipid metabolism in goat mammary epithelial cells[J]. PPAR Research, 2016, 2016: 9195680. |
| [33] |
TAKEUCHI Y, YAHAGI N, IZUMIDA Y, et al. Polyunsaturated fatty acids selectively suppress sterol regulatory element-binding protein-1 through proteolytic processing and autoloop regulatory circuit[J]. Journal of Biological Chemistry, 2010, 285(15): 11681-11691. DOI:10.1074/jbc.M109.096107 |
| [34] |
PETERSON D G, MATITASHVILI E A, BAUMAN D E. The inhibitory effect of trans-10, cis-12 CLA on lipid synthesis in bovine mammary epithelial cells involves reduced proteolytic activation of the transcription factor SREBP-1[J]. The Journal of Nutrition, 2004, 134(10): 2523-2527. DOI:10.1093/jn/134.10.2523 |




