反刍动物拥有一个复杂的瘤胃发酵系统,瘤胃中栖息的微生物与机体互利共生[1]。微生物将饲粮中的纤维物质、淀粉等营养成分进行降解发酵,发酵产物为机体代谢提供营养物质和能量[2],但在发酵过程产生甲烷(CH4)和二氧化碳(CO2)等气体造成能量的损失。植物提取物作为一种新型饲料添加剂引起各界广泛关注,其作用主要表现在改善瘤胃发酵、减少CH4的排放、将消化代谢的损失降到最低,以此提高饲料利用率和畜产品品质[3],并可减少抗生素带来的药物残留等问题,因此成为目前的研究热点。沙葱是在草原分布广泛的牧草,为牛羊所喜食,可改善畜产品品质,增强动物机体免疫功能和抗氧化能力,因而引起人们的关注。但目前关于沙葱及其提取物调控肉羊瘤胃发酵的报道较少,因此有必要进行深入研究。
沙葱又名蒙古韭,广泛分布于我国内蒙古中西部、宁夏、甘肃、青海和新疆等地区,是一种优质牧草[4]。沙葱及其提取物具有抗菌、抗病毒、抗肿瘤等生物活性作用,具有提高动物的生产性能[5]、改善肉品质[6]、提高抗氧化能力和调节免疫等功能[7]。木其尔[8]研究报道,在饲粮中添加11~33 mg/kg沙葱黄酮可提高肉羊血清、肝脏和脾脏中的总超氧化物歧化酶(T-SOD)活性。陈仁伟[9]研究结果表明,在肉羊饲粮中添沙葱黄酮显著提高了其采食量、日增重和饲料报酬。陈圣阳等[10]研究发现,在肉羊饲粮中添加沙葱能够提高β-防御素基因在肠道中的表达。包雨洪[11]通过体外批次培养试验发现,沙葱多糖可以提高绵羊瘤胃液总挥发性脂肪酸及菌体蛋白(MCP)浓度。包玲玲等[12]利用体外发酵技术,在2 g底物中添加0.042 mg的沙葱黄酮类化合物,氨态氮(NH3-N)浓度减少了16%;添加0.032 mg时,MCP浓度提高了11%。瘤胃内厌氧真菌可通过高效降解饲料粗纤维进而维护瘤胃功能,张霞[13]研究发现在绵羊饲粮中添加沙葱可提高瘤胃pH和真菌数量。但关于沙葱水溶性提取物和脂溶性提取物对瘤胃内环境和瘤胃微生物区系影响的研究较少。因此,本试验在肉羊饲粮中添加沙葱及其提取物,研究其对瘤胃内环境参数和微生物区系的影响,以期为沙葱及其提取物作为饲料添加剂在肉羊生产中的实际应用提供理论依据。
1 材料与方法 1.1 试验材料沙葱提取物由本实验室制备。沙葱粉购自内蒙古自治区阿拉善盟阿拉善左旗。将脱脂后的沙葱粉与75%的乙醇以料液比为1 : 30的比例混合,超声处理20 min,得到脂溶性提取物,为黄色粉末。脂溶性提取物的得率为28%。将脂提后的沙葱粉与蒸馏水以料液比为1 : 20的比例混合,放入65 ℃烘箱,得到水溶性提取物,为红褐色粉末。水溶性提取物的得率为34%。
本实验室前期已测得沙葱的主要活性物质为烷烃和非杂环含硫有机物及一些带芳香气味的酚类和醛类。本次试验开始前采用液-质联用方法,测得沙葱水溶性提取物中主要活性物质为有机酸及其衍生物(α-羟基异丁酸、2-羟基丁酸), 羟基肉桂酰衍生物(对羟基苯丙酸)和植物激素(N6-异戊烯腺嘌呤)。沙葱脂溶性提取物中主要是氨基酸衍生物[S-(5-腺苷)-L-高半胱氨酸]、脂质-甘油酯(单酰甘油酯)、脂质-甘油磷脂(溶血磷脂酰胆碱)。
1.2 试验方法 1.2.1 试验动物与管理本试验于2017年9月15日至2017年11月30日在内蒙古巴彦淖尔市富川养羊场进行。选取24只体况良好、体重为(37.1±0.5) kg的杜寒F1杂交羊为动物模型,采用单因素随机分组设计,随机分为4组(每组6只羊)。饲养试验共持续75 d,其中预试期15 d,正试期60 d。在预试期进行消毒、驱虫,并进行防疫。试验期内每天06:00和18:00各饲喂1次,自由饮水。
1.2.2 沙葱及其提取物添加量及饲粮组成对照组饲喂基础饲粮,沙葱组在基础饲粮中添加沙葱粉[10 g/(d·只)],脂溶组在基础饲粮中添加沙葱脂溶性提取物[2.8 g/(d·只)],水溶组在基础饲粮中添加沙葱水溶性提取物[3.4 g/(d·只)]。每天饲喂前,将每组羊的沙葱及其提取物按照试验需要量拌匀在羊基础饲粮中,以保证试验羊每天能够足量采食试验品。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
分别在正试期第0、30、60天时从每组随机选取4只羊于晨饲后2 h用瘤胃液采样器采集瘤胃液。装保温桶后迅速带回实验室,经4层纱布过滤后,用pH计测定瘤胃液pH。将滤液放入液氮中,测定发酵参数和瘤胃微生物区系。
1.2.4 NH3-N、MCP、挥发性脂肪酸(VFA)浓度的测定滤液经4 000×g离心10 min后取4 mL上清液用于VFA浓度测定,取2 mL用于测定NH3-N浓度,剩余测定MCP浓度。
瘤胃液NH3-N浓度采用冯宗慈等[14]的方法进行测定。瘤胃液MCP浓度按照严淑红等[15]的方法进行测定。瘤胃液VFA浓度是以二乙基丁酸(2-EB)为内标物,采用气相色谱法,按照胡伟莲[16]的方法进行测定。
1.2.5 瘤胃微生物含量的测定 1.2.5.1 瘤胃微生物总DNA的提取采用珠磨-十六烷基三甲基溴化铵(CTAB)提取总DNA[17]。取均质后的样品500 μL,加920 μL CTAB抽提液、75 μL 10%十二烷基磺酸钠(SDS)、5 μL蛋白酶K,37 ℃温浴1 h。液氮中快速冷冻3 min,迅速置于65 ℃水槽中温浴2 min,反复冻融2次。在珠磨仪上破碎5 min。3 000×g离心5 min,取上清液,加入260 μL 10 mol/L乙酸铵,混匀,置冰上冷冻5 min。16 000×g离心10 min, 取上清液到离心管中加等体积酚:氯仿:异戊醇(25 : 24 : 1),12 000×g离心10 min。将上清液放到离心管中加入等体积异丙醇,混合均匀,置冰上冷冻30~60 min。16 000×g离心10 min,弃上清液。加入70%乙醇,混合均匀,16 000×g离心10 min,弃上清液,待乙醇全部挥发后,加入100 μL TE缓冲液溶解沉淀。
1.2.5.2 实时荧光定量PCR(qRT-PCR)的反应条件和引物的设计与合成qRT-PCR的反应条件参照SYBR PreMix Plus试剂盒建立20 μL反应体系[18]。qRT-PCR的引物序列参照文献[19-21]中瘤胃总细菌(total bacteria)、真菌(fungi)、甲烷菌(methanogen)、原虫(protozoa)、产琥珀酸丝状杆菌(Ruminococcus succinogenes)、黄色瘤胃球菌(Ruminococcus flavefaciens)、溶纤维丁酸弧菌(Butyrivibrio fibrisolvens)、白色瘤胃球菌(Ruminococcus albus),见表 2。从瘤胃微生物总DNA中扩增16S rDNA。将目标菌含量表示为相对于瘤胃总细菌16S rDNA的百分比,公式[17]为:
|
|
表 2 实时荧光定量PCR引物信息 Table 2 Information of primers for qRT-PCR |
目标菌含量(%)=100×2-(Ct目标菌-Ct总细菌)。
1.3 数据统计与分析利用SPSS 17.0软件的one-way ANOVA对数据进行单因素方差分析,用Duncan氏法对平均值进行多重比较。P < 0.05为差异显著判定标准,P>0.05为差异不显著判定标准。
2 结果 2.1 沙葱及其提取物对肉羊瘤胃液pH以及MCP、NH3-N浓度的影响由表 3可知,各组在不同时间的瘤胃液pH均在正常范围(6~7),在60 d时, 沙葱及其提取物组pH均显著高于对照组(P < 0.05),在0 d时, 各组间差异不显著(P>0.05),但均高于对照组;沙葱组瘤胃液MCP浓度较其他3组高,在60 d时达到显著水平(P<0.05);在60 d时,沙葱及其提取物组瘤胃液NH3-N浓度低于对照组,但差异不显著(P>0.05)。
|
|
表 3 沙葱及其提取物对肉羊瘤胃液pH以及MCP、NH3-N浓度的影响 Table 3 Effects of Allium mongolium Regel and its extracts on pH, MCP, NH3-N concentrations in ruminal fluid of sheep |
由表 4可知,与对照组相比,在60 d时,沙葱组和脂溶组瘤胃液丙酸浓度显著提高(P<0.05),沙葱组瘤胃液丁酸浓度显著提高而异丁酸浓度显著降低(P<0.05);在各时间点,各组间瘤胃液乙酸、戊酸和异戊酸浓度差异均不显著(P>0.05);在60 d时,脂溶组瘤胃液乙酸/丙酸显著降低(P < 0.05)。
|
|
表 4 沙葱及其提取物对肉羊瘤胃液VFA浓度的影响 Table 4 Effects of Allium mongolicum Regel and its extracts on VFA concentrations in ruminal fluid of sheep |
由图 1可知,利用琼脂糖凝胶电泳检测DNA的完整性,扩增的目的片段呈现1条亮带,且在Marker的相应位置,无拖尾现象。这说明设计的引物与提取的DNA能够用于qRT-PCR。
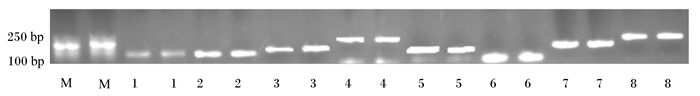
|
M:DNA分子量标记DNA molecular weight marker;1:溶纤维丁酸弧菌Butyrivibrio fibrisolvens (136 bp);2:甲烷菌Methanogen (140 bp);3:产琥珀酸丝状杆菌Ruminococcus succinogenes(134 bp);4:白色瘤胃球菌Ruminococcus albus(270 bp);5:真菌Fungi (120 bp);6:溶纤维丁酸弧菌Ruminococcus flavefaciens (190 bp);7:总菌total bacteria (130 bp);8:原虫Protozoa (250 bp)。 图 1 琼脂糖凝胶电泳结果 Fig. 1 Results of agarose gel electrophoresis |
由表 5可知,与对照组相比,在30和60 d时,沙葱及其提取物组产琥珀酸丝状杆菌和黄色瘤胃球菌含量显著提高(P<0.05),溶纤维丁酸弧菌、甲烷菌、白色瘤胃球菌含量无显著差异(P>0.05);在30 d时,水溶组和脂溶组真菌含量显著高于其他各组(P<0.05);在60 d时,水溶组真菌含量显著高于其他各组(P < 0.05);在30和60 d时,沙葱组的原虫含量均显著低于对照组和其他试验组(P<0.05)。
|
|
表 5 沙葱及其提取物对肉羊瘤胃微生物构成的影响 Table 5 Effects of Allium mongolicum Regel and its extracts on composition of ruminal microorganism of sheep |
瘤胃pH是反映瘤胃发酵状况的综合指标之一,它受到饲粮性质、唾液分泌、瘤胃内酸碱性物质排出和吸收等因素的影响,但导致其波动的根本原因是饲粮结构和营养水平[22]。瘤胃pH过高或过低均会影响其微生物的活力,从而进一步影响微生物对饲料的发酵。当瘤胃pH为6.2~7.0时,瘤胃内微生物生态系统较为稳定,能够保证瘤胃的正常发酵。研究证实,pH为6.2~6.8时,瘤胃微生物发酵纤维物质的活性最高;pH为5.5~6.0时,瘤胃微生物发酵淀粉的活性最强;当瘤胃pH降低到5.5以下时,原虫的生长就会受阻,动物容易出现酸中毒,可见中性至弱酸性环境是肉羊瘤胃微生物生存的最佳环境[23]。研究表明,在反刍动物的饲粮中添加沙葱可以显著影响瘤胃液pH[24]。赵国芬等[25]报道, 在肉羊基础饲粮中添加新鲜沙葱可以显著提高瘤胃液pH,这与赵春艳等[26]的研究结果一致。本试验发现,添加沙葱及其提取物均显著提高肉羊瘤胃液pH,瘤胃pH和动物机体唾液分泌量有较大关系,试验组添加沙葱及其提取物增强了饲粮适口性,刺激试验羊的咀嚼活动,进而增加了唾液分泌量,提高瘤胃pH。但各试验组瘤胃液pH在6.27~6.78内波动,均处于正常生理范围之内,因此对肉羊瘤胃微生物正常代谢不会产生不利影响,添加沙葱及其提取物提高瘤胃pH,稳定瘤胃内环境,有利于瘤胃微生物发酵。
反刍动物通过瘤胃微生物对饲料的发酵消化而获得主要的能量来源,碳水化合物在瘤胃中发酵所产生的乙酸、丙酸、丁酸、异丁酸及戊酸等短链VFA可提供反刍动物所需总能量的70%~80%,是反刍动物赖以生存、保持正常生长繁殖的重要能源,因此反刍动物瘤胃中VFA的浓度及组成比例是反映瘤胃消化代谢水平的重要指标[27-28]。乙酸/丙酸与饲料能量利用率呈反比。研究发现,在反刍动物的饲粮中添加沙葱及其提取物可以改变瘤胃发酵模式[29]。张霞[13]研究报道,在绵羊基础饲粮中添加沙葱及其提取物能显著提高瘤胃内乙酸和丙酸浓度。包玲玲等[12]研究报道,绵羊饲粮中添加沙葱黄酮类化合物能够促进瘤胃中的总VFA浓度的提升,进而调控瘤胃发酵模式,其原理主要是提高乙酸和丙酸浓度,这与蒋涛等[24]的研究结果一致。本试验研究发现,在肉羊饲粮中添加沙葱及其提取物显著提高了瘤胃液丙酸和丁酸浓度,降低了乙酸/丙酸。由此可见,沙葱及其提取物均能够促进肉羊瘤胃发酵,优化瘤胃内环境,改善瘤胃发酵模式,从而提高饲料转化率。
在瘤胃微生物区系中,瘤胃内氨的最主要去路是被瘤胃微生物利用,约有80%的细菌以NH3-N为生长的唯一氮源,大约55%的细菌既可以利用NH3-N也可以利用氨基酸为生长的氮源[30]。因此,瘤胃内NH3-N的浓度是直接反映瘤胃微生物活力的重要指标,也是微生物合成MCP的原料,反映了瘤胃内微生物氮供应状况。瘤胃内NH3-N和MCP浓度密切相关[31];微生物蛋白质代谢是瘤胃微生物区系营养代谢的重要组成部分,MCP能够提供反刍动物蛋白质需要的40%~80%,是反刍动物最主要的氮源供应者。微生物的生长会受到蛋白质和碳水化合物等营养物质含量及瘤胃内环境的影响,MCP是瘤胃微生物经过复杂发酵过程而合成的。因此,MCP浓度可以间接反映微生物种群数量及微生物利用NH3-N的能力[32-33]。Van Nevel等[34]通连续培养发酵试验证明,瘤胃中NH3-N浓度为5 mg/dL时就足以维持微生物的最高生长率。韩正康等[35]研究发现, 瘤胃中NH3-N浓度为8.5 mg/dL时,瘤胃微生物合成蛋白质的能力饱和,超过该浓度也无法提高MCP的产量。NH3-N是反刍动物最重要的氮代谢的中间产物,大部分被瘤胃微生物吸收合成蛋白质,但是当NH3-N浓度过高时,NH3-N被瘤胃壁吸收,从而使血浆尿素氮含量升高,加重机体对氮代谢的负担,进而会影响微生物的生长[36]。有研究表明,在绵羊饲粮中添加沙葱黄酮类化合物之后可降解蛋白质,进而导致瘤胃NH3-N浓度下降。包玲玲等[12]研究报道,在进行绵羊体外批次培养时,添加沙葱黄酮类化合物极显著降低培养液中NH3-N浓度并提高了培养液中的MCP浓度,赵国芬等[25]在绵羊饲粮中添加4%鲜沙葱,显著降低了瘤胃NH3-N浓度,提高了MCP浓度。本试验研究发现,在肉羊饲粮中添加沙葱及其提取物均降低瘤胃液NH3-N的浓度,且均在正常范围内,其中沙葱组瘤胃液NH3-N浓度降低的同时,MCP浓度显著升高,这与包玲玲等[12]和赵国芬等[25]的研究结果一致,可能是由于沙葱及其提取物降低了瘤胃微生物对含氮物质的分解作用,导致NH3-N浓度的降低,而未被瘤胃微生物分解的含氮物质被微生物利用合成了MCP。
3.2 沙葱及其提取物对肉羊瘤胃微生物区系的影响反刍动物瘤胃中的微生物主要包括细菌、厌氧真菌和原虫,这些微生物的种类繁多、数量巨大且相互之间存在竞争和协同的复杂关系[37]。瘤胃微生物通过发酵将饲料转化为反刍动物能够利用的营养物质,反刍动物对营养物质的消化利用受瘤胃微生物的种类及相互之间比例的影响,因此,瘤胃微生物区系对维系机体正常生长和生产起着重要作用。
瘤胃原虫能降解蛋白质并提高宿主微生物蛋白质流量,且原虫可以通过发酵碳水化合物控制瘤胃内VFA的生成从而维持瘤胃内pH稳定。但是,原虫在营养方面存在较大的负面效应,原虫可以降低饲料中纤维物质的利用率以及增加微生物生长的维持需要,同时原虫对细菌氮的利用率较低会导致整个微生物蛋白质的低效率合成。研究发现去原虫能够使可发酵有机物流向小肠的氮增加36%且明显提高饲料利用率[38]。赵春艳等[26]发现在绵羊精料中添加沙葱可以有效抑制原虫数量,导致瘤胃细菌利用氮源合成MCP的量增加。赵国芬等[25]证实在绵羊饲粮精饲料中添加4%的沙葱可以显著降低纤毛虫的数量,可以有效促进微生物对氮的利用和瘤胃发酵。本试验研究发现,在肉羊饲粮中添加沙葱,瘤胃中原虫含量显著降低,与上述文献报道的结果一致,但其机理有待于进一步阐明。
各类瘤胃微生物协同作用使得反刍动物得以分解利用饲料中的纤维物质,其中真菌和细菌发挥了80%的作用[15]。瘤胃真菌可以分泌多种降解纤维素的酶而降解纤维素,虽然在体外试验中瘤胃真菌可以消化70%的纤维素,但是真菌的繁殖速度比细菌慢,所以细菌在瘤胃发酵中占主导地位[39]。产琥珀酸丝状杆菌、白色瘤胃球菌、黄色瘤胃球菌是瘤胃内主要的纤维分解细菌,能够产生大量的纤维素酶,在纤维降解中具有重要作用,而溶纤维丁酸弧菌主要水解半纤维素[40]。张霞[13]研究发现,在绵羊饲粮中添加沙葱和沙葱水溶性提取物分别使真菌数量提高了6.1%和45.6%,并能提高产琥珀酸丝状杆菌、白色瘤胃球菌、黄色瘤胃球菌3种主要纤维分解细菌相对数量。本试验研究发现,沙葱及其提取物对瘤胃细菌和真菌的影响具有选择性,肉羊饲喂沙葱及其提取物后瘤胃液中产琥珀酸丝状杆菌和黄色瘤胃球菌含量显著增多,但是对溶纤维丁酸弧菌、甲烷菌、白色瘤胃球菌含量没有显著影响,而沙葱水溶性提取物组真菌含量显著高于其他组。究其原因,可能是因为沙葱水溶性提取物有效降低了瘤胃内NH3-N浓度,作为真菌生长氮源的铵根离子和氨基酸增多,从而使真菌含量增加。原虫和细菌之间存在协同作用,但同时互相竞争营养源,沙葱能够有效地降低瘤胃内原虫含量从而导致瘤胃中产琥珀酸丝状杆菌和黄色瘤胃球菌含量显著增多。
瘤胃内的甲烷主要由甲烷菌产生,瘤胃原虫与甲烷产生并无直接关系,但由于甲烷菌常和纤毛虫结合, 其产生的甲烷占总甲烷量的9%~25%,瘤胃甲烷菌和纤毛虫之间是兼性共生关系,因此瘤胃原虫数量的变化可能会引起瘤胃甲烷菌及甲烷产量的变化[41]。但Machmüller等[42]体内试验发现,祛除原虫并不能减少甲烷产量,并认为瘤胃液中纤毛虫和甲烷菌数量的减少并不意味着已经有效地降低了瘤胃的甲烷产量。本试验研究发现,添加沙葱及其提取物对肉羊瘤胃内甲烷菌含量无显著影响。沙葱及其提取物对甲烷产量的影响机理还需深入研究。
4 结论① 饲粮中添加沙葱及其提取物有助于改善肉羊瘤胃液pH和促进瘤胃MCP的合成, 也可在正常范围内降低肉羊瘤胃液NH3-N浓度;沙葱及其脂溶性提取物可提高肉羊瘤胃液丙酸、丁酸浓度,降低乙酸/丙酸,但对总VFA浓度无显著影响。
② 饲粮中添加沙葱及其提取物可显著增加肉羊瘤胃液产琥珀酸丝状杆菌、黄色瘤胃球菌和真菌的含量,减少瘤胃液原虫的含量。
③ 综合认为,沙葱及其提取物对肉羊瘤胃发酵和微生物结构变化有积极作用。
| [1] |
HESPELL R B.Bacteria, fungi and protozoa of the rumen[M]//MACKIE R I, WHITE B A, ISAACSON R E.Gastrointestinal microbiology.New York: Chapman and Hall Press, 1997: 59-186
|
| [2] |
刘兵, 瞿明仁, 张学峰, 等. 瘤胃灌注大豆寡糖对绵羊消化道内营养物质流通与消化的影响[J]. 畜牧兽医学报, 2008(7): 915-922. DOI:10.3321/j.issn:0366-6964.2008.07.012 |
| [3] |
张华, 童津津, 孙铭维, 杨德莲, 张婕, 熊本海, 蒋林树. 植物提取物对反刍动物瘤胃发酵、生产性能及甲烷产量的调控作用及其机制[J]. 动物营养学报, 2018, 30(6): 2027-2035. DOI:10.3969/j.issn.1006-267x.2018.06.002 |
| [4] |
斯琴巴特尔, 刘新民. 蒙古韭的营养成分及民族植物学[J]. 中国草地, 2002, 24(3): 52-54. |
| [5] |
燕玲, 王六英, 李红. 内蒙古10种葱属植物染色体数目及核型分析[J]. 中国草地, 1999(5): 73-75. |
| [6] |
李亚蕾, 罗瑞明. 沙葱提取物抗菌效果的研究[J]. 安徽农业科学, 2008, 36(33): 14596-14597, 14618. DOI:10.3969/j.issn.0517-6611.2008.33.101 |
| [7] |
凌关庭. 天然抗氧化剂及其消除氧自由基的进展[J]. 食品工业, 2000(3): 19-22. |
| [8] |
木其尔.沙葱黄酮对肉羊机体抗氧化和免疫功能的影响及其机理研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10129-1016250444.htm
|
| [9] |
陈仁伟.沙葱黄酮对肉羊生产性能及其肉品质的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10129-1016249868.htm
|
| [10] |
陈圣阳, 敖长金, 郑彦楷, 等. 沙葱黄酮对肉羊生产性能和肠道组织β-防御素基因表达的影响[J]. 动物营养学报, 2018, 30(3): 1095-1102. DOI:10.3969/j.issn.1006-267x.2018.03.034 |
| [11] |
包雨洪.沙葱多糖对绵羊瘤胃发酵、纤维素降解及血液生化指标的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2009. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1473941
|
| [12] |
包玲玲, 敖长金, 萨茹丽, 等. 沙葱黄酮类化合物对绵羊瘤胃内环境(体外)的影响[J]. 饲料工业, 2015, 36(14): 6-10. |
| [13] |
张霞.沙葱提取物对绵羊瘤胃发酵和微生物区系的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2007. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1137898
|
| [14] |
冯宗慈, 高民. 通过比色测定瘤胃液氨氮含量方法的改进[J]. 畜牧与饲料科学, 2010, 31(6/7): 37. |
| [15] |
严淑红, 赵士萍, 蒋琦晖, 等. 茶皂素对奶牛瘤胃发酵及瘤胃微生物区系的影响[J]. 动物营养学报, 2016, 28(8): 2485-2496. DOI:10.3969/j.issn.1006-267x.2016.08.020 |
| [16] |
胡伟莲.皂甙对瘤胃发酵与甲烷产量及动物生产性能影响的研究[D].博士学位论文.杭州: 浙江大学, 2005. http://cdmd.cnki.com.cn/Article/CDMD-10335-2005095419.htm
|
| [17] |
BÜRGMANN H, PESARO M, WIDMER F, et al. A strategy for optimizing quality and quantity of DNA extracted from soil[J]. Journal of Microbiological Methods, 2001, 45(1): 7-20. DOI:10.1016/S0167-7012(01)00213-5 |
| [18] |
刘薇, 辛杭书, 刘彩娟, 等. 海南霉素对瘤胃发酵模式、甲烷生成和微生物区系的影响[J]. 畜牧兽医学报, 2012, 43(2): 242-249. |
| [19] |
DENMAN S E, MCSWEENEY C S. Development of a real-time PCR assay for monitoring anaerobic fungal and cellulolytic bacterial populations within the rumen[J]. FEMS Microbiology Ecology, 2006, 58(3): 572-582. DOI:10.1111/fem.2006.58.issue-3 |
| [20] |
DENMAN S E, TOMKINS N W, MCSWEENEY C S. Quantitation and diversity analysis of ruminal methanogenic populations in response to the antimethanogenic compound bromochloromethane[J]. FEMS Microbiology Ecology, 2007, 62(3): 313-322. DOI:10.1111/fem.2007.62.issue-3 |
| [21] |
赵玉华.瘤胃微生物Real Time PCR定量方法的建立及其应用[D].博士学位论文.北京: 中国农业科学院, 2005. http://cdmd.cnki.com.cn/Article/CDMD-82101-2005114962.htm
|
| [22] |
赵国琦, 贾亚红, 陈小连, 等. 不同NDF/NFE比的日粮对山羊瘤胃发酵参数影响的研究[J]. 中国畜牧杂志, 2006, 42(13): 29-33. DOI:10.3969/j.issn.0258-7033.2006.13.011 |
| [23] |
CALSAMIGLIA S, FERRET A, DEVANT M. Effects of pH and pH fluctuations on microbial fermentation and nutrient flow from a dual-flow continuous culture system[J]. Journal of Dairy Science, 2002, 85(3): 574-579. DOI:10.3168/jds.S0022-0302(02)74111-8 |
| [24] |
蒋涛, 敖长金.沙葱和沙葱残渣对绵羊瘤胃内环境指标的影响[C]//中国畜牧兽医学会动物营养学分会第十次学术研讨会论文集.杭州: 中国畜牧兽医学会动物营养学分会, 2008: 1. http://cpfd.cnki.com.cn/Article/CPFDTOTAL-SEKM200810002229.htm
|
| [25] |
赵国芬, 敖长金, 赵志恭, 等. 沙葱和油料籽实对蒙古羊瘤胃内环境的影响[J]. 黑龙江畜牧兽医, 2006(12): 52-55. DOI:10.3969/j.issn.1004-7034.2006.12.024 |
| [26] |
赵春艳, 敖长金, 张宇宏, 等. 沙葱对绵羊瘤胃内环境的影响[J]. 黑龙江畜牧兽医, 2007(1): 58-59. DOI:10.3969/j.issn.1004-7034.2007.01.030 |
| [27] |
赵广永, 李凤学, 杨雅芳, 等. 玉米油对秸秆瘤胃降解率与肉牛日粮消化率的影响[J]. 中国农业大学学报, 2000, 5(3): 102-105. DOI:10.3321/j.issn:1007-4333.2000.03.018 |
| [28] |
SAUVANT D, BAUMONT R, FAVERDIN P. Development of a mechanistic model of intake and chewing activities of sheep[J]. Journal of Animal Science, 1996, 74(11): 2785-2802. DOI:10.2527/1996.74112785x |
| [29] |
哈斯额尔敦, 敖长金, 张巧娥, 等. 沙葱水溶性提取物对绵羊瘤胃发酵功能(体外)的影响[J]. 饲料工业, 2007, 28(11): 48-51. DOI:10.3969/j.issn.1001-991X.2007.11.016 |
| [30] |
苑文珠.茶皂素对湖羊生产性能及瘤胃发酵的影响[D].硕士学位论文.杭州: 浙江大学, 2002. http://cdmd.cnki.com.cn/Article/CDMD-10335-2003041007.htm
|
| [31] |
SRINIVAS B, GUPTA B N. Rumen fermentation, bacterial and total volatile fatty acid (TVFA) production rates in cattle fed on urea-molasses-mineral block licks supplement[J]. Animal Feed Science and Technology, 1997, 65. |
| [32] |
BARAN M, BOD'A K, SIROKA P. The effect of monensin on rumen fermentation in sheep fed on all-roughage and barley/roughage diets[J]. Animal Feed Science and Technology, 1986, 15(1): 7-12. DOI:10.1016/0377-8401(86)90033-7 |
| [33] |
MAO H L, WANG J K, ZHOU Y Y, et al. Effects of addition of tea saponins and soybean oil on methane production, fermentation and microbial population in the rumen of growing lambs[J]. Livestock Science, 2010, 129(1/2/3): 56-62. |
| [34] |
VAN NEVEL C J, DEMEYER D I. Effect of monensin on rumen metabolism in vitro[J]. Applied and Environmental Microbiology, 1977, 34(3): 251-257. |
| [35] |
韩正康, 陈杰. 反刍动物瘤胃的消化和代谢[M]. 北京: 科学出版社, 1988: 1-244.
|
| [36] |
王洪荣, 冯宗慈, 卢德勋, 等. 应用瘤胃液氨氮、挥发性脂肪酸和血浆尿素氮水平检测放牧绵羊营养状况的研究[J]. 内蒙古畜牧科学, 1992(3): 34-40. |
| [37] |
茅慧玲, 王佳, 刘建新. 日粮中添加茶皂素和豆油对羔羊瘤胃细菌区系的影响[J]. 中国畜牧杂志, 2010, 46(21): 43-46. |
| [38] |
BIRD S H, LENG R A. Further studies on the effects of the presence or absence of protozoa in the rumen on live-weight gain and wool growth of sheep[J]. British Journal of Nutrition, 1984, 52(3): 607-611. DOI:10.1079/BJN19840127 |
| [39] |
JOBLIN K N.Physical disruption of plant fiber by rumen fungi of the sphaeromonas group[M]//NOLAN J V, LENG R A, DEMEYER D I.The roles of protozoa and fungi in ruminant digestion.Armidale: Penambul Books: 1989: 259-260.
|
| [40] |
陈旭伟.不同皂苷对山羊瘤胃原虫和细菌种属变化以及纤维降解的影响[D].硕士学位论文.扬州: 扬州大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-11117-2009192881.htm
|
| [41] |
张婷婷, 杨在宾, 刘建新, 等. 茶皂素对甲烷产量和瘤胃发酵影响的研究进展[J]. 家畜生态学报, 2011, 32(2): 96-99. DOI:10.3969/j.issn.1673-1182.2011.02.021 |
| [42] |
MACHMÜLLER A, SOLIVA C R, KREUZER M. Effect of coconut oil and defaunation treatment on methanogenesis in sheep[J]. Reproduction Nutrition Development, 2003, 43(1): 41-55. DOI:10.1051/rnd:2003005 |




