营养素通过表观遗传修饰(DNA甲基化、组蛋白修饰、microRNA调控等)调控基因表达,从而调节包括脂肪代谢在内的各项生命活动。哺乳动物中,DNA甲基化是脱氧核糖核酸分子的胞嘧啶-磷酸-鸟嘌呤(CpG)二核苷酸中5-甲基胞嘧啶在甲基转移酶催化下共价结合一碳基团(如甲基、亚甲基等),DNA序列不变,且这种化学修饰可遗传到子代,CpG集中分布的区域被称为CpG岛[1]。基因启动子区及第一外显子区的CpG甲基化通常抑制基因的表达,而去甲基化则促进基因表达[2]。研究表明,妊娠期饲粮蛋白质限制的大鼠,其后代断奶后肝脏糖皮质激素受体(GR)、过氧化物酶体增殖物激活受体α(PPARα)基因启动子甲基化水平显著降低,mRNA表达量显著升高[3]。Amaral等[4]报道,补充鱼油可以阻止高脂饲粮诱导的肥胖大鼠肌肉过氧化物酶体增殖物激活受体γ转录变体2(Pparg2)基因启动子甲基化水平的降低。长期饲喂高精饲粮上调了泌乳中期奶山羊乳腺组织脂肪合成基因甲基化水平,从而下调其基因表达,降低乳脂肪含量[5]。由此可见,生命早期(胚胎期)或成年后长期的营养作用均可以操控机体的DNA甲基化状态,但目前对于营养素对反刍动物肌肉DNA特定区域甲基化修饰的研究较少。S-腺苷甲硫氨酸(SAM)在一碳代谢循环中合成,提供DNA甲基化所需的甲基基团,因此,能够直接或间接控制一碳代谢循环的营养素均可能改变DNA甲基化水平[6-7]。
沙葱作为一种营养物质含量均衡的百合科葱属植物,分布于我国西北部荒漠和戈壁,又名“蒙古韭”,是被西北地区人民所青睐的绿色蔬菜,且羊喜食。肉羊饲粮中添加沙葱及其提取物不仅可以提高肉羊免疫机能,还能调控肉羊机体脂肪酸的组成与分布,提高肉品质[8-9]。本课题组之前的研究表明,沙葱水溶性提取物中主要活性成分有半胱氨酸衍生物、大蒜素、苯并吡喃衍生物、螺甾烷衍生物、黄芪甙衍生物,沙葱脂溶性提取物中主要活性成分有烷烃、氨类化合物、醇类、酸类、酚类[10]。饲喂肉羊沙葱水溶性提取物可以显著降低肉羊背最长肌饱和脂肪酸(SFA)含量;沙葱水溶性提取物和沙葱脂溶性提取物混合饲喂肉羊,显著增加了其背最长肌单不饱和脂肪酸(MUFA)含量和C18 : 2/C18 : 3比例;饲喂肉羊沙葱粉可以增加背最长肌多不饱和脂肪酸(PUFA)的含量,饲喂肉羊沙葱及其提取物可以增加背最长肌肌内脂肪(IMF)含量[9]。沙葱还可以在一定程度上提高IMF中共轭亚油酸(CLA)含量[11]。之前的研究多集中在沙葱及其提取物对肉羊脂肪酸分布等表型特征的效应上,未能从分子的角度对其具体机制进行研究。因此,本研究旨在通过饲喂肉羊沙葱提取物,对其脂肪代谢相关基因表达及甲基化进行检测,探讨沙葱提取物对肉羊脂肪沉积及脂肪酸组成影响的表观遗传机制,为沙葱及其提取物的进一步开发与应用提供科学依据。
1 材料与方法 1.1 沙葱提取物的制备沙葱粉购自阿拉善盟浩海生物科技有限公司,经本实验室脱脂脱色、蒸馏水浸提、抽滤、浓缩冻干制备沙葱水溶性提取物,经本实验室脱脂脱色、乙醇浸提、超声、抽滤、浓缩冻干制备沙葱脂溶性提取物。经检测,沙葱水溶性提取物和沙葱脂溶性提取物中黄酮类含量分别为21.05%和25.47%。
1.2 试验设计采用单因素完全随机设计,选取60只体重(35~40 kg)相近、4.5月龄的健康无病的杜寒杂交母羊,随机分为4组,每组15只。对照组(T1组)饲喂基础饲粮,试验组在基础饲粮中每只分别添加沙葱粉(10.0 g/d,T2组)、沙葱水溶性提取物(3.2 g/d,T3组)、沙葱脂溶性提取物(2.8 g/d,T4组)。沙葱粉饲喂量参考卢媛[12]的试验研究,提取物饲喂量由沙葱粉按提取得率折算后确定。预试期为15 d,正试期为60 d。饲养试验于2017年9—11月在内蒙古自治区巴彦淖尔市临河区富川养殖科技股份有限公司进行。
1.3 饲养管理在饲养试验开始前,对羊舍进行消毒,预试期摸清肉羊采食量。试验期间每天06:30和18:30进行饲喂,由固定人员饲喂,减少各种应激,肉羊自由采食与饮水。正试期每天记录肉羊采食量,计算干物质采食量。定期对羊舍进行清扫,保证羊舍适宜的温度和湿度条件,各组间除沙葱及其提取物添加剂外的其他饲养管理条件保持一致。基础饲粮组成及营养水平见表 1。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
试验期结束后,屠宰放血后采集背最长肌样品,剔去表面脂肪与筋膜,迅速分装样品并编号置于液氮中,之后迅速转移至-80 ℃超低温冰箱,用于测定乙酰辅酶A羧化酶α(ACACA)、硬脂酰辅酶A去饱和酶(SCD)、固醇调节元件结合转录因子1(SREBF1)基因表达量及甲基化水平。采样用的手术刀、镊子、剪刀等均经过高压灭菌。
1.5 测定指标 1.5.1 饲粮营养成分测定依据GB/T 6432—1994方法,采用凯氏定氮仪测定粗蛋白质含量;依据GB/T 6433—2006方法,采用索氏浸提法测定粗脂肪含量;依据GB/T 20806—2006方法测定中性洗涤纤维含量;采用Van Soest等[14]的方法测定酸性洗涤纤维含量;依据GB/T 6436—2002方法,采用高锰酸钾滴定法测定钙含量;依据GB/T 6437—2002方法,采用分光光度法测定磷含量。
1.5.2 脂肪代谢相关基因表达测定按照RNA提取试剂盒(Axygen,美国)说明,提取肌肉组织总RNA,通过分光光度计检测RNA浓度和纯度,1.5%琼脂糖凝胶电泳检测RNA结构完整性。将RNA反转录成cDNA(RR047A,TaKaRa)。使用Primer 3.0设计引物[15],由上海生工生物工程技术服务有限公司合成,荧光定量PCR引物序列及参数见表 2。以甘油醛-3-磷酸脱氢酶(GAPDH)为内参基因,根据荧光定量PCR试剂盒(RR820A,TaKaRa)配制20 μL反应体系,每个样品重复3次,实时荧光定量PCR的反应程序为:95 ℃ 30 s;40个循环:95 ℃ 5 s;60 ℃ 20 s。目的基因相对表达量用2-ΔΔCt法计算。
|
|
表 2 荧光定量PCR引物序列及参数 Table 2 Primer sequences and parameters for fluorescent quantitation PCR |
DNA提取采用DNA提取试剂盒(天根,北京),经检测DNA浓度和纯度均符合要求,使用EZ DNA Methylation-GoldTM Kit甲基化试剂盒(Zymo Research公司,美国)将基因组DNA未被甲基化修饰的胞嘧啶转化为胸腺嘧啶。通过美国国家生物技术信息中心(NCBI)查询基因并对目标区域CpG位点进行分析,由上海天昊生物科技有限公司利用软件(http://primer3.ut.ee/)设计合成多重PCR引物,甲基化引物序列及参数见表 3。以经重亚硫酸氢盐转化后的基因组DNA为模板,经目标CpG区域的多重PCR扩增,琼脂糖凝胶纯化回收,建立文库,最终于Illumina Miseq平台进行高通量测序,获得FastQ序列,FastQ序列与绵羊基因组参考序列进行比对(此方法具体操作见文献[16])。目的区域的多重PCR扩增结合二代测序,能准确计算每个CpG位点的甲基化水平。
|
|
表 3 甲基化引物序列及参数 Table 3 Primer sequences and parameters for methylation |
CpG位点甲基化水平=甲基化的胞嘧啶的数目(检测到未转化的胞嘧啶数目)/该位点全部检测的胞嘧啶数目;
平均甲基化水平=片段内(CpG岛)所有检测的CpG位点甲基化水平的均值。
经评估,ACACA、SCD、SREBF1基因在转录起始位点上游2K至第一外显子下游1K区域内均各有2个高甲基化的CpG岛(ACACAM1、ACACAM2、SCDM1、SCDM2、SREBF1M1、SREBF1M2)。
1.6 数据分析采用SAS 9.0软件进行单因素方差分析(one way-ANOVA),采用Duncan氏法进行多重比较,结果采用平均值±标准误表示,并对基因表达与各CpG岛的平均甲基化水平进行Pearson相关性分析,P < 0.05表示差异显著或显著相关,P≥0.05表示差异不显著或不相关。
2 结果与分析 2.1 沙葱提取物对杜寒杂交羊干物质采食量的影响由表 4可知,试验第1~30天,T2组肉羊干物质采食量显著低于其他3组(P < 0.05),其他3组间差异不显著(P>0.05)。试验第31~60天,4个组肉羊干物质采食量无显著差异(P>0.05)。
|
|
表 4 沙葱提取物对杜寒杂交羊干物质采食量的影响 Table 4 Effects of Allium mongolicum Regel extracts on dry matter intake of Dorper×thin-tailed Han crossbred sheep |
由表 5可知,T2组ACACA基因相对表达量显著高于T1组(P < 0.05),SCD、SREBF1基因相对表达量高于T1组,但差异不显著(P>0.05);T3组ACACA、SCD、SREBF1基因相对表达量均显著高于T1组(P < 0.05);T4组ACACA、SCD基因相对表达量高于T1组,但差异不显著(P>0.05);T3组ACACA、SCD、SREBF1基因相对表达量均高于T2组,但差异不显著(P>0.05),T3组ACACA、SREBF1基因相对表达量显著高于T4组(P < 0.05);T2组ACACA、SCD、SREBF1基因相对表达量均高于T4组,但差异不显著(P>0.05)。
|
|
表 5 沙葱提取物对杜寒杂交羊背最长肌脂肪代谢相关基因表达的影响 Table 5 Effects of Allium mongolicum Regel extracts on expression of fat metabolism related genes in longissimus dorsi muscle of Dorper×thin-tailed Han crossbred sheep |
由表 6可知,脂肪代谢相关基因ACACA、SCD、SREBF1的CpG岛的平均甲基化水平在4个组中均为低甲基化水平,且组间无显著差异(P>0.05)。
|
|
表 6 沙葱提取物对杜寒杂交羊背最长肌脂肪代谢相关基因CpG岛平均甲基化水平的影响 Table 6 Effects of Allium mongolicum Regel extracts on mean methylation level of fat metabolism related genes CpG island in longissimus dorsi muscle of Dorper×thin-tailed Han crossbred sheep |
图 1统计出ACACA、SCD、SREBF1基因转录起始位点上游2K至第一外显子下游1K区域内CpG岛中CpG位点的甲基化水平,ACACAM1、ACACAM2、SCDM1、SCDM2、SREBF1M1、SREBF1M2中各CpG位点整体上均处于低甲基化状态。ACACAM1的23个CpG位点中,在54、61 bp位点的甲基化水平相对高于其他位点,T2、T3组在54 bp位点的甲基化水平低于T1、T4组,T2组在61 bp位点的甲基化水平低于T3组,T3组又低于T1、T4组(图 1-A)。ACACAM2的11个CpG位点中,在137、142 bp位点的甲基化水平相对高于其他位点,T3、T4组在137 bp位点的甲基化水平低于T2组,T2组又低于T1组,T4组在142 bp位点的甲基化水平低于T2组,T2组又低于T1、T3组(图 1-B)。SCDM1的31个CpG位点中,T3组在46 bp位点的甲基化水平高于T1、T4组,T1、T4组又高于T2组(图 1-C)。SCDM2的21个CpG位点中,211、216 bp位点的甲基化水平相对高于其他位点,且T1组在211 bp位点的甲基化水平高于T2组,T2组又高于T3、T4组(图 1-D)。SREBF1M1的16个CpG位点中,125、190 bp位点的甲基化水平相对高于其他位点,T4组在190 bp位点的甲基化水平高于T1、T3组,T1、T3组又高于T2组(图 1-E)。SREBF1M2的26个CpG位点中,48、54、59、61、71、77 bp位点的甲基化水平相对高于其他位点,甲基化水平在4%~12%之间,T4组在48 bp位点的甲基化水平低于T2组,T2组又低于T1、T3组,T4组在54 bp位点的甲基化水平高于T3组,T3组又高于T1、T2组,T2组在61 bp位点的甲基化水平低于T3组,T3组又低于T1、T4组,T2组在71 bp位点的甲基化水平低于其他3组,T3组在77 bp位点的甲基化水平高于T1组,T1组又高于T2、T4组(图 1-F)。综上,CpG位点甲基化水平在组间虽然具有一定差异,但整体无明显的规律性,且甲基化水平低,相互间比较没有统计意义。
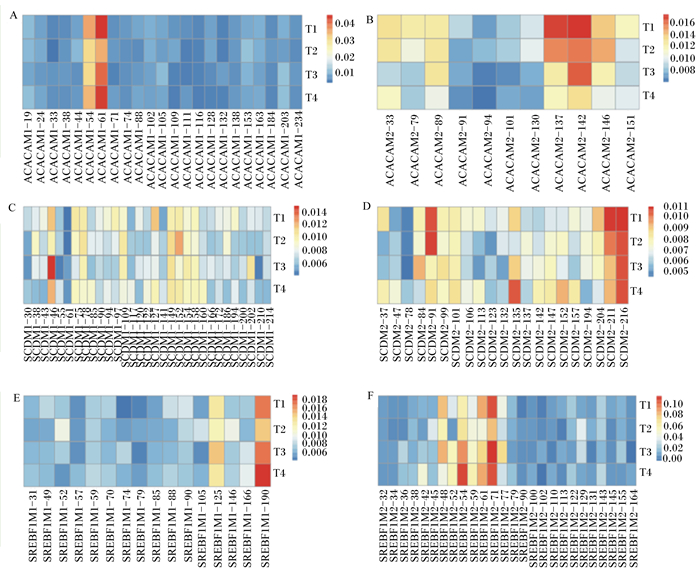
|
ACACAM1(A)、ACACAM2(B)、SCDM1(C)、SCDM2(D)、SREBF1M1(E)和SREBF1M2(F)为ACACA、SCD、SREBF1基因转录起始位点上游2K至第一外显子下游1K区域内的CpG岛。CpG位点根据其所处CpG岛上的位置进行编号。 ACACAM1(A), ACACAM2(B), SCDM1(C), SCDM2(D), SREBF1M1(E) and SREBF1M2(F) represent CpG islands of ACACA, SCD, SREBF1 genes from 2K upstream of transcriptional start site to 1K downstream of the first exon. CpG sites are numbered according to the location in the CpG islands. 图 1 沙葱提取物对杜寒杂交羊背最长肌ACACA、SCD、SREBF1基因特定区域CpG岛内各CpG位点甲基化水平的影响 Fig. 1 Effects of Allium mongolicum Regel extracts on methylation level of CpG sites in CpG islands of ACACA, SCD and SREBF1 gene specific regions in longissimus dorsi muscle of Dorper×thin-tailed Han crossbred sheep |
相关性分析结果如表 7所示,ACACA基因相对表达量与ACACAM1、ACACAM2甲基化水平不相关(P>0.05)。SCD基因相对表达量与SCDM1、SCDM2甲基化水平不相关(P>0.05)。SREBF1基因相对表达量与SREBF1M1、SREBF1M2甲基化水平不相关(P>0.05)。
|
|
表 7 基因特定区域CpG岛的平均甲基化水平与基因相对表达量的相关分析 Table 7 Correlation analysis between mean methylation level of CpG islands in specific regions of genes and relative expressions of genes |
在试验前期,沙葱粉组肉羊干物质采食量显著低于其他3组,其他3组间无显著差异,而试验后期4个组的干物质采食量无显著差异,可能是肉羊在试验前期还不适应沙葱粉的气味,后期逐渐适应,采食量得到恢复,与赵国芬[11]报道的饲喂肉羊沙葱粉未改变其干物质采食量的结果一致,因此,本研究中基因相对表达量的上调应为沙葱及提取物中活性成分对DNA或组蛋白等的表观遗传修饰的后果。
3.2 沙葱提取物对杜寒杂交羊背最长肌脂肪代谢相关基因表达的影响根据之前的研究,沙葱及其提取物通过降低相应部位脂肪酸合成酶(FAS)活性和提高激素敏感脂酶(HSL)活性,降低皮下脂肪、肾脏脂肪和总的体脂肪沉积[17],饲喂肉羊沙葱水溶性提取物能够上调其背部脂肪过氧化物酶体增殖物激活受体γ(PPARγ)的基因表达,下调脂蛋白脂酶(LPL)的基因表达[18],以上表明沙葱及其提取物能够影响肉羊胴体脂肪的分布,但迄今为止,还没有从酶活性和基因的角度研究沙葱及其提取物对肉羊肌内脂肪沉积及脂肪酸组成的影响。肌肉IMF沉积及脂肪酸的组成均是影响肉品质的重要经济性状。肌内脂肪可以增加风味、嫩度等感官肉品质,还能提供各种脂肪酸。本试验研究的与IMF沉积及脂肪酸组成相关的3个候选基因,均在脂肪代谢过程中发挥重要的作用。ACACA基因编码乙酰辅酶A羧化酶(ACC),ACC参与长链脂肪酸的生物合成,是脂肪酸从头合成的限速酶,催化乙酰辅酶形成丙二酰辅酶A的ATP依赖的羧化反应,而丙二酰辅酶A是合成棕榈酸的底物[15]。由SCD基因编码的SCD是MUFA生物合成的限速酶,并参与生成CLA。SREBF1基因调控固醇调节元件结合蛋白1c(SREBP1c)的合成,SREBP1c是调节脂肪代谢的重要转录因子,SREBF1可以激活脂肪酸合成酶(FASN)、SCD、ACACA、PPARα基因的表达[19-20]。Chen等[21]研究报道,育肥猪SREBF1基因表达与IMF沉积呈显著正相关。本试验结果显示,饲粮添加沙葱水溶性提取物显著提高了肉羊背最长肌ACACA、SCD、SREBF1基因表达,且效果优于沙葱粉和沙葱脂溶性提取物。张巧娥[9]表型测定的结果表明,沙葱水溶性提取物能够显著提高40 kg绵羊背最长肌中MUFA、PUFA、IMF含量及PUFA/SFA,且高于沙葱脂溶性提取物组及沙葱粉组,推测可能是沙葱水溶性提取物通过上调ACACA、SCD、SREBF1这3个脂肪酸合成相关基因的表达从而改善肉羊背最长肌中脂肪酸的组成,提高肌内脂肪含量。此外,本试验中饲喂肉羊沙葱粉提高肉羊背最长肌SCD基因表达与之前报道的沙葱粉可以提高绵羊肌内脂肪中CLA含量的结果[11]相吻合。
3.3 沙葱提取物对杜寒杂交羊背最长肌脂肪代谢相关基因甲基化水平的影响实际生产中,除了选育具有优良性状的畜禽品种外,还可以通过胚胎期对母体补充特定的营养素或者出生后长期的饲粮营养素作用,改变子代的表观遗传修饰,从而调控其基因表达,使其表现出一些具有经济意义的优良性状。本研究探讨饲粮营养素如何调控脂代谢基因表达,即DNA甲基化修饰对基因表达的影响。不同组织包括肌肉的甲基化模式具有特异性,肌肉的发生发育过程受DNA甲基化与去甲基化的调控,且肌肉组织特异性表达基因依靠DNA去甲基化激活,在不同细胞模型中已证实,细胞分化的过程伴随着组织特异性祖细胞发生谱系特异性去甲基化[22-23]。本研究结果显示,ACACA、SCD、SREBF1基因转录起始位点上游2K至第一外显子下游1K区域内的CpG岛甲基化水平低,呈现高度去甲基化状态,且CpG岛的平均甲基化水平各组间无显著差异,可能是肌肉组织ACACA、SCD、SREBF1基因在早期生命活动中建立起来的去甲基化模式,提高了转录因子与启动子结合的机会,激活其基因表达,从而发挥其在肌肉组织中的特异性功能。在哺乳动物基因组中,持家基因和组织特异性表达基因的调控区CpG岛呈现低甲基化,而且高表达的基因趋向于低甲基化,低表达的基因往往是高甲基化[24]。此外,在其他组织如脂肪组织同样发现类似的结果,郑彦楷[18]研究表明,背脂LPL,PPARγ基因转录起始位点及第一外显子附近CpG岛处于低甲基化状态。赵海谕[24]研究也表明,奶山羊脂肪及肌肉组织中垂体同型框转录因子2(PITX2)启动子CpG岛甲基化水平极低,表明反刍动物脂肪和肌肉组织中存在特异性表达的基因,其调控区呈现低甲基化状态。目前多数的学者致力于营养素对啮齿动物及禽类DNA甲基化调控的研究上,关于其对反刍动物机体脂代谢基因甲基化修饰的研究很少,Osorio等[25]发现饲喂瘤胃保护的甲硫氨酸有提高奶牛肝脏PPARα启动子甲基化水平的趋势,并显著上调其基因表达,从而改善围产期奶牛的脂质代谢,与本研究基因调控区低甲基化的结果不同,可能是由于研究的组织不同、动物模型不同等。
3.4 脂肪代谢相关基因特定区域DNA甲基化与基因相对表达量的相关性DNA调控区的甲基化通常对基因表达起负调控作用[22],而本研究中,由相关性分析可知,ACACA、SCD、SREBF1基因转录起始位点上游2K至第一外显子下游1K区域内各CpG岛的平均甲基化水平与基因相对表达量不相关,可能是基因低甲基化的后果。基因表达的表观遗传调控机制十分复杂,本研究中沙葱及其提取物不同程度地上调3个脂代谢关键基因表达,可能是组蛋白修饰、microRNA调控等其他表观遗传修饰的作用,也可能是对其上游基因的DNA甲基化修饰间接影响其基因表达,还可能是非CpG位点甲基化的作用。最新研究表明,哺乳动物体细胞如骨骼肌、脑组织、造血细胞中基因非CpG位点甲基化的变化也会导致基因表达的改变[26]。因此,沙葱提取物对肉羊背最长肌脂肪代谢调控的表观遗传机制尚需进一步的研究。
4 结论① 沙葱及其提取物可以上调脂代谢关键基因(ACACA、SCD、SREBF1)的表达,从而调节杜寒杂交羊肌肉脂肪酸组成与含量,其中沙葱水溶性提取物的上调效果最明显,沙葱粉次之,沙葱脂溶性提取物最低。
② ACACA、SCD、SREBF1基因转录起始位点上游2K至第一外显子下游1K区域内的CpG岛呈现高度去甲基化状态,且各组间差异不显著。
③ 沙葱及其提取物对ACACA、SCD、SREBF1的上调与其特定区域DNA甲基化水平无相关性。
| [1] |
BAIK M, KANG H J, PARK S J, et al. Triennial growth and development symposium:molecular mechanisms related to bovine intramuscular fat deposition in the longissimus muscle[J]. Journal of Animal Science, 2017, 95(5): 2284-2203. |
| [2] |
解小莉, 俞英, 袁志发, 等. 奶牛产奶性状与乳房炎相关基因CpG含量及分布特征的比较分析[J]. 遗传, 2012, 34(4): 437-444. |
| [3] |
LILLYCROP K A, PHILLIPS E S, JACKSON A A, et al. Dietary protein restriction of pregnant rats induces and folic acid supplementation prevents epigenetic modification of hepatic gene expression in the offspring[J]. The Journal of Nutrition, 2005, 135(6): 1382-1386. DOI:10.1093/jn/135.6.1382 |
| [4] |
AMARAL C L, CRISMA A R, MASI L N, et al. DNA methylation changes induced by a high-fat diet and fish oil supplementation in the skeletal muscle of mice[J]. Journal of Nutrigenetics and Nutrigenomics, 2014, 7(4/5/6): 314-326. |
| [5] |
TIAN P, LUO Y W, LI X, et al. Negative effects of long-term feeding of high-grain diets to lactating goats on milk fat production and composition by regulating gene expression and DNA methylation in the mammary gland[J]. Journal of Animal Science and Biotechnology, 2017, 8: 74. DOI:10.1186/s40104-017-0204-2 |
| [6] |
FUKUOKA H, KUBOTA T.One-carbon metabolism and lipid metabolism in DOHaD[M]//KUBOTA T, FUKUOKA H.Developmental origins of health and disease (DOHaD).Singapore: Springer, 2018, 1012: 3-9.
|
| [7] |
GERAGHTY A A, LINDSAY K L, ALBERDI G, et al. Nutrition during pregnancy impacts offspring's epigenetic status-evidence from human and animal studies[J]. Nutrition and Metabolic Insights, 2016, 8(Suppl.1): 41-47. |
| [8] |
木其尔.沙葱黄酮对肉羊机体抗氧化和免疫功能的影响及其机理研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2016: 32-52. http://cdmd.cnki.com.cn/Article/CDMD-10129-1016250444.htm
|
| [9] |
张巧娥.沙葱提取物的分离鉴定及其对绵羊消化道共轭亚油酸含量和胴体脂肪沉积影响的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2007: 94-116. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1138213
|
| [10] |
张巧娥, 敖长金. 沙葱提取物中营养成分的分析[J]. 畜牧与兽医, 2008, 40(5): 53-54. |
| [11] |
赵国芬.沙葱和油料籽实对绵羊瘤胃发酵、营养物质消化流通及胴体品质影响的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2005: 130-144. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y919355
|
| [12] |
卢媛.沙葱、地椒风味活性成分及其对绵羊瘤胃发酵和羊肉风味的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2002: 36-64. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y435307
|
| [13] |
刘洁.肉用绵羊饲料代谢能与代谢蛋白质预测模型的研究[D].博士学位论文.北京: 中国农业科学院, 2012: 41-42. http://cdmd.cnki.com.cn/Article/CDMD-82101-1012415986.htm
|
| [14] |
VAN SOEST P J, ROBERTSON J B, LEWIS B A. Methods for dietary fiber, neutral detergent fiber, and nonstarch polysaccharides in relation to animal nutrition[J]. Journal of Dairy Science, 1991, 74(10): 3583-3597. DOI:10.3168/jds.S0022-0302(91)78551-2 |
| [15] |
DERVISHI E, SERRANO C, JOY M, et al. The effect of feeding system in the expression of genes related with fat metabolism in semitendinous muscle in sheep[J]. Meat Science, 2011, 89(1): 91-97. DOI:10.1016/j.meatsci.2011.04.003 |
| [16] |
ZHOU S Y, CAI B Y, ZHANG Z Z, et al. CDKN2B methylation and aortic arch calcification in patients with ischemic stroke[J]. Journal of Atherosclerosis and Thrombosis, 2017, 24(6): 609-620. DOI:10.5551/jat.36897 |
| [17] |
哈斯额尔敦.沙葱提取物对绵羊脂肪代谢的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2007: 60-62. http://cdmd.cnki.com.cn/article/cdmd-10129-2007219487.htm
|
| [18] |
郑彦楷.沙葱水溶性提取物对肉羊脂肪代谢相关基因表达量及甲基化的影响[D].硕士学位论文.呼和浩特: 内蒙古农业大学, 2017: 21-25. http://cdmd.cnki.com.cn/Article/CDMD-10129-1017212485.htm
|
| [19] |
NAFIKOV R A, SCHOONMAKER J P, KORN K T, et al. Sterol regulatory element binding transcription factor 1(SREBF1) polymorphism and milk fatty acid composition[J]. Journal of Dairy Science, 2013, 96(4): 2605-2616. DOI:10.3168/jds.2012-6075 |
| [20] |
BOUCHARD-MERCIER A, RUDKOWSKA I, LEMIEUX S, et al. SREBF1 gene variations modulate insulin sensitivity in response to a fish oil supplementation[J]. Lipids in Health and Disease, 2014, 13: 152. DOI:10.1186/1476-511X-13-152 |
| [21] |
CHEN J, YANG X J, XIA D, et al. Sterol regulatory element binding transcription factor 1 expression and genetic polymorphism significantly affect intramuscular fat deposition in the longissimus muscle of Erhualian and Sutai pigs[J]. Journal of Animal Science, 2008, 86(1): 57-63. DOI:10.2527/jas.2007-0066 |
| [22] |
王波, 罗海玲. DNA甲基化与去甲基化调控肌肉发育研究进展[J]. 动物营养学报, 2017, 29(8): 2622-2629. DOI:10.3969/j.issn.1006-267x.2017.08.002 |
| [23] |
CARRIÓ E, SUELVES M. DNA methylation dynamics in muscle development and disease[J]. Frontiers in Aging Neuroscience, 2015, 7: 19. |
| [24] |
赵海谕.奶山羊PITX1、PITX2基因的遗传变异、mRNA表达及DNA甲基化修饰对泌乳性能的影响[D].硕士学位论文.杨凌: 西北农林科技大学, 2014: 36-38. http://cdmd.cnki.com.cn/Article/CDMD-10712-1014429817.htm
|
| [25] |
OSORIO J S, JACOMETO C B, ZHOU Z, et al. Hepatic global DNA and peroxisome proliferator-activated receptor alpha promoter methylation are altered in peripartal dairy cows fed rumen-protected methionine[J]. Journal of Dairy Science, 2016, 99(1): 234-244. DOI:10.3168/jds.2015-10157 |
| [26] |
PINNEY S E. Mammalian non-CpG methylation:stem cells and beyond[J]. Biology, 2014, 3(4): 739-751. DOI:10.3390/biology3040739 |




