功能性寡糖是一种新型绿色添加剂,由α-1, 2、α-1, 6、β-1, 2和β-1, 6型等糖苷键连接形成的只能被肠道内有益菌利用的低度聚合糖类[1]。饲粮中功能性寡糖不能被单胃动物直接消化吸收[2],但进入肠道后段能优先被双歧杆菌利用并显著促进机体内双歧杆菌的增殖[3],提高畜禽的生产性能和免疫机能[4]。功能性寡糖对肠道有害菌的抑制作用主要通过2个方面来实现:一是通过促进有益菌的增殖间接抑制有害菌在肠道内的繁殖;二是寡糖可以与有害菌结合,抑制其对肠道上皮细胞的黏附作用[5]。不同功能性寡糖对有益菌的增殖作用可能存在较大差异;袁缨等[6]测定了4种功能性寡糖对肉仔鸡免疫及肠道主要菌群的影响,发现寡糖存在功能差异;李梅等[7]试验也表明不同功能性寡糖对仔猪免疫力和生长性能的影响存在差异。另外,功能性低聚糖不仅能够促进乳酸杆菌等有益菌的增殖,且可以降低大肠杆菌和沙门氏菌对细胞的黏附率[8-9],增加肠道菌群的多样性[10]。肠道上皮组织是动物非特异性免疫中一道非常重要的屏障,黏附是病原菌致病作用的第1步,也是肠道有害菌侵入致病的前提[11]。如果能抑制病原菌对宿主细胞的黏附作用,往往能抑制病原菌的致病作用[12]。Ghasemian等[13]研究也表明,在饲粮中低聚甘露寡糖可以快速地使黏附到肠上皮细胞壁的大肠杆菌脱落,而常见的葡萄糖及半乳糖却没有效果。关于对比分析不同功能性寡糖对细菌的增殖及抗黏附作用并探讨其功能差异的研究目前国内外鲜见报道。本试验以干酪乳杆菌、植物乳杆菌、大肠杆菌(O157 : H7 NCTC12900)、肠炎沙门氏菌肠炎亚种(ATCC 14028)为试验对象,在培养基中添加相同剂量的不同功能性寡糖,来探讨不同寡糖对有益菌及有害菌增殖的影响;同时采用猪空肠上皮细胞(IPEC-J2)为模型,探讨不同寡糖在抑制沙门氏菌和大肠杆菌黏附IPEC-J2的差异性,为功能性寡糖在畜禽饲粮中的应用提供科学依据。
1 材料与方法 1.1 试验材料异麦芽寡糖(纯度99%)、半乳甘露寡糖(纯度99%)、木寡糖(纯度99%)、甘露寡糖(纯度99%)、纤维寡糖(纯度99%)、果寡糖(纯度95%)、大豆寡糖(纯度99%)、壳寡糖(纯度98%)均由河南华瑞同升科技有限公司提供。试验用植物乳杆菌、干酪乳杆菌、大肠杆菌(O157 : H7 NCTC12900)、肠炎沙门氏菌肠炎亚种(ATCC 14028)由河南农业大学牧医工程学院微生物实验室保存。IPEC-J2由河南农业大学牧医工程学院兽医微生物实验室保存。
1.2 试验方法 1.2.1 不同功能性寡糖对细菌增殖的影响分别将植物乳杆菌、干酪乳杆菌、大肠杆菌、沙门氏菌活化,挑取单个菌落,2株乳杆菌接种至MRS液体培养基,37 ℃静置培养,大肠杆菌及沙门氏菌接种到LB培养基,37 ℃、150 r/min振荡培养过夜。收集细菌,将活化好的菌种用无菌生理盐水洗涤2次后,用麦氏比浊仪将菌液浓度调至1×107 CFU/mL;按1%的接种量分别接种到MRS培养基(或LB培养基)重新悬浮。在以无糖的MRS培养基(或LB培养基)为基础配制的9种培养基中分别添加8种寡糖(终浓度均为2.5 g/L)及葡萄糖(终浓度为2.5 g/L),另用无糖的MRS(或LB培养基)作空白对照,共10个处理,每个处理独立进行3次重复。
接种后,将菌种与各组液体培养基摇匀,在37 ℃恒温下培养,每4 h取3 mL菌液,10 000 r/min离心5 min,底层菌体用3 mL生理盐水冲悬混匀,测定其在630 nm的吸光度(OD)值,以培养时间为横坐标,相应的OD值为纵坐标,记录数据并绘制生长曲线。
1.2.2 不同功能性寡糖对病原菌黏附性的影响各寡糖溶液配制浓度为200 mg/mL。在24孔细胞培养板中培养IPEC-J2至致密单层细胞(约1×107个/孔)。迅速将各寡糖溶液25 μL和大肠杆菌或沙门氏菌100 μL接种到单层IPEC-J2,并设置不含寡糖的对照组(以25 μL磷酸盐缓冲液替代寡糖溶液);再补加375 μL DMEM营养液,每个处理设4个重复孔。37 ℃、5% CO2培养2 h,弃上清,磷酸盐缓冲液(pH=7.4)洗去未黏附细菌(轻轻冲洗3遍),再加入500 μL 0.1 % Triton X-100和10 μL胰酶裂解15 min。收集混合液并倍比稀释,涂布到BHI固体平板上,37 ℃培养16 h后菌落计数。
1.3 数据分析试验数据采用SPSS 22.0软件进行统计分析。试验各组之间的差异采用单因素方差分析(one-way ANOVA),Duncan氏法进行多重比较,结果用平均值±标准误表示,P < 0.05表示差异显著。
2 结果 2.1 不同功能性寡糖对2株乳杆菌增殖的影响由图 1可知,8种功能性寡糖对试验菌株生长的支持良好,且表现出明显差异。其中,果寡糖组效果最好,8 h前与葡萄糖组最接近;而壳寡糖对试验菌株生长支持相对较差;培养至12 h后,各功能性寡糖组OD值均远高于无糖组;在平稳期(16~28 h),果寡糖和大豆寡糖组OD值最高,且数值接近;葡萄糖组在16 h后很快进入衰退期。
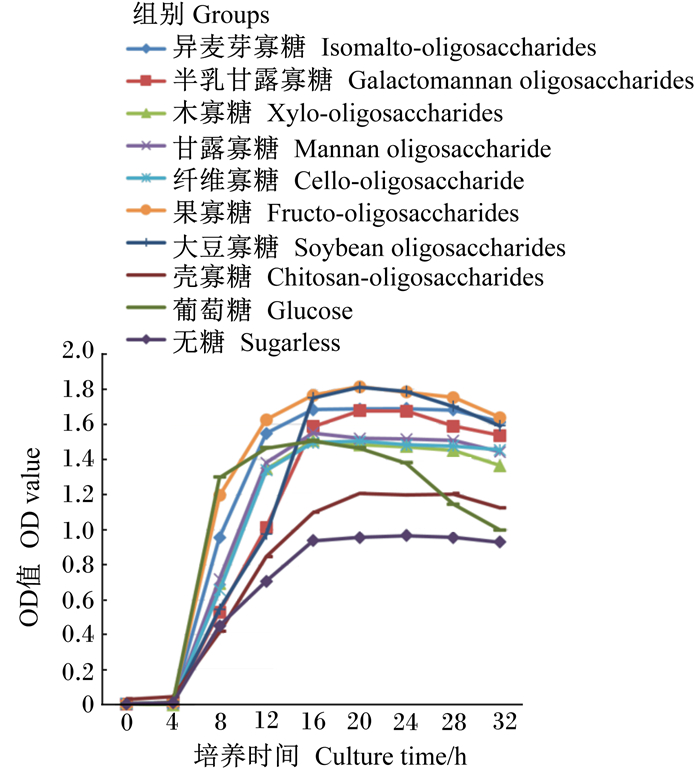
|
图 1 干酪乳杆菌生长曲线 Fig. 1 Growth curve of Lactobacillus casei |
由表 1可知,培养至8 h时,除壳寡糖组外,其他功能性寡糖组OD值显著高于无糖组(P < 0.05),且各功能性寡糖组之间均有显著差异(P < 0.05),其中果寡糖组OD值显著高于其他功能性寡糖组(P < 0.05);培养至20 h时,各功能性寡糖组间差异缩小,果寡糖与大豆寡糖组、异麦芽寡糖与半乳甘露寡糖组、木寡糖与纤维寡糖组间差异不显著(P>0.05)。
|
|
表 1 不同功能性寡糖对干酪乳杆菌的增殖作用 Table 1 Proliferation of Lactobacillus casei under different functional oligosaccharides |
由图 2可知,植物乳杆菌在各功能性寡糖菌液中的生长趋势与干酪乳杆菌类似。但在0~4 h的迟缓期,干酪乳杆菌几乎无变化,植物乳杆菌则有明显增长;在8 h时,各功能性寡糖组间差异不如干酪乳杆菌大;葡萄糖组16 h后进入衰退期并且在28 h后OD值低于无糖组。
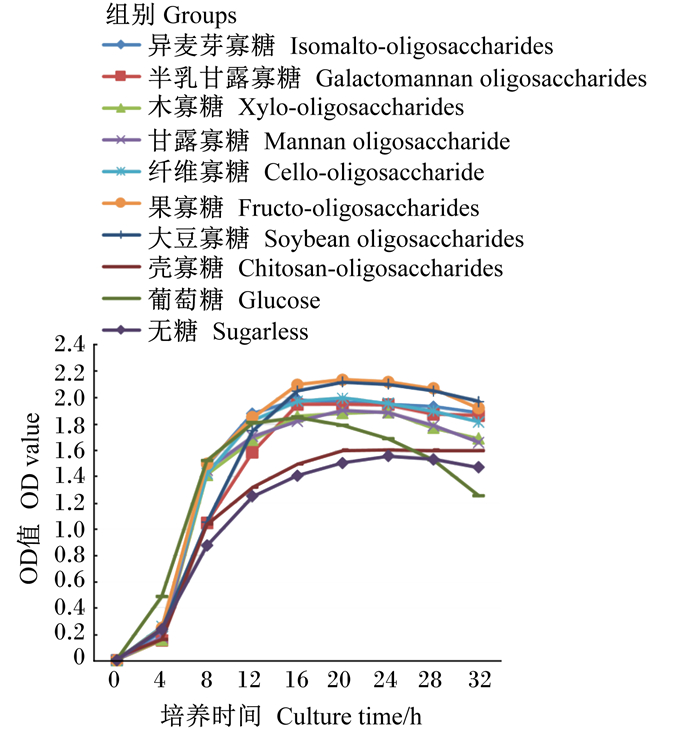
|
图 2 植物乳杆菌的生长曲线 Fig. 2 Growth curve of Lactobacillus plantarum |
由表 2可知,在8、12、16、20、24 h时,各功能性寡糖组OD值均显著高于无糖组(P < 0.05)。
|
|
表 2 不同功能性寡糖对植物乳杆菌的增殖作用 Table 2 Proliferation of Lactobacillus plantarum under different functional oligosaccharides |
由图 3、图 4可知,不同功能性寡糖对大肠杆菌、沙门氏菌增殖的作用相似,从2 h之后各功能性寡糖组开始表现出组间差异,壳寡糖和果寡糖组生长曲线与无糖组基本重合。
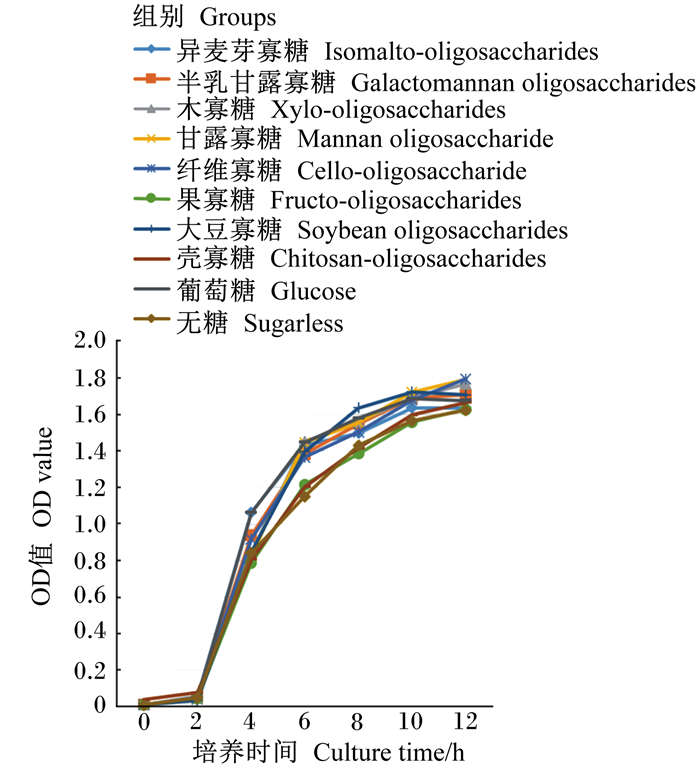
|
图 3 大肠杆菌的生长曲线 Fig. 3 Growth curve of Escherichia coli |
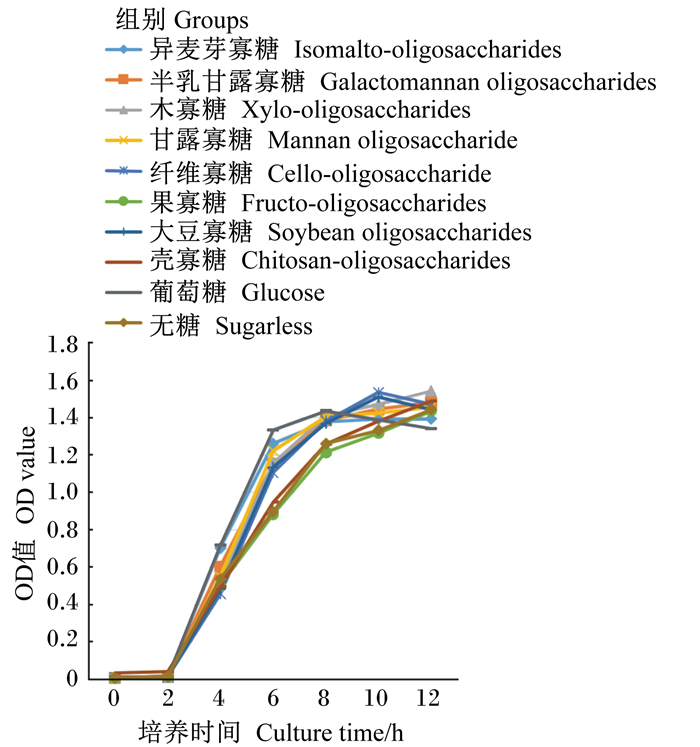
|
图 4 沙门氏菌的生长曲线 Fig. 4 Growth curve of Salmonella |
由表 3可知,在6 h时,各功能性寡糖组OD值显著高于无糖组(P < 0.05),在8 h时,除壳寡糖、果寡糖、异麦芽寡糖、纤维寡糖组外,其他功能性寡糖组OD值显著高于无糖组(P < 0.05)。10 h时,除壳寡糖、果寡糖、异麦芽寡糖组外,其他功能性寡糖组OD值显著高于无糖组(P < 0.05)。由表 4可知,在6、8、10 h时,除壳寡糖、果寡糖组外,其他功能性寡糖组OD值显著高于无糖组(P < 0.05)。
|
|
表 3 不同功能性寡糖对大肠杆菌的增殖作用 Table 3 Proliferation of Escherichia coli under different functional oligosaccharides |
|
|
表 4 不同功能性寡糖对沙门氏菌的增殖作用 Table 4 Proliferation of Salmonella under different functional oligosaccharides |
由表 5可知,与对照组相比,各功能性寡糖组中大肠杆菌对IPEC-J2的黏附量均显著降低(P < 0.05),且各功能性寡糖组间也存在差异。其中果寡糖对大肠杆菌黏附抑制作用最强,其次是甘露寡糖和木聚糖。
|
|
表 5 不同功能性寡糖对大肠杆菌黏附IPEC-J2的影响 Table 5 Effects of different functional oligosaccharides on Escherichia coli adhesion to IPEC-J2 |
由表 6可知,与对照组相比,8种功能性寡糖均显著降低了沙门氏菌对IPEC-J2的黏附量(P < 0.05);且甘露寡糖组对沙门氏菌的黏附抑制作用最明显,与果寡糖组无显著差异(P>0.05),但黏附量显著低于其他各组(P < 0.05)。
|
|
表 6 不同功能性寡糖对沙门氏菌黏附IPEC-J2的影响 Table 6 Effects of different functional oligosaccharides on Salmonella adhesion to IPEC-J2 |
寡糖能够通过增加畜禽消化道中的双歧杆菌、乳酸菌等有益菌的数量[14-16],抑制有害菌增殖[17],从而有效减少肠道疾病的发生,并可在一定程度上提高动物的免疫能力。本研究中8种寡糖对4种菌株增殖的测定结果表明,无论是有益菌还是有害菌,均能分解利用寡糖,并且有益菌对寡糖的利用能力远远高于有害菌。试验结果表明功能性寡糖的作用机制是促进有益菌在肠道内的大量增殖,从而抑制了有害菌的增殖,而非病原菌不能利用寡糖。不同低聚糖促进益生菌生长的效果不一及同种寡糖对不同菌株的作用差异表明,菌株对低聚糖的利用情况与菌株特性以及糖的分子结构有关。Cardelle-Cobas等[18]发现分子内的糖苷键对益生菌生长特性有一定影响。Kaplan等[19]研究28株肠道有益菌对果寡糖的利用情况,试验表明这些菌株并非都能发酵果寡糖。另外试验结果显示,4株菌对于寡糖的利用能力前期均不如葡萄糖,但葡萄糖组比寡糖组提前进入衰退期,这可能是因为葡萄糖是单糖更易于被利用,在对数期葡萄糖组增殖过快,养分消耗过快,导致后期糖源不足。2株乳酸杆菌在0~4 h的生长适应期有明显差异,这表明了不同乳杆菌对低聚糖的适应性不同,这导致了大豆寡糖和半乳甘露寡糖等对数期的延后。寡糖本质上是碳水化合物能为生命体功能提供碳源,在本试验条件下,大肠杆菌及沙门氏菌利用寡糖的能力不如2株乳杆菌,这可能是由于大多数乳杆菌能够表达多种糖苷酶从而降解多种寡糖[20],而大肠杆菌和沙门氏菌不能。
在宿主体内,细菌的感染性和黏附性之间都存在着某种重要的关联。病原菌对于肠道细胞的黏附是其致病的关键也是在肠道定植的第1步,许多肠道病原菌,如肠杆菌科的沙门氏菌和出血性大肠杆菌等病原菌在其菌毛或绒毛等菌体表面存在能够与宿主细胞表面特异性寡糖配体结合的蛋白,被称为黏附素、凝集素或血凝素。病原菌在肠道的定植多数是通过细菌表面的凝集素识别并结合肠道上皮细胞表面的特异性糖分子或糖残基(如D-甘露糖、N-乙酰氨基半乳糖、L-岩藻糖、唾液酸等)受体来实现的[20]。大多数黏附素可以与含有3~5个单糖的特定寡糖片段相结合,因此,采用某些特定糖类结合细菌表面的凝集素,在一定程度上能够阻止病原菌与肠道上皮细胞的结合[21]。有研究表明功能性寡糖可以吸附病原菌,阻止其在肠道内定植[25],例如,木寡糖可以减少李斯特菌对Caco-2细胞的黏附[9],壳寡糖可以与病原菌的黏附素结合,从而随着肠道蠕动排出体外[22-23]。还有研究表明,人乳中的寡糖可抑制大肠杆菌、霍乱弧菌和沙门氏菌对上皮细胞系的黏附,牛奶也被证明含有降低细菌黏附的寡糖、抗体和糖蛋白等[24-25],这种方法不会杀死细菌,但是通过抑制细菌对宿主细胞和组织的黏附来防止其对宿主造成伤害,不仅能够有效防止细菌疾病的感染,还会降低细菌耐药性的风险[26]。本试验结果表明,8种功能性寡糖都能显著抑制大肠杆菌和沙门氏菌黏附IPEC-J2细胞。在大肠杆菌的试验中,果寡糖对IPEC-J2的黏附抑制效果最高。在沙门氏菌的试验中,甘露寡糖对IPEC-J2的抑制效果最高。
4 结论① 试验用8种功能性寡糖中,果寡糖对有益菌的增殖效果最显著,且对有害菌增殖效果最低并有一定抑制生长的趋势;不同功能性寡糖表现出不同的功能特性。
② 所选8种功能性寡糖均能显著抑制大肠杆菌和沙门氏菌对IPEC-J2的黏附作用,其中甘露寡糖对沙门氏菌的黏附抑制作用最为明显,果寡糖则对大肠杆菌黏附抑制作用更为明显。
| [1] |
陈惠娜, 王蜀金, 郭春华, 等. 功能性寡糖在仔猪中的作用机制及在仔猪饲养中的应用效果[J]. 饲料研究, 2015(5): 19-23. |
| [2] |
FLICKINGER E, WOLF B K, CHOW J, et al. Glucose-based oligosaccharides exhibit different in vitro fermentation patterns and affect in vivo apparent nutrient digestibility and microbial populations in dogs[J]. Journal of Nutrition, 2000, 130(5): 1267-1273. |
| [3] |
ZHAO C, WU Y J, LIU X Y, et al. Functional properties, structural studies and chemo-enzymatic synthesis of oligosaccharides[J]. Trends in Food Science & Technology, 2017, 66: 135-145. |
| [4] |
SELIM K M, REDA R M. Beta-glucans and mannan oligosaccharides enhance growth and immunity in Nile Tilapia[J]. North American Journal of Aquaculture, 2015, 77(1): 22-30. |
| [5] |
BARRANGOU R, ALTERMANN E, HUTKINS R, et al. Functional and comparative genomic analyses of an operon involved in fructooligosaccharide utilization by Lactobacillus acidophilus[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100(15): 8957-8962. |
| [6] |
袁缨, 闫际平, 陈立华, 等. 不同寡糖对肉仔鸡肠道主要菌群和免疫器官指数的影响[J]. 中国饲料, 2007(15): 15-17. DOI:10.3969/j.issn.1004-3314.2007.15.006 |
| [7] |
李梅, 刘文利, 赵桂英, 等. 不同寡糖对仔猪免疫力和生产性能的影响研究[J]. 安徽农业科学, 2010, 38(28): 15655-15657. DOI:10.3969/j.issn.0517-6611.2010.28.082 |
| [8] |
马岩.木二糖与木三糖分离纯化及其对鸡肠道细菌增殖和细胞黏附率的影响[D].硕士学位论文.广州: 华南农业大学, 2015.
|
| [9] |
EBERSBACH T, ANDERSEN J B, BERGSTRÖM A, et al. Xylo-oligosaccharides inhibit pathogen adhesion to enterocytes in vitro[J]. Research in Microbiology, 2012, 163(1): 22-27. DOI:10.1016/j.resmic.2011.10.003 |
| [10] |
ZHOU X L, KONG X F, LIAN G Q, et al. Dietary supplementation with soybean oligosaccharides increases short-chain fatty acids but decreases protein-derived catabolites in the intestinal luminal content of weaned Huanjiang mini-piglets[J]. Nutrition Research, 2014, 34(9): 780-788. |
| [11] |
COTTER P A, MILLER J F. Triggering bacterial virulence[J]. Science, 1996, 273(5279): 1183-1185. |
| [12] |
范小兵, 周丛, 杭晓敏, 等. 昂立植物乳杆菌粘附肠上皮细胞的研究[J]. 中国微生态学杂志, 2004, 16(6): 353-355. DOI:10.3969/j.issn.1005-376X.2004.06.013 |
| [13] |
GHASEMIAN M, JAHANIAN R. Dietary mannan-oligosaccharides supplementation could affect performance, immunocompetence, serum lipid metabolites, intestinal bacterial populations, and ileal nutrient digestibility in aged laying hens[J]. Animal Feed Science and Technology, 2016, 213: 81-89. |
| [14] |
SLAVIN J. Fiber and prebiotics:mechanisms and health benefits[J]. Nutrients, 2013, 5(4): 1417-1435. DOI:10.3390/nu5041417 |
| [15] |
GÄNZLE M G, FOLLADOR R. Metabolism of oligosaccharides and starch in lactobacilli:a review[J]. Frontiers in Microbiology, 2012, 3: 340. |
| [16] |
NAGPAL R, KAUR A. Synbiotic effect of various prebiotics on in vitro activities of probiotic lactobacilli[J]. Ecology of Food and Nutrition, 2011, 50(1): 63-68. |
| [17] |
房晓, 段荣帅, 王凤山. 低聚糖对乳杆菌生物活性的作用[J]. 药物生物技术, 2014(4): 338-342. |
| [18] |
CARDELLE-COBAS A, CORZO N, OLANO A, et al. Galactooligosaccharides derived from lactose and lactulose:influence of structure on Lactobacillus, Streptococcus and Bifidobacterium growth[J]. International Journal of Food Microbiology, 2011, 149(1): 81-87. |
| [19] |
KAPLAN H, HUTKINS R W. Fermentation of fructooligosaccharides by lactic acid bacteria and bifidobacteria[J]. Applied and Environmental Microbiology, 2000, 66(6): 2682-2684. |
| [20] |
潘晓东.若干寡糖的功能特性及对肠道生理生态调控机制的研究[D].博士学位论文.杭州: 浙江大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10335-1011066291.htm
|
| [21] |
孙芝兰.卷曲乳杆菌益生特性及黏附机理研究[D].博士学位论文.济南: 山东大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10422-1012461386.htm
|
| [22] |
ORTIZ G G. Natural sources against veterinary pathogens:evaluation of the anti-adhesive and anti-biofilm activity of wheat bran[J]. Canadian Review of Sociology/revue Canadienne De Sociologie, 2013, 23(1): 97-117. |
| [23] |
ZOU P, YANG X, WANG J, et al. Advances in characterisation and biological activities of chitosan and chitosan oligosaccharides[J]. Food Chemistry, 2016, 190: 1174-1181. |
| [24] |
COPPA G V, ZAMPINI L, GALEAZZI T, et al. Human milk oligosaccharides inhibit the adhesion to Caco-2 cells of diarrheal pathogens:Escherichia coli, Vibrio cholerae, and Salmonella fyris[J]. Pediatric Research, 2006, 59(3): 377-382. DOI:10.1203/01.pdr.0000200805.45593.17 |
| [25] |
王凤英, 王玉梅, 常青, 等. 母乳及婴儿食品对致病性大肠杆菌粘附的影响[J]. 第三军医大学学报, 2001, 23(4): 478-480. DOI:10.3321/j.issn:1000-5404.2001.04.037 |
| [26] |
COZENS D, READ R C. Anti-adhesion methods as novel therapeutics for bacterial infections[J]. Expert Review of Anti-Infective Therapy, 2012, 10(12): 1457-1468. |




