2. 河北农业大学动物科技学院, 保定 071000
2. College of Animal Science and Technology, Agricultural University of Hebei, Baoding 071001, China
玉米赤霉烯酮(ZEA)也称F-2毒素,是一类由镰刀菌属真菌性霉菌毒株分离出来的、具类雌激素性质的霉菌毒素,主要由自然条件下发生霉变的谷物(玉米、大麦、小麦、高粱等)产生[1]。它普遍存在于食品和饲料中,极大地危害食品、畜牧等行业的发展。受污染饲料中所含ZEA的毒性能够引起动物细胞损伤、神经毒性、肝肾功能损伤、免疫抑制、繁殖机能障碍等[2-6],给畜牧业带来严重的经济损失。因此,深入研究ZEA对机体侵害的毒性机制显得尤为重要。
ZEA主要的靶器官之一是生殖系统,而近几年,据报道霉变饲粮ZEA以剂量依赖的方式增加了后备母猪子宫等生殖器官大小和平滑肌的增生[7]及ZEA能够导致卵巢萎缩、卵泡闭锁和雌性动物子宫壁肥大[8]。细胞凋亡是多细胞生物的一种基本生命活动,在机体的生长发育、免疫调节及维持内环境稳定等各方面发挥重要的作用。原位末端标记法(TUNEL)是检测细胞凋亡的常用方法,相关凋亡因子[B细胞淋巴瘤/白血病-2(Bcl-2)基因和半胱天冬蛋白酶(caspase)基因]在调节细胞凋亡中起着不可或缺的作用。研究表明,ZEA的毒性能够引起肝脏[9]、肾脏[10]、脾脏[11]及卵巢[12]等组织凋亡,胡进等[13]通过体外培养小鼠子宫内膜基质细胞,发现ZEA能够引起子宫内膜基质细胞凋亡。有资料显示,在体外和体内试验中ZEA及其衍生物通过活性氧(ROS)产生诱导细胞毒性,导致脂质过氧化、DNA损伤和线粒体途径的凋亡[14]。上述研究,绝大多数通过细胞培养方式研究ZEA对子宫内细胞的影响,而通过饲养方式针对ZEA对子宫细胞凋亡影响的研究却鲜有报道。因此,本试验通过在小鼠不同时期饲喂受ZEA污染的饲粮,观察ZEA对子宫细胞凋亡及凋亡因子的影响,并探究ZEA毒性对相关凋亡因子的调节机制。
1 材料与方法 1.1 试验材料及试剂ZEA购自Triplebond公司(加拿大),ZEA纯度≥98%。
脱氧核糖核酸酶Ⅰ(deoxyribonuclease Ⅰ,DNase Ⅰ)、牛血清白蛋白五组分(BSA)均购自北京博奥拓达科技有限公司,蛋白酶K(proteinase K)购自Merck公司,Tris-Base购自北京索莱宝科技有限公司,金属增强型二胺基联苯胺(3, 3-N-diaminobenzidine tertrahydrochloride,DAB)显色试剂盒购自Thermo Fisher科技公司,TUNEL凋亡试剂盒购自Roche公司,反转录试剂盒(Prime ScriptTM RT reagent Kit with gDNA Eraser)、荧光定量试剂盒[TB GreenTM Premix Ex TaqTMⅡ(Tli RNaseH Plus)]均购自宝生物工程(大连)有限公司,其余试剂为国产分析纯。
1.2 试验动物及饲粮选取4周龄昆明雌性小鼠120只,随机分为4组,每组30只。选取雄性小鼠20只,随机分为4组,每组5只。7 d预试期结束后,试验分2个阶段。第1阶段,各组雌鼠分别饲喂在基础饲粮中添加0(对照组)、50(试验1组)、100(试验2组)、150 mg/kg(试验3组)ZEA的饲粮,饲喂时间是20 d。第2阶段,第1阶段结束后所有小鼠饲喂常规基础饲粮,各组挑选处于发情前期、发情期的雌鼠处死取材,剩余雌鼠与雄鼠按2 : 1合笼,进行产仔试验。
小鼠基础饲粮的营养水平参考NRC(2012)需要配制, 其组成及营养水平见表 1。试验期间, 小鼠自由采食与饮水,每隔1 d更换1次垫料,在室温22~25 ℃、通风良好的环境中饲养。
|
|
表 1 基础饲粮组成及营养水平(干物质基础) Table 1 Composition and nutrient levels of the basal diet (DM basis) |
用分析天平称取一定量的ZEA,将纯品ZEA按照溶解比例1 : 1(即1 mg/mL)溶解在无水乙醇,然后喷洒在一定量的基础饲粮粉状鼠料上,过夜室温挥发溶剂,而后按照试验设计添加到基础饲粮中达到试验水平,加蒸馏水进行搅拌,蒸馏水与饲粮比例大约1 : 2,待饲粮松软适宜时,使用筒状玻璃胶枪制成颗粒料,在50 ℃烘箱中烘干5~6 h。运用酶联免疫吸附试验(ELISA)检测各组饲粮ZEA的含量。
1.4 样品采集第1阶段饲养试验结束后的第2、3、4天,通过观察雌性小鼠外阴部以及阴道涂片的方法随机挑选出每组处于发情前期、发情期各10只小鼠,脱椎处死,摘取子宫角固定于4%中性甲醛[甲醛溶液与pH 7.2~7.4的磷酸盐缓冲液(PBS)比例1 : 9]中,用于子宫细胞凋亡的检测;另一部分包于锡箔纸内,180 ℃烘干5 h,然后将样品在液氮速冻后置于-80 ℃冰箱内保存,以备子宫细胞凋亡相关因子mRNA相对表达量的检测。剩余40只雌性小鼠与20只雄鼠按2 : 1合笼,饲养19~21 d产仔,产仔次日按上述方法取材。
1.5 子宫组织TUNEL染色将子宫组织切片常规脱蜡至水,用吸水纸擦拭组织周围(切勿触碰组织);用20 μg/mL蛋白酶K工作液(蛋白酶K冻干粉溶于10 mmol/L Tris-HCl,pH 7.5)处理组织20 min(25 ℃),PBS漂洗2次,每次4 min;制备TUNEL反应混合液,试验组用50 μL脱氧核糖核苷酸末端转移酶(TdT)+450 μL荧光素标记的三磷酸脱氧尿甘(dUTP)液混匀;而对照组仅加50 μL荧光素标记的dUTP液,对照组先加入100 μL 2 000 U/mL DNase 1(50 mmol/L Tris-HCl,pH 7.5,10 mmol/L MgCl2,1 mg/mL BSA),反应在室温下进行10 min,后面步骤同试验组;吸水纸擦拭组织周围后,加50 μL TUNEL反应混合液于标本上,加盖玻片在暗湿盒中37 ℃反应1 h,PBS漂洗3次,每次4 min;吸水纸擦拭组织周围后加50 μL辣根过氧化物酶标记的抗荧光抗体(converter-POD)于标本上,加盖玻片或封口膜在暗湿盒中37 ℃反应30 min,PBS漂洗3次,每次4 min;在组织处加50 μL DAB底物,25 ℃反应10 min,PBS漂洗3次,每次4 min,用苏木素复染几秒后立即用自来水冲洗;梯度酒精脱水、二甲苯透明、中性树胶封片,显微镜观察。采用Image J软件测量子宫切片截面凋亡阳性表达细胞平均光密度值,每组挑选3张较好切片,每张切片随机测量3处数据。
1.6 实时荧光定量PCR(RT-qPCR)法测定子宫中凋亡因子mRNA的表达根据GenBank中小鼠caspase-3、caspase-8、caspase-9、Bcl-2及磷酸甘油醛脱氢酶(GAPDH)基因的mRNA序列,运用Primer 6.0软件设计相应的特异引物,引物由宝生物工程有限公司合成。引物序列见表 2。
|
|
表 2 引物序列 Table 2 Primer sequences |
用分析天平称取50~100 mg储存在-80 ℃子宫组织,按照RNAiso Plus总RNA提取试剂盒提取总RNA。将提取总RNA通过Nano drop 2000核酸蛋白测定仪进行纯度分析,按照反转录试剂盒操作说明合成cDNA,其反应体系为40 μL。所得cDNA用于常规PCR及RT-qPCR。
按照RT-qPCR试剂盒操作说明进行操作。qRT-PCR反应体系为20 μL,其组成为:TB Green Premix Ex Taq Ⅱ 10 μL;上、下游引物各1 μL(10 μmol/L);cDNA 1 μL;ddH2O 7 μL。每组3个样品且重复3次。其反应条件:预变性95 ℃ 30 s,变性95 ℃ 5 s,退火60 ℃ 34 s,95 ℃ 15 s,60 ℃ 1 min,95 ℃ 15 s, 循环40次。根据RT-qPCR试验结果所得Ct值,以2-△△Ct法分析子宫内凋亡基因caspase-3、caspase-8、caspase-9及Bcl-2 mRNA的相对表达量。每个样品中的目的基因与内参基因均进行3次重复测定。
1.7 数据分析所得试验数据采用SPSS 21.0软件进行单因素方差分析,试验结果采用“平均值±标准误”表示。P<0.05为差异显著,P<0.01为差异极显著。
2 结果 2.1 ZEA对不同时期小鼠子宫内膜细胞凋亡的影响TUNEL凋亡染色结果显示,子宫中凋亡的细胞主要分布在子宫内膜间质细胞、上皮细胞和子宫腺体上皮细胞。发情前期试验组(图 1-B1至图 1-D1)子宫内膜腺体分布较少,凋亡的细胞呈现较多且主要位于子宫内膜间质细胞及上皮细胞,而对照组凋亡细胞较少且分布较为均匀(图 1-A1)。发情期试验组(图 1-B2至图 1-D2)子宫内膜腺体分布较多,凋亡的细胞呈现也较多,除在子宫内膜间质细胞及上皮细胞外分布外,子宫腺也可见较多凋亡细胞存在,而对照组虽然子宫腺体增多但细胞凋亡较少(图 1-A2)。产仔后期(图 1-A3至图 1-D3)子宫内膜间质细胞凋亡数量减少。
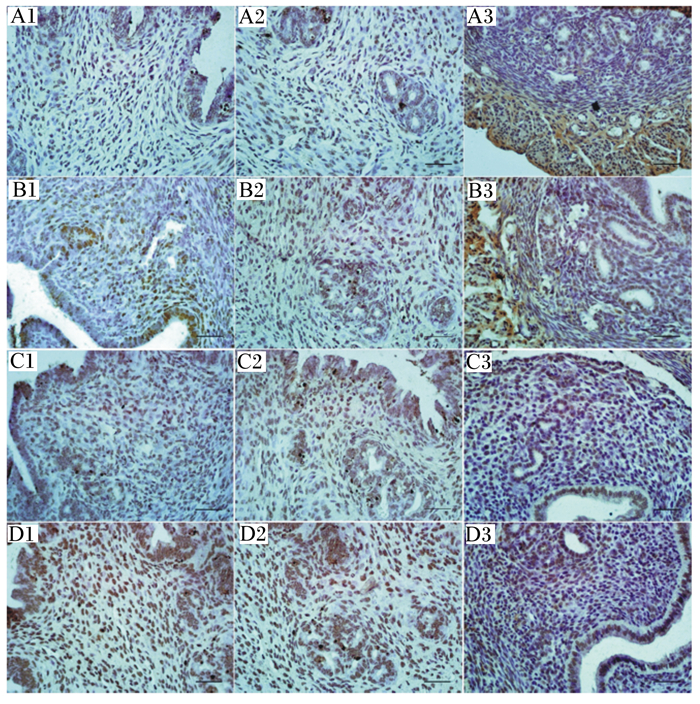
|
A、B、C、D分别代表对照组、试验1组、试验2组、试验3组;1、2、3分别代表发情前期、发情期、产仔后期。图中所示标尺为50 μm。 A, B, C and D represent the control group, experimental group 1, experimental group 2 and experimental group 3, respectively; 1, 2 and 3 represent the pre-estrus, estrus and post-partition periods, respectively. The scale shown in the figures is 50 μm. 图 1 ZEA对不同时期小鼠子宫内膜细胞凋亡的影响 Fig. 1 Effects of ZEA on apoptosis of mice uterus endometrial cells in different periods (400×) |
子宫阳性表达细胞的平均光密度值测量结果见表 3。发情前期,试验1组子宫内细胞凋亡阳性表达细胞平均光密度值与对照组相比显著上升(P<0.05),试验2组和3组极显著高于对照组(P < 0.01)。发情期,与对照组比较,试验组子宫内细胞凋亡阳性表达细胞平均光密度值极显著高于对照组(P < 0.01)。产仔后期,试验2组子宫内细胞凋亡阳性表达细胞平均光密度值显著高于对照组(P<0.05),试验3组极显著高于对照组(P < 0.01)。
|
|
表 3 ZEA对不同时期子宫凋亡阳性表达细胞平均光密度值的影响 Table 3 Effects of ZEA on average optical density values of uterine apoptosis-positive cells in different periods |
发情前期凋亡因子的mRNA相对表达量见表 4。与对照组相比,试验组Bcl-2、caspase-9 mRNA相对表达量均极显著升高(P < 0.01);试验组间相比,试验2组和3组的子宫caspase-3 mRNA相对表达量较试验1组极显著升高(P < 0.01)。
|
|
表 4 ZEA对发情前期子宫凋亡相关基因相对表达量的影响 Table 4 Effects of ZEA on relative expression levels of uterine apoptosis-related genes in pre-estrus period |
发情期小鼠子宫凋亡因子caspase-3、caspase-8、caspase-9和Bcl-2的mRNA相对表达量见表 5。试验组子宫Bcl-2、caspase-3、caspase-8 mRNA相对表达量相对于对照组均极显著升高(P < 0.01);与对照组相比,试验1组子宫caspase-9 mRNA相对表达量显著升高(P < 0.05),试验2、3组子宫caspase-9 mRNA相对表达量极显著升高(P < 0.01)。
|
|
表 5 ZEA对发情期子宫凋亡相关基因相对表达量的影响 Table 5 Effects of ZEA on relative expression levels of uterine apoptosis-related genes in estrus period |
产仔后期小鼠子宫凋亡因子的mRNA相对表达量见表 6。与对照组相比,试验1组Bcl-2、caspase-3 mRNA相对表达量未出现显著变化(P>0.05),试验2、3组Bcl-2、caspase-3 mRNA相对表达量显著升高(P < 0.05);试验3组caspase-8、caspase-9 mRNA相对表达量较其他各组显著升高(P < 0.05)。
|
|
表 6 ZEA对产仔后期子宫凋亡相关基因相对表达量的影响 Table 6 Effects of ZEA relative expression levels of apoptosis-related genes in post-partition uterus period |
子宫是雌性动物重要的生殖器官之一,它在动物性激素分泌、受精卵的着床、胎儿的形成直至分娩等过程中起着重要作用,是胎儿最初成长的“温室”。雌性子宫损伤是动物发生流产、死胎、畸形胎等一系列繁殖机能障碍的重要原因。因此,子宫的生理机能是动物健康的重要保证之一。ZEA是一种类雌激素性真菌毒素,可在子宫中与雌激素受体(ER)结合,能够使ER的构型发生改变,所形成的复合物从胞质转移至胞核,再与DNA模板相结合,调节子宫中相关基因转录和蛋白质合成,从而影响细胞的分裂与生长。研究表明,低剂量的ZEA可以发挥雌激素样作用和致癌特性,可以刺激细胞增殖,而高剂量的ZEA可通过诱导细胞周期停滞、氧化应激、DNA损伤、线粒体损伤和细胞凋亡而导致细胞死亡[15]。
对暴露于低剂量ZEA(50和75 μg/kg BW)的青春期前母犬进行的选择性子宫黏膜细胞凋亡和增殖的免疫组织进行化学评估研究,结果表明,与较高ZEA剂量相比,低剂量ZEA仅在子宫内膜衬里的上皮细胞中促进细胞的凋亡,而在固有层和子宫腺体中却引起细胞的增殖作用[16]。然而,本试验TUNEL分析结果表明,不同时期的子宫细胞凋亡主要发生在子宫内膜间质细胞、上皮细胞及子宫内膜腺体细胞。此外在发情前期随着ZEA添加水平增加,细胞凋亡在ZEA中、高水平组的阳性反应显著增加;在发情期随着ZEA添加水平的增加,细胞凋亡阳性反应增强;在产仔后期高水平ZEA显著增加阳性反应细胞的数量。值得注意的是,随着饲粮ZEA水平从100 mg/kg增加到150 mg/kg,caspase-3、caspase-8、caspase-9 mRNA相对表达量呈剂量依赖性增加,这与TUNEL染色结果相符。据此推测,摄入的ZEA通过上调caspase-3、caspase-8、caspase-9的表达来加速子宫内膜上皮、基质和子宫腺体的细胞凋亡,caspase可能在诱导子宫新陈代谢中起重要作用。此外,先前的研究报道表明ZEA(25和50 μg/kg BW)及其代谢产物引起母犬颗粒细胞的变性和萎缩[17]。关于ZEA促进或抑制细胞凋亡的研究尚存在争议,ZEA对caspase表达的影响可能与物种、年龄、器官类型和添加水平有关。
有研究认为,雄性生殖细胞凋亡率的降低和Bcl-2表达的增强是阻碍ZEA(10 mg/d)诱导的雄性小鼠生殖细胞凋亡的分子机制[18]。此外,体外ZEA的存在增加了小鼠卵巢内TUNEL和DNA双链断裂的标志(γH2AX)检测结果阳性细胞的数量以及凋亡基因Bax/Bcl-2的mRNA表达量的比率[19]。类似研究也表明,ZEA介导的细胞凋亡作用是ZEA上调促凋亡基因Bax表达,同时下调促凋亡基因Bcl-2表达[20]。最近,在接触ZEA(0.1 mg/kg)的雌性小鼠的子宫中观察到凋亡因子caspase-9和caspase-3的高表达[21],饮食中的ZEA和呕吐毒素(DON)上调卵巢和子宫中的凋亡蛋白caspase-3的表达,同时下调卵巢中的抗凋亡蛋白Bcl-2的表达[22]。值得探讨的是,本试验的结果与之前的研究并不完全一致。与上述研究的不同之处在于,本研究中不同时期Bcl-2的mRNA相对表达量均随着ZEA添加水平的增加而增加。caspase-3、caspase-8、caspase-9在该研究中的表达增加,表明摄入的ZEA在一定程度上促进了子宫细胞的凋亡,但是Bcl-2表达量的增加可能是通过异源二聚体Bax/Bcl-2的形成中和了细胞凋亡[23-24]。研究表明,ZEA(0.5~1.5 mg/kg)通过对断奶后小母猪子宫内增殖细胞核抗原(PCNA)、Bcl-2表达上调使处理的子宫细胞处于高增殖状态,表明ZEA可加速子宫增殖,促进子宫发育[25]。而饲粮中一定水平的ZEA可能导致母猪生殖器官畸形、假发情、产仔数减少和流产[26]。然而,本试验表明,ZEA不仅可以通过上调caspase的表达来促进子宫凋亡,而且可能通过积累的Bax/Bcl-2异二聚体在Bcl-2水平增加时促进子宫增殖,并诱发子宫的畸形发育,但这一机制还有待进一步研究。
4 结论ZEA促进不同时期小鼠子宫内膜细胞凋亡增加,并且能够上调凋亡相关基因caspase-3、caspase-8、caspase-9、Bcl-2的表达。
| [1] |
RICHARD J L. Some major mycotoxins and their mycotoxicoses-an overview[J]. International Journal of Food Microbiology, 2007, 119(1/2): 3-10. |
| [2] |
ZHANG K Z, TAN X T, LI Y, et al. Transcriptional profiling analysis of zearalenone-induced inhibition proliferation on mouse thymic epithelial cell line 1[J]. Ecotoxicology and Environmental Safety, 2018, 153: 135-141. DOI:10.1016/j.ecoenv.2018.01.005 |
| [3] |
REDDY K E, JEONG J Y, LEE Y, et al. Deoxynivalenol- and zearalenone-contaminated feeds alter gene expression profiles in the livers of piglets[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(4): 595-606. DOI:10.5713/ajas.17.0466 |
| [4] |
REDDY K E, LEE W, JEONG J Y, et al. Effects of deoxynivalenol- and zearalenone-contaminated feed on the gene expression profiles in the kidneys of piglets[J]. Asian-Australasian Journal of Animal Sciences, 2018, 31(1): 138-148. DOI:10.5713/ajas.17.0454 |
| [5] |
MUTHULAKSHMI S, MAHARAJAN K, HABIBI H R, et al. Zearalenone induced embryo and neurotoxicity in zebrafish model (Danio rerio):role of oxidative stress revealed by a multi biomarker study[J]. Chemosphere, 2018, 198: 111-121. DOI:10.1016/j.chemosphere.2018.01.141 |
| [6] |
REN Z H, DENG H D, DENG Y T, et al. Combined effects of deoxynivalenol and zearalenone on oxidative injury and apoptosis in porcine splenic lymphocytes in vitro[J]. Experimental and Toxicologic Pathology, 2017, 69(8): 612-617. DOI:10.1016/j.etp.2017.05.008 |
| [7] |
CHEN X X, YANG C W, HUANG L B, et al. Zearalenone altered the serum hormones, morphologic and apoptotic measurements of genital organs in post-weaning gilts[J]. Asian-Australasian Journal of Animal Sciences, 2015, 28(2): 171-179. |
| [8] |
MINERVINI F, DELL'AQUILA M E. Zearalenone and reproductive function in farm animals[J]. International Journal of Molecular Sciences, 2008, 9(12): 2570-2584. DOI:10.3390/ijms9122570 |
| [9] |
高爽, 邓又天, 张超, 等. 脱氧雪腐镰刀菌烯醇、玉米赤霉烯酮及其联合染毒对小鼠肝脏功能及肝细胞凋亡的影响[J]. 中国兽医学报, 2015, 35(12): 2021-2026. |
| [10] |
张薇, 张诗画, 李建平, 等.三种镰刀菌毒素对猪肾细胞凋亡及N-乙酰半胱胺酸保护作用的研究[C]//第二届(2017)东北养猪论坛暨东北猪业博览会论文集.哈尔滨: 北京天可瀚传媒科技有限公司, 2017: 6.
|
| [11] |
马勇江, 许利娜, 李玉谷, 等. 玉米赤霉烯酮对小鼠脾淋巴细胞凋亡的影响[J]. 家畜生态学报, 2009, 30(1): 52-56. DOI:10.3969/j.issn.1673-1182.2009.01.013 |
| [12] |
周迎芳.F-2毒素对小鼠卵巢颗粒细胞凋亡及其相关因素的影响研究[D].硕士学位论文.长沙: 湖南农业大学, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10537-2007207709.htm
|
| [13] |
胡进.玉米赤霉烯酮对小鼠子宫内膜基质细胞的毒性作用及机制研究[D].博士学位论文.南京: 南京农业大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10307-1017259912.htm
|
| [14] |
BEN SALEM I, PROLA A, BOUSSABBEH M, et al. Crocin and quercetin protect HCT116 and HEK293 cells from zearalenone-induced apoptosis by reducing endoplasmic reticulum stress[J]. Cell Stress and Chaperones, 2015, 20(6): 927-938. DOI:10.1007/s12192-015-0613-0 |
| [15] |
ZHENG W L, WANG B J, LI X, et al. Zearalenone promotes cell proliferation or causes cell death?[J]. Toxins, 2018, 10(5): 184. DOI:10.3390/toxins10050184 |
| [16] |
STOPA E, BABIN ŃSKA I, ZIELONKA Ł, et al. Immunohistochemical evaluation of apoptosis and proliferation in the mucous membrane of selected uterine regions in pre-pubertal bitches exposed to low doses of zearalenone[J]. Polish Journal of Veterinary Sciences, 2016, 19(1): 175-186. |
| [17] |
GAJECKA M, OBREMSKI K, JAKIMIUK E, et al. Histopathological examination of ovaries in bitches after experimental zearalenone mycotoxicosis[J]. Polish Journal of Veterinary Sciences, 2008, 11(4): 363-366. |
| [18] |
YUAN H, DENG Y T, YUAN L Y, et al. Gynostemma pentaphyllum protects mouse male germ cells against apoptosis caused by zearalenone via Bax and Bcl-2 regulation[J]. Toxicology Mechanisms and Methods, 2010, 20(3): 153-158. DOI:10.3109/15376511003660185 |
| [19] |
ZHANG G L, SUN X F, FENG Y Z, et al. Zearalenone exposure impairs ovarian primordial follicle formation via down-regulation of Lhx8 expression in vitro[J]. Toxicology and Applied Pharmacology, 2017, 317: 33-40. DOI:10.1016/j.taap.2017.01.004 |
| [20] |
WANG J J, LI M M, ZHANG W, et al. Protective effect of N-acetylcysteine against oxidative stress induced by zearalenone via mitochondrial apoptosis pathway in SIEC02 cells[J]. Toxins, 2018, 10(10): 407. DOI:10.3390/toxins10100407 |
| [21] |
SAMIK A, SAFITRI E. Potency of mycotoxin binders on MDA level, expressions of caspase 9 and caspase 3 in the uterus of mice exposed to zearalenone[J]. Iraqi Journal of Veterinary Sciences, 2017, 31(1): 29-33. |
| [22] |
SHI D H, ZHOU J C, ZHAO L H, et al. Alleviation of mycotoxin biodegradation agent on zearalenone and deoxynivalenol toxicosis in immature gilts[J]. Journal of Animal Science and Biotechnology, 2018, 9: 42. DOI:10.1186/s40104-018-0255-z |
| [23] |
LARANJEIRO C S M, DA SILVA L J G, PEREIRA A M P T, et al. The mycoestrogen zearalenone in portuguese flowing waters and its potential environmental impact[J]. Mycotoxin Research, 2018, 34(1): 77-83. DOI:10.1007/s12550-017-0301-2 |
| [24] |
LAHOUAR A, JEDIDI I, SANCHIS V, et al. Aflatoxin B1, ochratoxin A and zearalenone in sorghum grains marketed in tunisia[J]. Food Additives & Contaminants:Part B, 2018, 11(2): 103-110. |
| [25] |
ZHOU M, YANG L J, SHAO M H, et al. Effects of zearalenone exposure on the TGF-β1/Smad3 signaling pathway and the expression of proliferation or apoptosis related genes of post-weaning gilts[J]. Toxins (Basel), 2018, 10(2): E49. DOI:10.3390/toxins10020049 |
| [26] |
FLECK S C, CHURCHWELL M I, DOERGE D R. Metabolism and pharmacokinetics of zearalenone following oral and intravenous administration in juvenile female pigs[J]. Food and Chemical Toxicology, 2017, 106: 193-201. DOI:10.1016/j.fct.2017.05.048 |




