2. 辽宁省水产设施养殖与装备工程研究中心, 大连 116023;
3. 中国科学院半导体研究所, 北京 100083;
4. 深圳市超频三科技股份有限公司, 深圳 518000;
5. 青岛海洋科学与技术国家实验室, 青岛 266000
2. Liaoning Aquaculture Facilities and Equipment Engineering Research Center, Dalian 116023, China;
3. Institute of Semiconductors, Chinese Academy of Sciences, Beijing 100083, China;
4. Shenzhen Led Cooler Technology Co., Ltd., Shenzhen 518000, China;
5. Qingdao National Laboratory for Marine Science and Technology, Qingdao 266000, China
光作为一个重要且复杂的生态因子,直接或间接地影响水产动物的摄食、生长及发育等生理活动[1-5]。大量研究表明鱼类对光的应答效应与物种[6]、系统发育阶段[7]及生态因素[5]等息息相关。近几十年,对光色环境的应用研究主要集中在家禽上。谢电等[8]研究发现,在肉鸡早期生长阶段,选用绿光可不同程度改善小肠对营养物质的吸收能力;Karakaya等[9]也发现,绿光、蓝光灯共同转换可有效提高罗斯308肉鸡的肌肉品质;另有研究发现,蓝光饲养条件下可以显著提高公鸡的增重率及屠宰率[10]。这说明不同的光色环境对家禽尤其是鸡类表现出了不同的生理促进作用。目前,国内外有关光色环境对养殖鱼类生理生态影响的研究也在日益增加。Migaud等[11]对大西洋鲑(Salmo salar)的研究发现,高强度蓝光LED环境可引起其强烈的应激反应,而能够很好地适应低强度的蓝光和白光LED环境;仇登高等[12]研究发现,红光LED环境下(光强8.60 W/m2,光周期12L : 12D)可以一定程度上使大西洋鲑获得更佳的成活率、摄食率、饲料转化效率。扬世光等[13]研究表明,红光LED环境有利于2种热带鱼[蓝凤凰短鲷(Nanochromis nudiceps)和斑马鱼(Brachydanio rerio)]摄食、繁殖、生长及代谢;也有研究表明豹纹鳃棘鲈(Plectropomus leopardus)在绿光LED环境中各项生长性能均高于在黑暗、白光、红光、黄光LED环境中[14];对条斑星蝶(Verasper moseri)的研究表明,绿光LED饲养环境下可以大幅度提高其特定增长率及增重率[15]。由此可见,鱼类对光色环境的选择具有一定的差异性。
欧洲舌齿鲈(Dicentrarchus labrax)隶属鲈形目(Perciformes),狼鲈科(Moronidae),舌齿鲈属(Dicentrarchus),又名欧鲈,为广温广盐性种[16],是地中海沿海地区一种重要的经济型养殖鱼类[17]。其个体大、抗病力强、味道鲜美,富含多种必需氨基酸、不饱和脂肪酸及微量元素,营养价值极高,深受消费者喜爱,因其较高的市场需求及独特的芳香品质,欧洲舌齿鲈的市场价格在数十年间不断增长[18-19],冠有“鱼中之王”的美称。自2010年欧洲舌齿鲈引入我国至今,已开展了部分繁育攻关工作,并进行了陆基工厂化、池塘和海上网箱试养殖,其养殖密度可达85 kg/m3,年产量15万t[20]。近年来,我国围绕欧洲舌齿鲈亲鱼培育、苗种繁育、幼鱼养成等开展了一些研究与生产试验工作[21-23],取得了一定成效。目前,国外关于欧洲舌齿鲈的研究大多数集中在生长、消化生理[24]、行为学[25]、基因组学[26]等方面, 少数学者也阐述了不同光色环境下欧洲舌齿鲈的生理生态变化[4, 27-30],而关于光色环境对欧洲舌齿鲈营养品质的研究还未见报道。鉴于此,在大量查阅LED光色环境对鱼类影响相关文献的基础上,本试验筛取使用较为普遍的5种光色(全光谱光、蓝色、绿色、黄色、红色)环境对欧洲舌齿鲈营养品质的影响进行研究,以期为LED光色在水产养殖生产中的应用提供理论依据。
1 材料与方法 1.1 试验材料与处理试验用欧洲舌齿鲈来自大连海洋大学水产设施与养殖装备团队实验室,选取无外伤、体质健壮的欧洲舌齿鲈幼鱼[体质量(29.91±0.39) g、体长(13.78±0.35) cm]600尾。
将试验鱼随机分至5个光色组:全光谱光组、蓝光组、绿光组、黄光组、红光组,每组设置4个重复,每个重复30尾。试验鱼于小型循环水养殖水槽(300 L)中暂养3 d,以适应系统环境。暂养结束后开始正式试验,试验期为50 d。养殖期间,投喂加州鲈鱼专用饲料[粗蛋白质含量(51.01±0.32)%,粗脂肪含量(7.23±0.03)%,粗灰分含量(31.40±0.86)%,由广东越群海洋生物研究开发有限公司生产],按鱼体质量的2%进行投喂,每日1次。水温控制在(19±1) ℃、溶氧(DO)浓度>5.5 mg/L、盐度31.5±0.5、pH 7.5±0.1。每2 d换水1次,换水体积为水体的50%,定期清除残饵粪便。
试验灯具由中国科学院半导体研究所设计,深圳超频三科技有限公司制造,采用全光谱(波长在400~780 nm)、蓝色(波长在450~455 nm)、绿色(波长在525~530 nm)、黄色(波长在590~595 nm)、红色(波长在625~630 nm)5种光色,是型号为GK5A的LED光源。在水面正上方60 cm固定灯光,以水面正上方5 cm处为统一测量标准,每日开灯5 min后调节灯光以保证各组光照强度为(274.89±33.88) mW/m2,各组之间采用遮光布遮盖,以避免不同光源间的交叉污染。光质与光照强度均采用尚泽光电股份有限公司研制的SRI-2000-UV光谱照度计测定;光照周期16L : 8D(电子定时器进行控制)。
试验结束后,每个养殖桶随机取试验鱼2尾,每个光色组共取鱼8尾,MS-222麻醉,于冰盘上解剖后迅速取鱼体两侧头后至尾柄前的全部肌肉,去鳞、去皮,去离子水冲洗干净,高速捣碎机将肌肉捣碎,于真空冷冻干燥机中干燥至恒重,置于-80 ℃超低温冰箱中保存,用以测定肌肉脂肪酸、氨基酸组成及常规营养成分(粗蛋白质、粗脂肪、粗灰分)含量。每个光色组再随机取3尾试验鱼,105 ℃烘干至恒重,存于干燥器中,以供进行全鱼常规营养成分含量分析。
1.2 测定方法 1.2.1 全鱼和肌肉常规营养成分含量测定水分含量测定按照GB 5009.3—2010方法执行;粗灰分含量按照GB 5009.4—2016方法进行测定;粗蛋白质含量采用K9860凯氏定氮仪,依照GB 5009.5—2010中的凯氏定氮法测定;粗脂肪含量采用YG-2型脂肪抽提器,依照GB 5009.168—2016中的索氏抽提法测定。
1.2.2 肌肉中氨基酸组成的测定采用GB/T 15399—1994中方法氧化酸处理肌肉样品。采用荧光分光光度法测定色氨酸的含量;按照GB/T 5009.124—2003的方法使用日立L-8900氨基酸分析仪测定除色氨酸外的17种氨基酸的含量。
1.2.3 肌肉中脂肪酸组成的测定将肌肉冷冻干燥至恒重后,采用Scion 456-GC气相色谱仪进行脂肪酸组成的测定。通过与标准品脂肪酸停留时间对比标记各脂肪酸,面积归一化法计算各脂肪酸的相对含量,每个样品检测5次。
1.3 肌肉营养品质评价根据1973年联合国粮农组织/世界卫生组织(FAO/WHO)提出的氨基酸评分标准模式和中国预防医学科学院营养与食品卫生研究所在1991年提出的全鸡蛋蛋白质氨基酸模式进行比较,分别按照以下公式计算氨基酸评分(AAS)、化学评分(CS)和必需氨基酸指数(EAAI),计算公式如下:

|
式中:n为比较的氨基酸数;a,b,…,h为待评蛋白质中各氨基酸含量(mg/g N);A,B,…,H为全鸡蛋蛋白质中各氨基酸含量(mg/g N)。
将氨基酸含量的数据换算成每克氮中含氨基酸毫克数的计算公式如下:
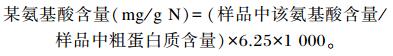
|
应用Excel 2007软件进行常规数据统计,使用SPSS 22.0统计软件的ANOVA程序进行单因素方差分析,并用Duncan氏法进行多重比较,P < 0.05表示差异显著。试验所有数据均以平均值±标准差(mean±SD)表示。
2 结果与分析 2.1 5种光色环境下欧洲舌齿鲈的常规营养成分含量5种光色环境下欧洲舌齿鲈全鱼和肌肉的水分、粗蛋白质、粗脂肪、粗灰分含量测定结果见表 1。由表中数据可知,各光色组的全鱼水分、粗灰分含量差异不显著(P>0.05),全鱼粗蛋白质含量以绿光组最高,但各组间差异不显著(P>0.05);绿光组全鱼粗脂肪含量显著高于其他各组(P<0.05)。各组间肌肉水分及粗灰分含量无显著差异(P>0.05);绿光组和蓝光组肌肉粗蛋白质含量略高,但各组间差异不显著(P>0.05);绿光组肌肉粗脂肪含量显著高于其他各组(P<0.05),由高至低依次为绿光组、蓝光组、黄光组、全光谱光组、红光组。
|
|
表 1 5种光色环境下欧洲舌齿鲈全鱼、肌肉的常规营养成分含量(干物质基础) Table 1 Common nutritional component contents in whole body and muscle of Dicentrarchus labrax in five kinds of light color environments (DM basis) |
5种光色环境下欧洲舌齿鲈肌肉中氨基酸组成变化见表 2。由表中数据可知,各组欧洲舌齿鲈均检测出18种氨基酸,其中包括8种必需氨基酸(EAA)、2种半必需氨基酸(HEAA)、8种非必需氨基酸(NEAA)。方差分析结果显示,18种氨基酸在5种光色环境下部分存在显著性差异,其中绿光组中5种非必需氨基酸(天冬氨酸、谷氨酸、甘氨酸、丙氨酸和酪氨酸)、1种必需氨基酸(苯丙氨酸)、1种半必需氨基酸(精氨酸)以及总氨基酸、必需氨基酸和非必需氨基酸含量均显著高于全光谱光组、黄光组和红光组(P<0.05),而略高于蓝光组(P>0.05);7种必需氨基酸(苏氨酸、缬氨酸、蛋氨酸、异亮氨酸、亮氨酸、色氨酸和赖氨酸)和2种非必需氨基酸(丝氨酸、脯氨酸和半胱氨酸)、1种半非必需氨基酸(组氨酸)的含量在5种光色环境下差异不显著(P>0.05)。从肌肉氨基酸组成中可以得出,5种光色环境下肌肉18种氨基酸中均以谷氨酸的含量最高,全光谱光组、绿光组、蓝光组、黄光组、红光组肌肉谷氨酸含量分别为13.68%、16.55%、16.18%、14.03%、11.45%,而后依次为天冬氨酸、赖氨酸、亮氨酸、精氨酸、丙氨酸,半胱氨酸含量最低,全光谱光组、绿光组、蓝光组、黄光组、红光组肌肉半胱氨酸含量仅分别为0.52%、0.64%、0.62%、0.54%、0.44%。5种光色环境下必需氨基酸/总氨基酸均为0.41%,必需氨基酸/非必需氨基酸在0.82%~0.83%,组间差异均不显著(P>0.05)。
|
|
表 2 5种光色环境下欧洲舌齿鲈肌肉氨基酸组成(干物质基础) Table 2 Amino acid composition in muscle of Dicentrarchus labrax in five kinds of light color environments (DM basis) |
将表 2中的必需氨基酸含量的数据换算成每克氮中含氨基酸毫克数后,与全鸡蛋蛋白质氨基酸模式、FAO/WHO氨基酸模式进行比较,并分别计算出5种光色环境下欧洲舌齿鲈肌肉的AAS、CS和EAAI。
由表 3可知,5种光色环境下欧洲舌齿鲈肌肉中必需氨基酸的含量不同,由高至低依次为绿光组、蓝光组、全光谱光组、黄光组、红光组,分别为3 880.87、3 657.21、3 177.18、3 141.50、2 732.00 mg/g N,均高于FAO/WHO氨基酸模式(2 250 mg/g N),仅红光组低于全鸡蛋蛋白质氨基酸模式(3 059 mg/g N)。赖氨酸含量均超出FAO/WHO氨基酸模式(340 mg/g N)和全鸡蛋蛋白质氨基酸模式(441 mg/g N),除红光组外各组异亮氨酸、亮氨酸、苏氨酸、苯丙氨酸+酪氨酸含量均超出FAO/WHO氨基酸模式和全鸡蛋蛋白质氨基酸模式。由此可知,欧洲舌齿鲈具有较高的营养价值,且绿光组、蓝光组欧洲舌齿鲈的营养品质更佳。
|
|
表 3 5种光色环境下欧洲舌齿鲈肌肉中必需氨基酸含量与FAO/WHO氨基酸模式和全鸡蛋蛋白质氨基酸模式比较 Table 3 Comparison of EAA contents in muscle of Dicentrarchus labrax in five kinds of light color environments with FAO/WHO amino acid pattern and whole egg protein amino acid pattern |
由表 4可知,5种光色环境下欧洲舌齿鲈肌肉中必需氨基酸的AAS均接近或大于1,CS均大于0.5,且5种光色环境下欧洲舌齿鲈肌肉中必需氨基酸的AAS和CS基本上都符合绿光组最高,蓝光组次之,红光组最低的规律,这说明绿光、蓝光环境下欧洲舌齿鲈肌肉中必需氨基酸的组成较红光环境下更为平衡,营养更为丰富。由AAS和CS可知,5种光色环境下欧洲舌齿鲈肌肉中的第一限制性氨基酸均为蛋氨酸+半胱氨酸,第二限制性氨基酸均为缬氨酸。5种光色环境下欧洲舌齿鲈的EAAI如下:绿光组为119.37、蓝光组为112.54、全光谱光组为99.18、黄光组为95.61、红光组为86.57。
|
|
表 4 5种光色环境下欧洲舌齿鲈肌肉必需氨基酸的AAS、CS和EAAI比较 Table 4 Comparison of AAS, CS and EAAI of EAA in muscle of Dicentrarchus labrax in five kinds of light color environments |
运用气相色谱-质谱联用(GC/MS)仪采用面积归一化法检测5种光色环境下欧洲舌齿鲈肌肉脂肪酸组成,结果见表 5。5种光色环境下欧洲舌齿鲈肌肉脂肪酸组成类似,均检测出16种脂肪酸,包括6种饱和脂肪酸(SFA)、4种单不饱和脂肪酸(MUFA)、6种多不饱和脂肪酸(PUFA)。在5种光色环境下欧洲舌齿鲈肌肉中饱和脂肪酸及多不饱和脂肪酸含量均表现为绿光组显著高于全光谱光组、黄光组、红光组(P<0.05),红光组的饱和脂肪酸与多不饱和脂肪酸含量均最低。在5种光色环境下欧洲舌齿鲈肌肉脂肪酸含量方面:饱和脂肪酸中,绿光组的C14 : 0和C16 : 0含量显著高于其他组(P<0.05),红色组的C14 : 0和C16 : 0含量均最低;单不饱和脂肪酸中,以C18 : 1n-9含量(20.89%~22.80%)最高,5个组中以绿光组较高,红光组最低,但各组间差异不显著(P>0.05);多不饱和脂肪酸中,C18 : 2n-6含量最高,但各组间差异不显著(P>0.05),其次是C22 : 6n-3(DHA)、C20 : 5n-3(EPA),绿光组DHA和EPA+DHA含量显著高于红光组(P<0.05),而略高于其他3组(P>0.05),而EPA含量在各组间差异不显著(P>0.05)。
|
|
表 5 5种光色环境下欧洲舌齿鲈肌肉脂肪酸组成(干物质基础) Table 5 Fatty acid composition in muscle of Dicentrarchus labrax in five kinds of light color environments (DM basis) |
肌肉组织是养殖鱼类最主要的食用部位,其粗蛋白质、粗脂肪的含量及其营养成分组成比例代表鱼类的整体营养价值[19],具体体现在水分、粗灰分、粗脂肪、粗蛋白质、碳水化合物、微量元素和矿物质元素含量等方面[14, 31]。本试验结果表明,5种光色环境下欧洲舌齿鲈全鱼、肌肉粗脂肪含量表现出类似的变化规律,即绿光组全鱼和肌肉的粗脂肪含量显著高于其他各组,而红光组全鱼、肌肉粗脂肪含量最低。有研究表明蓝光环境可以大幅度降低虹鳟(Oncorhynchus mykiss)肝脏的粗脂肪含量,暗示蓝光对虹鳟存在一定程度的胁迫,从而大量消耗能量以应对外界环境的胁迫[2];由本试验可以看出,红光也产生了类似的现象,说明红光对欧洲舌齿鲈造成了一定程度的胁迫;而绿光并没有导致欧洲舌齿鲈全鱼、肌肉粗脂肪含量的降低,说明了绿光对欧洲舌齿鲈不存在胁迫或胁迫较小。另外,低强度红光可以显著增加镜鲤(Cyprinue carpio)鱼体的粗蛋白质含量[32];而在试验中,不同光色环境下,欧洲舌齿鲈鱼体和肌肉粗蛋白质含量并无显著变化。目前,关于不同光色是如何影响鱼类营养代谢的机制仍然不清楚,有待进一步深入研究。
3.2 5种光色环境下欧洲舌齿鲈肌肉氨基酸组成分析与营养品质评价饲料中的蛋白质是首要营养素,由多种氨基酸组成,因而蛋白质营养又被称为氨基酸营养。动物蛋白质的鲜美程度与其鲜味氨基酸含量相关,其中天冬氨酸、谷氨酸是最主要的鲜味氨基酸。鱼类部分呈味氨基酸通过调节相关酶的生成,改变三羧酸循环(TCA)、糖酵解途径,实现其生物合成[33]。在本试验中,绿光组、蓝光组2种鲜味氨基酸(天冬氨酸、谷氨酸)、2种甘味氨基酸(甘氨酸、丙氨酸)、2种香味氨基酸(酪氨酸、苯丙氨酸)的含量均显著高于其他3组,且均以红光组最低。造成以上差异的原因可能是绿光、蓝光更有利于鱼体肌肉细胞中相关酶的合成,通过TCA和糖酵解途径促进其肌肉中呈味氨基酸的合成。有研究表明豹纹鳃棘鲈(Plectropomus leopardus)幼鱼在绿光环境下有着较高的鲜味,且天冬氨酸、谷氨酸、精氨酸、甘氨酸、丙氨酸、酪氨酸和苯丙氨酸等呈味氨基酸的含量在绿光环境下较高[14]。
评价蛋白质的营养价值必须依据氨基酸的含量与组成,尤其是人体所需的8种必需氨基酸含量的高低和组成比例。在本试验中,总氨基酸、必需氨基酸、非必需氨基酸、半必需氨基酸含量变化均表现为绿光组>蓝光组>黄光组>全光谱光组>红光组。上述结果说明不同的光色环境对鱼类肌肉营养品质产生了不同的影响。
根据FAO/WHO的理想模式,质量较好的蛋白质其组成的氨基酸中必需氨基酸/总氨基酸应该在40%左右,必需氨基酸/总氨基酸应在60%以上[34]。在本试验中,5种光色环境下欧洲舌齿鲈肌肉必需氨基酸/总氨基酸均在41%左右,必需氨基酸/非必需氨基酸在83%左右,5种光色环境并没有对欧洲舌齿鲈肌肉必需氨基酸/总氨基酸、必需氨基酸/非必需氨基酸产生显著影响,这也进一步说明欧洲舌齿鲈具有较优的蛋白质质量。EAAI是评价蛋白质营养价值的常用指标之一,EAAI越高,氨基酸组成越平衡,蛋白质质量越高。在本试验中,EAAI由高至低依次为绿光组、蓝光组、全光谱光组、黄光组、红光组,分别为119.37、112.54、99.18、95.61、86.57。由此可见,在绿光、蓝光环境下欧洲舌齿鲈肌肉中氨基酸的组成符合优质蛋白质标准,且平衡效果较好。
按照AAS,5种光色环境下欧洲舌齿鲈肌肉中的第一限制性氨基酸均为蛋氨酸和半胱氨酸,第二限制性氨基酸均为缬氨酸,这与王广军等[35]报道的大口黑鲈(Micropterus salmoides)、中国花鲈(Lateolabrax maculatus),樊佳佳等[36]报道的大口黑鲈优鲈1号(Micropterus salmoides “Youlu No.1”),陈佳毅等[37]报道的加州鲈(Micropterus salmoides)、河鲈(Percafkuviatilis linnaeus)的结果一致。
3.3 5种光色环境下欧洲舌齿鲈肌肉脂肪酸组成分析脂肪酸除作为能源外,还是必需脂肪酸源。鱼类生长和生存所需的必需脂肪酸除受种类影响外,还受年龄、性别、温度、盐度、饲料等影响。研究表明,机体在受到外界刺激后,饱和脂肪酸发挥重要的分解功能,其中C16 : 0被优先利用于能量消耗[38]。且在饱和脂肪酸中,C14 : 0、C16 : 0、C18 : 0的含量占绝大部分,且以C16 : 0含量最高[39]。在本试验中,绿光组、蓝光组肌肉C16 : 0含量显著高于其他3组,可能是由于欧洲舌齿鲈在红光、全光谱光、黄光环境下消耗了大量能量。评价鱼体营养品质高低的另一个重要指标是鱼体肌肉多不饱和脂肪酸的含量,高含量的多不饱和脂肪酸在加热后能显著增加香气,在一定程度上反映了肌肉的多汁性[34]。在本试验中,绿光组欧洲舌齿鲈肌肉中多不饱和脂肪酸含量显著高于其他各组。在多不饱和脂肪酸中,最主要的是EPA、DHA和C20 : 4n-6(AA)。5种光色环境下欧洲舌齿鲈肌肉中EPA+DHA的含量占肌肉脂肪酸总量的15.14%~18.77%,高于道氏虹鳟(Oncorhyrtchus mykiss)的5个品系[40]、尼罗尖吻鲈(Lates nilotieus)[41]等。DHA及EPA是海水鱼类的必需脂肪酸,在细胞膜结构中担任重要角色,特别是对于鱼类早期发育阶段的色素沉积及脑、视神经等神经组织发育均发挥着重要作用[42-44]。在本试验中,绿光组欧洲舌齿鲈肌肉中DHA、EPA含量比红光组分别高出57.73%、33.80%,肌肉中EPA+DHA的含量由高至低依次为绿光组、全光谱光组、蓝光组、黄光组、红光组。可见,5种光色环境下欧洲舌齿鲈肌肉脂肪均具有较高的保健和营养价值,以绿光组、全光谱光组更佳。
4 结论综合全鱼和肌肉常规营养成分含量以及肌肉氨基酸和脂肪酸组成,评价不同光色环境下欧洲舌齿鲈营养品质后得出:除了粗脂肪含量外,5种光色环境下欧洲舌齿鲈全鱼和肌肉常规营养成分含量的均无显著差异;绿光环境不同程度提高了欧洲舌齿鲈肌肉中部分氨基酸(天冬氨酸、谷氨酸、甘氨酸、丙氨酸、酪氨酸、精氨酸及苯丙氨酸)及必需氨基酸的含量,而且绿光环境下欧洲舌齿鲈肌肉中必需氨基酸的含量及必需氨基酸的AAS和CS均表现出了较高的水平;5种光色环境下欧洲舌齿鲈肌肉中饱和脂肪酸及多不饱和脂肪酸的含量均表现为绿光组显著高于其他组,且绿光环境下欧洲舌齿鲈肌肉脂肪酸中EPA、DHA含量较高。从欧洲舌齿鲈营养组成上看,绿光环境可以在一定程度上改善其营养品质,提高其营养价值。
| [1] |
WANG T, CHENG Y Z, LIU Z P, et al. Effects of light intensity on growth, immune response, plasma cortisol and fatty acid composition of juvenile Epinephelus coioides reared in artificial seawater[J]. Aquaculture, 2013, 414-415: 135-139. DOI:10.1016/j.aquaculture.2013.08.004 |
| [2] |
KARAKATSOULI N, PAPOUTSOGLOU S E, PIZZONIA G, et al. Effects of light spectrum on growth and physiological status of gilthead seabream Sparus aurata and rainbow trout Oncorhynchus mykiss reared under recirculating system conditions[J]. Aquacultural Engineering, 2007, 36(3): 302-309. DOI:10.1016/j.aquaeng.2007.01.005 |
| [3] |
逯尚尉.不同饵料、密度和光周期对点带石斑鱼(Epinephelus malabaricus)幼鱼的影响[D].硕士学位论文.南京: 南京农业大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10307-1012490353.htm
|
| [4] |
VILLAMIZAR N, GARCÍA-ALCAZAR A, SÁNCHEZ-VÁZQUEZ F J. Effect of light spectrum and photoperiod on the growth, development and survival of European sea bass (Dicentrarchus labrax) larvae[J]. Aquaculture, 2009, 292(1/2): 80-86. |
| [5] |
VILLAMIZAR N, GARCÍA-MATEOS G, SÁNCHEZ-VÁZQUEZ F J. Behavioral responses of European sea bass (Dicentrarchus labrax) larvae and Artemia sp. exposed to constant light or darkness vs. light/dark cycles of white, red or blue wavelengths[J]. Aquaculture, 2011, 317(1/2/3/4): 197-202. |
| [6] |
MARCHESAN M, SPOTO M, VERGINELLA L, et al. Behavioural effects of artificial light on fish species of commercial interest[J]. Fisheries Research, 2005, 73(1/2): 171-185. |
| [7] |
DOWNING G. Impact of spectral composition on larval haddock, Melanogrammus aeglefinus L. growth and survival[J]. Aquaculture Research, 2002, 33(4): 251-259. DOI:10.1046/j.1355-557x.2002.00668.x |
| [8] |
谢电, 陈耀星, 王子旭, 等. 单色光对肉雏鸡小肠黏膜形态结构的影响[J]. 中国农业科学, 2009, 42(3): 1084-1090. DOI:10.3864/j.issn.0578-1752.2009.03.042 |
| [9] |
KARAKAYA M, PARLAT S S, YILMAZ M T, et al. Growth performance and quality properties of meat from broiler chickens reared under different monochromatic light sources[J]. British Poultry Science, 2009, 50(1): 76-82. DOI:10.1080/00071660802629571 |
| [10] |
KE Y Y, LIU W J, WANG Z X, et al. Effects of monochromatic light on quality properties and antioxidation of meat in broilers[J]. Poultry Science, 2011, 90(11): 2632-2637. DOI:10.3382/ps.2011-01523 |
| [11] |
MIGAUD H, COWAN M, TAYLOR J, et al. The effect of spectral composition and light intensity on melatonin, stress and retinal damage in post-smolt Atlantic salmon, Salmo salar[J]. Aquaculture, 2007, 270(1/2/3/4): 390-404. |
| [12] |
仇登高, 徐世宏, 刘鹰, 等. 光环境因子对循环水养殖系统中大西洋鲑生长和摄食的影响[J]. 中国水产科学, 2015, 22(1): 68-78. |
| [13] |
扬世光, 李学勇. LED有色光源在水生物生长中的作用和影响[J]. 照明工程学报, 2003, 14(3): 35-38. DOI:10.3969/j.issn.1004-440X.2003.03.009 |
| [14] |
吴亮.光照对豹纹鳃棘鲈幼鱼栖息、生长和肌肉营养成分的影响[D].硕士学位论文.上海: 上海海洋大学, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10264-1016912248.htm
|
| [15] |
TAKAHASHI A, KASAGI S, MURAKAMI N, et al. Chronic effects of light irradiated from LED on the growth performance and endocrine properties of barfin flounder Verasper moseri[J]. General and Comparative Endocrinology, 2016, 232: 101-108. DOI:10.1016/j.ygcen.2016.01.008 |
| [16] |
FRIMODT C. Multilingual illustrated guide to the world's commercial warmwater fish[M]. Osney Mead, Oxford: Fishing News Books, 1995.
|
| [17] |
MORETTI A, FERNANDEZ-CRIADO M P, CITTOLIN G, et al.Manual on hatchery production of seabass and gilthead seabream: volume 1[R]. Rome: FAO, 1999.
|
| [18] |
ALASALVAR C, TAYLOR K D A, ZUBCOV E, et al. Differentiation of cultured and wild sea bass (Dicentrarchus labrax):total lipid content, fatty acid and trace mineral composition[J]. Food Chemistry, 2002, 79(2): 145-150. DOI:10.1016/S0308-8146(02)00122-X |
| [19] |
PERIAGO M J, AYALA M D, LÓPEZ-ALBORS O, et al. Muscle cellularity and flesh quality of wild and farmed sea bass, Dicentrarchus labrax L.[J]. Aquaculture, 2005, 249(1/2/3/4): 175-188. |
| [20] |
FEAP.European aquaculture production report 2005-2014[R].[S.l.]: Federation of European Aquaculture Producers, 2015.
|
| [21] |
张静, 李勇, 赵宁宁, 等. 欧洲舌齿鲈和花鲈生长期营养需求特点综述[J]. 渔业现代化, 2016, 43(5): 12-17. DOI:10.3969/j.issn.1007-9580.2016.05.003 |
| [22] |
张磊, 郑纪盟, 夏苏东, 等. 盐度和温度对欧洲舌齿鲈(Dicentrarchus labrax)幼鱼活动与存活的影响[J]. 安徽农业科学, 2014, 42(34): 12121-12122. DOI:10.3969/j.issn.0517-6611.2014.34.042 |
| [23] |
高露, 徐承旭. 大连海洋大学工厂化繁育欧洲舌齿鲈苗种获得突破[J]. 水产科技情报, 2017(5): 284. |
| [24] |
BONVINI E, BONALDO A, MANDRIOLI L, et al. Effects of feeding low fishmeal diets with increasing soybean meal levels on growth, gut histology and plasma biochemistry of sea bass[J]. Animal, 2017, 12(5): 923-930. |
| [25] |
O'NEILL R, MAOILÉIDIGH N, MCGINNITY P, et al. The novel use of pop-off satellite tags (PSATs) to investigate the migratory behaviour of European sea bass Dicentrarchus labrax[J]. Journal of Fish Biology, 2018, 92(5): 1404-1421. DOI:10.1111/jfb.2018.92.issue-5 |
| [26] |
ZHAO Y F, PENG W Z, GUO H Y, et al. Population genomics reveals genetic divergence and adaptive differentiation of chinese sea bass (Lateolabrax maculatus)[J]. Marine Biotechnology, 2018, 20(1): 45-59. DOI:10.1007/s10126-017-9786-0 |
| [27] |
BAYARRI M J, ⅡGO M, MUÑOZ-CUETO J A, et al. Binding characteristics and daily rhythms of melatonin receptors are distinct in the retina and the brain areas of the European sea bass retina (Dicentrarchus labrax)[J]. Brain Research, 2004, 1029(2): 241-250. DOI:10.1016/j.brainres.2004.09.049 |
| [28] |
BAYARRI M J, MADRID J A, SANCHEZ-VÁZQUEZ F J. Influence of light intensity, spectrum and orientation on sea bass plasma and ocular melatonin[J]. Journal of Pineal Research, 2002, 32(1): 34-40. DOI:10.1034/j.1600-079x.2002.10806.x |
| [29] |
BEGTASHI I, RODRÍGUEZ L, MOLES G, et al. Long-term exposure to continuous light inhibits precocity in juvenile male European sea bass (Dicentrarchus labrax, L.).Ⅰ.Morphological aspects[J]. Aquaculture, 2004, 241(1/2/3/4): 539-559. |
| [30] |
RODRÍGUEZ L, BEGTASHI I, ZANUY S, et al. Long-term exposure to continuous light inhibits precocity in European male sea bass (Dicentrarchus labrax, L.):hormonal aspects[J]. General and Comparative Endocrinology, 2005, 140(2): 116-125. DOI:10.1016/j.ygcen.2004.10.011 |
| [31] |
佩利特P L, 扬V R.蛋白质食物的营养评价[M].范文洵, 译.北京: 人民卫生出版社, 1984.
|
| [32] |
KARAKATSOULI N, PAPOUTSOGLOU E S, SOTIROPOULOS N, et al. Effects of light spectrum, rearing density and light intensity on growth performance of scaled and mirror common carp Cyprinus carpio reared under recirculating system conditions[J]. Aquacultural Engineering, 2010, 42(3): 121-127. DOI:10.1016/j.aquaeng.2010.01.001 |
| [33] |
王镜岩, 朱圣庚, 徐长法. 生物化学教程[M]. 北京: 高等教育出版社, 2008.
|
| [34] |
邴旭文, 蔡宝玉, 王利平. 中华倒刺鲃肌肉营养成分与品质的评价[J]. 中国水产科学, 2005, 12(2): 211-215. DOI:10.3321/j.issn:1005-8737.2005.02.018 |
| [35] |
王广军, 关胜军, 吴锐全, 等. 大口黑鲈肌肉营养成分分析及营养评价[J]. 海洋渔业, 2008, 30(3): 239-244. DOI:10.3969/j.issn.1004-2490.2008.03.008 |
| [36] |
樊佳佳, 白俊杰, 李胜杰, 等. 大口黑鲈"优鲈1号"选育群体肌肉营养成分和品质评价[J]. 中国水产科学, 2012, 19(3): 423-429. |
| [37] |
陈佳毅, 叶元土, 郭建林, 等. 梭鲈、河鲈和加州鲈的肌肉营养成分分析[J]. 饲料研究, 2007(9): 52-54. DOI:10.3969/j.issn.1002-2813.2007.09.019 |
| [38] |
HENDERSON R J, SARGENT J R, HOPKINS C C E. Changes in the content and fatty acid composition of lipid in an isolated population of the capelin Mallotus villosus during sexual maturation and spawning[J]. Marine Biology, 1984, 78(3): 255-263. |
| [39] |
张永珍, 杨英明, 王磊, 等. 半滑舌鳎不同家系肌肉中脂肪酸含量的分析[J]. 中国水产科学, 2016, 23(2): 417-424. |
| [40] |
孙中武, 李超, 尹洪滨, 等. 不同品系虹鳟的肌肉营养成分分析[J]. 营养学报, 2008, 30(3): 298-302. DOI:10.3321/j.issn:0512-7955.2008.03.018 |
| [41] |
朱健, 闵宽洪, 张成锋, 等. 尼罗尖吻鲈鱼肉营养成分的测定及评价[J]. 营养学报, 2007, 29(1): 97-98, 100. DOI:10.3321/j.issn:0512-7955.2007.01.026 |
| [42] |
宋超.长江口中华鲟幼鱼及其饵料生物的体成分与营养关系研究[D].硕士学位论文.上海: 上海海洋大学, 2008. http://d.wanfangdata.com.cn/Thesis/Y1290797
|
| [43] |
马爱军, 刘新富, 翟毓秀, 等. 野生及人工养殖半滑舌鳎肌肉营养成分分析研究[J]. 渔业科学进展, 2006, 27(2): 49-54. DOI:10.3969/j.issn.1000-7075.2006.02.007 |
| [44] |
MOURENTE G, ODRIOZOLA J M. Effect of broodstock diets on lipid classes and their fatty acid composition in eggs of gilthead sea bream (Sparus aurata L.)[J]. Fish Physiology and Biochemistry, 1990, 8(2): 93-101. DOI:10.1007/BF00004436 |




