脂酰辅酶A合成酶(acyl-CoA synthetase, ACS)首先在辅酶A和ATP存在情况下催化游离脂肪酸合成脂酰辅酶A,这是外源及内源性脂肪酸进入代谢途径的第1步,而后经过活化的脂肪酸便可参与合成甘油三酯(TG)、神经酰胺,以及进入线粒体进行β-氧化分解供能,因此ACS是脂肪酸合成与分解代谢的关键酶。ACS由多基因家族编码,人ACS家族至少存在26个成员。由于催化脂肪酸碳链的长度不同,可将ACS分为超长链脂酰辅酶A合成酶(ACSVL)、长链脂酰辅酶A合成酶(long chain acyl-CoA synthetase, ACSL)、中链脂酰辅酶A合成酶(ACSM)以及短链脂酰辅酶A合成酶(ACSS)等[1-3]。
ACSL主要催化C : 12~C : 22长链脂肪酸活化成长链脂酰辅酶A,从而参与到细胞的生命活动中[4]。目前在哺乳动物中已经发现了5种不同的ACSL家族成员:ACSL1、ACSL3、ACSL4、ACSL5、ACSL6[5]。2004年,人类基因命名委员会(HGNC)和鼠类基因命名委员会(MGNC)修订了ACSL基因的命名,将原来的ACSL1和ACSL2合并为ACSL1基因,因此,ACSL基因家族中没有ACSL2基因,但最近研究发现,硬骨鱼类ACSL2基因仍然存在[6]。ACSL4主要活化多不饱和脂肪酸,对于二十碳五烯酸(C20 : 5n6)和花生四烯酸(C20 : 4n6)的活化作用要比亚油酸(C18 : 1)的活化作用高5~6倍[7]。ACSL4作为外周膜蛋白存在于线粒体膜和微粒体的过氧化物膜上,通过影响肾上腺以及肝脏来表达其生理功能,它与肥胖、脂肪肝等脂质代谢引起的相关疾病有密切联系[8],同时ACSL4的多态性表达与脂质种类以及含量有明显的关联,在斑马鱼(Danio rerio)中,ACSL4a表达在幼体和成体的消化道中,而ACSL4b则表达在成体肝胰脏和肠道中[9-10]。目前,虽然研究学者已经完成了草鱼(Ctenopharyngodon idellus)基因组的测序,但由于可变剪接的存在,有些基因的mRNA前体可以通过不同的剪接方式产生不同的mRNA剪接异构体,可变剪接是调节基因表达和产生蛋白质组多样性的重要机制,因此,为有效地探究ACSL4基因的表达情况,基因克隆是识别可变剪接的有效方式。
草鱼是我国重要养殖鱼类,由于近些年高密度的集约化养殖,鱼类营养性脂肪肝问题日益严重,肝胰脏的损伤病变直接导致机体代谢机能紊乱,降低疾病抵抗力,影响鱼类生长,进而造成经济损失。鱼类脂肪的堆积和代谢往往受脂肪代谢调控酶的影响。为进一步探究脂肪代谢的分子机理,本试验克隆了草鱼ACSL4基因全长cDNA,分析其在不同组织中的表达情况,并对投喂不同淀粉源饲料以及饥饿再投喂后草鱼肝胰脏ACSL4 mRNA的相对表达量进行研究,以期为预防鱼类脂肪肝、促进生产、研制饲料配方提供参考。
1 材料与方法 1.1 草鱼ACSL4基因全长cDNA分子克隆试验草鱼来自连云港市赣榆区罗阳镇渔场,挑选3尾湿重在1 300 g左右的个体。提取草鱼大脑、心脏、脾脏、肝胰脏、肌肉、肾脏、肠系膜脂肪、前肠、中肠、后肠10种组织总RNA,制成混合RNA,并以Oligo(dT)16AP为引物反转录合成cDNA第1链,作为基因克隆模板。
根据斑马鱼等的ACSL4保守序列设计2对核心序列兼并引物(表 1),PCR扩增ACSL4基因2对核心序列,采用1%琼脂糖电泳凝胶检测PCR产物,将胶回收纯化目的片段后进行克隆测序;根据测序验证后的核心片段序列设计3′和5′cDNA末端快速扩增(RACE)特异性引物(表 1),3′和5′末端序列克隆按照Cheng等[11]的方法进行。
|
|
表 1 本试验所用引物序列及预期产物大小 Table 1 Sequences and expected product sizes of primers used in this experiment |
使用DNAStar软件测序,将得到的草鱼ACSL4核心序列、3′和5′末端序列进行组装拼接,获得草鱼ACSL4基因cDNA全长,并通过NCBI网站进行同源性序列分析,使用http://www.cbs.dtu.dk/services网站预测信号肽;使用http://www.cbs.dtu.dk/services/网站预测糖基化位点、磷酸化位点;使用http://www.ebi.ac.uk/interpro/及http://www.cbs.dtu.dk/services/TMHMM/网站预测跨膜结构域;使用http://web.expasy.org/protparam/网站分析亲疏水性;使用http://npsa-pbil.ibcp.fr/及http://swissmodel.expasy.org网站进行蛋白质二级结构预测。
1.2 草鱼ACSL4基因组织表达提取3尾草鱼大脑、心脏、脾脏、肝胰脏、白肌、肾脏、肠系膜脂肪、前肠、中肠、后肠10种组织总RNA,以随机引物反转录合成cDNA第1链,稀释10倍后作为实时荧光定量PCR反应模板。根据克隆得到的草鱼ACSL4基因cDNA设计实时荧光定量PCR引物(表 1),以真核翻译延伸因子1A(eEF1A)、甘油醛-3-磷酸脱氢酶1(GAPDH1)和核糖体蛋白L13A(RPL13A)为内参基因,参照严媛等[12]的反应体系和条件分析草鱼ACSL4基因在不同组织中的表达情况。
1.3 不同淀粉源饲料对草鱼肝胰脏中ACSL4基因表达的影响 1.3.1 试验饲料配方试验用鱼粉及预混料由通辽市岳泰饲料有限公司提供。以鱼粉、豆粕、菜籽粕等为主要蛋白质源,以豆油为主要脂肪源,分别以玉米淀粉、马铃薯淀粉和小麦淀粉为淀粉源配制3种试验饲料。3种试验饲料中淀粉的添加量均为25%,其他组分完全相同,其组成及营养水平见表 2。
|
|
表 2 试验饲料组成及营养水平(干物质基础) Table 2 Composition and nutrient levels of experimental diets (DM basis) |
试验用鱼购自连云港市赣榆区罗阳镇渔场。挑选规格整齐、体态健壮的草鱼幼鱼270尾,规格为(39.4±1.6) g/尾,随机分为3组,分别为玉米淀粉组、马铃薯淀粉组和小麦淀粉组,每组3个重复,每个重复30尾,养殖周期15周。试验期间,每天按照鱼体重2%~4%投喂至饱食,投喂时间分别为08:00、11:00、14:00、17:00;隔周交替使用二氧化氯和土霉素进行消毒杀菌。
1.3.3 不同淀粉源饲料对草鱼生长性能及肝胰脏中ACSL4基因表达的影响待饲养试验结束,在进食6 h后采用MS-222麻醉草鱼并逐条称重;每缸解剖6尾鱼,测量体长和内脏重;取其肝胰脏并提取总RNA进行反转录后用于肝胰脏中ACSL4基因定量表达研究。生长性能指标计算公式如下:

|
饲养试验结束后,将上述小麦淀粉组草鱼饥饿24 h后饱食投喂小麦淀粉组试验饲料,分别在投喂0、3、6、12和24 h后取3尾,每尾90 g左右,解剖取其肝胰脏并提取总RNA反转录后用于肝胰脏中ACSL4基因定量表达研究。
1.5 数据分析组织中ACSL4基因相对表达量采用2-△△Ct法计算。试验数据采用SPSS 25.0软件的单因素方差分析(one-way ANOVA)和LSD法多重比较进行统计学分析,P < 0.05表示差异显著。结果采用平均值±标准差表示,使用Origin 2018进行制图。
2 结果与分析 2.1 草鱼ACSL4基因全长cDNA分子特征草鱼ACSL4基因cDNA全长2 418 bp(GenBank登录号为MH822320),其中开放阅读框2 121 bp,共编码706个氨基酸;ACSL4属于亲水性蛋白,具有1个跨膜结构域,第7~29氨基酸位点是跨膜区;对其蛋白质二级结构预测发现,其由α螺旋(Hh)、延伸链(Ee)和无规则卷曲(Cc)组成,其中Hh占22.665%,Ee占28.33%,Cc占49.01%;无信号肽和糖基化位点。
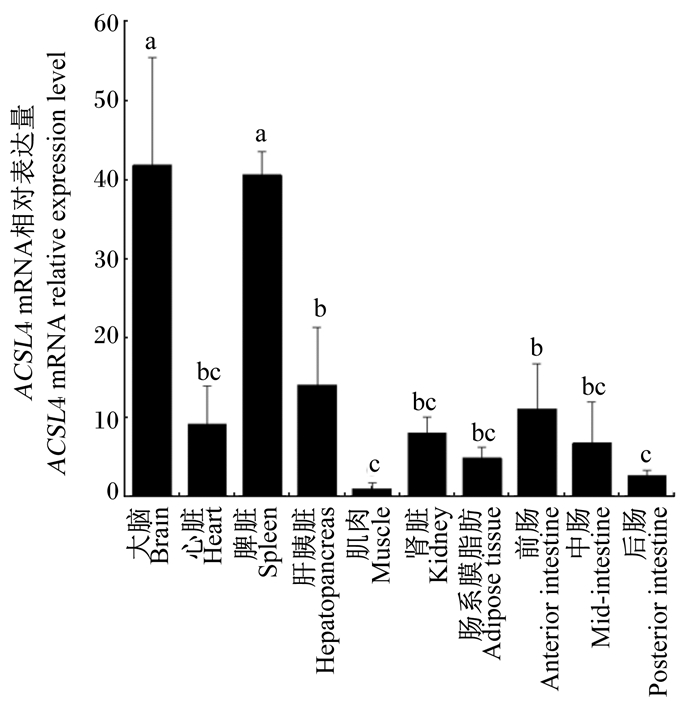
2.2 草鱼ACSL4基因的组织表达将反应模板分别以10-1稀释5种不同浓度,实时荧光定量PCR并制作内参基因标准曲线,根据内参基因筛选原则,选取扩增效率在99%~101%且表达稳定的草鱼eEF1A和RPL13A基因组合为内参基因,对草鱼ACSL4基因在大脑、心脏、脾脏、肝胰脏、肌肉、肾脏、肠系膜脂肪、前肠、中肠、后肠10种组织中的表达情况进行研究,结果见图 1。ACSL4 mRNA相对表达量在大脑和脾脏中较高,分别为41.85和40.63,显著高于其他组织(P < 0.05);其次是在肝胰脏和前肠中,分别为14.14和11.03;在肌肉中最低,仅为1.00。
|
数据柱上标注不同字母表示差异显著(P<0.05),无字母或相同字母表示差异不显著(P>0.05)。下图同。 Value columns with different letters mean significant difference (P < 0.05), while with no or the same letters mean no significant difference (P>0.05). The same as below. 图 1 草鱼ACSL4基因组织表达分析 Fig. 1 Expression analysis of ACSL4 gene in different tissues of grass carp |
由表 3可知,马铃薯淀粉组和小麦淀粉组的增重率分别为162.7%和158.3%,显著高于玉米淀粉组(P < 0.05);马铃薯淀粉组和小麦淀粉组的饲料系数分别为1.20和1.23,显著低于玉米淀粉组(P < 0.05);此外,马铃薯淀粉组和小麦淀粉组脏体比显著低于玉米淀粉组(P < 0.05);马铃薯淀粉组和小麦淀粉组之间各项生长指标均无显著差异(P>0.05)。
|
|
表 3 不同淀粉源饲料对草鱼生长性能的影响 Table 3 Effects of diets with different starch sources on growth performance of grass carp |
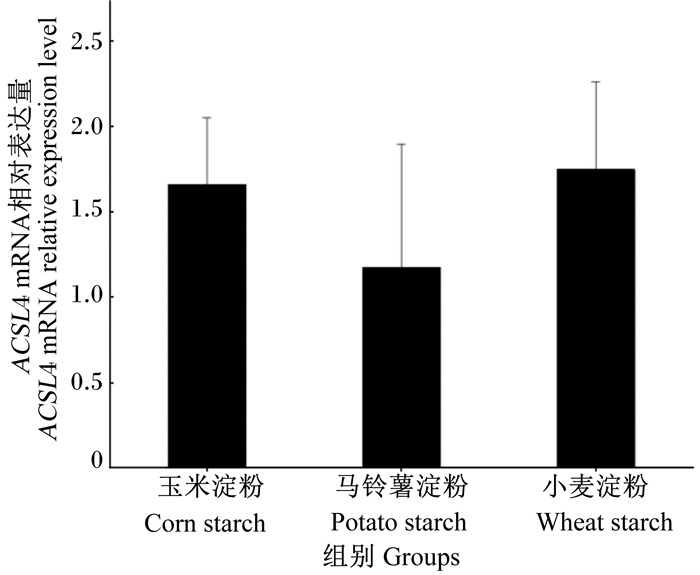
由图 2可知,投喂不同淀粉源饲料对草鱼肝胰脏中ACSL4 mRNA相对表达量无显著影响(P>0.05)。
|
图 2 投喂不同淀粉源饲料的草鱼肝胰脏ACSL4 mRNA相对表达量 Fig. 2 Relative expression level of ACSL4 mRNA in hepatopancreas of grass carp fed diets with different starch sources |
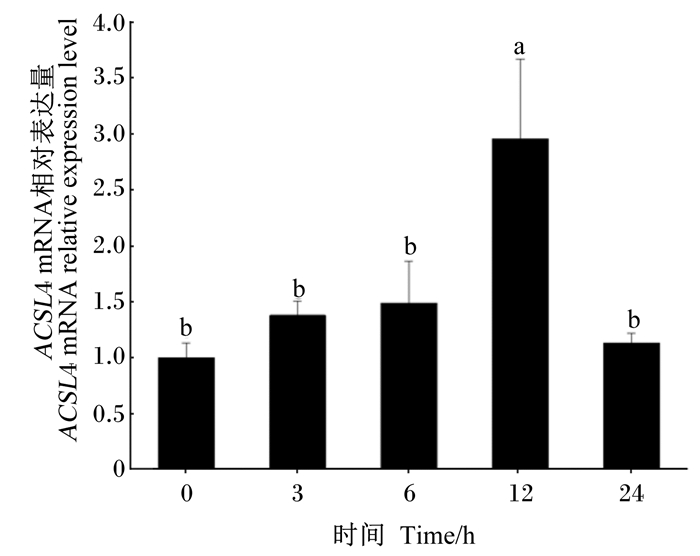
饥饿再投喂后,草鱼肝胰脏中ACSL4 mRNA相对表达量随投喂后时间的延长呈先升高再下降趋势,饥饿再投喂后12 h达到最高值,为2.87,显著高于其他时间段(P < 0.05),饥饿再投喂后24 h显著下降(P < 0.05),并恢复至最初水平(图 3)。
|
图 3 饥饿再投喂后草鱼肝胰脏中ACSL4 mRNA相对表达量 Fig. 3 Relative expression level of ACSL4 mRNA in hepatopancreas of grass carp after starvation and refeeding |
对草鱼ACSL4蛋白的氨基酸序列功能分析发现,草鱼ACSL4蛋白具有1个脂肪酸绑定基序(V201~Q236)和1个ATP/AMP绑定基序(V381~I418),这与其他物种[13]保持一致,说明这段序列在不同物种间高度保守;跨膜结构预测发现草鱼ACSL4蛋白具有1个跨膜结构域(V7~L29),与大鼠[7]和猪[14]等哺乳类结果一致;对草鱼ACSL4蛋白的氨基酸序列相似性分析发现,其氨基酸序列与其他脊椎动物具有较高相似性,与斑马鱼相似度为92%,其次是墨西哥丽脂鲤(Astyanax mexicanus),为86%,与人类(Homo sapiens)相似度为75%。
3.2 草鱼ACSL4基因的组织表达ACSL4在脂肪代谢中起重要作用,通过辅酶A催化长链脂肪酸产生长链脂酰辅酶A,从而参与到脂肪酸的合成和分解代谢过程,是脂肪代谢过程中的限速酶。研究表明,ACSL4优先使用花生四烯酸作为底物,在人类中,ACSL4基因主要表达于类固醇组织如胎盘、脑、卵巢、脾脏和肾上腺皮质中,而在人类肝脏以及肠胃系统中较低程度或直接不表达,在鹅中主要表达于大脑,在心脏和脂肪组织中少量表达[15]。本研究发现草鱼ACSL4基因主要表达在大脑和脾脏,其次是肝胰脏和前肠,在肌肉中表达量最低;在哺乳动物中,ACSL4是前列腺素和白三烯的前体物,可调控花生四烯酸向类二十烷酸的流出通路,并且ACSL4基因过表达可增加类二十烷酸辅酶A的合成并且促进花生四烯酸向脑磷脂、磷脂酰肌醇以及甘油三酯的转化[7, 16],而花生四烯酸对大脑的生理活动极其重要,较多的花生四烯酸需求决定了ACSL4在大脑中高表达;而在一些免疫器官,如脾脏、肾上腺等合成类固醇组织中,ACSL4基因的表达与类固醇激素和生长因子受体有关,沉默ACSL4基因可以抑制类固醇激素的合成[17-18],这充分说明ACSL4主要参与类固醇脂质的合成,ACSL4基因主要表达于合成类固醇的组织中,对于其他非合成类固醇的组织如肌肉、后肠等中,则表达量较低。
3.3 不同淀粉源饲料对草鱼生长性能的影响在饲料所有供能原料中,淀粉是最廉价的能量来源,适当的利用淀粉可以有效节约饲料成本。一般来讲,肉食性鱼类对淀粉的利用率较低,至多可以利用10%~20%,而草鱼是植食性鱼类,饲料中淀粉的含量可以达到56%。田丽霞等[19]研究发现,草鱼对小麦淀粉的表观消化率高于玉米淀粉,但在草鱼生长上二者并无显著差异。郭文英[20]在对西伯利亚鲟鱼的研究中发现,鲟鱼对α-淀粉的利用率大于小麦淀粉和玉米淀粉。叶元土等[21]认为由于直链淀粉的含量不同,鱼类对薯类淀粉的利用率高于谷类淀粉。本研究发现,马铃薯淀粉组和小麦淀粉组草鱼的饲料系数分别为1.20和1.23,显著低于玉米淀粉组的1.51,说明马铃薯淀粉和小麦淀粉有利于草鱼的消化吸收,而玉米淀粉不利于草鱼的消化吸收,分析原因,可能是由于玉米淀粉中直链淀粉含量较高,不利于水产颗粒饲料的黏接,可通过熟化后适当应用;而在消化吸收方面,目前饲料运用的玉米淀粉多为玉米角质层淀粉,不利于水产动物的消化和吸收,因此,玉米淀粉不适合作为水产饲料的淀粉源。
3.4 不同淀粉源饲料对草鱼肝胰脏中ACSL4基因表达的影响肝脏是鱼类进行糖代谢的重要器官,履行糖原的合成与分解功能,从而维持血糖的稳定,同时高糖饲料能够促进鱼体的脂肪生成[19, 22],淀粉经肠道消化吸收后直接为鱼体的生理活动提供能量,多余的糖类可转变成脂肪储存起来。Lin等[23]研究表明,脂肪酸合成酶(FAS)的活性受饲料中碳水化合物的正向调节,碳水化合物可能控制着整个肝脏中的脂肪合成过程;冯姣[24]和夏晓杰[25]在对齐口裂腹鱼的饲料中添加氧化魔芋葡甘露聚糖(OKGM)和RS4型抗性淀粉(RS)的研究中发现,添加1.6%OKGM能提高肝胰脏中脂蛋白脂肪酶(LPL)、过氧化物酶体增殖物激活受体α(PPARα)基因的相对表达量。在本研究中,对ACSL4基因在饲喂不同淀粉源饲料的草鱼肝胰脏中的表达情况进行分析后发现,ACSL4 mRNA相对表达量没有显著变化,这说明ACSL4基因在肝胰脏中是稳定表达的,并不受外源性淀粉源的影响;或者可能由于ACSL4对底物选择中更多的偏好于多不饱和脂肪酸,而本试验中饲料不同的淀粉源对脂肪的生物合成的影响并没有达到显著差异,为进一步探究不同淀粉源对草鱼脂肪代谢相关基因的影响,可对mRNA表达谱进行深度分析以了解整个脂肪代谢的通路情况。
3.5 饥饿再投喂对草鱼肝胰脏中ACSL4基因表达的影响鱼类在饥饿胁迫下会通过降低代谢水平和调节自身能量并通过分解体内储存的脂肪和糖原来维持机体基础代谢。田娟等[26]报道,在饥饿胁迫下,罗非鱼肝脏LPL mRNA相对表达量显著增强,并在重投喂后LPL mRNA相对表达量显著下降。同样的,覃川杰等[27]在黄颡鱼的饥饿再投喂试验中发现,随着饥饿时间的延长,肝脏中LPL mRNA相对表达量显著上升,而脂肪酸结合蛋白(FAPB)及FAS mRNA相对表达量则显著下降,这说明饥饿胁迫下肝脏可能通过分解脂肪供能,同时降低脂肪的生物合成;严媛等[12]在对草鱼的研究中发现,饥饿再投喂12 h后,草鱼肝胰脏中乙酰辅酶A羧化酶2(ACC2)mRNA相对表达量达到最高,24 h后显著下降。本研究中,草鱼饥饿再投喂12 h后,肝胰脏中ACSL4 mRNA相对表达量显著升高,24 h后显著下降至最初水平,与草鱼肝胰脏中ACC2基因的表达规律相同,说明再投喂12 h后ACSL4开始参与脂肪分解供能,而在饥饿再投喂0~6 h内肝胰脏中ACSL4 mRNA相对表达量并无显著差异,说明此期间鱼体内主要进行的是脂肪的生物合成。
4 结论本试验从草鱼10种混合组织中克隆了ACSL4基因全长cDNA,其编码的氨基酸序列主要功能性位点脂肪酸绑定基序和ATP/AMP绑定基序在不同物种间高度保守;草鱼ACSL4基因主要在大脑和脾脏中表达;草鱼对马铃薯淀粉和小麦淀粉的利用效果优于玉米淀粉;饲料淀粉源对草鱼肝胰脏中ACSL4基因的表达无显著影响;在饥饿再投喂12 h后,草鱼肝胰脏中ACSL4 mRNA相对表达量达到最高,随后显著下降至最初水平。
| [1] |
PICCINI M, VITELLI F, BRUTTINI M, et al. FACL4, a new gene encoding long-chain acyl-CoA synthetase 4, is deleted in a family with Alport syndrome, elliptocytosis, and mental retardation[J]. Genomics, 1998, 47(3): 350-358. DOI:10.1006/geno.1997.5104 |
| [2] |
WATKINS P A, MAIGUEL D, JIA Z Z, et al. Evidence for 26 distinct acyl-coenzyme a synthetase genes in the human genome[J]. Journal of Lipid Research, 2007, 48(12): 2736-2750. DOI:10.1194/jlr.M700378-JLR200 |
| [3] |
SOUPENE E, KUYPERS F A. Mammalian long-chain acyl-CoA synthetases[J]. Experimental Biology and Medicine, 2008, 233(5): 507-521. DOI:10.3181/0710-MR-287 |
| [4] |
于莉莉, 谭小力, 侯文胜. 大豆长链脂酰辅酶A合成酶基因GmLACS在酵母中的表达[J]. 大豆科学, 2011, 30(5): 719-722. |
| [5] |
WU M H, LIU H Y, CHEN W, et al. Hepatic expression of long-chain acyl-CoA synthetase 3 is upregulated in hyperlipidemic hamsters[J]. Lipids, 2009, 44(11): 989-998. DOI:10.1007/s11745-009-3341-3 |
| [6] |
LOPES-MARQUES M, CUNHA I, REIS-HENRIQUES M A, et al. Diversity and history of the long-chain acyl-CoA synthetase (Acsl) gene family in vertebrates[J]. BMC Evolutionary Biology, 2013, 13: 271. DOI:10.1186/1471-2148-13-271 |
| [7] |
KANG M J, FUJINO T, SASANO H, et al. A novel arachidonate-preferring acyl-CoA synthetase is present in steroidogenic cells of the rat adrenal, ovary, and testis[J]. Proceedings of the National Academy of Sciences of the United States of America, 1997, 94(7): 2880-2884. DOI:10.1073/pnas.94.7.2880 |
| [8] |
LEWIN T M, VAN HORN C G, KRISANS S K, et al. Rat liver acyl-CoA synthetase 4 is a peripheral-membrane protein located in two distinct subcellular organelles, peroxisomes, and mitochondrial-associated membrane[J]. Archives of Biochemistry and Biophysics, 2002, 404(2): 263-270. DOI:10.1016/S0003-9861(02)00247-3 |
| [9] |
KOTRONEN A, YKI-JÄRVINEN H, AMINOFF A, et al. Genetic variation in the ADIPOR2 gene is associated with liver fat content and its surrogate markers in three independent cohorts[J]. European Journal of Endocrinology, 2009, 160(4): 593-602. DOI:10.1530/EJE-08-0900 |
| [10] |
QUINLIVAN V H, FARBER S A. Lipid uptake, metabolism, and transport in the larval zebrafish[J]. Frontiers in Endocrinology, 2017, 8: 319. DOI:10.3389/fendo.2017.00319 |
| [11] |
CHENG H L, CHEN S, XU J H, et al. Molecular cloning and nutrient regulation analysis of long chain acyl-CoA synthetase 1 gene in grass carp, Ctenopharyngodon idella L[J]. Comparative Biochemistry and Physiology Part B:Biochemistry and Molecular Biology, 2017, 204: 61-68. DOI:10.1016/j.cbpb.2016.11.007 |
| [12] |
严媛, 程汉良, 许建和, 等. 草鱼乙酰辅酶A羧化酶β基因全长cDNA分子克隆与表达分析[J]. 动物营养学报, 2018, 30(5): 1827-1836. DOI:10.3969/j.issn.1006-267x.2018.05.025 |
| [13] |
WEIMAR J D, DIRUSSO C C, DELIO R, et al. Functional role of fatty acyl-coenzyme A synthetase in the transmembrane movement and activation of exogenous long-chain fatty acids.Amino acid residues within the ATP/AMP signature motif of Escherichia coli FadD are required for enzyme activity and fatty acid transport[J]. The Journal of Biological Chemistry, 2002, 277(33): 29369-29376. DOI:10.1074/jbc.M107022200 |
| [14] |
郭丽娟.野猪、家猪ACSL4基因的克隆、表达及多态性研究[D].硕士学位论文.哈尔滨: 东北农业大学, 2008. http://cdmd.cnki.com.cn/article/cdmd-10224-2008145169.htm
|
| [15] |
王继文, 潘志雄, 吕佳, 等. 鹅ACSL4基因克隆及其与肝脂质沉积的关系研究[J]. 中国畜牧杂志, 2012, 48(5): 6-10. DOI:10.3969/j.issn.0258-7033.2012.05.002 |
| [16] |
GOLEJ D L, ASKARI B, KRAMER F, et al. Long-chain acyl-CoA synthetase 4 modulates prostaglandin E2 release from human arterial smooth muscle cells[J]. Journal of Lipid Research, 2011, 52(4): 782-793. DOI:10.1194/jlr.M013292 |
| [17] |
WU X Y, LI Y R, WANG J H, et al. Long chain fatty acyl-CoA synthetase 4 is a biomarker for and mediator of hormone resistance in human breast cancer[J]. PLoS One, 2013, 8(10): e77060. |
| [18] |
MALOBERTI P, CASTILLA R, CASTILLO F, et al. Silencing the expression of mitochondrial acyl-CoA thioesterase Ⅰ and acyl-CoA synthetase 4 inhibits hormone-induced steroidogenesis[J]. The FEBS Journal, 2005, 272(7): 1804-1814. |
| [19] |
田丽霞, 刘永坚, 冯健, 等. 不同种类淀粉对草鱼生长、肠系膜脂肪沉积和鱼体组成的影响[J]. 水产学报, 2002, 26(3): 247-251. |
| [20] |
郭文英.α-淀粉水平及不同淀粉类型对西伯利亚鲟幼鱼摄食生长和能量收支的影响[D].硕士学位论文.石家庄: 河北师范大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10094-2010161746.htm
|
| [21] |
叶元土, 蔡春芳. 鱼类营养与饲料配制[M]. 北京: 化学工业出版社, 2013: 117-118.
|
| [22] |
张宝龙.饲料中不同水平蛋白、糖、脂肪对鲤鱼生长及相关代谢调控的影响[D].硕士学位论文.天津: 天津农学院, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10061-1017079322.htm
|
| [23] |
LIN J H, CUI Y B, HUNG S S O, et al. Effect of feeding strategy and carbohydrate source on carbohydrate utilization by white sturgeon (Acipenser transmontanus) and hybrid tilapia (Oreochromis niloticus×O.aureus)[J]. Aquaculture, 1997, 148(2/3): 201-211. |
| [24] |
冯姣.抗性淀粉与OKGM降解产物对齐口裂腹鱼营养成分及脂质代谢相关基因表达的影响[D].硕士学位论文.雅安: 四川农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10626-1016049122.htm
|
| [25] |
夏晓杰.多糖对齐口裂腹鱼肌肉品质、脂质代谢及HSP70基因表达的影响[D].硕士学位论文.雅安: 四川农业大学, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10626-1016049128.htm
|
| [26] |
田娟, 涂玮, 曾令兵, 等. 饥饿和再投喂期间尼罗罗非鱼生长、血清生化指标和肝胰脏生长激素、类胰岛素生长因子-Ⅰ和胰岛素mRNA表达丰度的变化[J]. 水产学报, 2012, 36(6): 900-907. |
| [27] |
覃川杰, 邵婷, 杨洁萍, 等. 饥饿胁迫对瓦氏黄颡鱼脂肪代谢的影响[J]. 水生生物学报, 2015, 39(1): 58-65. |




