2. 海南大学动物科技学院, 海口 570228
2. College of Animal Science and Technology, Hainan University, Haikou 570228, China
动物的产奶量高低和乳品质优劣与乳腺的健康状况密切相关[1]。乳腺组织作为动物体内新陈代谢最为旺盛的功能部位,在泌乳期间需氧代谢活动明显加剧,存在生成过量自由基的风险,如活性氧(ROS)、过氧化氢(H2O2)、一氧化氮(NO)以及花生四烯酸(ARA)等生成过量。对高产奶牛而言,围产后期和泌乳前期尤为明显。在正常生理状态下,机体自由基的生成与清除速率维持动态平衡。当自由基生成速率大于清除速率时,则自由基大量累积并与细胞DNA、蛋白质、类脂膜等发生氧化反应[2-3],会降低奶牛乳腺上皮细胞(BMEC)的抗氧化机能、免疫功能及炎症应答能力,增强奶牛对疾病的易感性,进而影响泌乳功能,最终导致产奶量和乳品质下降[4]。乳腺氧化应激水平的进程性提高会使乳腺免疫功能发生障碍,进而导致乳房炎发病率和严重程度提高[5]。因此,减缓乳腺细胞氧化应激、保持细胞氧化还原平衡,对维持动物健康及高产具有重要意义[6]。研究表明,维生素A可以有效调控ARA及NO的生成,具有提高机体抗氧化和清除自由基的能力,防御细胞炎症及氧化应激的发生。本文主要综述了维生素A对动物抗氧化功能的调节作用及其机制的研究进展,对深入开展维生素A调节机制的研究、科学补充维生素A及增强动物的抗氧化功能具有重要的理论与实际意义。
1 维生素A对氧化应激的减缓作用抗氧化指标超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化物酶(GPx)和硫氧还蛋白还原酶(TrxR)的活性与总抗氧化能力(T-AOC)等以及脂质过氧化产物丙二醛(MDA)的含量是反映机体抗氧化水平的重要指标。本课题组的前期试验结果显示,维生素A具有提高抗氧化功能、减缓氧化应激的作用,可增强奶牛血清中SOD和GPx的活性并降低MDA的含量[7];另有报道指出,在NRC(2001)推荐量的基础上提高维生素A水平到220 IU/kg BW,可以显著提高奶牛的抗氧化功能[7]。LeBlanc等[8]的研究显示,血清视黄醇含量每增加100 ng/mL,临床性乳腺炎风险相对降低60%。利用体外法的研究也发现,维生素A可以减缓因H2O2、NO和脂多糖(LPS)诱导引起的BMEC氧化应激损伤[9-11],以肉牛、大鼠、羊为试验动物的研究也得出了类似的试验结果[12-14]。因此,维生素A能够减缓奶牛等动物氧化应激的发生,提高机体的抗氧化能力,但其确切机制尚不十分清楚。
2 维生素A减缓动物乳腺氧化应激的作用机制 2.1 提高硒蛋白的表达和活性硒蛋白富含硒代半胱氨酸(Sec)结构,且大多数具有抗氧化功能[15],可以作为反映机体抗氧化能力的重要指标。GPx、TrxR、硒蛋白P、硒蛋白W及脱碘酶等是对其功能研究比较清楚的硒蛋白[16]。GPx是最早发现的一种硒蛋白,其中GPx1是哺乳动物体内含量最为丰富的硒蛋白亚型[17-18],是脂类氢过氧化物的清除剂,并可在CAT活性或产量很低的组织中代替CAT清除H2O2,进而保护DNA、脂质和蛋白质免受氧化损伤[19]。通过过表达GPx1,可以保护细胞免受由H2O2、脂质过氧化物、氧化还原药物等引发的细胞凋亡,进一步佐证了GPx1的抗氧化功能[20]。TrxR是一种二聚体硒蛋白,通过尼克酰胺腺嘌呤二核苷酸磷酸(NADPH)还原氧化型的硫氧还蛋白(Trx)及其类似物来减少氧化还原反应的过度发生[21]。大量研究结果表明,添加维生素A可以提高GPx1和TrxR1基因与蛋白的表达[7, 22-23];另外,以大鼠和人乳腺癌细胞MCF-7为研究对象的试验结果均得出了相似的结果[24-26]。
2.2 调节ARA的过量生成ARA是一种n-6系列多不饱和脂肪酸,属于类花生酸类物质的前体,主要以磷脂形式存在于细胞膜中。通常情况下ARA以酯化形式存在于机体胞膜磷脂sn-2位上,多数没有生理活性,小部分ARA存在于胞质和体液中且具有正常的生理活性[27],决定着细胞膜的一些重要生理活性。当细胞受到各种炎症介质,如LPS、肿瘤坏死因子(TNF)、白细胞介素-1(IL-1)和NO刺激时,细胞受磷脂酶A2(PLA2)的催化释放出大量ARA[28]。过多的ARA会诱导ROS的大量产生,诱发氧化应激,损害细胞正常形态和生理功能[29]。已知一定浓度的ARA是细胞正常生理功能必不可少的,但过量的ARA则会产生毒性作用。机体存在有效的调节机制保持细胞内适宜浓度的ARA,这是细胞执行正常生理功能的必要前提。维生素A有3种活性形式,即视黄醇、视黄酸和视黄醛。据报道,视黄酸可以抑制人关节滑液和大鼠腹膜巨噬细胞中由Ca2+激活的PLA2活性和ARA浓度的过度升高[30]。维生素A对H2O2诱导的BMEC中ARA的大量释放具有抑制作用,削弱ARA及其代谢产物对细胞膜结构和功能造成的损伤,提高细胞的抗氧化能力[9]。
2.2.1 通过提高TrxR活性调节ARA的释放Kurosawa等[27]研究发现TrxR对细胞中胞浆型PLA2(cPLA2)的活性有抑制作用,可以降低ARA的释放,进而减少其对细胞的毒性作用。Bruzelius等[28]研究发现,维生素A可能是通过TrxR调节cPLA2的生物活性,维持细胞内ARA浓度的平衡状态,进而保障乳腺细胞内抗氧化机能的稳态。本课题组在BMEC中的研究发现,ARA的浓度增加会抑制TrxR活性,添加维生素A可以抑制ARA在BMEC中的蓄积,且TrxR的活性也呈相反的变化[9];因此,维生素A可能是通过提高TrxR的活性来减弱ARA对细胞造成的损伤,从而发挥其抗氧化作用,这在金鹿[31]进行的拮抗TrxR的研究中得到了佐证。
2.2.2 通过丝裂原活化蛋白激酶(MAPK)信号通路调节ARA的释放P38 MAPK、c-Jun氨基末端激酶(JNK)和胞外信号调节激酶(ERK)1/2是构成MAPK信号通路的3个重要组成部分。MAPK的3个主要成员可分别被上游位点相应的丝裂原活化蛋白激酶激酶(MEKs或MAP2K)活化,而MEKs又可被其上游激酶丝裂原活化蛋白激酶激酶激酶(MAP3K)活化,其中,细胞凋亡信号激酶-1(ASK-1)是MAP3K家族的重要成员,Trx可以结合在ASK-1的N端区域,抑制其活性,TrxR活性降低促进Trx转变为氧化形式,ASK-1被激活,从而激活MAPK信号通路中的JNK和p38 MAPK[29]。此外,ROS、LPS、细胞因子等刺激原也可激活MAPK信号通路[32]。MAPK被磷酸化后,会增强cPLA2的活性,导致ARA的大量合成和释放[33]。Jin等[9]以BMEC为对象的研究发现,添加维生素A显著提高TrxR的活性,同时降低p38 MAPK和JNK的磷酸化水平以及ARA的浓度,即维生素A通过增强TrxR的活性抑制了ASK-1的活性,进而抑制MAPK信号通路的激活,最终减少ARA的释放,缓解氧化应激水平。
2.3 调节NO的过量生成NO是一种自由基性质的气体分子。研究证实,细胞内左旋-精氨酸可受一氧化氮合酶(NOS)的催化,与氧分子经过多步氧化还原反应,不断生成低浓度的内源性NO分子[34]。NO具有双重量效作用。低浓度的NO具有杀菌作用,可抑制病毒、真菌、细菌、原生动物、蠕虫、肿瘤细胞的增殖[35],并能够加快血液循环。但高浓度的NO会损伤机体的健康细胞,使组织发生氧化应激[36]。当细胞受到炎症因子或LPS等诱导时,诱导型一氧化氮合酶(iNOS)被激活,导致NO过量生成,致使组织损伤,加剧炎症程度[37]。同时,NO本身易与氧自由基发生反应,生成过氧化亚硝基阴离子(ONOO-),即毒性更强的强氧化剂,进而介导细胞毒性反应。因此,NO浓度过高对氧自由基的损伤效应和炎症反应以及组织损伤程度起放大作用,加剧了机体的氧化应激水平[38],是引起氧化应激的重要因素之一。
2.3.1 抑制IL-1介导的NO生成有关NO的生成受维生素A的调节作用主要集中在人和小鼠的研究领域。Hung等[39]的研究表明,IL-1可以诱导人软骨细胞产生iNOS、环氧酶-2(COX-2)和细胞因子,iNOS被激活进而产生大量的NO;但视黄酸可以下调iNOS基因的表达,减少NO的过量生成。Ertesvag等[40]的研究发现,视黄酸能够下调小鼠体内T细胞白细胞介素-2(IL-2)基因的表达量,进而减少NO的过量生成。添加维生素A有效地下调了BMEC中iNOS基因与蛋白的表达,缓解了NO诱导的细胞氧化损伤,并且其减缓作用呈剂量依赖效应[10, 41]。石惠宇[42]通过添加IL-1受体拮抗剂IL-1ra抑制IL-1的生物活性,探究了维生素A减缓LPS诱导的BMEC氧化损伤是否是由于维生素A降低了IL-1的生成实现的,结果发现,添加维生素A或者IL-1ra均能发挥保护细胞免受LPS氧化损伤的功能,说明IL-1诱发的NO过量生成是造成细胞氧化应激损伤的重要因素。维生素A通过提高视黄酸受体(RARα)的蛋白表达量抑制了核转录因子-κB(NF-κB)信号通路的磷酸化程度,降低了白细胞介素-1β(IL-1β)和iNOS基因与蛋白的表达和NO的浓度,发挥其减缓氧化应激的功能,即维生素A抑制了IL-1介导的NO生成,减缓了细胞的氧化应激。
2.3.2 通过核因子E2相关因子2(Nrf2)/GPx1/NF-κB途径减缓细胞的氧化损伤Nrf2属于CNC亮氨酸拉链转录激活因子家族(CNC-bZIP),在各种细胞内均有表达[43]。Nrf2能够与DNA目的基因的抗氧化反应原件(ARE)序列相结合,启动Ⅱ型解毒酶基因的表达,包括CAT、SOD、GPx、氧合酶(HO-1)等[44],加快超氧化物和过氧化物的分解与代谢,减缓ROS和活性氮(RNS)造成的氧化损伤,维持细胞内稳态,即调控机体抗氧化系统的Nrf2信号通路一旦被激活,作为其下游靶向基因的GPx等抗氧化酶的基因表达显著加强[45]。越来越多的研究证明,维生素A可以增强GPx的活性,提高抗氧化能力,抑制NF-κB炎症信号通路的活化[46]。NF-κB在正常细胞中主要以二聚体与其抑制蛋白(IκB)相结合的形式存在,且游离于胞浆中无任何活性。当细胞受到外源刺激时,IκB随即发生磷酸化反应,从而与其二聚体解离即活化,移位于细胞核内的DNA启动区,促进胞内iNOS基因的转录与表达[47],从而促进NO的合成。以人乳腺癌细胞系和小鼠为模型的研究指出,GPx1对NF-κB上游的抑制蛋白κB激酶(IKK)以及下游的NF-κB p65磷酸化有抑制作用[48-49]。研究也发现,GPx过量可以下调人乳腺癌细胞MCF-7中NF-κB的DNA结合活性及其下游基因的转录活性[48]。也有研究发现,沉默了GPx1的原代小鼠大动脉上皮细胞中,加剧了IκB的磷酸化水平,激活了NF-κB的活性[19]。另有研究结果表明,添加维生素A可以通过激活Nrf2,启动下游包括GPx1在内的抗氧化酶基因的表达[50]。Shi等[41]在BMEC中的研究发现,维生素A可以激活Nrf2信号通路,上调硒蛋白GPx1的活性及其基因与蛋白的表达,最终减少NO的生成。用LPS处理大鼠乳腺上皮细胞后,iNOS mRNA表达量显著增强,Toll样受体4(TLR4)的蛋白表达量以及NF-κB与DNA的结合活性显著上调;但添加视黄醇后上述指标呈相反的变化趋势,即添加LPS加剧原代大鼠乳腺上皮细胞炎性相关因子基因的表达主要是由于激活了TLR4/NF-κB炎症信号通路,而添加视黄醇能逆转上述变化,反馈性地下调TLR4蛋白的表达,抑制相关炎性因子的过量表达[51]。这些研究提示,维生素A可能通过Nrf2提高GPx的活性,发挥抑制NF-κB信号通路、降低NO过量生成的作用,以减缓氧化应激,针对BMEC也有相似的研究报道[11]。石惠宇[42]通过沉默和过表达GPx1,从Nrf2-GPx-NF-κB-NO途径诠释了维生素A的抗氧化防御机制,GPx1沉默后,添加维生素A对减缓LPS诱导的BMEC氧化损伤的作用显著减弱,而GPx1过表达处理后的BMEC,添加维生素A对LPS诱导的BMEC氧化损伤有显著的增强效果。因此,维生素A主要是通过激活Nrf2信号通路的磷酸化水平增强下游GPx的活性,抵御NF-κB信号通路的磷酸化,从而减少IL-1β的生成,降低iNOS基因的表达,减少NO的释放,最终保护细胞免受氧化应激。
综上,本文主要从NO、ARA释放及其信号通路MAPK、Nrf2及NF-κB方面综述了维生素A对动物细胞氧化应激的减缓作用机制,总结归纳后如图 1所示。
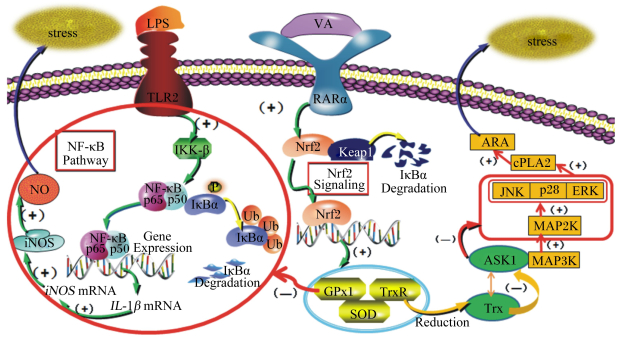
|
LPS:脂多糖lipopolysaccharide;TLR2:Toll样受体2 Toll-like receptor 2;IKK-β:IκB激酶-β IκB kinase-β;NF-κB p65:核转录因子-κB p65 nuclear transcription factor-kappa B p65;IκBα:κB抑制蛋白-α kappa B inhibitor protein-α;IκBs Degradation:κB抑制蛋白降解kappa B inhibitor protein degradation;Gene Expression:基因表达;IL-1β mRNA:白介素-1β信使RNA interleukin-1β messenger RNA;iNOS mRNA:诱导型一氧化氮合酶信使RNA inducible nitric oxide synthase messenger RNA;iNOS:诱导型一氧化氮合酶inducible nitric oxide synthase;NO:一氧化氮nitric oxide;NF-κB Pathway:核转录因子-κB通路nuclear transcription factor-kappa B pathway;stress:应激;VA:维生素A vitamin A;RARα:视黄酸受体α retinoic acid receptor α;Nrf2:核因子E2相关因子nuclear factor E2 related factor;Keap1:Kelch样结合蛋白1 Kelch-like epichlorohydrin-associated protein 1;Nrf2 Signaling:核因子E2相关因子信号nuclear factor E2 related factor signaling;Keap1 Degradation:Kelch样结合蛋白1降解Kelch-like epichlorohydrin-associated protein 1 degradation;GPx1:谷胱甘肽过氧化物酶1 glutathione peroxidase 1;TrxR:硫氧还蛋白还原酶thioredoxin reductase;SOD:超氧化物歧化酶superoxide dismutase;reduction:减少;Trx:硫氧还蛋白thioredoxin;ASK1:细胞凋亡信号激酶-1 apoptosis signaling kinase-1;MAP3K:丝裂原激活蛋白激酶激酶激酶mitogen-activated protein kinase kinase kinase;MAP2K:丝裂原激活蛋白激酶激酶mitogen-activated protein kinase kinase;JNK:c-Jun氨基末端激酶c-Jun N-terminal kinase;p38:p38丝裂原激活蛋白激酶p38 mitogen-activated protein kinase;ERK:胞外信号调节激酶extracellular signal-regulated kinase;cPLA2:胞浆型磷脂酶A2 cytosolic phospholipase A2;ARA:花生四烯酸arachidonic acid。 图 1 维生素A通过减少ARA和NO生成缓解细胞氧化应激的调控机制 Fig. 1 Regulation mechanism of vitamin A alleviating oxidative stress of cells by reducing ARA and NO production |
维生素A主要通过TrxR和MAPK途径减少ARA的过量生成,通过IL-1和Nrf2/GPx1/NF-κB途径对NO的过量生成进行调节,进而减缓动物细胞的氧化应激。维生素A对动物氧化应激的调节机制非常复杂,仍然需要进一步研究。
| [1] |
崔祥, 刁其玉, 屠焰, 等. 奶用后备牛不同生理阶段乳腺发育特点及营养调控作用[J]. 中国奶牛, 2014(3/4): 5-9. |
| [2] |
RYMAN V E, PACKIRISWAMY N, SORDILLO L M. Role of endothelial cells in bovine mammary gland health and disease[J]. Animal Health Research Reviews, 2015, 16(2): 135-149. DOI:10.1017/S1466252315000158 |
| [3] |
FANG Y Z, YANG S, WU G Y. Free radicals, antioxidants, and nutrition[J]. Nutrition, 2002, 18(10): 872-879. DOI:10.1016/S0899-9007(02)00916-4 |
| [4] |
JOZWIK A, KRZYZEWSKI J, STRZALKOWSKA N, et al. Relations between the oxidative status, mastitis, milk quality and disorders of reproductive functions in dairy cows-a review[J]. Animal Science Papers and Reports, 2012, 30(4): 297-307. |
| [5] |
SORDILLO L M. Selenium-dependent regulation of oxidative stress and immunity in periparturient dairy cattle[J]. Veterinary Medicine International, 2013, 2013: 154045. |
| [6] |
MILLER J K, BRZEZINSKA-SLEBODZINSKA E, MADSEN F C. Oxidative stress, antioxidants, and animal function[J]. Journal of Dairy Science, 1993, 76(9): 2812-2823. DOI:10.3168/jds.S0022-0302(93)77620-1 |
| [7] |
JIN L, YAN S M, SHI B L, et al. Effects of vitamin A on the milk performance, antioxidant functions and immune functions of dairy cows[J]. Animal Feed Science and Technology, 2014, 192: 15-23. DOI:10.1016/j.anifeedsci.2014.03.003 |
| [8] |
LEBLANC S J, HERDT T H, SEYMOUR W M, et al. Peripartum serum vitamin E, retinol, and beta-carotene in dairy cattle and their associations with disease[J]. Journal of Dairy Science, 2004, 87(3): 609-619. DOI:10.3168/jds.S0022-0302(04)73203-8 |
| [9] |
JIN L, YAN S M, SHI B L, et al. Retinoic acid attenuates oxidative injury in bovine mammary epithelial cells induced by hydrogen peroxide[J]. Czech Journal of Animal Science, 2017, 62(12): 539-548. DOI:10.17221/CJAS |
| [10] |
SHI H, YAN S, JIN L, et al. Vitamin A affects the expression of antioxidant genes in bovine mammary epithelial cells with oxidative stress induced by diethylene triamine-nitric oxide polymer[J]. Czech Journal of Animal Science, 2016, 61(3): 117-126. DOI:10.17221/CJAS |
| [11] |
SHI H Y, YAN S M, GUO Y M, et al. The pre-protective effect of vitamin A on LPS-induced oxidative stress of bovine mammary epithelial cells[J]. Italian Journal of Animal Science, 2018, 17(4): 959-966. DOI:10.1080/1828051X.2018.1453757 |
| [12] |
马向明, 杨在宾, 杨维仁, 等. 不同水平维生素A对肉牛机体抗氧化能力的影响[J]. 畜牧兽医杂志, 2005, 24(5): 4-9. |
| [13] |
韩磊, 马爱国, 张燕. 维生素A干预对大鼠抗氧化能力及细胞膜流动性影响的研究[J]. 卫生研究, 2004, 33(4): 450-452. DOI:10.3969/j.issn.1000-8020.2004.04.019 |
| [14] |
王平.维生素A对不同生理阶段济宁青山羊生产性能和血液指标影响的研究[D].硕士学位论文.泰安: 山东农业大学, 2011.
|
| [15] |
刘琼, 姜亮, 田静, 等. 硒蛋白的分子生物学及与疾病的关系[J]. 化学进展, 2009, 21(5): 819-830. |
| [16] |
高建忠, 黄克和. 动物硒蛋白研究进展[J]. 畜牧与兽医, 2004, 36(7): 39-42. DOI:10.3969/j.issn.0529-5130.2004.07.022 |
| [17] |
BRIGELIUS-FlOHÈ R. Glutathione peroxidases and redox-regulated transcription factors[J]. Biological Chemistry, 2006, 387(10/11): 1329-1335. |
| [18] |
LU J, HOLMGREN A. Selenoproteins[J]. The Journal of Biological Chemistry, 2009, 284(2): 723-727. DOI:10.1074/jbc.R800045200 |
| [19] |
SHARMA A, YUEN D, HUET O, et al. Lack of glutathione peroxidase-1 facilitates a pro-inflammatory and activated vascular endothelium[J]. Vascular Pharmacology, 2016, 79: 32-42. DOI:10.1016/j.vph.2015.11.001 |
| [20] |
ARTHUR J R, BECKETT G J, MITCHELL J H. The interactions between selenium and iodine deficiencies in man and animals[J]. Nutrition Research Reviews, 1999, 12(1): 55-73. DOI:10.1079/095442299108728910 |
| [21] |
HAWKES W C, ALKAN Z. Regulation of redox signaling by selenoproteins[J]. Biological Trace Element Research, 2010, 134(3): 235-251. DOI:10.1007/s12011-010-8656-7 |
| [22] |
BRUZELIUS K, SUNDLER R, PAGMANTIDIS V, et al. Regulation of selenoprotein mRNA expression by hormones and retinoic acid in bovine mammary cells[J]. Journal of Trace Elements in Medicine and Biology, 2010, 24(4): 251-256. DOI:10.1016/j.jtemb.2010.08.001 |
| [23] |
JIN L, YAN S, SHI B, et al. Effects of retinoic acid on the synthesis of selenoprotein and the antioxidative indices of bovine mammary epithelial cells in vitro[J]. Czech Journal of Animal Science, 2016, 61(4): 194-202. DOI:10.17221/CJAS |
| [24] |
KHAFAGA A F, EL-SAYED Y S. All-trans-retinoic acid ameliorates doxorubicin-induced cardiotoxicity:in vivo potential involvement of oxidative stress, inflammation, and apoptosis via caspase-3 and p53 down-expression[J]. Naunyn-Schmiedeberg's Archives of Pharmacology, 2018, 391(1): 59-70. DOI:10.1007/s00210-017-1437-5 |
| [25] |
SILVIS A M, MCCORMICK M L, SPITZ D R, et al. Redox balance influences differentiation status of neuroblastoma in the presence of all-trans retinoic acid[J]. Redox Biology, 2016, 7: 88-96. DOI:10.1016/j.redox.2015.11.012 |
| [26] |
CHU F F, ESWORTHY R S, LEE L, et al. Retinoic acid induces Gpx2 gene expression in MCF-7 human breast cancer cells[J]. The Journal of Nutrition, 1999, 129(10): 1846-1854. DOI:10.1093/jn/129.10.1846 |
| [27] |
KUROSAWA T, NAKAMURA H, YAMAURA E, et al. Cytotoxicity induced by inhibition of thioredoxin reductases via multiple signaling pathways:role of cytosolic phospholipase A2α-dependent and-independent release of arachidonic acid[J]. Journal of Cellular Physiology, 2009, 219(3): 606-616. DOI:10.1002/jcp.v219:3 |
| [28] |
BRUZELIUS K, PURUP S, JAMES P, et al. Biosynthesis of selenoproteins in cultured bovine mammary cells[J]. Journal of Trace Elements in Medicine and Biology, 2008, 22(3): 224-233. DOI:10.1016/j.jtemb.2008.03.009 |
| [29] |
LIU Y M, MIN W. Thioredoxin promotes ASK1 ubiquitination and degradation to inhibit ASK1-mediated apoptosis in a redox activity-independent manner[J]. Circulation Research, 2002, 90(12): 1259-1266. DOI:10.1161/01.RES.0000022160.64355.62 |
| [30] |
HOPE W C, PATEL B J, FIEDLER-NAGY C, et al. Retinoids inhibit phospholipase A2 in human synovial fluid and arachidonic acid release from rat peritoneal macrophages[J]. Inflammation, 1990, 14(5): 543-559. DOI:10.1007/BF00914275 |
| [31] |
金鹿.维生素A对奶牛乳腺硒蛋白合成及抗氧化功能影响机理的研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2014.
|
| [32] |
TAKEDA K, NAGURO I, NISHITOH H, et al. Apoptosis signaling kinases:from stress response to health outcomes[J]. Antioxidants & Redox Signaling, 2011, 15(3): 719-761. |
| [33] |
LIN L L, WARTMANN M, LIN A Y, et al. cPLA2 is phosphorylated and activated by MAP kinase[J]. Cell, 1993, 72(2): 269-278. DOI:10.1016/0092-8674(93)90666-E |
| [34] |
SCHMIDT H H H W, WALTER U. NO at work[J]. Cell, 1994, 78(6): 919-925. DOI:10.1016/0092-8674(94)90267-4 |
| [35] |
BOGDAN C, RÖLLINGHOFF M, DIEFENBACH A. Reactive oxygen and reactive nitrogen intermediates in innate and specific immunity[J]. Current Opinion in Immunology, 2000, 12(1): 64-76. DOI:10.1016/S0952-7915(99)00052-7 |
| [36] |
BANAN A, FIELDS J Z, DECKER H, et al. Nitric oxide and its metabolites mediate ethanol-induced microtubule disruption and intestinal barrier dysfunction[J]. The Journal of Pharmacology and Experimental Therapeutics, 2000, 294(3): 997-1008. |
| [37] |
潘会君, 唐宁, 华晓东, 等. 中药调控一氧化氮合酶-一氧化氮系统的研究[J]. 中国实验方剂学杂志, 2010, 16(12): 202-205. DOI:10.3969/j.issn.1005-9903.2010.12.065 |
| [38] |
张浩, 昝金行, 刘培勋. 诱导型一氧化氮合酶抑制剂的研究进展[J]. 中国新药杂志, 2013, 22(6): 665-669. |
| [39] |
HUNG L F, LAI J H, LIN L C, et al. Retinoid acid inhibits IL-1-induced iNOS, COX-2 and chemokine production in human chondrocytes[J]. Immunological Investigations, 2008, 37(7): 675-693. DOI:10.1080/08820130802307237 |
| [40] |
ERTESVAG A, AUSTENAA L M I, CARLSEN H, et al. Retinoic acid inhibits in vivo interleukin-2 gene expression and T-cell activation in mice[J]. Immunology, 2009, 126(4): 514-522. DOI:10.1111/imm.2009.126.issue-4 |
| [41] |
SHI H Y, YAN S M, GUO Y M, et al. Vitamin A pretreatment protects NO-induced bovine mammary epithelial cells from oxidative stress by modulating Nrf2 and NF-κB signaling pathways[J]. Journal of Animal Science, 2018, 96(4): 1305-1316. DOI:10.1093/jas/sky037 |
| [42] |
石惠宇.维生素A通过Nrf2/谷胱甘肽过氧化物酶1/NF-κB信号通路缓解奶牛乳腺上皮细胞氧化应激的机理研究[D].博士学位论文.呼和浩特: 内蒙古农业大学, 2018.
|
| [43] |
KENSLER T W, WAKABAYASHI N. Nrf2:friend or foe for chemoprevention?[J]. Carcinogenesis, 2010, 31(1): 90-99. DOI:10.1093/carcin/bgp231 |
| [44] |
CHEN X L, KUNSCH C. Induction of cytoprotective genes through Nrf2/antioxidant response element pathway:a new therapeutic approach for the treatment of inflammatory diseases[J]. Current Pharmaceutical Design, 2004, 10(8): 879-891. DOI:10.2174/1381612043452901 |
| [45] |
YANG W, SHEN Y M, WEI J, et al. MicroRNA-153/Nrf-2/GPx1 pathway regulates radiosensitivity and stemness of glioma stem cells via reactive oxygen species[J]. Oncotarget, 2015, 6(26): 22006-22027. |
| [46] |
ABDELHAMID L, HUSSEIN H, GHANEM M, et al. Retinoic acid-mediated anti-inflammatory responses in equine immune cells stimulated by LPS and allogeneic mesenchymal stem cells[J]. Research in Veterinary Science, 2017, 114: 225-232. DOI:10.1016/j.rvsc.2017.05.006 |
| [47] |
MC GUIRE C, PRINZ M, BEYAERT R, et al. Nuclear factor kappa B (NF-κB) in multiple sclerosis pathology[J]. Trends in Molecular Medicine, 2013, 19(10): 604-613. DOI:10.1016/j.molmed.2013.08.001 |
| [48] |
LI Q, SANLIOGLU S, LI S J, et al. GPx-1 gene delivery modulates NF-κB activation following diverse environmental injuries through a specific subunit of the IKK complex[J]. Antioxidants & Redox Signaling, 2001, 3(3): 415-432. |
| [49] |
TRAN T V, SHIN E J, JEONG J H, et al. Protective potential of the glutathione peroxidase-1 gene in abnormal behaviors induced by phencyclidine in mice[J]. Molecular Neurobiology, 2017, 54(9): 7042-7062. DOI:10.1007/s12035-016-0239-y |
| [50] |
TAN K P, KOSUGE K, YANG M D, et al. NRF2 as a determinant of cellular resistance in retinoic acid cytotoxicity[J]. Free Radical Biology and Medicine, 2008, 45(12): 1663-1673. DOI:10.1016/j.freeradbiomed.2008.09.010 |
| [51] |
顾蓓蓓.视黄醇对脂多糖诱导的大鼠乳腺炎症反应的调节及机制研究[D].博士学位论文.南京: 南京农业大学, 2010.
|




