2. 中国科学院亚热带农业生态研究所, 亚热带农业生态过程重点实验室, 畜禽养殖污染控制与资源化技术国家工程实验室, 湖南省畜禽健康养殖工程技术研究中心, 农业部中南动物营养与饲料科学观测实验站, 长沙 410125;
3. 习水富兴牧业有限公司, 习水 556400;
4. 白玉县牧旺农业科技有限公司, 白玉 627150;
5. 白玉玉牧丰源畜牧科技有限公司, 白玉 627150
2. Key Laboratory for Agri-Ecological Processes in Subtropical Region, National Engineering Laboratory for Pollution Control and Waste Utilization in Livestock and Poultry Production, Hunan Research Center of Livestock and Poultry Sciences, South Central Experimental Station of Animal Nutrition and Feed Science in Ministry of Agriculture, Institute of Subtropical Agriculture, The Chinese Academy of Sciences, Changsha 410125, China;
3. Xishui Fuxing Husbandry Co., Ltd., Xishui 556400, China;
4. Baiyu Muwang Agricultural Science and Technology Co., Ltd., Baiyu 627150, China;
5. Baiyu Yumu Fengyuan Animal Husbandry Science and Technology Co., Ltd., Baiyu 627150, China
脂肪酸是维持机体各种功能的关键营养素之一,是肝脏、肌肉和心脏等组织能量生产和储存的主要底物之一。脂肪酸也是构成生物膜磷脂的基本组成成分,并可通过细胞膜受体信号和转录因子活化等途径调节基因表达。脂肪酸的理化性质决定其存在和转运的形式,在血浆和间质中的脂肪酸可被白蛋白大量结合,或以脂肪酸酯的形式存在于脂蛋白中;在细胞内,脂肪酸可与细胞质脂肪酸结合蛋白(cytoplasmic fatty acid-binding protein,FABPc)结合,作为血浆白蛋白的胞内配体[1]。早期研究认为,长链脂肪酸(long-chain fatty acids,LCFAs)通过被动扩散的方式穿过细胞膜进入细胞。近年来,研究者在细胞中发现了几种能显著促进细胞脂肪酸吸收和排出的膜相关蛋白,包括脂肪酸移位酶(fatty acid translocase,FAT)CD36/SR-B2(cluster of differentiation 36/scavenger receptor B2)、质膜脂肪酸结合蛋白(plasma membrane fatty acid binding protein,FABPpm)和脂肪酸转运蛋白(fatty acid transport protein,FATP)1-6等[2]。目前,关于脂肪酸跨膜转运的确切机制尚不清楚,研究仅证实以上膜相关蛋白可促进LCFAs的跨膜摄取,而CD36/SR-B2在细胞LCFAs的跨膜摄取中扮演着重要角色,但其作用机制尚不清楚。本文旨在探讨CD36/SR-B2的功能及其介导LCFAs跨膜转运的分子机制。
1 CD36/SR-B2简介20世纪90年代早期,Abumrad等[3]发现,抑制剂二异硫氰酸二磺酸可与85~88 ku的膜蛋白共价反应,抑制大鼠脂肪细胞约70%的脂肪酸摄取量,表明该蛋白可能参与脂肪酸的跨膜转运,并命名为FAT。FAT是人类血小板中普遍存在的一种蛋白,是跨膜糖蛋白分化抗原簇CD36的同系物,故称为FAT/CD36。在脂肪细胞分化过程中,FAT/CD36的表达和油酸摄取速率表现出时间叠加性;用糖皮质激素地塞米松处理后,可平行诱导前脂肪细胞中FAT/CD36的表达和油酸转运,进一步证实FAT/CD36可促进脂肪细胞中脂肪酸的摄取[3]。CD36是一种多配体B类清道夫受体(scavenger receptor,SR),因此也被命名为SR-B2,1993—2015年间的文献均使用了缩写FAT/CD36或CD36,而新推荐的名称为CD36/SR-B2[1]。
CD36/SR-B2由472个氨基酸组成,其分子质量为88 ku,糖基化程度较高。CD36/SR-B2介导细胞LCFAs的摄取,是促进肠上皮细胞、脂肪细胞、心肌细胞和骨骼肌细胞等脂肪酸转运的主要膜蛋白之一[4]。其介导细胞脂肪酸摄取分3步:第1步为吸收,即在胞外,CD36/SR-B2作为脂肪酸的受体,结合相应的LCFAs定位于质膜的脂筏结构中;第2步为易位,即脂肪酸的极性羧基通过脂质双层从胞外翻转进入胞内,并在相反的界面重新定位;第3步为解吸,即脂肪酸从质膜的内部结合位点进入细胞质,并与脂肪酸结合蛋白(fatty acid-binding protein,FABP)结合完成解吸。从膜上解吸是整个跨膜转运的限速步骤。在胞内,CD36/SR-B2可结合FABPc或长链酰基辅酶A合成酶促进脂肪酸转运,也可与FABPpm相互作用,调控细胞脂肪酸的摄取。另外,研究发现,在缺乏FABPc的大鼠心肌细胞系H9c2中转染CD36/SR-B2并不能增加大鼠的脂肪酸摄取,表明细胞内CD36/SR-B2的正常运行需要FABPc的协助[5]。此外,CD36/SR-B2可促进细胞对鱼油中脂肪酸的摄取,特别是二十碳五烯酸和二十二碳六烯酸,表明n-3长链多不饱和脂肪酸对健康的影响依赖于细胞膜的存在和CD36/SR-B2的正常运作[6]。
2 CD36/SR-B2亚细胞定位生物信息学和生物物理学研究表明,CD36/SR-B2无信号肽序列,不属于分泌蛋白,而是一种整合膜蛋白,其拓扑结构包括胞外区、跨膜区和胞内区。CD36肽链两端为2个跨膜区,跨膜区域可能是疏水区,中间区域为亲水区。CD36/SR-B2不仅存在于细胞膜上,还存在于细胞器中,尤其是内体中。Smith等[7]研究发现,在骨骼肌中CD36/SR-B2位于线粒体外膜上长链酰基辅酶A合成酶的上游,有助于调节线粒体脂肪酸转运。石伯阳[8]利用转染方法对奶牛乳腺上皮细胞中的CD36/SR-B2进行亚细胞定位,发现该蛋白主要存在于细胞质和细胞膜上。此外,Mikosz等[9]利用免疫染色法观察到大鼠L6肌管中的CD36/SR-B2分散在整个细胞内部和质膜上。总之,CD36/SR-B2广泛分布于细胞内和质膜上,对细胞脂肪酸代谢具有较大的贡献。
3 CD36/SR-B2介导细胞LCFAs摄取的调控机制CD36/SR-B2介导细胞脂肪酸摄取的分子机制较复杂,其不仅促进细胞脂肪酸的跨膜转运,还参与调节细胞脂肪酸的摄取速率。CD36/SR-B2对细胞脂肪酸摄取的调节分为短期调节和长期调节(图 1)。
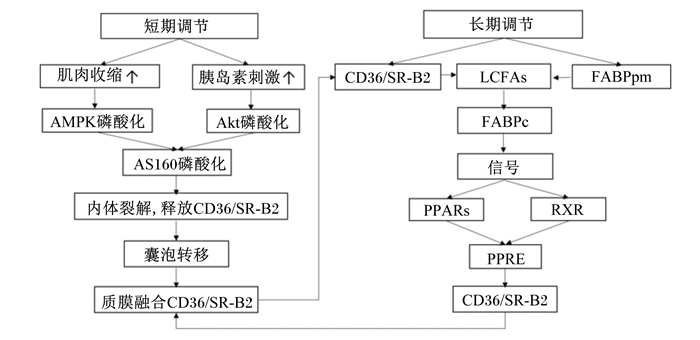
|
AMPK:一磷酸腺苷活化蛋白激酶AMP-activated kinase;Akt(PKB):蛋白激酶B protein kinase B;AS160:Rab GTP酶活化蛋白Rab GTPase-activating protein;CD36/SR-B2:cluster of differentiation 36/scavenger receptor B2;LCFAs:长链脂肪酸long-chain fatty acids;FABPpm:质膜脂肪酸结合蛋白plasma membrane fatty acid binding protein;FABPc:细胞质脂肪酸结合蛋白cytoplasmic fatty acid-binding protein;PPARs:核过氧化物酶体增殖物激活受体peroxisome proliferator-activated receptor;RXR:类视黄醇X受体retinoid X receptor;PPRE:过氧化物酶体增殖物应答原件peroxisome proliferator response element。 图 1 CD36/SR-B2介导细胞LCFAs摄取的可能机制 Fig. 1 Potential mechanism of CD36/SR-B2 mediating cellular LCFAs uptake |
即CD36/SR-B2的亚细胞循环机制。CD36/SR-B2从内体到质膜的胞内循环(即囊泡运输)可特异性调节LCFAs的转运,以确保含有膜蛋白的囊泡移位至质膜,而不与其他细胞器的膜随机融合[1]。介导CD36/SR-B2转运的信号传导途径主要有2种[10]:第1种为增加胞外肌肉收缩,上调一磷酸腺苷(AMP)与三磷酸腺苷(ATP)比例,以激活下游AMP活化蛋白激酶(AMP-activated kinase,AMPK),使其发生磷酸化。研究发现,骨骼肌收缩可激活AMPK,诱导小鼠骨骼肌细胞膜CD36/SR-B2的上调,且激活的AMPK可独立调控CD36的表达[11];第2种为增加血浆胰岛素刺激,以激活磷脂酰肌醇-3(phosphatidylinositide 3,PI3)途径的下游蛋白激酶B(protein kinase B,PKB,也称Akt)。AMPK和PI3/Akt的磷酸化可激活Akt的底物Rab三磷酸鸟苷(GTP)酶活化蛋白(AS160蛋白),使其发生磷酸化,进而调节CD36/SR-B2的转运[12]。Mikosz等[13]报道,在L6肌管内脂肪细胞中,中等失活的AS160蛋白可降低Rab 8a酶的活性,加速二磷酸鸟苷(GDP)/三磷酸鸟苷(GTP)的循环,进而上调CD36/SR-B2的表达,增加细胞脂肪酸的摄取。据报道,在心脏和骨骼肌中,增加肌肉收缩和胰岛素刺激,几分钟内CD36/SR-B2就可从内体移位至肌膜上,使脂肪酸摄取量增加2倍[10]。这种通过循环CD36/SR-B2来调节细胞脂肪酸摄取的机制与心脏和骨骼肌细胞中的葡萄糖摄取机制非常类似。随着肌肉收缩或胰岛素刺激的增加,CD36/SR-B2从内体转移到囊泡上,与特异性囊泡相关膜蛋白4(vesicle-associated membrane protein 4,VAMP4)结合,通过囊泡运输转移到质膜,作为受体与胞外脂肪酸结合,增加细胞脂肪酸的摄取率。葡萄糖转运蛋白4(glucose transporter 4,GLUT4)则从胞内转运小泡转移到囊泡上,与VAMP7结合并通过囊泡运输转移到质膜,以增加葡萄糖摄取率。此外,CD36/SR-B2的循环机制还发生在人类骨骼肌和脂肪组织中。
目前,相关研究试图进一步探索CD36/SR-B2的信号通路、囊泡运输和细胞骨架蛋白,以调控CD36/SR-B2的短期亚细胞循环。最近发现,CD36/SR-B2的易位不仅受胞内蛋白质循环的调控,还受蛋白质翻译后修饰的调控,特别是棕榈酰化、N-糖基化和泛素化[14]。此外,CD36/SR-B2是O-乙酰氨基葡萄糖(O-linked N-acetylglucosamine,O-GlcNac)的靶点,O-GlcNac的修饰可诱导CD36/SR-B2转移到心肌细胞膜上,进而增加肌细胞脂肪酸摄取和脂肪酸氧化速率[15]。
3.2 CD36/SR-B2介导细胞LCFAs摄取的长期调节即CD36/SR-B2的转录调控。在脂肪酸代谢旺盛的各种组织中,CD36/SR-B2可促进脂肪酸的跨膜转运,其促进作用因组织发育、激素水平和环境条件的不同而异。CD36/SR-B2在脂质吸收发生的大部分肠段、存储中性脂质的脂肪组织以及以脂肪酸为能量生产底物的心脏和骨骼肌中高度表达,而在肝脏中不表达或表达极低。此外,CD36/SR-B2也存在于内皮细胞、肺细胞、血小板和巨噬细胞中,其表达与脂肪酸的摄取和氧化低密度脂蛋白的结合有关。CD36/SR-B2的表达受核过氧化物酶体增殖物激活受体(peroxisome proliferator-activated receptor,PPARs)、类视黄醇X受体(retinoid X receptor,RXR)和过氧化物酶体增殖物应答原件(peroxisome proliferator response element,PPRE)的共同调控。PPARs是多种分子激活的转录因子家族,参与调控不同细胞类型中与代谢、炎症、增殖和分化等有关的基因转录。PPARs主要有3个家族成员,包括PPARα、PPARγ和PPARβ/δ。PPARα在肝脏、心脏、骨骼肌、肾脏和棕色脂肪组织中具有高脂肪酸氧化速率,参与调节脂肪酸分解代谢相关蛋白的表达。PPARγ在白色脂肪组织中高度表达,是脂肪生成的关键调节因子。PPARβ/δ是Neels等[16]首次从前脂肪细胞的cDNA中克隆得到的PPAR亚型,在组织中分布更广泛,是一种在前脂肪细胞中介导脂肪酸转录效应的蛋白。PPARs首先与RXR形成异源二聚体,再与DNA结合结构域和靶基因的启动子或转录区域中的PPRE序列结合,直接参与调控靶基因的转录[16]。脂肪酸(特别是LCFAs)及各种脂肪酸的代谢产物(如酰基辅酶A酯、氧化脂肪酸和类花生酸)都是PPARs的配体。心脏中PPARα和骨骼肌中PPARβ/δ的激活能上调介导脂肪酸线粒体β-氧化的各种蛋白和酶的表达,包括上调介导细胞脂肪酸摄取的蛋白表达,即CD36/SR-B2和FABPc。在肌膜脂筏上,CD36/SR-B2可与FABPpm协同作用,在胞内位点可与FABPc相互作用,促进脂肪酸进入细胞,进而影响其从头合成[17]。在心肌细胞中,PPARɑ缺失可降低心脏脂肪酸的利用能力,而过表达则可增强细胞脂肪酸的摄取和利用。
此外,在基因表达水平上,还存在几种转录激活因子参与调控CD36/SR-B2基因的表达,主要包括CCAAT/增强子结合蛋白(CCAAT/enhancer-binding protein,C/EBP)α、C/EBPβ和缺氧诱导因子-1(hypoxia-inducible factor-1,HIF-1)等[12]。CD36/SR-B2基因具有复杂的启动子结构,其中包含选择性转录起始位点。对小鼠CD36/SR-B2基因序列进行分析,发现CD36/SR-B2基因启动子的远端存在一个PPRE结合位点,而5’端特定位点存在一个C/EBPβ的显性隐性突变体应答元件。据报道,在几种细胞类型中,C/EBPα和C/EBPβ的过表达均可增加CD36/SR-B2的基因和蛋白表达水平。研究发现,在C/EBPα或C/EBPβ缺陷型小鼠胚胎成纤维细胞中,C/EBPα或C/EBPβ表达的恢复可增加CD36/SR-B2基因表达[18]。对人类CD36/SR-B2启动子区域进行研究,发现其启动子上存在一个HIF-1结合位点,而磷脂酰肌醇-3激酶(PI3K)通路的抑制能阻碍HIF-1诱导的CD36/SR-B2基因表达和启动子活性[19]。
4 机体CD36/SR-B2表达水平的调节因素 4.1 内部因素对机体CD36/SR-B2表达水平的调节内部因素主要指疾病和激素。正常肝脏中CD36/SR-B2表达水平较低,但高脂饮食(high-fat diet,HFD)可显著提高其表达水平。研究发现,CD36/SR-B2的缺失或使用其抑制剂磺基-N-琥珀酰亚胺酯可靶向抑制细胞脂肪酸代谢途径的主要步骤,从而改善HFD诱导的胰岛素抵抗和心脏收缩功能障碍[20]。临床研究也显示,病人血液中高水平的CD36/SR-B2与糖耐量异常、代谢综合征等疾病有关。在非酒精性脂肪肝患者肝脏中CD36/SR-B2表达水平显著提高,而催乳素受体过表达可显著下调CD36/SR-B2的表达[21]。肌肉生长抑制素(myostatin,Mstn)受抑制可导致肌肉萎缩症,研究发现,敲除Mstn相关基因可降低与肌肉脂质氧化途径减少和脂肪生成受损相关的脂质膜转运蛋白(CD36/SR-B2、FABP3、FATP1和FATP4)水平,从而调节肌肉的脂质代谢[22]。
过氧化物酶体增殖物激活受体辅激活因子-1α(peroxisome proliferator-activated receptor coactivator-1α,PGC-1α)与细胞中CD36/SR-B2、FATP1和FABPpm等蛋白的表达及共活化的PPAR的类型有关。研究发现,在小鼠棕色脂肪组织中敲除PGC-1α基因可降低脂质代谢酶和脂肪酸转运蛋白(FATP、FAT/CD36和FABP3)的水平,但在白色脂肪组织中结果却相反[23]。此外,脂质代谢异常通常与胰岛素抵抗有关,这表明共激活剂可作为该类疾病的潜在治疗靶点。据报道,妊娠期人类和小鼠的胎盘中CD36/SR-B2和PPAR的蛋白表达水平显著降低。在妊娠小鼠中,PPARγ的激动剂罗格列酮能增加CD36/SR-B2、FATP1、FATP4和FABPpm的蛋白表达水平,表明这种胰岛素敏感性药物对脂肪酸的摄取存在影响。进一步研究发现,靶基因PPARγ的转录调节发生在对小脂溶性配体如特异性脂肪酸及其衍生物的结合反应中[24]。另外,饲粮添加甜菜碱也可激活AMPK,上调PPARα的表达,进而上调CD36/SR-B2、FATP1和FABP3的表达,促进肌肉脂肪酸摄取[25]。
4.2 外部因素对机体CD36/SR-B2表达水平的调节据报道,剧烈运动、长期锻炼或者电刺激等外界因素可导致心肌和骨骼肌细胞中FATP蛋白表达水平上调或脂肪酸胞内快速定向移动的发生。在剧烈运动时,肌肉的收缩会引起CD36/SR-B2、FABP和FATP从内体快速转移到质膜上,促进脂肪酸的大量摄入以供能量代谢的需要。长期锻炼会显著提高这些脂肪酸转运因子的表达水平。Astorino等[26]研究显示,对机体进行高强度间歇训练或冲刺间隔训练会增加全身脂肪氧化,增加CD36/SR-B2的蛋白表达水平。Rocha-Rodrigues等[27]对HFD的大鼠进行自由体育锻炼和耐力训练,发现8周的耐力训练可降低机体体重、内脏脂肪细胞大小,增加CD36/SR-B2的蛋白表达水平及线粒体复合物Ⅳ和Ⅴ亚基的含量;同时,脂肪生成相关标记物(固醇调节原件结合蛋白-1c和乙酰辅酶A羧化酶)水平也显著降低。Manio等[28]敲除小鼠CD36/SR-B2基因发现,动物在休息和运动时全身新陈代谢都受到抑制,即使PGC-1α和线粒体基因正常上调,在慢性训练中PPAR和PPAR相关运动应答基因的上调也不足,表明CD36/SR-B2在耐力表现、能量生产和PPARs高效下游转录调控中具有重要作用。此外,Bonen等[29]对小鼠骨骼肌电刺激后发现,骨骼肌细胞LCFAs的摄取较未刺激前显著增加,同时伴有细胞膜上脂肪酸转运蛋白CD36/SR-B2表达水平的增加。
5 CD36/SR-B2对脂质代谢的病理生理学意义CD36/SR-B2对脂质和含脂质配体具有高亲和力,与相应的配体结合可启动多种细胞内信号传导途径,进而调控多种代谢疾病,包括代谢综合征、非酒精性脂肪肝、动脉粥样硬化、胰岛素抵抗、Ⅱ型糖尿病及心血管疾病等。在脂质代谢过程中,CD36/SR-B2主要通过识别、吞噬脂类分子而发挥重要作用。因此,CD36/SR-B2也可能是一系列代谢疾病的治疗干预靶点,特别是代谢综合征。
CD36/SR-B2在肝脏、心脏和骨骼肌HFD诱导的脂质积累及其导致的胰岛素抵抗和收缩功能障碍中扮演着重要角色。脂肪酸长期过量摄入心脏或肌肉中会导致CD36/SR-B2亚细胞循环发生变化,进而引发FATP从内体到肌膜的持续性转移。在大鼠中,这种变化非常迅速,即在高脂饲喂后2~3 d,肌细胞脂肪酸摄取速率显著增加;同时,CD36/SR-B2过表达的转基因小鼠可免受HFD诱导的肝脏脂肪变性,减弱HFD诱导的胰岛素抵抗,并促进糖原的合成;另外,CD36/SR-B2的过表达会影响花生四烯酸的代谢,降低肝脏前列腺素和20-羟基二十碳四烯酸的水平,参与调控动脉粥样硬化和心血管疾病的病理过程[30]。脂肪酸不仅是能量生产的主要代谢底物,也可导致三酰甘油、二酰甘油和神经酰胺在肌内过量形成。后2种脂肪酸代谢物可抑制胰岛素信号,减弱GLUT4从内体向肌膜的易位,降低葡萄糖摄取量及葡萄糖向糖原的转化率。此阶段,心脏或肌肉会出现胰岛素抵抗,并伴有收缩功能障碍[31]。反之,会造成脂肪酸摄取增加、脂质诱导的胰岛素抵抗和进一步心功能损伤的恶性循环。因此,CD36/SR-B2在脂质过量引起的胰岛素抵抗发展的早期阶段发挥着重要作用,是治疗代谢综合征的有效靶点。
此外,脂质过量可抑制液泡ATP酶的活性,使ATP酶复合体从膜结合质子通道复合体解体,随后向可溶性细胞质迁移,进而抑制空泡型氢离子依赖ATP酶的质子泵活性,使胞内发生碱化,导致CD36/SR-B2移位至肌膜。研究发现,HFD大鼠出现早期脂质诱导的胰岛素抵抗时会发生胞内碱化,表明胞内液泡ATP酶的活化可能是治疗脂质诱导的糖尿病、心肌病的一种有效方法[32]。
6 小结LCFAs是动物必需的能源和结构物质,不仅是代谢底物和复合脂质的成分,也参与调节基因表达和蛋白质功能。CD36/SR-B2是介导肠、脂肪、心肌和骨骼肌等细胞LCFAs跨膜转运的主要膜蛋白之一,同时,脂肪酸转运速率受CD36/SR-B2亚细胞循环的调节。CD36/SR-B2与HFD诱导的胰岛素抵抗和糖尿病、心肌病等病理条件下发生的脂质代谢紊乱有关,是一系列代谢疾病的潜在治疗靶点,但其确切的作用机制尚不清楚,因此,需要对生理和病理条件下CD36/SR-B2的功能及其对细胞LCFAs的跨膜转运机制进行深入的研究,尝试探索脂肪酸摄取与机体代谢之间的可能关系。
| [1] |
GLATZ J F C, LUIKEN J J F P. From fat to FAT (CD36/SR-B2):understanding the regulation of cellular fatty acid uptake[J]. Biochimie, 2017, 136: 21-26. DOI:10.1016/j.biochi.2016.12.007 |
| [2] |
KAZANTZIS M, STAHL A. Fatty acid transport proteins, implications in physiology and disease[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2012, 1821(5): 852-857. DOI:10.1016/j.bbalip.2011.09.010 |
| [3] |
ABUMRAD N A, EL-MAGHRABI M R, AMRI E Z, et al. Cloning of a rat adipocyte membrane protein implicated in binding or transport of long-chain fatty acids that is induced during preadipocyte differentiation.Homology with human CD36[J]. Journal of Biological Chemistry, 1993, 268(24): 17665-17668. |
| [4] |
GLATZ J F C, NABBEN M, HEATHER L C, et al. Regulation of the subcellular trafficking of CD36, a major determinant of cardiac fatty acid utilization[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2016, 1861(10): 1461-1471. DOI:10.1016/j.bbalip.2016.04.008 |
| [5] |
VAN NIEUWENHOVEN F A, LUIKEN J J F P, DE JONG Y F, et al. Stable transfection of fatty acid translocase (CD36) in a rat heart muscle cell line (H9c2)[J]. Journal of Lipid Research, 1998, 39(10): 2039-2047. |
| [6] |
FRANEKOVA V, ANGIN Y, HOEBERS N T H, et al. Marine omega-3 fatty acids prevent myocardial insulin resistance and metabolic remodeling as induced experimentally by high insulin exposure[J]. American Journal of Physiology-Cell Physiology, 2015, 308(4): C297-C307. DOI:10.1152/ajpcell.00073.2014 |
| [7] |
SMITH B K, JAIN S S, RIMBAUD S, et al. FAT/CD36 is located on the outer mitochondrial membrane, upstream of long-chain acyl-CoA synthetase, and regulates palmitate oxidation[J]. Biochemical Journal, 2011, 437(1): 125-134. DOI:10.1042/BJ20101861 |
| [8] |
石伯阳.牛乳腺上皮细胞转运蛋白的亚细胞定位及油酸转运研究[D].硕士学位论文.长沙: 湖南农业大学, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10537-1015604376.htm
|
| [9] |
MIKŁOSZ A, ŁUKASZUK B, Ż ENDZIAN-PIOTROWSKA M, et al. Challenging of AS160/TBC1D4 alters intracellular lipid milieu in L6 myotubes incubated with palmitate[J]. Journal of Cellular Physiology, 2017, 232(9): 2373-2386. DOI:10.1002/jcp.25632 |
| [10] |
GLATZ J F C, LUIKEN J J F P. Fatty acids in cell signaling:historical perspective and future outlook[J]. Prostaglandins, Leukotrienes and Essential Fatty Acids, 2015, 92: 57-62. DOI:10.1016/j.plefa.2014.02.007 |
| [11] |
ADRIAN L, LENSKI M, TÖDTER K, et al. AMPK prevents palmitic acid-induced apoptosis and lipid accumulation in cardiomyocytes[J]. Lipids, 2017, 52(9): 737-750. DOI:10.1007/s11745-017-4285-7 |
| [12] |
CHANDA D, LUIKEN J J F P, GLATZ J F C. Signaling pathways involved in cardiac energy metabolism[J]. FEBS Letters, 2016, 590(15): 2364-2374. DOI:10.1002/1873-3468.12297 |
| [13] |
MIKŁOSZ A, ŁUKASZUK B, Ż ENDZIAN-PIOTROWSKA M, et al. The effects of AS160 modulation on fatty acid transporters expression and lipid profile in L6 myotubes[J]. Cellular Physiology and Biochemistry, 2016, 38(1): 267-282. DOI:10.1159/000438628 |
| [14] |
LUIKEN J J F P, CHANDA D, NABBEN M, et al. Post-translational modifications of CD36 (SR-B2):implications for regulation of myocellular fatty acid uptake[J]. Biochimica et Biophysica Acta:Molecular Basis of Disease, 2016, 1862(12): 2253-2258. DOI:10.1016/j.bbadis.2016.09.004 |
| [15] |
LACZY B, FVLÖP N, ONAY-BESIKCI A, et al. Acute regulation of cardiac metabolism by the hexosamine biosynthesis pathway and protein O-GlcNAcylation[J]. PLoS One, 2011, 6(4): e18417. DOI:10.1371/journal.pone.0018417 |
| [16] |
NEELS J G, GRIMALDI P A. Physiological functions of peroxisome proliferator-activated receptor β[J]. Physiological Reviews, 2014, 94(3): 795-858. DOI:10.1152/physrev.00027.2013 |
| [17] |
YANG J, SAMBANDAM N, HAN X L, et al. CD36 deficiency rescues lipotoxic cardiomyopathy[J]. Circulation Research, 2007, 100(8): 1208-1217. DOI:10.1161/01.RES.0000264104.25265.b6 |
| [18] |
QIAO L P, ZOU C H, SHAO P, et al. Transcriptional regulation of fatty acid translocase/CD36 expression by CCAAT/enhancer-binding protein α[J]. Journal of Biological Chemistry, 2008, 283(14): 8788-8795. DOI:10.1074/jbc.M800055200 |
| [19] |
MWAIKAMBO B R, YANG C, CHEMTOB S, et al. Hypoxia up-regulates CD36 expression and function via hypoxia-inducible factor-1-and phosphatidylinositol 3-kinase-dependent mechanisms[J]. Journal of Biological Chemistry, 2009, 284(39): 26695-26707. DOI:10.1074/jbc.M109.033480 |
| [20] |
MANSOR L S, DA LUZ SOUSA FIALHO M, YEA G, et al. Inhibition of sarcolemmal FAT/CD36 by sulfo-N-succinimidyl oleate rapidly corrects metabolism and restores function in the diabetic heart following hypoxia/reoxygenation[J]. Cardiovascular Research, 2017, 113(7): 737-748. DOI:10.1093/cvr/cvx045 |
| [21] |
ZHANG P Z, GE Z J, WANG H D, et al. Prolactin improves hepatic steatosis via CD36 pathway[J]. Journal of Hepatology, 2018, 68(6): 1247-1255. DOI:10.1016/j.jhep.2018.01.035 |
| [22] |
BAATI N, FEILLET-COUDRAY C, FOURET G, et al. Myostatin deficiency is associated with lipidomic abnormalities in skeletal muscles[J]. Biochimica et Biophysica Acta:Molecular and Cell Biology of Lipids, 2017, 1862(10): 1044-1055. DOI:10.1016/j.bbalip.2017.06.017 |
| [23] |
SUPRUNIUK E, MIKŁOSZ A, CHABOWSKI A, et al. The implication of PGC-1α on fatty acid transport across plasma and mitochondrial membranes in the insulin sensitive tissues[J]. Frontiers in Physiology, 2017, 8: 923. DOI:10.3389/fphys.2017.00923 |
| [24] |
DA FONSECA F C P, DE BARROS MUCCI D, ASSUMPÇÃO R P, et al. Differential long-chain polyunsaturated fatty acids status and placental transport in adolescent pregnancies[J]. Nutrients, 2018, 10(2): 1-14. |
| [25] |
LI S S, WANG H C, WANG X X, et al. Betaine affects muscle lipid metabolism via regulating the fatty acid uptake and oxidation in finishing pig[J]. Journal of Animal Science and Biotechnology, 2017, 8: 72. DOI:10.1186/s40104-017-0200-6 |
| [26] |
ASTORINO T A, SCHUBERT M M. Changes in fat oxidation in response to various regimes of high intensity interval training (HⅡT)[J]. European Journal of Applied Physiology, 2018, 118(1): 51-63. DOI:10.1007/s00421-017-3756-0 |
| [27] |
ROCHA-RODRIGUES S, RODRÍGUEZ A, BECERRIL S, et al. Physical exercise remodels visceral adipose tissue and mitochondrial lipid metabolism in rats fed a high-fat diet[J]. Clinical and Experimental Pharmacology and Physiology, 2017, 44(3): 386-394. DOI:10.1111/cep.2017.44.issue-3 |
| [28] |
MANIO M C C, MATSUMURA S, MASUDA D, et al. CD36 is essential for endurance improvement, changes in whole-body metabolism, and efficient PPAR-related transcriptional responses in the muscle with exercise training[J]. Physiological Reports, 2017, 5(10): e13282. DOI:10.14814/phy2.13282 |
| [29] |
BONEN A, PAROLIN M L, STEINBERG G R, et al. Triacylglycerol accumulation in human obesity and type 2 diabetes is associated with increased rates of skeletal muscle fatty acid transport and increased sarcolemmal FAT/CD36[J]. FASEB Journal, 2004, 18(10): 1144-1146. DOI:10.1096/fj.03-1065fje |
| [30] |
GARBACZ W G, LU P P, MILLER T M, et al. Hepatic overexpression of CD36 improves glycogen homeostasis and attenuates high-fat diet-induced hepatic steatosis and insulin resistance[J]. Molecular and Cellular Biology, 2016, 36(21): 2715-2727. DOI:10.1128/MCB.00138-16 |
| [31] |
BONEN A, JAIN S S, SNOOK L A, et al. Extremely rapid increase in fatty acid transport and intramyocellular lipid accumulation but markedly delayed insulin resistance after high fat feeding in rats[J]. Diabetologia, 2015, 58(10): 2381-2391. DOI:10.1007/s00125-015-3691-8 |
| [32] |
STEINBUSCH L K M, WIJNEN W, SCHWENK R W, et al. Differential regulation of cardiac glucose and fatty acid uptake by endosomal pH and actin filaments[J]. American Journal of Physiology-Cell Physiology, 2010, 298(6): C1549-C1559. DOI:10.1152/ajpcell.00334.2009 |




