2. 生物饲料添加剂北京市重点实验室, 北京 100193
2. Beijing Key Laboratory of Biological Feed Additives, Beijing 100193, China
随着我国养殖业的快速发展,畜禽氮排放造成的环境污染问题日趋严重。每年我国畜禽总氮排放量约为3 000万t,其中单胃动物(主要是猪)的氮排放量约占57%[1]。大量研究表明,在生产中通过使用合成氨基酸配制低蛋白质饲粮可以有效地降低蛋白质饲料的使用,同时能够显著地减少畜禽排泄物中氮污染物的含量,极大程度地改善畜禽养殖造成的环境污染问题[2-5]。
本课题组前期研究发现,在低蛋白质饲粮中添加支链氨基酸(BCAA)可以显著降低氮排放,提高饲粮氮利用效率;在低蛋白质饲粮中添加0.27%缬氨酸或者0.4%亮氨酸均显著降低尿氮损失,同时亮氨酸的添加能够促进蛋白质沉积,显著改善胴体品质[6]。亮氨酸是一种极为重要的支链氨基酸,其在动物机体蛋白质代谢中发挥着不可替代的作用[7-9],当前国内外对于猪低蛋白质饲粮中氨基酸添加的研究多局限于赖氨酸、蛋氨酸等,对于低蛋白质水平下生长育肥猪饲粮中亮氨酸的添加水平及添加后对氮平衡的具体影响仍不清楚。因此,本试验旨在研究低蛋白质饲粮中添加亮氨酸对育肥猪氮平衡的影响,以期为提高蛋白质利用率,同时降低生产中的氮排放提供科学依据。
1 材料与方法 1.1 试验饲粮参照NRC(1998)[10]理想氨基酸模式配制等消化能(13.93 MJ/kg)、等赖氨酸含量(标准回肠可消化赖氨酸为0.75%)、除亮氨酸外相同氨基酸模式的正常蛋白质饲粮(粗蛋白质含量为14.5%)和4个添加不同水平(0、0.4%、0.8%和1.2%)亮氨酸的低蛋白质饲粮(粗蛋白质含量为10.0%)。试验饲粮营养水平均满足或高于我国《猪饲养标准》(NY/T 65—2004)[11]的推荐值,试验饲粮组成见表 1,试验饲粮营养水平见表 2。
|
|
表 1 试验饲粮组成(饲喂基础) Table 1 Composition of experimental diets (as-fed basis) |
|
|
表 2 试验饲粮营养水平(饲喂基础) Table 2 Nutrient levels of experimental diets (as-fed basis) |
本试验选取10头初始体重为(70.7±3.1) kg的健康杜×长×大杂交去势公猪,根据体重分为5组,每组2头猪,采用5×5拉丁方设计,整个试验期为50 d,共分为5期,每期10 d,前5天为预试期,后5天为收集期。
1.3 饲养管理试验于农业部饲料效价与安全监督检验测试中心(北京)畜禽试验基地进行,采用全封闭式猪舍。猪舍温度、通风强度和湿度自动化控制,舍温恒定为26 ℃。育肥猪单笼饲养,猪笼体积为1.25 m×0.80 m×1.00 m,漏缝塑料地板,不锈钢可调式料槽,乳头式饮水器。每天08:00和16:00各饲喂1次,试验开始前5天为预试期,估测猪的大致采食量为2.5 kg/d,每次喂料量相同,动物采食后自由饮水。按常规管理程序进行驱虫和免疫。
1.4 样品采集在收集期内收集粪尿,粪样的收集采用全收粪法,尿样的收集采用全收尿法,并记录每期的饲粮采食量。在收集期内准确收集育肥猪所排粪便,并将粪样放入-20 ℃冰箱中保存。在收集期内准确收集育肥猪所排尿液,向盛放尿样的桶内加入适量10%的硫酸(98%的硫酸与水以体积比1 : 9混合)固氮,每天准确计量所收集尿样的体积,按5%取样后放入-20 ℃冰箱中保存。每个收集期结束时,每只育肥猪空腹前腔静脉采血10 mL,3 500 r/min离心10 min,分离血清,于-20 ℃冷冻保存备用。
1.5 检测指标与方法 1.5.1 饲粮营养物质含量的测定饲粮干物质、粗蛋白质、钙和总磷含量检测参照AOAC(2000)的方法。
饲粮氨基酸含量的检测:试验饲粮样品粉碎后分别在110 ℃下经6 mol/L盐酸水解24 h和0 ℃下经过甲酸氧化16 h后再经盐酸水解24 h,用氨基酸自动分析仪(S7130型,德国Sykam公司)测定15种氨基酸和含硫氨基酸含量;用4 mol/L氢氧化钠在110 ℃下水解22 h后,使用高效液相色谱仪(LC-10A型,日本岛津仪器公司)测定色氨酸含量。
1.5.2 氮平衡指标的测定收集期结束后,将4 d的粪样混合、称重并用四分法取鲜粪样重的10%于65 ℃烘箱中烘干,回潮24 h至恒重,粉碎并测定粪样中氮含量。
收集期结束后,把4 d所收取的全部尿样充分混匀,用于测定尿样中氮含量。
粪样和尿样中氮含量的测定方法同饲粮中氮含量的测定方法,根据育肥猪的日采食量、日排粪量、日排尿量,计算每日的氮摄入量、氮排出量和氮沉积量,并计算氮沉积率。
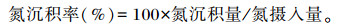
|
冻干粪样中氨基酸含量的测定方法同饲粮中氨基酸含量的测定方法,根据育肥猪的日采食量和日排粪量,计算氨基酸全肠道表观消化率,公式如下:

|
采用南京建成生物工程研究所生产的试剂盒测定血清尿素氮浓度。
1.6 统计分析数据采用SAS 9.3统计软件中的一般线性模型(GLM)以猪个体为试验单元进行方差分析,采用Tukey法对各饲粮处理结果进行多重比较,当P < 0.05时确定为差异显著,P < 0.01时确定为差异极显著,当0.05≤P < 0.10时认为有差异显著趋势。
2 结果与分析 2.1 低蛋白质饲粮中添加不同水平亮氨酸对育肥猪氮平衡和血清尿素氮浓度的影响从表 3中可以看出,在粗蛋白质含量为10.0%的低蛋白质饲粮中添加低于1.2%的亮氨酸时对育肥猪的干物质采食量无显著影响(P>0.05)。从氮平衡的数据可以看出,4个低蛋白质饲粮组中育肥猪氮摄入量显著低于正常蛋白质饲粮组(P < 0.05),继而氮排出量和氮沉积量也显著低于正常蛋白质饲粮组(P < 0.05),但是氮沉积率显著高于正常蛋白质饲粮组(P < 0.05)。与未添加亮氨酸的低蛋白质饲粮相比,在粗蛋白质含量为10.0%的低蛋白质饲粮中添加少量(0.4%)的亮氨酸时,氮排出量显著降低(P < 0.05),氮沉积量和氮沉积率出现显著升高(P < 0.05);而当亮氨酸添加水平继续增加时,氮沉积量和氮沉积率又会出现显著的下降(P < 0.05)。
|
|
表 3 低蛋白质饲粮中添加不同水平亮氨酸对育肥猪氮平衡和血清尿素氮浓度的影响 Table 3 Effects of low-protein diets supplemented with different levels of leucine on nitrogen balance and serum UN concentration of finishing pigs (n=10) |
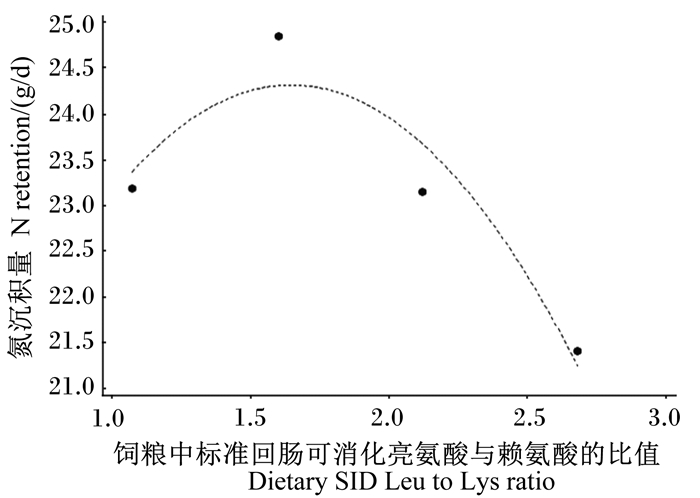
以氮沉积量为效应值进一步进行分析,得到图 1中饲粮中标准回肠可消化亮氨酸与赖氨酸比值(x)与育肥猪氮沉积量(y)的回归曲线。从曲线图可以看出,随着饲粮中标准回肠可消化亮氨酸与赖氨酸比值的增加,育肥猪氮沉积量先升高后下降,由二次回归方程[y=-2.87x2+9.45x+16.54(R2=0.90)]得出二次回归转折点对应的饲粮中标准回肠可消化亮氨酸与赖氨酸比值为1.65。
|
图 1 氮沉积量与饲粮中标准回肠可消化亮氨酸与赖氨酸比值的关系 Fig. 1 Relationship between N retention and dietary SID Leu to Lys ratio |
此外,血浆尿素氮浓度的测定结果显示,4个低蛋白质饲粮组血浆尿素氮浓度显著低于正常蛋白质饲粮组(P < 0.05),而亮氨酸的添加水平对各低蛋白质饲粮组血浆尿素氮浓度无显著影响(P>0.05)。
2.2 低蛋白质饲粮中添加不同水平亮氨酸对育肥猪氨基酸全肠道表观消化率的影响从表 4中可以看出,各组育肥猪的赖氨酸、蛋氨酸+半胱氨酸、色氨酸和苏氨酸全肠道表观消化率没有显著差异(P>0.05),正常蛋白质饲粮组育肥猪的异亮氨酸以及缬氨酸全肠道表观消化率显著高于4个低蛋白质饲粮组(P < 0.05)。4个低蛋白质饲粮组中,随着亮氨酸添加水平的升高,亮氨酸的全肠道表观消化率呈升高的趋势,而异亮氨酸和缬氨酸全肠道表观消化率则呈下降的趋势。这表明,亮氨酸的过量添加在一定程度上阻碍了异亮氨酸和缬氨酸的消化吸收。
|
|
表 4 低蛋白质饲粮中添加不同水平亮氨酸对育肥猪氨基酸全肠道表观消化率的影响 Table 4 Effects of low-protein diets supplemented with different levels of leucine on total tract apparent digestibility of amino acids of finishing pigs (n=10) |
氮是畜牧生产中造成环境污染的主要物质之一,近年来,国内外对于低蛋白质饲粮对生长肥育猪氮排泄影响的研究较多。对于生长育肥猪而言,饲粮中63%的氮通过粪和尿排出体外,既造成了氮的浪费又污染了环境[13]。大量研究表明,在不影响生长性能的前提下,生长肥育猪饲粮蛋白质水平每降低1%,猪氮排出量可减少8%~10%[14-17]。Canh等[18]发现,将饲粮蛋白质水平降低2%~4%,并添加赖氨酸、蛋氨酸、苏氨酸和色氨酸之后,55 kg的生长育肥猪粪氮排出量并未减少,但尿氮排出量显著下降,饲粮蛋白质水平每降低1%,粪尿释放出的氨气会减少10.0%~12.5%。在本试验中,粗蛋白质含量为10.0%的低蛋白质饲粮组的氮排出量比粗蛋白质含量为14.5%的正常蛋白质饲粮组低12.62%,该结果与上述相关研究结果相一致,说明降低饲粮中的蛋白质水平能减少氮排出,减少养猪生产中氮的浪费,缓解氮排放造成的环境污染。此外,众多研究发现,饲粮蛋白质水平降低时,血浆尿素氮浓度随之呈线性降低[19-20]。本试验显示,低蛋白质饲粮组与正常蛋白质饲粮组相比,育肥猪血浆尿素氮浓度出现显著降低,此结果进一步印证了饲粮蛋白质水平降低会降低氮排放。
大部分氮损失与氮源的消化利用率低有关,因而提高饲粮中蛋白质的利用效率非常重要。Rotz[21]的研究表明,在低蛋白质饲粮添加合成氨基酸,能够通过改善氨基酸的平衡,提高育肥猪的氮利用率,显著提升氮沉积率,有效减少氮的损失。此外,有试验证明,低蛋白质饲粮中添加支链氨基酸(亮氨酸、异亮氨酸、缬氨酸)能显著改善断奶仔猪的生长性能和氮利用效率[22]。故而,本试验进一步研究了在低蛋白质饲粮中添加不同水平度亮氨酸对育肥猪氮平衡的影响。
已有研究表明,在饲粮中添加过量(3.12%)的亮氨酸或α-酮戊己酸(亮氨酸的转氨产物)会显著影响断奶仔猪的平均日采食量,同时显著降低平均日增重,对断奶仔猪的生长产生有负面影响[23]。因此,在正式试验开始之前,本研究通过预试验研究了低蛋白质饲粮中添加不同水平亮氨酸对育肥猪采食量的影响,结果显示,当亮氨酸添加水平高达1.8%和2.5%时会显著降低育肥猪的采食量,故而正式试验时设定的低蛋白质饲粮中亮氨酸添加水平低于1.8%。正式试验所得结果与前人研究[24-25]相一致,即0.4%~1.2%的亮氨酸均未对育肥猪的采食量产生不良影响。
亮氨酸作为蛋白质合成的重要底物,无法在哺乳动物体内合成[26]。大量研究表明,亮氨酸能够有效地促进蛋白质合成,抑制蛋白质降解[27-30]。Sugawara等[31-32]研究发现在低蛋白质饲粮中添加亮氨酸能够缓解低蛋白质饲粮引发的蛋白质降解。近年的研究发现亮氨酸可以通过增强哺乳动物雷帕霉素靶蛋白复合物1(mTORC1)及活化其下游效应物来刺激新生仔猪肌肉蛋白质的合成[9, 33]。故而,本试验在应用粗蛋白质含量为10.0%的低蛋白质饲粮的基础上添加了不同水平的亮氨酸,结果表明亮氨酸的添加显著提高了氮沉积率,其中0.4%亮氨酸添加组效果最为显著,氮排出量较粗蛋白质含量为14.5%的正常蛋白质饲粮组低14.59%,而氮沉积率则高出12.62%。出现该结果可能是由于支链氨基酸在低蛋白质饲粮中的添加进一步平衡了低蛋白质饲粮的氨基酸平衡性,从而实现了对氮利用率的提升[34];同时,也可能是由于亮氨酸促进了育肥猪肌肉及内脏组织的蛋白质合成速率,从而提高了机体对氮的利用效率[9]。而当亮氨酸添加水平超过0.4%时,氮排出量反而有增高趋势,同时氮沉积量显著减少,氮沉积率显著降低,这可能是亮氨酸添加过量打破了原有的氨基酸平衡,影响了其他氨基酸的吸收和代谢,继而影响了整体氮代谢[35]。
以氮沉积量为效应指标的二次拟合曲线表明,随着饲粮中标准回肠可消化亮氨酸与赖氨酸比值的提高,氮沉积量呈现出先上升后下降的趋势,同时,二次回归方程评估生长育肥猪饲粮中适宜的标准回肠可消化亮氨酸与赖氨酸比值为1.65,与0.4%亮氨酸添加组最为接近。目前关于亮氨酸最适添加水平的研究主要集中在仔猪和生长猪阶段,对育肥猪的研究相对较少。Soumeh等[36]研究发现,在8~12 kg仔猪低蛋白质饲粮中添加亮氨酸使标准回肠可消化亮氨酸与赖氨酸比值约为0.93时,促生长效果最优;而Wessels等[37]在35 kg生长猪的研究中则发现,低蛋白质饲粮中标准回肠可消化亮氨酸与赖氨酸比值为1.08时生长性能最佳。本试验主要研究了亮氨酸对育肥猪氮沉积的影响,结果发现在低蛋白质饲粮中添加0.4%的亮氨酸使标准回肠可消化亮氨酸与赖氨酸比值为1.65时,氮沉积效果最佳。对于育肥猪而言,生长性能的改变已经很难显著,生产上的性能优势偏重于胴体组成,期望通过添加亮氨酸达到提高氮沉积、改善胴体组成的效果,有关在低蛋白质饲粮中添加亮氨酸对于机体蛋白质合成及胴体组成的影响还需要进行进一步的研究。
3.2 低蛋白质饲粮中添加不同水平亮氨酸对育肥猪氨基酸全肠道表观消化率的影响氨基酸全肠道表观消化率的结果显示,随着亮氨酸添加水平的升高,异亮氨酸和缬氨酸全肠道表观消化率均出现了线性下降的趋势。与未添加亮氨酸组相比,1.2%赖氨酸添加组异亮氨酸和缬氨酸全肠道表观消化率分别下降1.05%和1.50%。前人的试验证明,在饲粮中补充亮氨酸会对血清中异亮氨酸和缬氨酸的浓度产生影响[38-39]。
亮氨酸、异亮氨酸和缬氨酸同属于支链氨基酸,支链氨基酸是动物体自身不能合成而必须从饲粮中摄取的必需氨基酸。支链氨基酸在动物体内具有特殊的代谢途径,因而在动物营养中发挥着重要而独特的生物学功能。诸多研究已证明这3种支链氨基酸之间存在一定的拮抗作用,即当饲粮中任意一种支链氨基酸的含量过高,将影响其他2种支链氨基酸的正常代谢。Cervantes-Ramírez等[40]报道,在仔猪饲粮中添加0.50%的亮氨酸会显著降低仔猪血清中异亮氨酸的含量。而王彬等[41]的研究也发现断奶仔猪采食添加中(0.27%)和高水平(0.55%)亮氨酸的低蛋白质饲粮(粗蛋白质含量为16.90%)3 h后,血浆中缬氨酸和异亮氨酸的含量显著降低,这与本试验结论一致,表明当饲粮中添加的亮氨酸超过适宜水平时,会表现出支链氨基酸之间的拮抗作用,影响机体对于异亮氨酸和缬氨酸的吸收。究其原因,可能是由于支链氨基酸共用同一类型的降解酶和转运载体,其在支链氨基酸转移酶的作用下被初步分解为支链-α-酮酸,随后进一步脱羧后其代谢物共同参与到三羧酸循环中[42],三者之间存在着反馈抑制的机制[43],故而平衡一旦被打破,其中一种支链氨基酸含量的升高必然对剩余2种支链氨基酸的代谢造成影响。
4 结论① 在粗蛋白质含量为10.0%的低蛋白质饲粮中添加低于1.2%的亮氨酸时对育肥猪的干物质采食量无显著影响。
② 与正常蛋白质饲粮相比,采食添加亮氨酸的低蛋白质饲粮的育肥猪的氮排出量显著降低,氮沉积率显著提高。
③ 在粗蛋白质含量为10.0%的低蛋白质饲粮中添加0.4%的亮氨酸时,育肥猪的氮沉积量达到最大,而添加过量亮氨酸会导致氮排出量增加,氮沉积量减少,氮沉积率降低,同时异亮氨酸和缬氨酸全肠道表观消化率有下降趋势。
④ 根据本试验结果得出,育肥猪低蛋白质饲粮(粗蛋白质含量为10.0%)中亮氨酸的最适添加水平为0.4%。
| [1] |
甄吉福, 许庆庆, 李貌, 等. 低蛋白质饲粮添加谷氨酸对育肥猪蛋白质利用和生产性能的影响[J]. 动物营养学报, 2018, 30(2): 507-514. |
| [2] |
NRC.Nutrient requirements of swine[S].11th ed.Washington, D.C.: National Academy Press, 2012: 56.
|
| [3] |
AARNINK A J A, VERSTEGEN M W A. Nutrition, key factor to reduce environmental load from pig production[J]. Livestock Science, 2007, 109(1/2/3): 194-203. |
| [4] |
BREGENDAHL K, SELL J L, ZIMMERMAN D R. Effect of low-protein diets on growth performance and body composition of broiler chicks[J]. Poultry Science, 2002, 81(8): 1156-1167. DOI:10.1093/ps/81.8.1156 |
| [5] |
KERR B J, ZIEMER C J, TRABUE S L, et al. Manure composition of swine as affected by dietary protein and cellulose concentrations[J]. Journal of Animal Science, 2006, 84(6): 1584-1592. DOI:10.2527/2006.8461584x |
| [6] |
ZHANG S H, CHU L C, QIAO S Y, et al. Effects of dietary leucine supplementation in low crude protein diets on performance, nitrogen balance, whole-body protein turnover, carcass characteristics and meat quality of finishing pigs[J]. Animal Science Journal, 2016, 87(7): 911-920. DOI:10.1111/asj.2016.87.issue-7 |
| [7] |
ESCOBAR J, FRANK J W, SURYAWAN A, et al. Leucine and α-ketoisocaproic acid, but not norleucine, stimulate skeletal muscle protein synthesis in neonatal pigs[J]. The Journal of Nutrition, 2010, 140(8): 1418-1424. DOI:10.3945/jn.110.123042 |
| [8] |
BOUTRY C, ELKADI S W, SURYAWAN A, et al. Leucine pulses enhance skeletal muscle protein synthesis during continuous feeding in neonatal pigs[J]. American Journal of Physiology Endocrinology and Metabolism, 2013, 305(5): E620-E631. DOI:10.1152/ajpendo.00135.2013 |
| [9] |
TORRAZZA R R, SURYAWAN A, GAZZANEO M C, et al. Leucine supplementation of a low-protein meal increases skeletal muscle and visceral tissue protein synthesis in neonatal pigs by stimulating mTOR-dependent translation initiation[J]. The Journal of Nutrition, 2010, 140(12): 2145-2152. DOI:10.3945/jn.110.128421 |
| [10] |
NRC.Nutrient requirements of swine[S].10th ed.Washington, D.C.: National Academy Press, 1998.
|
| [11] |
中华人民共和国农业部.NY/T 65-2004猪饲养标准[S].北京: 中国农业出版社, 2004.
|
| [12] |
SAUVANT D, PEREZ J M, TRAM G.饲料成分与营养价值表[M].谯仕彦, 王旭, 王德辉, 译.北京: 中国农业大学出版社, 2005, 53.
|
| [13] |
VAN DER PEET-SCHWERING C M C, JONGBLOED A W, AARNINK A J A. Nitrogen and phosphorus consumption, utilisation and losses in pig production.The Netherlands[J]. Livestock Production Science, 1999, 58(3): 213-224. DOI:10.1016/S0301-6226(99)00010-X |
| [14] |
KERR B J, MCKEITH F K, EASTER R A. Effect on performance and carcass characteristics of nursery to finisher pigs fed reduced crude protein, amino acid-supplemented diets[J]. Journal of Animal Science, 1995, 73(2): 433-440. DOI:10.2527/1995.732433x |
| [15] |
PORTEJOIE S, DOURMAD J Y, MARTINEZ J, et al. Effect of lowering dietary crude protein on nitrogen excretion, manure composition and ammonia emission from fattening pigs[J]. Livestock Production Science, 2004, 91(1/2): 45-55. |
| [16] |
GALASSI G, COLOMBINI S, MALAGUTTI L, et al. Effects of high fibre and low protein diets on performance, digestibility, nitrogen excretion and ammonia emission in the heavy pig[J]. Animal Feed Science and Technology, 2010, 161(3/4): 140-148. |
| [17] |
GALLO L, MONTÀ G D, CARRARO L, et al. Growth performance of heavy pigs fed restrictively diets with decreasing crude protein and indispensable amino acids content[J]. Livestock Science, 2014, 161: 130-138. DOI:10.1016/j.livsci.2013.12.027 |
| [18] |
CANH T T, AARNINK A J A, SCHUTTE J B, et al. Dietary protein affects nitrogen excretion and ammonia emission from slurry of growing-finishing pigs[J]. Livestock Production Science, 1998, 56(3): 181-191. DOI:10.1016/S0301-6226(98)00156-0 |
| [19] |
KERR B J, EASTER R A. Effect of feeding reduced protein, amino acid-supplemented diets on nitrogen and energy balance in grower pigs[J]. Journal of Animal Science, 1995, 73(10): 3000-3008. DOI:10.2527/1995.73103000x |
| [20] |
LARSSON T, KOPPANG E O, ESPE M, et al. Fillet quality and health of Atlantic salmon (Salmo salar L.) fed a diet supplemented with glutamate[J]. Aquaculture, 2014, 426-427: 288-295. DOI:10.1016/j.aquaculture.2014.01.034 |
| [21] |
ROTZ C A. Management to reduce nitrogen losses in animal production[J]. Journal of Animal Science, 2004, 82(Suppl.E): E119-E137. |
| [22] |
刘尧君, 任曼, 曾祥芳, 等. 低氮日粮补充支链氨基酸提高断奶仔猪生长性能和氮的利用效率[J]. 中国畜牧杂志, 2014, 50(7): 44-47. |
| [23] |
GATNAU R, ZIMMERMAN D R, NISSEN S L, et al. Effects of excess dietary leucine and leucine catabolites on growth and immune responses in weanling pigs[J]. Journal of Animal Science, 1995, 73(1): 159-165. DOI:10.2527/1995.731159x |
| [24] |
HYUN Y, ELLIS M, MCKEITH F K, et al. Effect of dietary leucine level on growth performance, and carcass and meat quality in finishing pigs[J]. Canadian Journal of Animal Science, 2003, 83(2): 315-318. DOI:10.4141/A02-035 |
| [25] |
ROJO GOMEZ A.Evaluation of the effects of branched chain amino acids and corn-distillers dried grains by-products on the growth performance, carcass and meat quality characteristics of pigs[D].Ph.D.Thesis.Champaign: University of Illinois at Urbana-Champaign, 2011.
|
| [26] |
HUTSON S M. The case for regulating indispensable amino acid metabolism:the branched-chain α-keto acid dehydrogenase kinase-knockout mouse[J]. Biochemical Journal, 2006, 400: e1. DOI:10.1042/BJ20061506 |
| [27] |
BUSE M G, REID S S.Leucine. A possible regulator of protein turnover in muscle[J]. Journal of Clinical Investigation, 1975, 56(5): 1250-1261. DOI:10.1172/JCI108201 |
| [28] |
CHUA B, SIEHL D L, MORGAN H E. Effect of leucine and metabolites of branched chain amino acids on protein turnover in heart[J]. Journal of Biological Chemistry, 1979, 254(17): 8358-8362. |
| [29] |
COMBARET L, DARDEVET D, RIEU I, et al. A leucine-supplemented diet restores the defective postprandial inhibition of proteasome-dependent proteolysis in aged rat skeletal muscle[J]. Journal of Physiology, 2005, 569(2): 489-499. DOI:10.1113/jphysiol.2005.098004 |
| [30] |
SUGDEN P H, FULLER S J. Regulation of protein turnover in skeletal and cardiac muscle[J]. Biochemical Journal, 1991, 273(1): 21-37. DOI:10.1042/bj2730021 |
| [31] |
SUGAWARA T, ITO Y, NISHIZAWA N, et al. Supplementation with dietary leucine to a protein-deficient diet suppresses myofibrillar protein degradation in rats[J]. Journal of Nutritional Science and Vitaminology, 2007, 53(6): 552-555. DOI:10.3177/jnsv.53.552 |
| [32] |
SUGAWARA T, ITO Y, NISHIZAWA N, et al. Regulation of muscle protein degradation, not synthesis, by dietary leucine in rats fed a protein-deficient diet[J]. Amino Acids, 2009, 37(4): 609-616. DOI:10.1007/s00726-008-0180-0 |
| [33] |
SURYAWAN A, JEYAPALAN A S, ORELLANA R A, et al. Leucine stimulates protein synthesis in skeletal muscle of neonatal pigs by enhancing mTORC1 activation[J]. American Journal of Physiology:Endocrinology and Metabolism, 2008, 295(4): E868-E875. DOI:10.1152/ajpendo.90314.2008 |
| [34] |
LORDELO M M, GASPAR A M, LE BELLEGO L, et al. Isoleucine and valine supplementation of a low-protein corn-wheat-soybean meal-based diet for piglets:growth performance and nitrogen balance[J]. Journal of Animal Science, 2008, 86(11): 2936-2941. DOI:10.2527/jas.2007-0222 |
| [35] |
D'MELLO J P F. Plasma concentrations and dietary requirements of leucine, isoleucine and valine:studies with the young chick[J]. Journal of Science Food Agriculture, 2010, 25(2): 187-196. |
| [36] |
SOUMEH E A, VAN MILGEN J, SLOTH N M, et al. The optimum ratio of standardized ileal digestible leucine to lysine for 8 to 12 kg female pigs[J]. Journal of Animal Science, 2015, 93(5): 2218-2224. DOI:10.2527/jas.2014-8699 |
| [37] |
WESSELS A G, KLUGE H, MIELENZ N, et al. Estimation of the leucine and histidine requirements for piglets fed a low-protein diet[J]. Animal, 2016, 10(11): 1803-1811. DOI:10.1017/S1751731116000823 |
| [38] |
EDMONDS M S, BAKER D H. Amino acid excesses for young pigs:effects of excess methionine, tryptophan, threonine or leucine[J]. Journal of Animal Science, 1987, 64(6): 1664-1671. DOI:10.2527/jas1987.6461664x |
| [39] |
DARDEVET D, SORNET C, BALAGE M, et al. Stimulation of in vitro rat muscle protein synthesis by leucine decreases with age[J]. The Journal of Nutrition, 2000, 130(11): 2630-2635. DOI:10.1093/jn/130.11.2630 |
| [40] |
CERVANTES-RAMÍREZ M, MENDEZ-TRUJILLO V, ARAIZA-PIÑA B A, et al. Supplemental leucine and isoleucine affect expression of cationic amino acid transporters and myosin, serum concentration of amino acids, and growth performance of pigs[J]. Genetics and Molecular Research, 2013, 12(1): 115-126. DOI:10.4238/2013.January.24.3 |
| [41] |
王彬, 袁珍虎, 季海波, 等. 亮氨酸对断奶仔猪血浆游离氨基酸浓度变化的影响[J]. 饲料工业, 2017, 38(2): 8-11. |
| [42] |
ZHANG S H, ZENG X F, REN M, et al. Novel metabolic and physiological functions of branched chain amino acids:a review[J]. Journal of Animal Science and Biotechnology, 2017, 8: 10. DOI:10.1186/s40104-016-0139-z |
| [43] |
ELIŠÁKOVÁ V, PÁTEK M, HOLÁTKO J, et al. Feedback-resistant acetohydroxy acid synthase increases valine production in Corynebaeterium glutamicum[J]. Applied and Environmental Microbiology, 2005, 71(1): 207-213. DOI:10.1128/AEM.71.1.207-213.2005 |




