2. 安徽省农业科学院畜牧兽医研究所, 合肥 230031
2. Institute of Animal Husbandry and Veterinary Science, Anhui Academy of Agricultural Sciences, Hefei 230031, China
安徽省夏季高温导致的热应激反应一直是规模化养鸡场的一个难题。药物防治鸡热应激的研究较多,许多报道指出,饲粮中添加γ-氨基丁酸(γ-aminobutyric acid,GABA)能促进动物采食,提高体增重,改善畜禽胴体品质和繁殖性能[1],缓解动物热应激。我国卫生部门于2009年批准GABA用于食品加工[2]。GABA机制方面的研究主要涉及免疫、抗氧化、内分泌和肠道消化功能[3-5],下丘脑-垂体-肾上腺(hypothalamic-pituitary-adrenal,HPA)轴是动物调控应激的主要神经-内分泌途径,但有关HPA轴方面的研究并不多。研究发现,GABA具有抑制夏季热应激奶牛和猪HPA轴激素分泌的功能[6-7],但其作用机制尚不清楚。脑组织内的神经递质GABA具备抗焦虑、抗惊厥和调节内分泌等作用[8],能作用于促肾上腺皮质激素释放激素(corticotropin-releasing hormone,CRH)神经元调节动物HPA轴[9-10],但尚未见到脑组织外的GABA调控HPA轴激素分泌的报道。正常情况下GABA不能自由穿过哺乳动物的血脑屏障[11]。鸡28日龄后血脑屏障发育完全,经静脉或口服给药很难进入脑组织内发挥作用[12],既然如此,饲喂的GABA如何调控HPA轴激素分泌?是否热应激破坏了鸡的血脑屏障,从而使得GABA穿过血脑屏障发挥作用?因此,本试验采用28日龄淮南麻黄鸡作为研究对象,于夏季高温季节进行为期30 d的试验,旨在探讨夏季热应激下淮南麻黄鸡HPA轴激素的分泌及饲粮中添加GABA对其的影响,通过检测脑组组中GABA含量,研究饲粮中添加的GABA能否穿过鸡的血脑屏障,以初步探明GABA对夏季热应激鸡HPA轴的调控机制。
1 材料与方法 1.1 试验材料和试验设计淮南麻黄鸡购于安徽皖西麻黄鸡禽业原种有限公司,GABA购自上海源叶生物科技有限公司,饲粮购自合肥正大饲料有限公司,基础饲粮组成及营养水平见表 1。选择120羽28日龄淮南麻黄母鸡,随机分成4组,每组5个重复,每个重复6羽鸡。Ⅰ组(对照组)饲喂基础饲粮,Ⅱ、Ⅲ、Ⅳ组分别在基础饲粮中添加50、100和150 mg/kg GABA。预试期7 d,正试期30 d。
|
|
表 1 基础饲粮组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
在鸡舍内的四面墙壁中部距地面1.5 m处各悬挂1个温湿计,每天08:00、14:00和20:00记录温度、相对湿度,按照公式计算THI[13]:
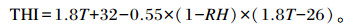
|
式中:T为平均环境温度(℃);RH为平均相对湿度(%)。
1.2.2 鸡直肠温度的测量在试验第10、20和30天14:00,每组随机抽取5羽鸡,用温度计检测直肠温度。
1.2.3 生长性能的检测每天称取各组鸡的给料量,第2天早晨称剩料量,计算试验期间各组鸡的耗料量,于试验第10、20、30天空腹称重,计算平均日采食量、平均日增重和料重比(F/G)。
1.2.4 血清和脑组织指标的检测试验第10、20、30天,每组随机选取5羽鸡,在空腹状态下翅静脉采血,制备血清,待测血清中CRH、促肾上腺皮质激素(adreno-cortico-tropic-hormone,ACTH)、皮质酮(corticotropin,Cor)、热休克蛋白70(heat shock protein 70,HSP70)和GABA含量。将Ⅰ、Ⅲ组鸡迅速断头在冰浴上取出大脑,用高速匀浆机将脑组织充分搅碎,制成10%的组织匀浆液,于4 ℃冰箱中静置20 min后在低温超速离心机上以12 000 r/min离心15 min,保存上清液于-20 ℃冰箱,待测脑组织中GABA含量。
血清中CRH、ACTH、Cor、HSP70、GABA的含量和脑组织中GABA的含量采用酶联免疫吸附测定(ELISA)法检测,按照试剂盒说明书的步骤进行操作。CRH、ACTH、GABA检测试剂盒购自江苏雨桐生物科技有限公司,Cor、HSP70检测试剂盒购自南京森贝伽生物科技有限公司。
1.3 数据统计用SPSS 17.0统计软件对数据进行分析,包括单因素方差分析(one-way ANOVA)、Duncan氏法多重比较和t检验方法,数据以平均值±标准差表示。
2 结果与分析 2.1 鸡舍内的温度、相对湿度和THI第1~10天,舍内温度为28~39 ℃,相对湿度为40%~84%,THI为80~89;第11~20天,舍内温度为32~36 ℃,相对湿度为42%~74%,THI为85~90;第21~30天,舍内温度为32~37 ℃,相对湿度为46%~76%,THI为80~87。
2.2 饲粮中添加GABA对鸡直肠温度的影响由表 2可知,与Ⅰ组相比,第10天时,Ⅱ、Ⅲ组的直肠温度分别显著(P < 0.05)、极显著(P < 0.01)降低;第20天时,Ⅳ组的直肠温度与Ⅰ组相近,Ⅱ、Ⅲ组低于Ⅰ组,其中,Ⅲ组与Ⅰ组间差异显著(P < 0.05);第30天时,Ⅱ、Ⅲ、Ⅳ组的直肠温度均低于Ⅰ组,其中,Ⅲ组与Ⅰ组间差异显著(P < 0.05)。
|
|
表 2 饲粮中添加GABA对鸡直肠温度的影响 Table 2 Effects of dietary GABA on rectal temperature of chickens |
由此可见,饲粮中添加GABA降低了夏季热应激鸡的直肠温度,其中以Ⅲ组效果最佳。
2.3 饲粮中添加GABA对鸡生长性能的影响由表 3可知,与Ⅰ组相比,第1~10天和第11~20天,Ⅱ、Ⅲ、Ⅳ组的平均日采食量无显著差异(P>0.05);第21~30天,Ⅱ、Ⅲ组的平均日采食量显著高于Ⅰ组(P < 0.05)。第1~10天,Ⅱ、Ⅲ、Ⅳ组的平均日增重极显著高于Ⅰ组(P < 0.01);第11~20天,Ⅲ、Ⅳ组的平均日增极显著高于Ⅰ组(P < 0.01);第21~30天,Ⅲ组的平均日增极显著高于Ⅰ组(P < 0.01),Ⅱ、Ⅳ组的平均日增显著高于Ⅰ组(P < 0.05)。各组之间各个阶段的料重比无显著差异(P>0.05),均是Ⅰ组最高,Ⅲ组最低。
|
|
表 3 饲粮中添加GABA对鸡生长性能的影响 Table 3 Effects of dietary GABA on growth performance of chickens |
由表 4可知,与Ⅰ组相比,第10、20、30天时,Ⅱ、Ⅲ、Ⅳ组血清中CRH含量均降低。其中,第10天时,Ⅱ组血清中CRH含量显著低于Ⅰ组(P < 0.05),Ⅲ组血清中CRH含量极显著低于Ⅰ组(P < 0.01);第20天时,Ⅱ、Ⅲ、Ⅳ组血清中CRH含量虽降低,但与Ⅰ组间差异不显著(P>0.05);第30天时,Ⅲ、Ⅳ组血清中CRH含量显著低于Ⅰ组(P < 0.05)。
|
|
表 4 饲粮中添加GABA对鸡血清中CRH含量的影响 Table 4 Effects of dietary GABA on serum CRH content of chickens |
由此可见,饲粮中添加GABA降低了夏季热应激鸡血清中CRH含量,其中以Ⅲ组效果最佳。
由表 5可知,与Ⅰ组相比,第10、20、30天时,Ⅱ、Ⅲ、Ⅳ组血清中ACTH含量均降低。其中,第10天时,Ⅱ组血清中ACTH含量显著低于Ⅰ组(P < 0.05),Ⅲ组血清中ACTH含量极显著低于Ⅰ组(P < 0.01);第20天时,Ⅲ组血清中ACTH含量显著低于Ⅰ组(P < 0.05);第30天时,Ⅱ组血清中ACTH含量显著低于Ⅰ组(P < 0.05),Ⅲ组血清中ACTH含量极显著低于Ⅰ组(P < 0.01)。
|
|
表 5 饲粮中添加GABA对鸡血清中ACTH含量的影响 Table 5 Effects of dietary GABA on serum ACTH content of chickens |
由此可见,饲粮中添加GABA降低了夏季热应激鸡血清中ACTH含量,其中以Ⅲ组效果最佳。
由表 6可知,与Ⅰ组相比,第10、20、30天时,Ⅱ、Ⅲ、Ⅳ组血清中Cor含量均降低。其中,第10天时,Ⅲ组血清中Cor含量显著低于Ⅰ组(P < 0.05);第20天时,Ⅱ、Ⅲ、Ⅳ组血清中Cor含量虽降低,但与Ⅰ组间差异不显著(P>0.05);第30天时,Ⅱ、Ⅲ、Ⅳ组血清中Cor含量均极显著低于Ⅰ组(P < 0.01)。
|
|
表 6 饲粮中添加GABA对鸡血清中Cor含量的影响 Table 6 Effects of dietary GABA on serum Cor content of chickens |
由此可见,饲粮中添加GABA降低了夏季热应激鸡血清中Cor含量,其中以Ⅲ组效果最佳。
2.5 饲粮中添加GABA对鸡血清中HSP70含量的影响由表 7可知,与Ⅰ组相比,第10、20、30天时,Ⅱ、Ⅲ、Ⅳ组血清中HSP70含量均降低。其中,第10天时,Ⅲ组血清中HSP70含量极显著低于Ⅰ组(P < 0.01),Ⅱ组血清中HSP70含量显著低于Ⅰ组(P < 0.05);第20天时,Ⅲ组血清中HSP70含量极显著低于Ⅰ组(P < 0.01);第30天时,Ⅲ组血清中HSP70含量极显著低于Ⅰ组(P < 0.01),Ⅱ组血清中HSP70含量显著低于Ⅰ组(P < 0.05)。
|
|
表 7 饲粮中添加GABA对鸡血清中HSP70含量的影响 Table 7 Effects of dietary GABA on serum HSP70 content of chickens |
由此可见,饲粮中添加GABA降低了夏季热应激鸡血清中HSP70含量,其中以Ⅲ组效果最佳。
2.6 饲粮中添加GABA对鸡血清中GABA含量的影响由表 8可知,与Ⅰ组相比,第10、20、30天时,Ⅱ、Ⅲ、Ⅳ组血清中GABA含量均提高。其中,第10天时,Ⅲ、Ⅳ组血清中GABA含量极显著高于Ⅰ组(P < 0.01),Ⅱ组血清中GABA含量显著高于Ⅰ组(P < 0.05);第20、30天时,Ⅳ组血清中GABA含量极显著高于Ⅰ组(P < 0.01)。
|
|
表 8 饲粮中添加GABA对鸡血清中GABA含量的影响 Table 8 Effects of dietary GABA on serum GABA content of chickens |
由表 9可知,与Ⅰ组相比,第10、20、30天时,Ⅲ组脑组织中GABA含量均提高。其中,第10、30天时,Ⅲ组脑组织中GABA含量显著高于Ⅰ组(P < 0.05)。
|
|
表 9 饲粮中添加GABA对鸡脑组织中GABA含量的影响 Table 9 Effects of dietary GABA on brain tissue GABA content of chickens |
由此可见,饲粮中添加GABA提高了夏季热应激鸡脑组织中HSP7含量。
3 讨论 3.1 饲粮中添加GABA对鸡生长性能的影响本研究所用动物为28~58日龄的淮南麻黄鸡,是肉蛋兼用型安徽省优质地方良种鸡,《淮南麻黄鸡青年鸡饲养管理规程》(DB34/T 884—2009)[14]中指出:淮南麻黄鸡青年鸡最适宜的环境温度为13~25 ℃。当环境温度超过27 ℃时,即可引起家禽发生热应激[15]。试验期间鸡舍环境温度最低28 ℃,最高39 ℃,THI为80~90,说明试验期间鸡处于热应激状态。
遭受热应激的鸡体温升高、采食量减少、体增重降低[16]。陈黎龙等[17]在饲粮中添加30 mg/kg GABA,提高了淮南麻黄鸡的平均日增重,降低了料重比。研究发现,饲粮中分别添加50、100、150、200 mg/kg GABA,肉鸡的平均日增重和平均日采食量升高,而料重比降低[18]。本试验结果发现,饲粮中添加GABA降低了鸡的直肠温度和料重比,增加了体重,有效缓解了淮南麻黄鸡的夏季热应激。
3.2 饲粮中添加GABA对鸡血清HSP70含量的影响热休克蛋白是评价细胞损伤和遭受热应激的常用指标,HSP70以分子伴侣的形式发挥抵抗热应激损伤的作用,热应激时,HSP70基因表达量迅速提高[19]。本试验结果发现,饲粮中添加GABA降低了鸡血清HSP70含量,这可能是由于GABA缓解了淮南麻黄鸡热应激所致,戴四发[20]研究发现,饲粮中添加GABA能够抑制热应激下家禽骨骼肌细胞HSP70的过多表达。
3.3 饲粮中添加GABA对鸡血清HPA轴激素含量的影响HPA轴激素适度分泌有利于抵抗应激,但过度分泌会对动物机体产生不利影响[21]。本试验结果发现,饲粮中添加GABA抑制了鸡HPA轴激素的分泌,有效缓解了热应激。有报道指出,脑内分泌的GABA能够作用于CRH神经元调节HPA轴激素分泌[9-10],但目前尚未见脑组织外的GABA调节HPA轴激素分泌机制的研究报道。正常情况下GABA不能自由穿过成年动物和4周龄后鸡的血脑屏障[11],而本试验结果发现,Ⅲ组鸡脑组织中GABA含量显著高于Ⅰ组,这说明GABA穿过了鸡的血脑屏障。本课题组前期研究发现,给常温饲养的成年鸡静脉注射GABA并不能使其脑组织中GABA含量升高,说明常温环境下鸡血脑屏障的完整性良好;而给高温饲养的成年鸡静脉注射GABA,其脑组织中GABA含量显著升高,说明高温破坏了鸡的血脑屏障,使其通透性增大,GABA进入脑内,电镜观察结果也证明高温破坏了鸡的血脑屏障[22]。由此推断,夏季高温破坏了鸡的血脑屏障,使得由摄食吸收的GABA穿过受损的血脑屏障进入脑组织内,从而发挥对HPA轴的调控作用。
3.4 饲粮中添加GABA对鸡血清和脑组织中GABA含量的影响正常情况下GABA不能自由穿过哺乳动物的血脑屏障[23]。Knych等[24]给马静脉注射和口服GABA,证明外源性GABA无法进入到脑中。给鼠、家兔和猫注射GABA时,不能引起脑电生理活动,脑内GABA含量也不随着血液中GABA含量升高而上升,而当血脑屏障受到破坏时,注射GABA可引起脑电生理活动[25]。以上研究表明,正常情况下静脉或口服外源性GABA均不能穿过哺乳动物血脑屏障。鸡4周龄后血脑屏障发育完全,经静脉或口服给药很难进入脑组织内发挥作用[12],而本试验所用的淮南麻黄鸡大于4周龄,血脑屏障发育完整,GABA是不能穿过血脑屏障的。本试验结果显示,随饲粮中GABA添加量的增加,血清中GABA含量也呈递增趋势;Ⅲ组脑组织中的GABA含量在第10和30天显著高于Ⅰ组,说明饲粮中添加的GABA吸收后通过血液循环进入了脑内。张礼[26]用添加GABA的饲粮饲喂热应激肉鸭后发现,鸭的心脏、肝脏、肾脏等器官中GABA含量均无显著变化,只有脑中GABA含量显著提高,与本试验结果相符。4 h热应激导致大鼠脑内微血管塌陷,血管周围水肿和细胞膜受损[27]。本课题组前期研究发现,人工短时间高温使鸡的血脑屏障结构受到破坏,脑组织中紧密连接蛋白的mRNA及蛋白质的表达量显著低于常温组[22]。由此推断,鸡在持续不断遭受夏季热应激时,脑内血脑屏障逐渐被破坏,使得正常时不能穿过血脑屏障的GABA进入脑组织内。
本试验结果发现,虽然Ⅳ组饲粮中GABA添加量最高,但抗热应激指标和生长性能并不是最好,这说明并不是饲粮中GABA添加量越高穿过血脑屏障的GABA就越多。GABA属于氨基酸,而氨基酸主要是通过易化扩散透过血脑屏障的[28],热应激能够破坏鼠的血脑屏障,增加血脑屏障的通透性,使得GABA通过易化扩散方式通过血脑屏障进入脑内[29]。易化扩散有饱和性,它只能顺浓度差移动,在易化扩散过程中,当单位体积的溶质颗粒数目达到某一临界值后,再增加膜内外的浓度差也不能使透过率增加。当浸泡红细胞的血浆中葡萄糖浓度在1 mg以下时,浓度差与透入率呈线性关系,但在1 mg以上时,再提高血浆中的葡萄糖浓度就不能使葡萄糖的透入率继续呈正比增加[28]。由此推断,Ⅳ组饲粮中GABA添加量虽然最高,但可能受易化扩散饱和度的影响,进入脑内的GABA并不是最多,这可能是Ⅳ组饲粮中GABA添加量最高但抗热应激指标和生长性能并不是最好的原因之一,其他原因有待于今后深入研究。
4 结论饲粮中添加GABA降低了夏季热应激鸡的直肠温度及血清中CRH、ACTH、Cor、HSP70含量,其中以Ⅲ组效果最佳。GABA具有抑制夏季热应激鸡HPA轴激素分泌的功能。
| [1] |
罗锐, 张彬, 宋虎威. γ-氨基丁酸在猪生产中的应用研究进展[J]. 饲料博览, 2011(1): 18-20. DOI:10.3969/j.issn.1001-0084.2011.01.006 |
| [2] |
李晓清, 田子罡, 张军, 等. γ-氨基丁酸生物学功能及作用机制的研究进展[J]. 中国饲料, 2011(9): 18-21. DOI:10.3969/j.issn.1004-3314.2011.09.004 |
| [3] |
ZHANG M, ZOU X T, LI H, et al. Effect of dietary γ-aminobutyric acid on laying performance, egg quality, immune activity and endocrine hormone in heat-stressed Roman hens[J]. Animal Science Journal, 2012, 83(2): 141-147. DOI:10.1111/asj.2012.83.issue-2 |
| [4] |
CHENG J B, ZHENG N, SUN X Z, et al. Feeding rumen-protected gamma-aminobutyric acid enhances the immune response and antioxidant status of heat-stressed lactating dairy cows[J]. Journal of Thermal Biology, 2016, 60: 103-108. DOI:10.1016/j.jtherbio.2016.06.011 |
| [5] |
CHEN Z, XIE J, WANG B, et al. Effect of γ-aminobutyric acid on digestive enzymes, absorption function, and immune function of intestinal mucosa in heat-stressed chicken[J]. Poultry Science, 2014, 93(10): 2490-2500. DOI:10.3382/ps.2013-03398 |
| [6] |
徐同锏, 钟刚, 王希春, 等. 脂肪包被γ-氨基丁酸对持续热应激奶牛HPA轴和部分免疫指标的影响[J]. 南京农业大学学报, 2014, 37(1): 127-132. |
| [7] |
邹晓庭, 胡家澄, 曹德瑞, 等. γ-氨基丁酸对夏季高温期生长肥育猪生产性能、抗氧化及HPA、HPT轴激素分泌的影响[J]. 畜牧兽医学报, 2009, 40(8): 1196-1201. DOI:10.3321/j.issn:0366-6964.2009.08.011 |
| [8] |
BARRAGAN A, WEIDNER J M, JIN Z, et al. GABA ergic signalling in the immune system[J]. Acta Physiologica, 2015, 213(4): 819-827. DOI:10.1111/apha.2015.213.issue-4 |
| [9] |
LEVY B H, TASKER J G. Synaptic regulation of the hypothalamic-pituitary-adrenal axis and its modulation by glucocorticoids and stress[J]. Frontiers in Cellular Neuroscience, 2012, 6: 24. |
| [10] |
DROUET J B, FAUVELLE F, MAUNOIR-REGIMBAL S, et al. Differences in prefrontal cortex GABA/glutamate ratio after acute restraint stress in rats are associated with specific behavioral and neurobiological patterns[J]. Neuroscience, 2015, 285: 155-165. DOI:10.1016/j.neuroscience.2014.10.058 |
| [11] |
ABBOTT N J, PATABENDIGE A A K, DOLMAN D E M, et al. Structure and function of the blood-brain barrier[J]. Neurobiology of Disease, 2010, 37(1): 13-25. DOI:10.1016/j.nbd.2009.07.030 |
| [12] |
斯托凯.禽类生理学[M].《禽类生理学》翻译组译.北京: 科学出版社, 1982.
|
| [13] |
INGRAHAM R H, STANLEY R W, WAGNER W C. Relationship of temperature and humidity to conception rate of Holstein cows in Hawaii[J]. Journal of Dairy Science, 1976, 59(12): 2086-2090. DOI:10.3168/jds.S0022-0302(76)84491-8 |
| [14] |
安徽省质量技术监督局.DB34/T 884-2009淮南麻黄鸡青年鸡饲养管理规程[S].合肥: 安徽省质量技术监督局, 2009.
|
| [15] |
王继华, 傅庆民. 鸡饲料配方设计技术[M]. 北京: 中国农业大学出版社, 2005: 239.
|
| [16] |
OKUYAMA H, KHAN S I, TSUKADA A, et al. Heat exposure alters the mRNA expression of growth- and stress-related genes in chicks[J]. Livestock Science, 2017, 198: 97-103. DOI:10.1016/j.livsci.2017.02.010 |
| [17] |
陈黎龙, 游金明, 黄建珍, 等. γ-氨基丁酸对崇仁麻鸡生长性能和血液生理生化指标的影响[J]. 动物营养学报, 2010, 22(2): 452-459. DOI:10.3969/j.issn.1006-267x.2010.02.031 |
| [18] |
李超, 赵青余, 马悦培, 等. γ-氨基丁酸对持续高温热应激肉仔鸡生产性能和血液指标的影响[J]. 中国兽医学报, 2010, 30(4): 556-559. |
| [19] |
白水莉, 章世元, 刘大林. 鸡热应激与热应激蛋白的作用机理研究[J]. 饲料工业, 2007, 28(13): 14-16. DOI:10.3969/j.issn.1001-991X.2007.13.005 |
| [20] |
戴四发.谷氨酰胺和γ-氨基丁酸对肉鸡抗热应激和肉品质的影响及机理探讨[D].博士学位论文.南京: 南京农业大学, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10307-1013282892.htm
|
| [21] |
李文华, 刘忠, 袁东亚. 高原分子医学[M]. 上海: 复旦大学出版社, 2011.
|
| [22] |
姜丹, 冯士彬, 王希春, 等. 高温对淮南麻黄鸡血脑屏障的影响[J]. 畜牧兽医学报, 2017, 48(4): 769-776. |
| [23] |
HAWKER D D, SILVERMAN R B. Synthesis and evaluation of novel heteroaromatic substrates of GABA aminotransferase[J]. Bioorganic & Medicinal Chemistry, 2012, 20(19): 5763-5773. |
| [24] |
KNYCH H K, STEINMETZ S J, MCKEMIE D S. Endogenous concentrations, pharmacokinetics, and selected pharmacodynamic effects of a single dose of exogenous GABA in horses[J]. Journal of Veterinary Pharmacology and Therapeutics, 2015, 38(2): 113-122. DOI:10.1111/jvp.2015.38.issue-2 |
| [25] |
VAN GELDER N M, ELLIOTT K A C. Disposition of γ-aminobutyric acid administered to mammals[J]. Journal of Neurochemistry, 1958, 3(2): 139-143. DOI:10.1111/jnc.1958.3.issue-2 |
| [26] |
张礼.γ-氨基丁酸对热应激肉鸭生产性能的影响[D].博士学位论文.泰安: 山东农业大学, 2010. http://cdmd.cnki.com.cn/article/cdmd-10434-1011098057.htm
|
| [27] |
SHARMA H S. Hyperthermia influences excitatory and inhibitory amino acid neurotransmitters in the central nervous system[J]. Journal of Neural Transmission, 2006, 113(4): 497-519. DOI:10.1007/s00702-005-0406-1 |
| [28] |
邓孔昭, 黄如训. 血脑屏障[M]. 北京: 人民卫生出版社, 1984.
|
| [29] |
MURESANU D F, SHARMA A, SHARMA H S. Diabetes aggravates heat stress-induced blood-brain barrier breakdown, reduction in cerebral blood flow, edema formation, and brain pathology[J]. Annals of the New York Academy of Sciences, 2010, 1199(1): 15-26. DOI:10.1111/j.1749-6632.2009.05328.x |




