2. 赢创德固赛(中国)投资有限公司广州分公司, 广州 510050;
3. 农业部饲料生物技术重点开放实验室, 北京 100081
2. Evonik Degussa(China) Co., Ltd., Branch Company in Guangzhou, Guangzhou 510050, China;
3. Key Laboratory of Feed Biotechnology of Ministry of Agriculture, Feed Research Institute, Chinese Academy of Agricultural Sciences, Beijing 100081, China
鲤鱼(Cyprinus carpio)是全球最早集约化养殖的鱼类品种之一,关于鲤鱼蛋氨酸(Met)需求量的研究早在20世纪80年代就已有报道[1-3]。不同来源的Met,包括DL-Met、羟基蛋氨酸类似物钙盐(MHA-Ca),在不同含硫氨基酸[Met+半胱氨酸(Cys)]含量基础上Met基础含量为3.9~4.9 g/kg,Cys含量为3.0~7.9 g/kg,依据最高生长性能获得鲤鱼对Met的需求量变化范围较大,最低为5.3 g/kg,最高达到12.0 g/kg,占饲料蛋白质的1.69%~3.73%[4-9]。NRC(2011)建议幼鲤对饲料中Met需求量为7.0 g/kg(Cys含量为3.0 g/kg),占饲料可消化蛋白质的2.18%[1]。硬骨鱼类的必需氨基酸需求量与其鱼体必需氨基酸组成相近,含硫氨基酸需求量占饲料蛋白质的2%~5%[10]。
全球鱼粉资源缺乏,价格昂贵,鲤鱼市场价格常年低迷,无鱼粉饲料已经成为常态,Met已成为鲤鱼商品饲料中的第一限制性氨基酸。Met代谢生成的Cys可参与抗氧化物质谷胱甘肽(GSH)[11]和牛磺酸的合成,且其本身的巯基具有氧化还原的特点,使其在机体抗氧化系统中发挥着重要作用[12-13];Met具有促进脂肪分解代谢的作用,并为胆碱、甜菜碱、叶酸、维生素B12的合成提供甲基,维持体内氨基酸平衡[14]。由于文献报道的鲤鱼Met需求量荐范围过大,难以实际应用,而且晶体Met或MHA-Ca易在水中溶失,水产动物摄入的饲料中氨基酸含量的低于配方中氨基酸含量[15]。此外,无胃鱼是否能够有效利用晶体氨基酸一直存在争议,低投喂频率(1~2次/d)下可能存在不同步吸收的问题[16-18]。蛋氨酸二肽(Met-Met)是由4种不同结构的二肽组成的混合物(DL-Met-Met、LD-Met-Met、DD-Met-Met和LL-Met-Met),在水中的溶解度极低,在水产动物体内均能被消化成游离的DL-Met缓慢释放,从而被吸收[19]。目前Met-Met是否能提高无胃鱼的生产性能和蛋白质沉积率目前尚未见报道。本试验通过梯度饲喂试验,以生长性能和机体氨基酸池及相关生理指标为依据,对Met-Met在幼鲤饲料中的有效性进行研究,并基于Met-Met对幼鲤的Met需求量进行再评估。
1 材料与方法 1.1 试验饲料与试验设计试验用Met-Met由德国赢创德固赛公司提供,纯度为95%。在以豌豆浓缩蛋白作为蛋白质源的低Met基础饲料(Met含量为4.8 g/kg,Cys含量为4.4 g/kg)中分别添加0、1.5、2.0、2.5、3.0、4.0 g/kg的Met-Met, 配制6种试验饲料,分别用M0、M1.5、M2、M2.5、M3、M4命名,另配制含10%鱼粉同时补充3.0 g/kg晶体DL-Met的试验饲料,用FM命名。试验饲料组成及营养水平见表 1,试验饲料Met-Met含量与氨基酸组成见表 2。将饲料原料粉碎混匀后,蒸汽75 ℃调质,使用环膜蒸汽制粒机(MYZL180,江苏牧羊集团)制成直径为2.5 mm的硬颗粒饲料,自然晾干后备用。
|
|
表 1 试验饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of experimental diets (air-dry basis) |
|
|
表 2 试验饲料Met-Met含量与必需氨基酸组成(干物质基础) Table 2 Met-Met content and EAA composition of experimental diets (DM basis) |
试验在国家水产饲料安全评价基地(北京,南口)室内循环流水养殖系统容积为0.26 m3的圆锥形养殖桶中进行。试验正式开始前,试验鱼在养殖系统中暂养数周,暂养期间投喂含10%鱼粉的试验饲料。随机挑选体质健康、个体均匀的幼鲤[平均体重为(16.7±0.08) g],随机分为7组,每组6个重复,每个重复(桶)30尾,分别饲喂1种试验饲料,以饲喂含10%鱼粉饲料的组为正对照组(FM组),试验期为10周。每天表观饱食投喂2次,投喂时间分别为08:00、16:00。定期检测水质,水质条件保持在溶氧(DO)浓度>7.0 mg/L,总氨氮(NH4+-N)浓度<0.3 mg/L,pH=7.5~8.5,水温保持在(20±3) ℃。试验期间记录每日摄食量。
1.3 样品采集和指标检测试验结束时,每桶鱼饥饿24 h后称重,统计摄食量,计算生长指标。每桶随机取6尾鱼,三氯叔丁醇(300 mg/L)麻醉后测量体长、体重,然后尾静脉取血,取内脏和肝脏称重,用于计算形体指标。血液采用氟化钠草酸钾抗凝,在4 ℃、4 000 r/min的条件下离心10 min,取上层血浆保存在-80 ℃冰箱中待测。每桶另取3尾鱼,70 ℃烘干后粉碎待测体成分。饲料和全鱼样品分别采用105 ℃常压干燥法(GB/T 6435—2014)、凯氏定氮法(GB/T 6432—2018)、550 ℃灼烧法(GB/T 6438—2007)、反相高效液相色谱法(GB/T 18246—2000)测定水分、粗蛋白质、粗灰分、氨基酸含量。饲料中粗脂肪含量采用GB/T 6433—2006所述方法测定,总能采用氧弹仪燃烧法(GB/T 213—2008)测定,Met-Met含量采用AOAC(2005)[20]中方法测定。
血浆生化指标包括总胆固醇(TC)、甘油三酯(TG)、高密度脂蛋白胆固醇(HDL-C)、总蛋白(TP)、白蛋白(ALB)、葡萄糖(GLU)、尿素氮(UN)含量以及谷丙转氨酶(ALT)、谷草转氨酶(AST)活性;血浆抗氧化指标包括丙二醛(MDA)含量、总抗氧化能力(T-AOC)、谷胱甘肽硫转移酶(GST)活性。其中TC、TG、HDL-C含量测定试剂盒购自浙江东瓯诊断产品有限公司,其余指标测定试剂盒购自南京建成生物工程研究所。按说明书所述方法使用酶标仪(Bio-Tek,美国)对各指标进行检测。
1.4 计算公式

|
式中:N0为初始鱼数量(尾);Nt为终末鱼数量(尾);W0为初始体总重(g);Wt为终末鱼体总重(g);Wd为死亡鱼体总重(g);C为摄食量(g);t为养殖天数;Baat为终末鱼体氨基酸含量(%);Baa0为初始鱼体氨基酸含量(%);Daa为饲料氨基酸含量(%);DM为饲料干物质含量(%);Bpt为终末鱼体粗蛋白质含量(%);Bp0为初始鱼体粗蛋白质含量(%);Dp为饲料粗蛋白质含量(%)。
1.5 数据统计与分析试验数据以平均值±标准误(mean±SE)表示,所有数据用SPSS 20.0软件进行单因素方差分析(one-way ANOVA),并采用Duncan氏法进行组间多重比较,显著性水平为P < 0.05。幼鲤的Met需求量用一元二次线性回归模型(y=ax2+bx+c;其中y代表相应指标,x代表饲料Met含量,a代表方程截距,b代表线性项系数,c代表二次项系数)和折线回归模型(y=a+bx;其中y代表相应指标,x代表饲料Met含量,a代表线性回归截距,b代表线性回归斜率)确定[21],回归模型使用GraphPad Prism 6.0进行分析与绘制。
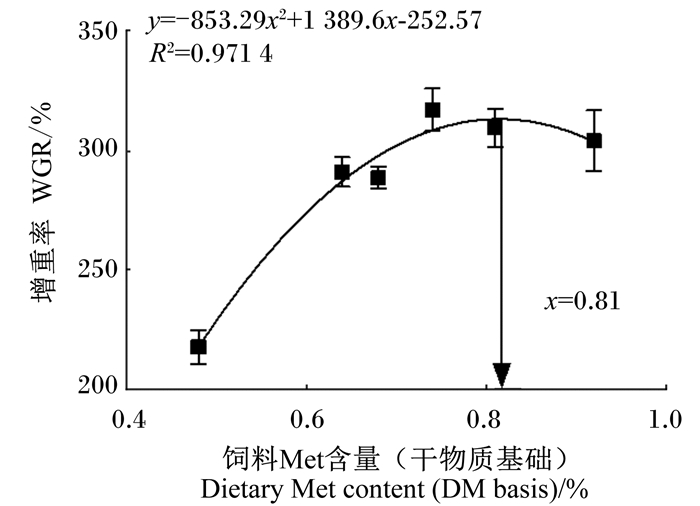
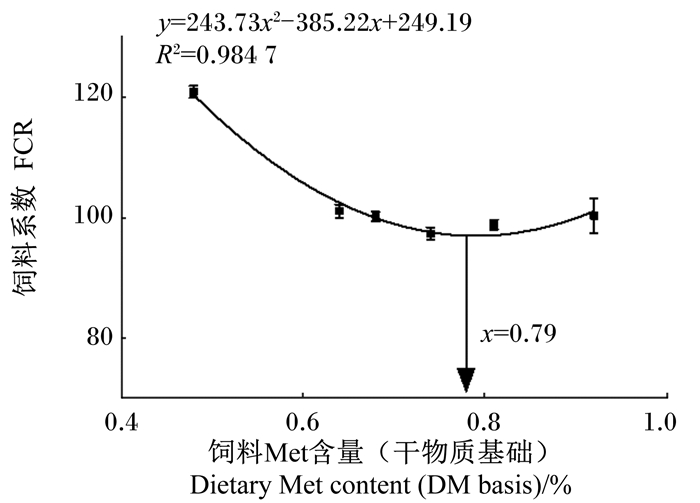
2 结果与分析 2.1 饲料中添加不同水平Met-Met对幼鲤生长性能和形体指标的影响饲料中添加不同水平Met-Met对幼鲤生长性能的影响见表 3。试验各组存活率均大于99%。与M0组(未添加Met-Met组)相比,各Met-Met添加组幼鲤的末均重、增重率、特定生长率均显著增加(P < 0.05),而饲料系数均显著降低(P < 0.05)。此外,M0组幼鲤的摄食率显著高于除M4组外的其余各组(P < 0.05)。各Met-Met添加组幼鲤的摄食率与FM组没有显著差异(P > 0.05)。当饲料中Met-Met添加量达到2.5 g/kg时,增重率和特定生长率达到最大且饲料系数最低,生长性能优于FM组(饲料中含10%鱼粉的正对照组)。对增重率(y)和饲料Met含量(x)进行一元二次回归模型分析,如图 1所示,通过回归方程y=-853.29x2+1 389.6x-252.57(R2=0.971 4)可知,在饲料Met含量达到8.1 g/kg时,增重率最高,据此获得幼鲤的Met需求量为8.1 g/kg;对饲料系数(y)和饲料Met含量(x)进行一元二次回归模型分析,如图 2所示,通过回归方程(y=243.73x2-385.22x+249.19,R2=0.984 7)可知,在饲料Met含量为7.9 g/kg时,饲料系数最低,据此获得幼鲤的Met需求量为7.9 g/kg。
|
|
表 3 饲料中添加不同水平Met-Met对幼鲤生长性能和形体指标的影响 Table 3 Effects of diets with different Met-Met supplemental levels on growth performance and body shape indexes of juvenile common carp (n=6) |
|
图 1 饲料Met含量与幼鲤增重率的回归关系 Fig. 1 Regression relationship between dietary Met content and WGR of juvenile common carp |
|
图 2 饲料Met含量与幼鲤饲料系数的回归关系 Fig. 2 Regression relationship between dietary Met content and FCR of juvenile common carp |
由表 3可知,与M0组相比,饲料中添加不同水平Met-Met后幼鲤的肝胰指数和脏体指数均有所降低,其中M1.5和M4组的肝胰指数以及M2.5和M3组的脏体指数与M0组的差异达到显著水平(P < 0.05)。在相近的饲料Met含量下,FM组与M3组的肥满度差异显著(P < 0.05)。
2.2 饲料中添加不同水平Met-Met对幼鲤体成分、全鱼必需氨基酸含量以及蛋白质、必需氨基酸、Met和Lys沉积率的影响饲料中添加不同水平Met-Met对幼鲤体成分的影响见表 4。与M0组相比,饲料中添加不同水平Met-Met均可增加全鱼水分含量,其中M1.5组与对照组的差异达到显著水平(P < 0.05),但对全鱼粗蛋白质含量无显著影响(P > 0.05)。M0组全鱼粗灰分含量显著高于其余各组(P < 0.05),其余各组间差异不显著(P > 0.05)。
|
|
表 4 饲料中添加不同水平Met-Me对幼鲤体成分的影响 Table 4 Effects of diets with different Met-Met supplemental levels on body composition of juvenile common carp (n=3) |
饲料中添加不同水平Met-Me对幼鲤全鱼必需氨基酸含量的影响见表 5。与M0组相比,饲料中添加不同水平Met-Met均可显著增加全鱼中Met、Met+Cys、赖氨酸(Lys)、色氨酸(Trp)、异亮氨酸(Ile)、亮氨酸(Leu)、缬氨酸(Val)、组氨酸(His)的含量(P < 0.05),但各Met-Met添加组之间无显著差异(P > 0.05),且各Met-Met添加组与FM组也没有显著差异(P > 0.05)。M0组全鱼中Thr含量显著低于M3、M4组(P < 0.05),其他组间差异不显著(P > 0.05)。
|
|
表 5 饲料中添加不同水平Met-Me对幼鲤全鱼必需氨基酸含量的影响 Table 5 Effects of diets with different Met-Met supplemental levels on essential amino acid contents in whole body of juvenile common carp (n=3) |
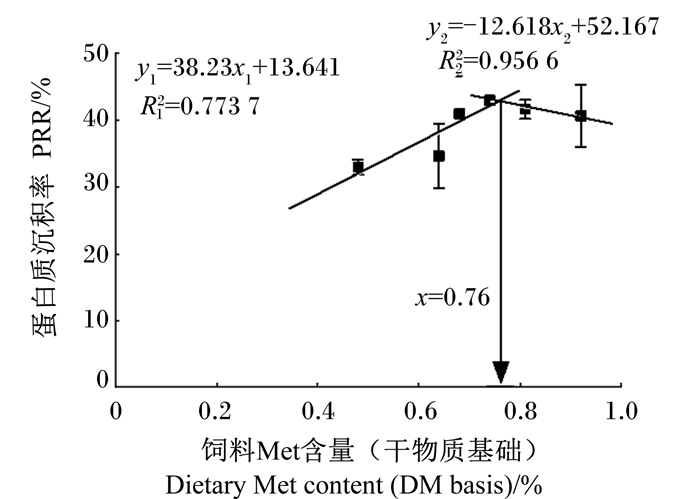
饲料中添加不同水平Met-Met对幼鲤蛋白质、必需氨基酸、Met和Lys沉积率的影响见表 6。鱼体蛋白质沉积率随饲料Met-Met添加水平的增加先增加后降低,蛋白质沉积率(y)和饲料Met含量(x)进行折线模型分析,如图 3所示,通过折线模型(y1=38.23x1+13.641,R12=0.773 7;y2=-12.618x2+52.167,R22=0.956 6)可知,饲料Met含量为7.6 g/kg时,蛋白质沉积率达到最大,据此获得幼鲤的Met需求量为7.6 g/kg。M0组幼鲤必需氨基酸沉积率显著低于其余各组(P < 0.05);Met沉积率随Met-Met添加量的增加整体呈下降趋势,M0、M1.5、M2、M2.5组的Met沉积率显著高于FM组(P < 0.05)。除M1.5组外,各Met-Met添加组Lys沉积率均显著高于M0组(P < 0.05),且各Met-Met添加组之间以及它们与FM组之间均没有显著差异(P > 0.05)。
|
|
表 6 饲料中添加不同水平Met-Me对幼鲤蛋白质、必需氨基酸、Met和Lys沉积率的影响 Table 6 Effects of diets with different Met-Met supplemental levels on protein, EAA, Met and Lys retention rates of juvenile common carp (n=3) |
|
图 3 饲料Met含量与幼鲤蛋白质沉积率的回归关系 Fig. 3 Regression relationship between dietary Met content and PRR of juvenile common carp |
饲料中添加不同水平Met-Met对幼鲤血浆生化及抗氧化指标的影响见表 7。各组血浆生化指标(UN、ALB、GLU、TC、TG、TP含量与ALT、AST活性)基本都在参考值范围之内;各组血浆GLU含量都处于较低水平;与M0组相比,饲料中添加不同水平Met-Met均显著降低了血浆UN含量(P < 0.05),而M0组与FM组差异不显著(P > 0.05);与M0组相比,饲料中添加不同水平Met-Met不同程度地增加了血浆TP含量,M3、M4组与M0组的差异达到显著水平(P < 0.05),且M3、M4组能获得与FM组相当的效果(P > 0.05)。血浆ALT活性随Met-Met添加量的增加呈波动变化,M2、M2.5、M3组显著低于M0、FM组(P < 0.05),M4组显著高于M0、FM组(P < 0.05)。M2、M2.5、M3、M4组血浆AST活性显著高于FM组(P < 0.05)。血浆TC含量随饲料Met-Met添加量的增加基本呈降低趋势,其中M1.5、M3、M4组显著低于M0组(P < 0.05)。M2.5组的血浆TG含量最低,显著低于M0组(P < 0.05)。M2、M3、M4组血浆HDL-C含量显著低于M0组(P < 0.05)。M4组血浆HDL-C/TC显著高于FM和M0组(P < 0.05)。与M0组相比,饲料中添加不同水平Met-Met不同程度地增加了血浆T-AOC,且不同程度地降低了血浆GST活性,其中M2、M4组血浆T-AOC以及M2、M2.5、M4组血浆GST活性与M0组的差异达到了显著水平(P < 0.05)。血浆MDA含量以M3组最低,显著低于除M1.5、M4组外的其余各组(P < 0.05)。
|
|
表 7 饲料中添加不同水平Met-Met对幼鲤血浆生化及抗氧化指标的影响 Table 7 Effects of diets with different Met-Met supplemental levels on plasma biochemical and antioxidant parameters of juvenile common carp (n=12) |
目前,鱼类饲料中关于Met需求量已有大量报道,大部分鱼类品种对Met需求量均占饲料蛋白质的2%左右[23-25]。一般看来,在生长速度较快的幼鱼期氨基酸需求量要大于成鱼期,肉食性鱼类[26]高于杂食性鱼类[27]。对于鲤鱼Met需求量的研究,依据生长性能确定的需求量在5.3~12.0 g/kg(占饲料蛋白质的1.69%~3.73%)[1, 4, 28-29]。已有研究中存在的主要问题是饲料加工工艺脱离实际,试验鱼的生长性能偏低,饲料系数偏高(>2),对商业鲤鱼饲料配方的指导意义有限。Tang等[8]研究发现,在含Cys 3.0 g/kg的饲料中添加MHA-Ca得出建鲤的Met需求量达到12 g/kg,虽然对Met需求量的评定受到投饵率、投饵频率、鱼的规格和品种、试验条件等因素的影响,但主要原因是该研究在24%的鱼粉配方条件下,经过8周试验,建鲤的特定生长率仅为1.0左右,饲料系数超过2,显著低于正常生产水平,过低的生长性能导致建鲤Met需要量的高估。本研究在每天饲喂2次的频率下,幼鲤特定生长率达到1.84~1.93,说明Met-Met相比高水溶性的晶体Met及MHA-Ca在饲喂效果和转化效率上更优。此外,本研究中试验饲料采用商品饲料中普遍采用的蒸汽调制和环模制粒工艺,也是保证幼鲤正常生长的原因之一。通过增重率和饲料系数与饲料Met含量的一元二次回归分析得出,饲料Met含量达到7.9~8.1 g/kg时,即占饲料蛋白质的2.0%~2.1%时,生长性能较佳,与Nose[1]和NRC(2011)给出的幼鲤8.0 g/kg的Met需求量接近。本研究中,饲料中添加Met-Met后幼鲤的生长与摄食均得到改善,M2.5组增重率、特定生长率均显著高于FM组。徐美娜[30]研究发现Met-Met的生物学效价是DL-Met的150%,这可能是由于Met-Met投入水中时溶失率较低[15],并且在消化道内相比晶体形式的Met能够更有效地被吸收[16-18, 31-32]。在罗非鱼的研究发现,饲料中添加适量DL-Met可促进罗非鱼脂肪沉积率、肝胰指数下降,导致出肉率下降[33]。本试验中,各Met-Met添加组相比M0与FM组,肝胰指数、脏体指数有降低趋势。同样,在大黄鱼上的研究也发现饲料中添加Met寡肽(2~8肽)相比添加晶体Met肝胰指数显著降低,这说明饲料中适量添加小肽形式的Met有助于改善幼鲤肝脏形态,促进生长。但是,本研究中,Met-Met的添加显著提高了幼鲤的蛋白质沉积率,但降低了Met沉积率,由于氨基酸利用的木桶效应作用,Met-Met的添加也提高了幼鲤的Lys与必需氨基酸沉积率,这与Wang等[23]与贾鹏等[24]研究发现植物性蛋白质源替代鱼粉时添加DL-Met或者MHA-Ca可以有效提高异育银鲫Lys沉积率,促进异育银鲫生长的结果相一致。在相近的饲料Met含量下,M2.5组幼鲤的Met沉积率显著高于FM组,说明Met-Met利用率相比DL-Met更好。据此推测,与晶体和其他形式的Met相比,饲料中Met-Met提供的Met与蛋白质源中结合态Met的消化吸收特性相似,以Met-Met为Met来源评估幼鲤Met需求量会更加准确。
3.2 饲料中添加不同水平Met-Met对幼鲤血浆生化和抗氧化指标的影响对必需氨基酸需求量的设定除了要满足水产动物的需求外,还要考虑水产动物健康,血浆生化指标能够直观地反映鱼体生理代谢是否正常[23]。Met及其分解代谢产物可以为体内各种生化反应提供甲基供体,促进肝脏脂肪代谢[34]并维持肝脏健康。高密度脂蛋白作为一种血清蛋白,它能够从周边组织转运胆固醇到肝脏中,参与合成胆汁酸[35]。HDL-C作为容易检出的血液指标,其占TC的比例代表鱼体脂肪代谢转运系统的状况。饲料中Met的分解代谢为肝脏中胆碱的合成提供甲基[14],为脂蛋白的合成提供了足够的磷脂,促进高密度脂蛋白的合成[36];因此,血浆中HDL/TC随着饲料中Met-Met添加量的升高而升高;同时,各组血浆TG和TC的含量因Met-Met的添加而降低,印证了适量添加Met-Met可以促进胆固醇向肝脏运输。在哺乳动物中,食物中缺乏和过量Met均会影响肝脏正常脂肪代谢[37],饲料中适量的Met会改善动物肝脏健康,这与本试验所得结果类似。血浆ALT与AST的活性是肝细胞损伤的敏感指标,Met-Met适量添加组(M2、M2.5、M3组)血浆中ALT活性显著低于M0和FM组,这一现象与在建鲤[38]上的研究结果相似。血浆UN含量能够间接反映动物体内蛋白质的代谢情况和饲料氨基酸的平衡状况,其含量与氨基酸的利用率或饲料氨基酸的平衡程度呈负相关[23]。在相同饲料Met含量下,Met-Met添加组血浆UN含量显著低于FM组,并且FM组饲料中添加了0.3%的晶体DL-Met作为补充,这种现象可能说明了Met-Met的吸收利用率高于晶体DL-Met,不易造成代谢负担。Met代谢生成的Cys可参与抗氧化物质GSH和牛磺酸的合成[11],且其本身的巯基具有氧化还原的特点,使其在机体抗氧化系统中发挥着重要作用[12-13];当肝脏受到过氧化损伤时,GST和MDA大量释放到血液中,是肝脏过氧化损伤的敏感指标。本试验中,幼鲤血浆中GST活性和MDA含量因Met-Met的添加而降低,同时总抗氧化力上升,且适量添加Met-Met组的效果好于FM组,说明饲料中添加适量Met-Met有利于促进幼鲤肝脏健康。
4 结论Met-Met可以作为幼鲤低鱼粉饲料中有效的Met补充剂。分别以增重率、饲料系数和蛋白质沉积率为指标构建回归模型,获得幼鲤Met需求量为7.6~8.1 g/kg(饲料中Met-Met添加量为2.95~3.47 g/kg),占饲料蛋白质的2.0%~2.1%。饲料中Met-Met所提供的Met与天然蛋白质源中Met在消化吸收与利用上特性相似,以Met-Met为来源评估幼鲤Met需求量更加准确。
| [1] |
NOSE T.Summary report on the requirements of essential amino acids for carp[C]//HALVER J E, TIEWS K.Finfish nutrition and fish feed technology.Berlin: Heinemann, 1979.
|
| [2] |
OGINO C. Requirements of carp and rainbow trout for essential amino acids[J]. Bulletin of the Japanese Society of Scientific Fisheries, 1980, 46(2): 171-174. DOI:10.2331/suisan.46.171 |
| [3] |
SCHWARZ F J, KIRCHGESSNER M, DEURINGER U. Studies on the methionine requirement of carp(Cyprinus carpio L.)[J]. Aquaculture, 1998, 161(1/2/3/4): 121-129. |
| [4] |
高文, 董延, SILVA C. 饲料外源添加DL-蛋氨酸对鲤鱼生长以及鱼体利用影响[J]. 海洋与渔业·水产前沿, 2013(3): 90-92. DOI:10.3969/j.issn.1672-4046.2013.03.041 |
| [5] |
周长海, 贾友刚, 齐淑艳, 等. 低鱼粉日粮添加蛋氨酸对幼鲤生长的影响[J]. 水产科学, 2011, 30(4): 206-209. DOI:10.3969/j.issn.1003-1111.2011.04.005 |
| [6] |
彭艳, 唐凌, 帅柯, 等. 蛋氨酸对幼建鲤生长及消化吸收功能的影响[J]. 中国畜牧杂志, 2009, 45(13): 33-38. |
| [7] |
单玲玲, 李小勤, 郑小淼, 等. 不同形式蛋氨酸对建鲤生长性能及血清游离氨基酸含量的影响[J]. 水生生物学报, 2015, 39(2): 259-266. |
| [8] |
TANG L, WANG G X, JIANG J, et al. Effect of methionine on intestinal enzymes activities, microflora and humoral immune of juvenile Jian carp(Cyprinus carpio var. Jian)[J]. Aquaculture Nutrition, 2009, 15(5): 477-483. DOI:10.1111/anu.2009.15.issue-5 |
| [9] |
SARDAR P, ABID M, RANDHAWA H S, et al. Effect of dietary lysine and methionine supplementation on growth, nutrient utilization, carcass compositions and haemato-biochemical status in Indian major carp, Rohu(Labeo rohita H.) fed soy protein-based diet[J]. Aquaculture Nutrition, 2009, 15(4): 339-346. DOI:10.1111/anu.2009.15.issue-4 |
| [10] |
AHMED I, KHAN M A, JAFRI A K. Dietary methionine requirement of fingerling Indian major carp, Cirrhinus mrigala(Hamilton)[J]. Aquaculture International, 2003, 11(5): 449-462. DOI:10.1023/B:AQUI.0000004181.89420.a2 |
| [11] |
WANG S T, CHEN H W, SHEEN L Y, et al. Methionine and cysteine affect glutathione level, glutathione-related enzyme activities and the expression of glutathione S-transferase isozymes in rat hepatocytes[J]. The Journal of Nutrition, 1997, 127(11): 2135-2141. DOI:10.1093/jn/127.11.2135 |
| [12] |
CHENG Z J, HARDY R W, BLAIR M. Effects of supplementing methionine hydroxy analogue in soybean meal and distiller's dried grain-based diets on the performance and nutrient retention of rainbow trout[Oncorhynchus mykiss (Walbaum)][J]. Aquaculture Research, 2003, 34(14): 1303-1310. DOI:10.1046/j.1365-2109.2003.00940.x |
| [13] |
HOSHI T, HEINEMANN S H. Regulation of cell function by methionine oxidation and reduction[J]. The Journal of Physiology, 2001, 531(1): 1-11. |
| [14] |
NWANNA L C, LEMME A, METWALLY A, et al. Response of common carp(Cyprinus carpio L.) to supplemental DL-methionine and different feeding strategies[J]. Aquaculture, 2012, 356/357: 365-370. DOI:10.1016/j.aquaculture.2012.04.044 |
| [15] |
ZARATE D D, LOVELL R T. Free lysine (L-lysine·HCl) is utilized for growth less efficiently than protein-bound lysine(soybean meal) in practical diets by young channel catfish(Ictalurus punctatus)[J]. Aquaculture, 1997, 159(1/2): 87-100. |
| [16] |
DABROWSKI K, ARSLAN M, TERJESEN B F, et al. The effect of dietary indispensable amino acid imbalances on feed intake:is there a sensing of deficiency and neural signaling present in fish?[J]. Aquaculture, 2007, 268(1/2/3/4): 136-142. |
| [17] |
DABROWSKI K, LEE K J, RINCHARD J. The smallest vertebrate, teleost fish, can utilize synthetic dipeptide-based diets[J]. The Journal of Nutrition, 2003, 133(12): 4225-4229. DOI:10.1093/jn/133.12.4225 |
| [18] |
RØNNESTAD I, CONCEIÇÃO L E C, ARAGÃO C, et al. Free amino acids are absorbed faster and assimilated more efficiently than protein in postlarval Senegal sole (Solea senegalensis)[J]. The Journal of Nutrition, 2000, 130(11): 2809-2812. DOI:10.1093/jn/130.11.2809 |
| [19] |
FERJANCIC-BIAGINI A, GIARDINA T, PUIGSERVER A. Acylation of food proteins and hydrolysis by digestive enzymes:a review[J]. Journal of Food Biochemistry, 1998, 22(4): 331-345. DOI:10.1111/jfbc.1998.22.issue-4 |
| [20] |
AOAC.Official methods of analysis[S]. 18th ed.Gaitherburg: Association of Official Analytical Chemists, 2005.
|
| [21] |
KHAN M A, ABIDI S F. Dietary methionine requirement of Indian major carp fry, Cirrhinus mrigala(Hamilton) based on growth, feed conversion and nitrogen retention efficiency[J]. Aquaculture Research, 2013, 44(2): 268-281. DOI:10.1111/are.2013.44.issue-2 |
| [22] |
SVOBODOVA Z, PRAVDA D, PALACKOVA J.Unified methods of haematological examination of fish[R]. Arlington, Virginia: Research Institute of Fish Culture and Hydrobiology, 1991.
|
| [23] |
WANG X, XUE M, FIGUEIREDO-SILVA C, et al. Dietary methionine requirement of the pre-adult gibel carp (Carassius auratus gibeilo) at a constant dietary cystine level[J]. Aquaculture Nutrition, 2016, 22(3): 509-516. DOI:10.1111/anu.2016.22.issue-3 |
| [24] |
贾鹏, 薛敏, 朱选, 等. 饲料蛋氨酸水平对异育银鲫幼鱼生长性能影响的研究[J]. 水生生物学报, 2013, 37(2): 217-226. |
| [25] |
林仕梅, 麦康森, 谭北平. 实用饲料中添加结晶蛋氨酸对罗非鱼生长、体组成的影响[J]. 水生生物学报, 2008, 32(5): 741-749. |
| [26] |
陈乃松, 马建忠, 周恒永, 等. 大口黑鲈对饲料中蛋氨酸需求量的评定[J]. 水产学报, 2010, 34(8): 1244-1253. |
| [27] |
KASPER C S, WHITE M R, BROWN P B. Choline is required by tilapia when methionine is not in excess[J]. The Journal of Nutrition, 2000, 130(2): 238-242. DOI:10.1093/jn/130.2.238 |
| [28] |
肖伟伟, 冯琳, 刘扬, 等. 日粮中等硫添加DL-蛋氨酸和蛋氨酸羟基类似物游离酸在幼建鲤上饲喂效果的比较研究[J]. 动物营养学报, 2010, 22(4): 1122-1130. DOI:10.3969/j.issn.1006-267x.2010.04.046 |
| [29] |
SUPRAYUDI M A, INARA C, EKASARI J, et al. Preliminary nutritional evaluation of rubber seed and defatted rubber seed meals as plant protein sources for common carp Cyprinus carpio L. juvenile diet[J]. Aquaculture Research, 2015, 46(12): 2972-2981. DOI:10.1111/are.2015.46.issue-12 |
| [30] |
徐美娜.鲤鱼饲料蛋氨酸需求量的研究[D].硕士学位论文.大连: 大连海洋大学, 2011.
|
| [31] |
MURAI T, OGATA H, HIRASAWA Y, et al. Portal absorption and hepatic uptake of amino acids in rainbow trout force-fed complete diets containing casein or crystalline amino acids[J]. Nippon Suisan Gakkaishi, 1987, 53(10): 1847-1859. DOI:10.2331/suisan.53.1847 |
| [32] |
COWEY C B, WALTON M J. Studies on the uptake of (14C) amino acids derived from both dietary (14C) protein and dietary (14C) amino acids by rainbow trout, Salmo gairdneri Richardson[J]. Journal of Fish Biology, 1988, 33(2): 293-305. DOI:10.1111/jfb.1988.33.issue-2 |
| [33] |
MICHELATO M, FURUYA W M, GRACIANO T S, et al. Digestible methionine+cystine requirement for Nile tilapia from 550 to 700 g[J]. Revista Brasileira de Zootecnia, 2013, 42(1): 7-12. DOI:10.1590/S1516-35982013000100002 |
| [34] |
BROSNAN J T, BROSNAN M E. The sulfur-containing amino acids:an overview[J]. The Journal of Nutrition, 2006, 136(Suppl.6): 1636S-1640S. |
| [35] |
NOGA A A, VANCE D E. A gender-specific role for phosphatidylethanolamine N-methyltransferase-derived phosphatidylcholine in the regulation of plasma high density and very low density lipoproteins in mice[J]. The Journal of Biological Chemistry, 2003, 278(24): 21851-21859. DOI:10.1074/jbc.M301982200 |
| [36] |
OBEID R, HERRMANN W. Homocysteine and lipids:S-adenosyl methionine as a key intermediate[J]. FEBS Letters, 2009, 583(8): 1215-1225. DOI:10.1016/j.febslet.2009.03.038 |
| [37] |
TOUE S, KODAMA R, AMAO M, et al. Screening of toxicity biomarkers for methionine excess in rats[J]. The Journal of Nutrition, 2006, 136(Suppl.6): 1716S-1721S. |
| [38] |
FENG L, XIAO W W, LIU Y, et al. Methionine hydroxy analogue prevents oxidative damage and improves antioxidant status of intestine and hepatopancreas for juvenile Jian carp(Cyprinus carpio var. Jian)[J]. Aquaculture Nutrition, 2011, 17(6): 595-604. DOI:10.1111/anu.2011.17.issue-6 |




