2. 湛江市澳华水产饲料有限公司, 湛江 524047;
3. 广东省水产动物精准营养与高效饲料工程技术研究中心, 湛江 524074
2. Zhanjiang Aohua Aquatic Feed Co., Ltd., Zhanjiang 524047, China;
3. Accurate Nutrition and High Efficiency Feed Engineering Research Center for Aquatic Animals in Guangdong province, Zhanjiang 524074, China
硒是保证动物正常生长繁殖所必需的微量元素之一。它作为肝脏谷胱甘肽过氧化物酶(GSH-Px)和含硒转移核糖核酸(tRNA)的组成成分,不仅具有抗氧化的作用,可以保护生物膜结构免受损伤,而且能够特异地促使信使核糖核酸(mRNA)翻译蛋白质的过程,在一定程度上促进动物的生长[1]。此外,硒能够有效地提高机体的免疫力,增强机体的抗病力。Ashouri等[2]研究也发现,饲料中添加1 mg/kg的纳米硒,能够改善鲤鱼(Cyprinus carpio Linnaeus)的生长性能、抗氧化系统和健康状况。
硒在动物体具有重要的生理作用,但缺乏和过量均会对动物造成不良的影响。与其他微量元素相比,硒的需要量和中毒剂量差异较小,因此精准需要量的研究尤为重要。动物体内缺乏硒,会导致机体出现一系列不良症状。早在1976年,Poston等[3]指出,大西洋鲑(Salmo salar)硒缺乏表现为死亡率升高、生长迟缓、组织中硒的含量及谷胱甘肽转移酶的活性下降和肌肉萎缩。但硒具有一定的毒性,摄入过量会对机体造成伤害。Hamilton[4]认为,鱼类饲料中毒性浓度的阈值接近3 mg/kg,而鱼体毒性浓度的阈值接近4 mg/kg。高浓度硒以产生自由基(活性氧)为主,会对机体产生毒性作用[5]。Hicks等[6]研究表明,通过16周的养殖试验,投喂硒水平为11.4 mg/kg的饲料,虹鳟的体重减轻,死亡率升高,其中90%虹鳟的肾脏出现钙盐沉积,致使肾发生损伤,同时肾脏和肝脏的镁含量升高。
斜带石斑鱼(Epinephelus coioides)是我国南方和东南亚国家主要海水养殖鱼类之一,其生长迅速、肉质鲜美、市场价值高,是一种极受欢迎的养殖品种和食用鱼。目前,关于硒对水产动物营养生理作用影响的研究已有相关报道,主要集中在鱼类对硒的需要量以及异育银鲫(Carassius auratus gibelio)[1]、草鱼(Ctenopharyngodon idellus)[7]、鲤鱼[8]等鱼类对不同硒源的利用率、生长效果及抗氧化酶活性的研究。Lin等[9]研究发现,以蛋氨酸硒(selenite methionine,Se-Met)为硒源,点带石斑鱼(Epinephelus malabaricus)硒的需要量为0.7 mg/kg。但是,目前同时比较不同硒源和硒水平对石斑鱼影响的报道较少。因此,本试验同时比较亚硒酸钠(selenite sodium,Se-S)和Se-Met 2种硒源及不同硒水平对斜带石斑鱼幼鱼生长性能、免疫酶活性和全鱼及脊椎骨硒含量的影响,从而为斜带石斑鱼配合饲料的开发、硒源的选择与利用提供理论依据。
1 材料与方法 1.1 试验饲料配制以酪蛋白和秘鲁红鱼粉为蛋白质源,鱼油、玉米油和大豆磷脂油为脂肪源,玉米淀粉为糖源配制半纯合基础饲料,以Se-S和Se-Met为硒源, 在基础饲料中分别添加0、0.3、0.6、0.9和1.2 mg/kg硒。基础饲料硒水平为0.48 mg/kg,Se-S添加组饲料硒水平分别为0.82、1.15、1.32和1.79 mg/kg,Se-Met添加组饲料硒水平分别为0.81、1.18、1.51和1.94 mg/kg。基础饲料组成及营养水平见表 1。将各种固态原料粉碎过60目筛后,按配方精确称量原料,用逐级扩大的方法充分混合,加入鱼油、玉米油和磷脂油混合均匀,加入蒸馏水(30%,V/m),混合均匀,双螺杆挤条机(华南理工大学,F-75型)制成粒径为3 mm的颗粒饲料。风干后用封口袋密封,-20 ℃冰箱保存备用。
|
|
表 1 基础饲料组成及营养水平(风干基础) Table 1 Composition and nutrient levels of the basal diet (air-dry basis) |
养殖试验于广东海洋大学东海岛海洋生物研究基地进行,试验用鱼购自广东省湛江市覃斗镇石斑鱼苗场。正式试验前,石斑鱼于室外水泥池暂养2周,并以石斑鱼商品饲料(粗蛋白质含量为48%)饱食投喂4 d,使之适应养殖环境,然后投喂试验基础饲料(粗蛋白质含量为52.13%)10 d后,饥饿24 h,选取规格均匀、体健无伤、初重为(8.99±0.03) g的斜带石斑鱼幼鱼810尾,随机分为9组,每组3个重复,每个重复30尾鱼,放养于1 m3玻璃纤维钢桶内。其中,对照组投喂基础饲料,试验组投喂相对应的试验饲料。
试验用水为经过沉淀、沙滤的天然海水,试验期间水温为28~31 ℃,海水盐度为27~29,连续充氧,溶氧含量不低于5.0 mg/L,每天定时换水2/3,保证养殖水体中氨氮含量不高于0.03 mg/L。每天08:00和16:00定时投喂,根据鱼体重,每天投喂量约为其体重3%,2周称重1次,根据体重及时调整投喂量,同时记录投喂量。养殖周期为10周。
1.3 样品采集养殖试验结束,石斑鱼饥饿24 h后,称重并记录尾数,计算增重率(WGR)、特定生长率(SGR)、成活率(SR)和饲料系数(FCR)。每桶随机抽取5尾鱼,放置-20 ℃冰箱保存,用于体成分和全鱼硒含量的测定。取10尾鱼,用1 mL无菌注射器,尾静脉取血,置于1.5 mL离心管中,于4 ℃冰箱中静置过夜,3 500 r/min离心10 min,取上清液-80 ℃下保存备用,用于血清酶活性的测定;另取10尾鱼,剥离肝脏组织,置于2 mL离心管中-80 ℃保存,用于肝脏相关免疫酶活性指标的测定。取完内脏的鱼通过蒸煮,去除肌肉后取出脊椎骨,用蒸馏水洗净,烘干,粉碎,密封保存以测定脊椎骨中硒含量。
1.4 测定方法及计算公式 1.4.1 测定方法原料、试验饲料、全鱼常规营养成分含量采用国际标准方法AOAC(1995)[10]进行分析。水分含量采用105 ℃常压干燥法测定;粗蛋白质含量采用凯氏定氮法(KT8400全自动定氮仪)测定;粗脂肪含量采用索氏抽提法(以乙醚为溶剂)测定;粗灰分含量是在电炉上完全碳化后,550 ℃马福炉中灼烧12 h后测定。
血清碱性磷酸酶(AKP)及肝脏总超氧化物歧化酶(T-SOD)、GSH-Px、谷胱甘肽还原酶(GR)活性和丙二醛(MDA)含量采用南京建成生物工程研究所提供的试剂盒测定,样品蛋白质含量也是采用南京建成生物工程研究所提供的考马斯亮兰测试盒测定。
将样品用硝酸消化过滤定容后,采用等离子体质谱(ICP-MS)仪(Agilent-7700)测定饲料、全鱼、脊椎骨硒的含量。
1.4.2 计算公式

|
采用SPSS 17.0统计软件分别对2种硒源及不同硒水平对斜带石斑鱼幼鱼的生长、饲料利用、免疫酶活性和全鱼及脊椎骨硒含量数据进行单因素方差分析(one-way ANOVA),然后对2种硒源及不同硒水平对斜带石斑鱼的生长、饲料利用和免疫酶活性数据进行双因素方差分析(two-way ANOVA),如有显著性差异(P < 0.05),则进行Duncan氏法多重比较。试验数据用“平均值±标准差”表示。
2 结果 2.1 硒源、硒水平及其交互作用对斜带石斑鱼幼鱼生长和饲料利用的影响以Se-S为硒源,经过10周养殖试验,各试验组斜带石斑鱼幼鱼的增重率、特定生长率、饲料系数和成活率见表 2。饲料硒水平对斜带石斑鱼幼鱼增重率和特定生长率有显著影响(P < 0.05),随着饲料硒水平的增加,斜带石斑鱼幼鱼增重率和特定生长率呈现先升高后趋于稳定的趋势,其中1.15 mg/kg组增重率和特定生长率最高,分别比对照组提升了13.4%和7.3%(P < 0.05),而饲料硒水平对斜带石斑鱼幼鱼成活率和饲料系数无显著影响(P > 0.05)。
|
|
表 2 硒源、硒水平及其交互作用对斜带石斑鱼幼鱼生长和饲料利用的影响 Table 2 Effects of Se sources, Se levels and their interaction on growth and feed utilization of juvenile grouper (n=3) |
以Se-Met为硒源,经过10周养殖试验,各试验组斜带石斑鱼幼鱼的增重率、特定生长率、饲料系数和成活率见表 2。饲料硒水平对斜带石斑鱼幼鱼增重率和特定生长率有显著影响(P < 0.05),随着饲料硒水平的增加,斜带石斑鱼幼鱼增重率和特定生长率呈现先升高后趋于稳定的趋势,其中1.18 mg/kg组增重率和特定生长率最高,分别比对照组提升了13.5%和7.3%(P < 0.05),而饲料硒水平对斜带石斑鱼幼鱼成活率和饲料系数无显著影响(P > 0.05)。
对斜带石斑鱼幼鱼的生长数据和饲料利用数据进行双因素分析,2种硒源和不同硒水平对斜带石斑鱼幼鱼增重率、特定生长率和饲料系数的影响见表 2。硒源对增重率和特定生长率无显著影响(P > 0.05),对饲料系数有显著影响(P < 0.05);硒水平对增重率、特定生长率和饲料系数无显著影响(P > 0.05),但饲料中适量硒水平可以提高增重率和特定生长率;对于增重率和特定生长率,硒源和硒水平之间交互作用显著(P < 0.05);对于饲料系数,二者交互作用不显著(P > 0.05)。
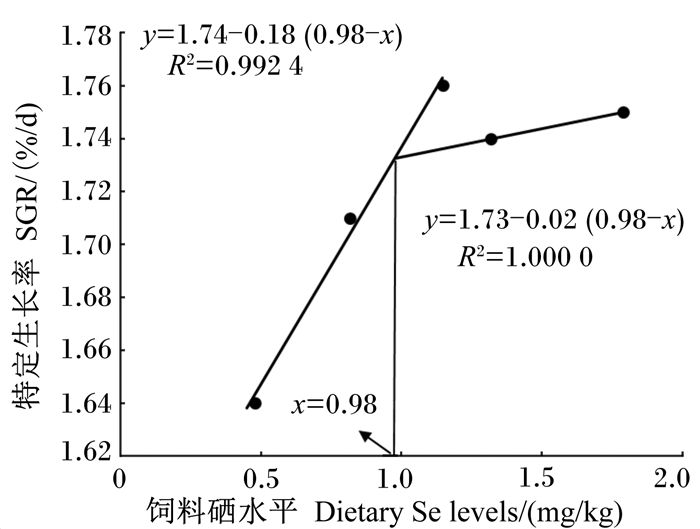
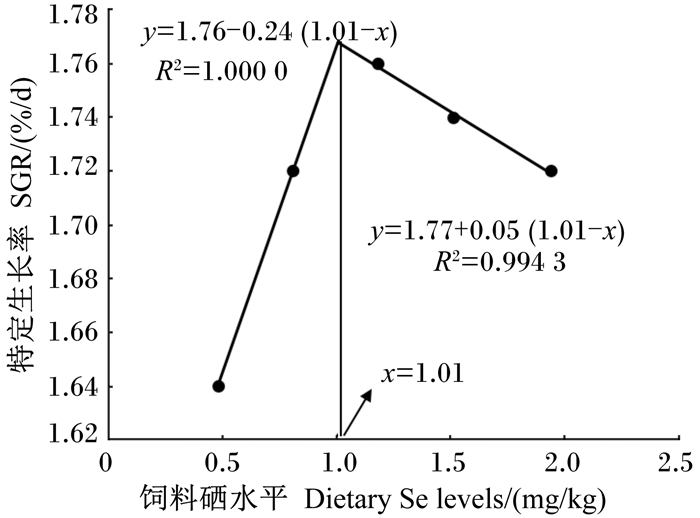
由图 1和图 2可知,以特定生长率为评价指标,以Se-S和Se-Met为硒源时,经折线模型得出斜带石斑鱼对饲料中硒的最适需要量分别为0.98和1.01 mg/kg。
|
图 1 饲料硒(亚硒酸钠)水平与斜带石斑鱼幼鱼特定生长率之间关系 Fig. 1 Relationship between dietary Se (Se-S) levels and SGR of juvenile grouper |
|
图 2 饲料硒(蛋氨酸硒)水平与斜带石斑鱼幼鱼特定生长率之间关系 Fig. 2 Relationship between dietary Se (Se-Met) levels and SGR of juvenile grouper |
以Se-S为硒源,饲料硒水平对斜带石斑鱼幼鱼免疫酶活性的影响见表 3。硒水平对斜带石斑鱼幼鱼血清AKP及肝脏T-SOD、GSH-Px、GR活性和MDA含量有显著影响(P < 0.05)。随着饲料硒水平的提高,斜带石斑鱼幼鱼血清AKP和肝脏GSH-Px活性呈现先升高后趋于稳定的趋势,其中1.15 mg/kg组血清AKP活性最高,比对照组提升了42.6%(P < 0.05),与其他添加组差异不显著(P > 0.05),1.79 mg/kg组肝脏GSH-Px活性最高,显著高于对照组和0.82 mg/kg组(P < 0.05);随着饲料硒水平的升高,肝脏T-SOD活性呈现先升高后降低的趋势,其中1.15 mg/kg组肝脏T-SOD活性最高,分别比对照组和1.79 mg/kg组提升了31.5%和25.9%(P < 0.05),与其他添加组差异不显著(P > 0.05);随着饲料硒水平的升高,肝脏GR活性和MDA含量呈现先降低后趋于稳定的趋势,进入一个平台期。
|
|
表 3 硒源、硒水平及其交互作用对斜带石斑鱼幼鱼免疫酶活性的影响 Table 3 Effects of Se sources, Se levels and their interaction on immunity enzyme activities of juvenile grouper (n=3) |
以Se-Met为硒源,饲料硒水平对斜带石斑鱼幼鱼免疫酶活性的影响见表 3。硒水平对斜带石斑鱼幼鱼血清AKP及肝脏T-SOD、GSH-Px、GR活性和MDA含量有显著影响(P < 0.05)。随着饲料硒水平的升高,斜带石斑鱼幼鱼血清AKP活性呈现先升高后下降的趋势,其中1.18 mg/kg组血清AKP活性最高,比对照组提升了36.0%(P < 0.05),与1.51 mg/kg组差异不显著(P > 0.05);随着饲料硒水平的升高,肝脏T-SOD和GSH-Px活性呈现先升高后趋于稳定的趋势,其中1.51 mg/kg组肝脏T-SOD和GSH-Px活性最高;随着饲料硒水平的升高,肝脏GR活性和MDA含量呈现先降低后趋于稳定趋势,进入一个平台期。
对斜带石斑鱼幼鱼免疫酶活性数据进行双因素分析,2种硒源和硒水平对斜带石斑鱼幼鱼免疫酶活性的影响见表 3。硒源对血清AKP及肝脏T-SOD、GSH-Px活性和MDA含量无显著影响(P > 0.05),而对肝脏GR活性有显著影响(P < 0.05),硒源为Se-Met的肝脏GR酶活性比Se-S低。硒水平对血清AKP及肝脏GSH-Px、GR活性和MDA含量有显著影响(P < 0.05),对肝脏T-SOD活性无显著影响(P > 0.05)。对于血清AKP及肝脏T-SOD、GSH-Px、GR活性和MDA含量,硒源和硒水平之间交互作用均不显著(P > 0.05)。
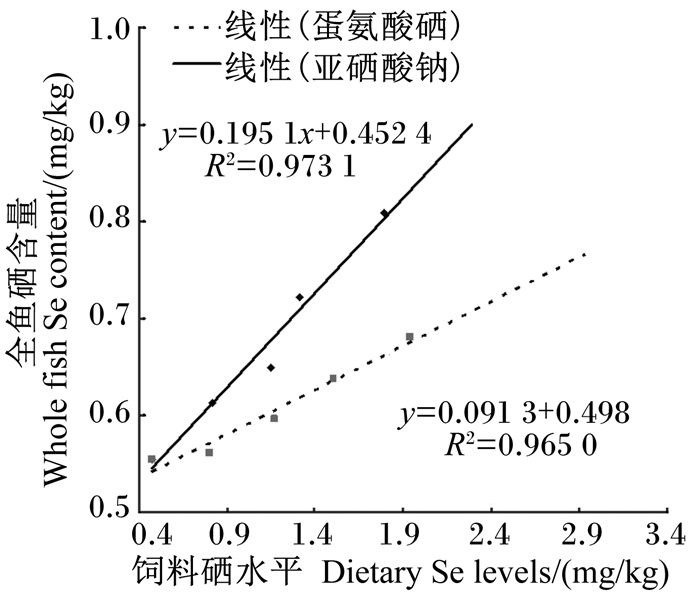
2.3 硒源及硒水平对斜带石斑鱼幼鱼全鱼及脊椎骨硒含量的影响2种硒源及硒水平对斜带石斑鱼幼鱼全鱼和脊椎骨硒含量的影响见表 4。无论是以Se-S为硒源,还是以Se-Met为硒源,脊椎骨硒含量低于全鱼硒含量。由图 3可知,随着饲料硒水平的增加,全鱼和脊椎骨硒含量均呈现线性升高的趋势。
|
|
表 4 硒源及硒水平对斜带石斑鱼全鱼和脊椎骨硒含量的影响 Table 4 Effects of Se sources and Se levels on Se contents in whole fish and vertebrae of juvenile grouper (n=3) |
|
图 3 饲料硒水平对斜带石斑鱼幼鱼全鱼硒含量的影响 Fig. 3 Effects of dietary Se levels on Se content in whole fish of juvenile grouper |
由表 5可知,选取的评价指标不同得出的相对生物学效价不同。以特定生长率为评价指标,以Se-S为参照,Se-Met的相对生物学效价为106%;以肝脏GSH-Px活性为评价指标,以Se-S为参照,Se-Met的相对生物学效价为119%。通过对特定生长率和肝脏GSH-Px活性分析得出,Se-Met的相对生物学效价为112.5%。
|
|
表 5 2种硒源相对生物学效价的比较 Table 5 Comparison of relative biological potency of two Se sources |
必需元素对任何动物都不可或缺,但其最适需要量具有一定范围,而硒也不例外。只有在合适范围内,硒对动物才存在营养作用,一旦超出这个范围,则会导致动物出现缺乏症状或慢、急性中毒[11]。研究表明,硒主要是通过以下机制提高动物的生长性能:第一,硒是GSH-Px的重要组成部分,能够降低机体应激反应,提高抗氧化、繁殖的能力,促进抗体的形成,增强机体免疫机能,降低死亡率,实现促生长作用[12]。第二,硒不仅作为5′-脱碘酶的组成部分(其中5′-脱碘酶活性与硒水平相关),而且还能介导甲状腺激素的形成和降解,在5′-脱碘酶的作用下,催化四碘甲状腺原氨酸(T4)转变为三碘甲状腺原氨酸(T3),而T3与生长激素基因的表达和合成有着密切关系,同时还能提高胰岛素水平和肌肉蛋白质合成与代谢的速率,从而促进生长[13-14]。
本研究结果显示,对照组的斜带石斑鱼幼鱼体重增长缓慢,而饲料中添加Se-S和Se-Met均能促进斜带石斑鱼幼鱼生长,提高增重率和特定生长率。这可能是由于硒能够促进胰岛素和肌肉蛋白质的合成,从而提高生长性能。对异育银鲫[1]、草鱼[7]、鲈(Lateolabrax japonicas)[15]和鲤[16]研究发现,饲料中补充适量的硒可以提高增重率和特定生长率,同时增加鱼体蛋白质含量或提高饲料蛋白质效率。本研究结果显示,分别以Se-S和Se-Met为硒源时,斜带石斑鱼幼鱼硒的需要量分别为0.98和1.01 mg/kg,表明斜带石斑鱼对不同硒源饲料的需要量差异较小。据Lin[17]研究指出,以Se-S和Se-Met为硒源,点带石斑鱼幼鱼的硒需要量分别为0.90和0.98 mg/kg,对不同硒源饲料需要量相差较小,与本试验结果相似。本试验结果与草鱼[7](0.6 mg/kg)和军曹鱼(Rachycentron canadum)[18](0.788 mg/kg)的硒需要量比较接近,但高于鲤鱼[8](0.39~0.53 mg/kg)、鲈[15](0.4 mg/kg)、虹鳟[19](0.15~0.38 mg/kg)、斑点叉尾(Ictalurus punctatus)[20](0.25 mg/kg)以及大黄鱼(Larimichthys croceus)[21](0.178 mg/kg)的硒需要量。究其可能原因主要与2方面有关:首先,鱼的品种不同,其需要量存在着差异;其次,饲料中硒水平及其化学形式不同,那么其在生物体内吸收和代谢就会出现差异[22],从而影响需要量。
3.2 硒源、硒水平及其交互作用对斜带石斑鱼幼鱼免疫酶活性的影响硒作为体内GSH-Px的组成成分和活性中心元素[5],通过GSH-Px等硒蛋白质具有较强的还原作用,间接地参与体内过氧化物的清除过程,同时也能影响其他抗氧化酶活性。在研究中,随饲料硒水平的增加,肝脏中GSH-Px活性先逐渐升高后趋于平稳。这说明在一定范围内,硒水平的升高有利于GSH-Px活性提高。这可能是由于硒是GSH-Px的重要组分,有利于GPX-Px合成。这与点带石斑鱼[9]、军曹鱼[18]、斑点叉尾[20]、大黄鱼[21]和大口黑鲈(Micropterus salmoides)[23]的研究结果相一致。Bell等[24]对虹鳟的研究也表明,饲料中缺硒会导致血清和肝脏中GSH-Px活性显著降低。然而对异育银鲫[1]、鲈鱼[15]和草鱼[25]的研究发现,随着饲料硒水平的升高,血清和肝脏中GSH-Px活性先升高后降低,这可能与鱼种类有关,因为过量的硒对鱼类表现出毒性作用,而不同的鱼种类对硒的耐受能力不同。
GR是一种黄素蛋白氧化还原酶,在还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)作为电子供体的条件下,该酶能够不断催化氧化型谷胱甘肽(GSSG)转换成还原型谷胱甘肽(GSH),使细胞中GSH/GSSG大于1且保持稳定,这对于保持细胞的抗氧化能力起到了至关重要的作用[26]。本试验中,随着饲料硒水平的增加,肝脏中GR活性显著降低后趋于稳定,此结果与点带石斑鱼[9]和大口黑鲈[23]上的研究结果相一致。刘康[27]对军曹鱼研究发现,当饲料中硒水平大于0.85 mg/kg,肝脏GR活性显著降低。Han等[28]对异育银鲫的研究表明,饲料中硒水平对肝脏GR活性影响的差异不显著。这些结果与本试验结果有一定差异。其原因可能与养殖环境、饲料组成及鱼类品种等因素有关。
MDA是脂质过氧化反应的最终分解产物,其含量可间接反映机体活性氧自由基和脂质的过氧化水平,从而间接反映细胞损伤的程度[29]。本试验中,随着饲料硒水平增加,肝脏MDA含量呈现先降低后趋于稳定的趋势,硒水平大于0.82 mg/kg的各组肝脏MDA含量差异不显著。这说明在一定范围内,硒水平的增加可抑制体内的脂质过氧化程度。苏传福等[25]研究硒对草鱼抗氧化功能的影响,结果表明随着饲料硒水平的增加,肝胰脏和血清中MDA含量呈现出先降低后升高的趋势,组织MDA含量最低值均出现在硒水平为0.60 mg/kg的组。对大口黑鲈的研究结果却发现,饲料硒水平对肝脏MDA含量影响差异不显著[23]。由此可见,硒水平对不同水产动物MDA含量影响的结果差异较大,这可能与试验鱼种类、大小、试验条件、硒源以及硒水平等差异有关,也可能与饲料中的抗氧化剂含量有关。
3.3 硒源及硒水平对斜带石斑鱼幼鱼全鱼及脊椎骨硒含量的影响本研究结果表明,斜带石斑鱼全鱼和脊椎骨硒含量与饲料硒水平呈正相关关系,并且脊椎骨中硒含量远低于全鱼硒含量,证明骨骼不是硒沉积的主要场所。这可能是由于Se-S的主要代谢场所是肝脏,而Se-Met是参于肌肉蛋白质的合成。Gatlin等[20]对斑点叉尾研究发现,随着饲料硒水平的增加,斑点叉尾肌肉中硒含量呈线性增加;对杂交条纹鲈(Morone saxatilis)的研究也表明,随着饲料硒水平的升高,全鱼和肝脏中硒含量均呈现线性升高的趋势[30]。本试验结果与上述研究结果相一致。对军曹鱼研究显示,随着饲料硒水平的增加,全鱼和骨骼硒含量呈现先升高后趋于稳定的趋势,因此将全鱼和骨骼硒含量作为评价军曹鱼硒需要量的指标[27];朱春峰[1]研究饲料中硒元素对异育银鲫组织中硒含量的影响发现,随着饲料硒水平的增加,全鱼、肌肉和肝胰脏的硒含量均随之增加,当添加水平达到0.6 mg/kg(实际含量无机硒组为1.28 mg/kg,有机硒组为1.27 mg/kg)后趋于平稳。曹娟娟[21]对大黄鱼的研究表明,随着饲料中硒水平的增加,全鱼和骨骼的硒含量呈现先升高后趋于稳定的趋势,饲料中硒水平为0.66 mg/kg时有最大值。Lorentzen等[31]研究发现,分别在饲料中添加亚硒酸盐和Se-Met,均能提高大西洋鲑组织中硒含量,饲料硒水平相同时,亚硒酸盐组肝脏中硒含量高于Se-Met组,而肌肉和全鱼硒含量则是Se-Met组高于亚硒酸盐组。这些研究结果与本试验结果有一定差异,这可能与不同硒源在不同鱼类体内吸收、转运和代谢途径不同有关。
3.4 2种硒源相对生物学效价的比较在本试验中,以特定生长率和肝脏GSH-Px活性为评价指标,Se-Met相对于Se-S的生物学效价分别为106%和119%;魏文志等[32]在异育银鲫基础饲料中添加Se-S和有机硒(含硒多糖和硒蛋白),研究饲料中添加有机硒对异育银鲫生长的影响,结果显示,与对照组相比,有机硒能够显著促进异育银鲫生长,降低饲料系数;而无机硒作用不显著。朱春峰[1]的研究也显示,对于异育银鲫的生长和非特异性免疫,有机硒整体效果较无机硒好。在本研究中,对于生长和免疫,有机硒Se-Met的作用效果均比无机硒Se-S突出。综合生长和免疫指标,Se-Met的相对生物学效价为112.5%。
4 结论在本试验条件下,以特定生长率为评价指标,当硒源为Se-S时,斜带石斑鱼幼鱼对饲料中硒的最适需要量为0.98 mg/kg;以特定生长率为评价指标,当硒源为Se-Met时,斜带石斑鱼幼鱼对饲料中硒的最适需要量为1.01 mg/kg。
以特定生长率和肝脏GSH-Px活性为评价指标综合分析得出,斜带石斑鱼幼鱼Se-Met的生物利用率比Se-S高,相当于Se-S的112.5%。
| [1] |
朱春峰.有机硒和无机硒对异育银鲫生长、生理的影响[D].硕士学位论文.苏州: 苏州大学, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10285-2009119000.htm
|
| [2] |
ASHOURI S, KEYVANSHOKOOH S, SALATI A P, et al. Effects of different levels of dietary selenium nanoparticles on growth performance, muscle composition, blood biochemical profiles and antioxidant status of common carp (Cyprinus carpio)[J]. Aquaculture, 2015, 446: 25-29. DOI:10.1016/j.aquaculture.2015.04.021 |
| [3] |
POSTON H A, COMBS J F, Jr, LEIBOVITZ L. Vitamin E and selenium interrelations in the diet of Atlantic salmon (Salmo salar):gross, histological and biochemical deficiency signs[J]. The Journal of Nutrition, 1976, 106(7): 892-904. DOI:10.1093/jn/106.7.892 |
| [4] |
HAMILTON S J. Review of selenium toxicity in the aquatic food chain[J]. Science of the Total Environment, 2004, 326(1/2/3): 1-31. |
| [5] |
左晓磊, 韩爱云. 微量元素硒的营养功能[J]. 河北畜牧兽医, 2005(5): 40-42. |
| [6] |
HICKS B D, HILTON J W, FERGUSON H W. Influence of dietary selenium on the occurrence of nephrocalcinosis in the rainbow trout, Salmo gairdneri Richardson[J]. Journal of Fish Diseases, 1984, 7(5): 379-389. DOI:10.1111/jfd.1984.7.issue-5 |
| [7] |
苏传福, 罗莉, 文华, 等. 硒对草鱼生长、营养组成和消化酶活性的影响[J]. 上海水产大学学报, 2007, 16(2): 124-129. |
| [8] |
金明昌, 汪开毓. 不同硒水平对幼鲤生产性能和免疫功能的影响[J]. 中国畜牧杂志, 2008, 44(5): 32-36. |
| [9] |
LIN Y H, SHIAU S Y. Dietary selenium requirements of juvenile grouper, Epinephelus malabaricus[J]. Aquaculture, 2005, 250(1/2): 356-363. |
| [10] |
AOAC.Official methods of analysis[S]. 16th ed.Gaithersburg, MD: AOAC International, 1995.
|
| [11] |
徐辉碧, 黄开勋. 硒的化学、生物化学及其在生命科学中的应用[M]. 武汉: 华中理工大学出版社, 1994: 32-34.
|
| [12] |
BURK R F. Selenium, an antioxidant nutrient[J]. Nutrition in Clinical Care, 2002, 5(2): 75-79. |
| [13] |
倪银星. 硒蛋白、硒与内分泌激素的关系研究进展[J]. 国外医学卫生学分册, 2002, 29(1): 38-41, 57. |
| [14] |
沈同, 王镜岩. 生物化学[M]. 北京: 高等教育出版社, 1990: 78-79.
|
| [15] |
梁萌青, 王家林, 常青, 等. 饲料中硒的添加水平对鲈鱼生长性能及相关酶活性的影响[J]. 中国水产科学, 2007, 13(6): 1017-1022. DOI:10.3321/j.issn:1005-8737.2007.06.019 |
| [16] |
SAFFARI S, KEYVANSHOKOOH S, ZAKERI M, et al. Effects of dietary organic, inorganic, and nanoparticulate selenium sources on growth, hemato-immunological, and serum biochemical parameters of common carp (Cyprinus carpio)[J]. Fish Physiology and Biochemistry, 2018, 44(4): 1087-1097. DOI:10.1007/s10695-018-0496-y |
| [17] |
LIN Y H. Effects of dietary organic and inorganic selenium on the growth, selenium concentration and meat quality of juvenile grouper Epinephelus malabaricus[J]. Aquaculture, 2014, 430: 114-119. DOI:10.1016/j.aquaculture.2014.03.048 |
| [18] |
LIU K, WANG X J, AI Q H, et al. Dietary selenium requirement for juvenile cobia, Rachycentron canadum L[J]. Aquaculture Research, 2010, 41(10): e594-e601. |
| [19] |
HILTON J W, HODSON P V, SLINGER S J. The requirement and toxicity of selenium in rainbow trout (Salmo gairdneri)[J]. The Journal of Nutrition, 1980, 110(12): 2527-2535. DOI:10.1093/jn/110.12.2527 |
| [20] |
GATLIN Ⅲ D M, WILSON R P. Dietary selenium requirement of fingerling channel catfish[J]. The Journal of Nutrition, 1984, 114(3): 627-633. DOI:10.1093/jn/114.3.627 |
| [21] |
曹娟娟.大黄鱼幼鱼微量元素铜和硒的营养生理研究[D].硕士学位论文.青岛: 中国海洋大学, 2014. http://cdmd.cnki.com.cn/article/cdmd-10423-1014328524.htm
|
| [22] |
FAIRWEATHER-TAIT S J, COLLINGS R, HURST R. Selenium bioavailability:current knowledge and future research requirements[J]. The American Journal of Clinical Nutrition, 2010, 91(5): 1484S-1491S. DOI:10.3945/ajcn.2010.28674J |
| [23] |
ZHU Y, CHEN Y J, LIU Y J, et al. Effect of dietary selenium level on growth performance, body composition and hepatic glutathione peroxidase activities of largemouth bass Micropterus salmoide[J]. Aquaculture Research, 2012, 43(11): 1660-1668. DOI:10.1111/are.2012.43.issue-11 |
| [24] |
BELL J G, PIRIE B J S, ADRON J W, et al. Some effects of selenium deficiency on glutathione peroxidase (EC 1.11.1.9) activity and tissue pathology in rainbow trout (Salmo gairdneri)[J]. British Journal of Nutrition, 1986, 55(2): 305-311. DOI:10.1079/BJN19860038 |
| [25] |
苏传福, 罗莉, 李芹, 等. 硒对草鱼抗氧化功能及组织结构的影响[J]. 西南师范大学学报(自然科学版), 2008, 33(5): 69-75. |
| [26] |
NIELSEN T K, WOLSTRUP C, SCHIRMER A L, et al. Mulberry heart disease in young pigs without vitamin E and selenium deficiency[J]. Veterinary Record, 1989, 124(20): 535-537. DOI:10.1136/vr.124.20.535 |
| [27] |
刘康.军曹鱼幼鱼(Rachycentron canadum)微量元素硒、锰的营养生理研究[D].硕士学位论文.青岛: 中国海洋大学, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10423-1011027694.htm
|
| [28] |
HAN D, XIE S, LIU M, et al. The effects of dietary selenium on growth performances, oxidative stress and tissue selenium concentration of gibel carp (Carassius auratus gibelio)[J]. Aquaculture Nutrition, 2011, 17(3): e741-e749. DOI:10.1111/anu.2011.17.issue-3 |
| [29] |
谭树华, 何典翼, 严芳, 等. 亚硝酸钠对鲫鱼肝脏丙二醛含量和总抗氧化能力的影响[J]. 农业环境科学学报, 2005, 24(S1): 21-24. |
| [30] |
COTTER P A, CRAIG S R, MCLEAN E. Hyperaccumulation of selenium in hybrid striped bass:a functional food for aquaculture?[J]. Aquaculture Nutrition, 2008, 14(3): 215-222. DOI:10.1111/j.1365-2095.2007.00520.x |
| [31] |
LORENTZEN M, MAAGE A, JULSHAMN K. Effects of dietary selenite or selenomethionine on tissue selenium levels of Atlantic salmon (Salmo salar)[J]. Aquaculture, 1994, 121(4): 359-367. DOI:10.1016/0044-8486(94)90270-4 |
| [32] |
魏文志, 杨志强, 罗方妮, 等. 饲料中添加有机硒对异育银鲫生长的影响[J]. 淡水渔业, 2001, 31(3): 45-46. DOI:10.3969/j.issn.1000-6907.2001.03.018 |




